酶法合成Levan多糖的过程调控与机理研究
2017-09-18黄双霞侯殿志陈华磊于玥蓝蔚冰王帅静陈山
黄双霞,侯殿志,陈华磊,于玥,蓝蔚冰,王帅静,陈山
(1.广西大学糖业工程技术研究中心,南宁 530004;2.广西蔗糖产业协同创新中心,南宁 530004;3.糖业及综合利用教育部工程研究中心,南宁 530004)
酶法合成Levan多糖的过程调控与机理研究
黄双霞1,3,侯殿志1,3,陈华磊1,3,于玥1,3,蓝蔚冰1,3,王帅静1,3,陈山1,2,3*
(1.广西大学糖业工程技术研究中心,南宁 530004;2.广西蔗糖产业协同创新中心,南宁 530004;3.糖业及综合利用教育部工程研究中心,南宁 530004)
Levan是一种主链由大量呋喃果糖基团以β-(2,6)糖苷键连接,少量支链以β-(2,1)糖苷键连接的胞外多糖。作为一种功能性多糖,Levan具有益生元、降血脂及抗肿瘤等重要的生理功能,在医药和食品行业具有巨大应用前景。就Levan多糖的制备方法、酶法合成Levan多糖的机理研究及过程调控几方面进行了综述,对酶法合成Levan多糖中存在的问题进行了分析和讨论,对未来酶法合成Levan多糖的研究方向进行了展望。
Levan多糖;酶法合成;Levan蔗糖酶;合成机理;过程调控
Levan多糖是一种主链以β-(2,6)果糖苷键连接,支链以β-(2,1)果糖苷键连接的微生物功能多糖,其分子量通常在2×103~1×105kDa(Levan多糖结构式见图1)[1]。Levan多糖具有多种重要的生物学功能,被广泛应用于食品、医药及化学工业行业中。在食品行业中,Levan多糖作为天然甜味剂、乳化剂、稳定剂、配方辅助物及风味和美味载体等,可以应用于糖果、焙烤食品、调味料及乳品中等[2];并且Levan多糖含热量低,进入人体后不易被消化吸收,是一种理想的可溶性膳食纤维,可用作减肥食品的原料[3]。在医药行业中,Levan多糖可作免疫增强因子与抗癌抗菌素[4]。在化学工业中,由于Levan多糖具有水溶性、保湿性、热稳定性、成膜性及抗氧化等特性,可以用来制备化妆品添加剂、冷冻保护剂、薄膜、涂层和纳米材料等[5]。Levan多糖的生理活性及功能作用使其具有巨大的商业应用价值,进而其制备方法的研究也越来越受到重视。
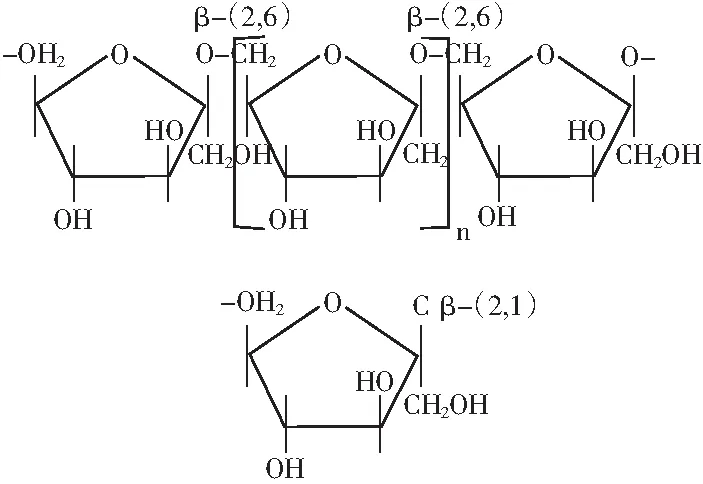
图1 Levan多糖结构图Fig.1 Structure chart of Levan polysaccharide
1 Levan多糖的制备方法
目前,制备Levan多糖的方法主要有微生物发酵法和酶法合成,也有用化学合成Levan多糖的报道,但由于其合成过程复杂,产物难以分离纯化,且仅获得以β-糖苷键连接的Levan三糖,进而很少采用此法[6]。
微生物发酵法是一种通过生产菌株在高浓度蔗糖培养基中发酵,经过离心、沉淀等工序得到多糖粗品的方法。但是此法目前存在诸多需要改进的地方,例如生产菌株筛选困难,易染杂菌;产物分离纯化困难,且发酵废液污染环境及成本高等;此外,该法得到的Levan多糖产量也较低,一般在10~50 g/L左右[7]。Feng等[8]构建了γ-PGA缺陷型解淀粉芽孢杆菌NK-ΔLP,在最适条件下发酵培养获得Levan多糖22.6 g/L;Silbir等[9]利用运动发酵单胞菌NRRLB-14023在最适条件下培养合成Levan多糖40.2 g/L,通过海藻酸钙固定化菌后获得Levan多糖31.8 g/L;Xu X等[10]利用类芽孢杆菌BD3526,在最优条件下培养得到Levan多糖36.25 g/L。
酶法是一种通过Levan蔗糖酶直接作用于底物蔗糖,通过转糖基反应聚合果糖基形成Levan多糖的方法[11]。相比于微生物发酵方法,酶法合成Levan多糖的过程反应体系简单,避免了发酵液中菌体的干扰,产物提取及纯化较易,并且反应条件温和;通过调控反应条件可提高生产效率及控制产物分子量分布,使得生产成本大大降低[12]。因此,酶法合成未来将成为Levan多糖制备的研究热点。
2 酶法合成Levan多糖的机理研究
2.1 Levan蔗糖酶
Levan蔗糖酶(Levansucrase,EC2.4.1.10)属于GH68家族果糖基转移酶(FTFs),具有蔗糖水解酶活性和转移酶活性,一般微生物Levan蔗糖酶分子量范围在45~80 kDa之间,少量在100 kDa以上[13]。Levan蔗糖酶生产菌株来源广泛,包括革兰氏阳性菌和革兰氏阴性菌,主要有枯草芽孢杆菌(Bacillussubtilis)、运动发酵单胞菌(Zymomonasmobilis)、地衣芽孢杆菌(Bacilluslicheniformis)和木醋杆菌(Acetobacterxylinum)等[14]。
不同来源菌种得到的Levan蔗糖酶,其动力学常数Km、酶活力、最适温度、最适pH值及结构等存在差异,所以Levan蔗糖酶的特性及其纯化分离技术的研究备受关注。目前,国内外学者利用菌种诱变、基因改造、固定化技术及优化培养基等手段,提高Levan蔗糖酶的活力和产量[15]。最适反应条件下不同来源Levan蔗糖酶催化蔗糖合成Levan多糖的分子量及产量的变化情况见表1。

表1 不同微生物Levan蔗糖酶催化蔗糖制备Levan多糖的研究Table 1 Study on enzymatic synthesis of Levan polysaccharide by different microbial Levansucrase

续 表
2.2 Levan蔗糖酶的分泌、酶结构与反应机制
2.2.1 Levan蔗糖酶的分泌
Levan蔗糖酶的基因表达包括诱导性表达和组成性表达,大多数细菌利用蔗糖底物诱导酶转录;同时底物存在时某些细菌也进行组成性表达,例如枯草芽孢杆菌、运动发酵单胞菌和谷氨酸木醋杆菌等。微生物Levan蔗糖酶的分泌机制包括以下两种:对于革兰氏阳性菌,通过切割引导前体酶的信号肽后分泌Levan蔗糖酶,如枯草芽孢杆菌、解淀粉芽孢杆菌和罗伊乳杆菌等[30];对于绝大多数革兰氏阴性菌,通过信号肽独立通道分泌Levan蔗糖酶,如解淀粉欧文氏菌、拉恩氏菌和丁香假单胞菌等,最后成熟的酶蛋白会被转移到外部介质或附着在细胞表面[31]。
然而革兰氏阴性谷氨酸木醋杆菌的Levan蔗糖酶分泌过程与革兰式阳性菌类似[32],首先合成N-末端带30个氨基酸残基的信号肽来引导前体酶形成,转移到周质后信号肽被切除,然后通过跨膜转移β-螺旋折叠的成熟酶蛋白,这种分泌过程称为II型分泌系统[33]。枯草芽孢杆菌B168菌株的蔗糖代谢途径以胞外代谢途径为主,即以sacB基因编码分泌型的Levan蔗糖酶后催化蔗糖转化成果糖和葡萄糖[34];其次以sacA、sacP基因催化进行胞内代谢途径;研究发现sacA和sacB操纵子均受到抗终止转录因子的调控,其中抗终止转录因子sacT和sacY起正调控作用,sacX起负调控作用;且sacX、sacY操纵子的表达又受sacY自身、degS、degU及底物蔗糖的调控[35]。
2.2.2 酶结构
Levan蔗糖酶属于胞外酶,其蛋白质分子结构中通常有5个重要区域:信号肽、N-末端结构域、催化结构域、细胞壁结合区域和C-末端结构域[36]。GH68家族FTFs都有3个高度保守的AA序列,分别称为共价催化基团、广义酸/碱催化基团和过渡态稳定基团形成催化三联体[37]。
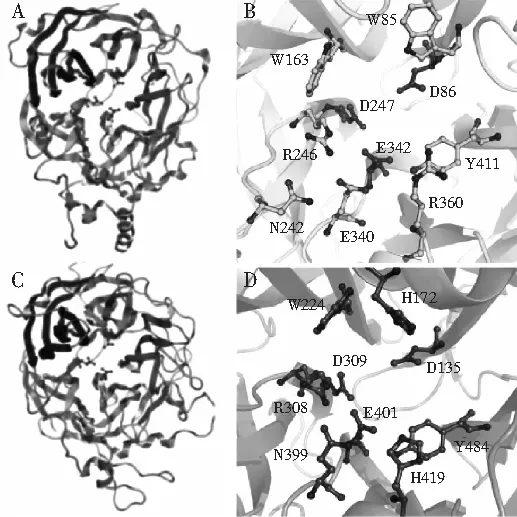
图2 Levan蔗糖酶的三维结构及其活性部位[38]Fig.2 The three-dimensional structure and active sites of Levansucrase
图2中,微生物Levan蔗糖酶的晶体结构相似,催化结构域均为5片折叠β-螺旋拓扑结构,形成一个带负电荷、中心深的口袋状结构[38]。
A为革兰氏阳性枯草芽孢杆菌Levan蔗糖酶(PDB ID∶1OYG)的三维结构图,B为其活性部位;C为革兰氏阴性谷氨酸木醋杆菌Levan蔗糖酶(PDB ID∶1W18)的三维结构图,D为其活性部位;Levan蔗糖酶催化结构域的5叶片分别对应橙色、蓝色、绿色、黄色和红色。
枯草芽孢杆菌Levan蔗糖酶的亲核催化基团Asp86(D86)、广义酸碱催化基团Glu342(E342)及过渡态稳定基团Asp247(D247);研究发现Arg360残基(R360)位于毗邻中央口袋的溶剂暴露位点,与活性中心周围的AA残基E340、N242相互作用形成一个果糖基受体底物的短暂停留位点,因此,Arg360残基与聚合酶的活性及Levan多糖的生物合成过程密切相关[39]。通过研究酶活性中心的氨基酸组成,有助于探索酶的结构与功能的关系。李润静等[40]利用化学修饰剂NBS与PMSF对Levan蔗糖酶进行化学修饰,其中NBS修饰色氨酸(Trp);PMSF修饰苏氨酸(Thr)或丝氨酸(Ser)的-OH基团,发现Levan蔗糖酶的水解酶活和转糖基酶活均受到抑制,说明Trp与-OH基团是Levan蔗糖酶活性的必需基团。
2.2.3 酶催化反应机制
Levan蔗糖酶催化反应过程遵循non-Leloir反应机制,包括形成一种共价的糖基-酶中间体并且通过过渡态氧化碳离子稳定这2个步骤[41]:第一阶段是糖基化过程,首先蔗糖作为供体,通过亲核-COOH基团攻击糖基的异头碳形成共价的果糖-酶中间体,侧链基团作为广义酸催化剂为糖基离去基团提供质子;第二阶段是去糖基化过程,广义碱催化剂作为质子受体,从转移的果糖基(或水分子、蔗糖)移去一个质子从而水解果糖-酶中间体[42,43]。
2.3 Levan多糖的合成过程
蔗糖底物同时作为果糖基的供体和受体;水分子、果糖、葡萄糖及低聚果糖均可作为受体;所以根据不同受体,Levan蔗糖酶利用蔗糖催化以下3个反应,见图3。
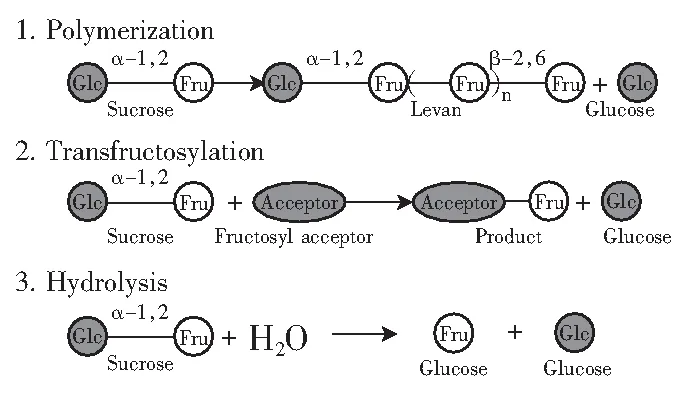
图3 Levan蔗糖酶利用蔗糖催化的3个反应[44]Fig.3 Three enzymatic reactions catalyzed by microbial Levansucrase
图3中1为聚合反应,以果聚糖链作为受体形成Levan多糖;2为转果糖基反应,以单糖、二糖或低聚糖作为果糖基受体;3为水解作用,以水分子为受体释放葡萄糖和果糖。
Levan蔗糖酶直接作用于蔗糖底物,其水解酶活和转糖基酶活同时起作用,催化蔗糖水解为葡萄糖和果糖基,同时逐步将呋喃果糖基单元以β-(2,6)糖苷键连接到葡萄糖残基受体上,不断延长糖链,最后形成Levan多糖。Méndez-Lorenzo L等[45]发现当底物蔗糖耗尽后,合成的聚合物作为果糖基供体,Levan蔗糖酶外切多糖的β-(2,6)糖苷键连续释放末端果糖,直到外切位点遇到多糖链上的分支点后停止,说明连接分支点β-(2,1)糖苷键是Levan多糖控制自身合成酶水解作用的关键部位。
根据不同Levan蔗糖酶来源及反应条件,合成Levan多糖的过程存在2种增长机制。对于革兰氏阳性菌产的Levan蔗糖酶催化合成聚合物的过程没有中间产物低聚果糖的积累,其果聚糖链与酶相结合可以产生高聚合度的Levan多糖,称为高度连续性增长机制,如巨大芽孢杆菌、枯草芽孢杆菌和唾液链球菌[46,47];而革兰氏阴性菌产的Levan蔗糖酶在反应过程中会生成中间产物,因为水解酶活性依次释放果糖基形成低聚果糖,导致Levan多糖产量低,这是一种半连续性增长机制,如谷氨酸杆菌、解淀粉欧文菌和丁香假单胞菌[48,49]。不同细菌Levan蔗糖酶对果糖基受体的亲和力有显著差异,因此合成Levan多糖的能力不同,进而需要更深一步研究Levan多糖的合成机制及建立模型。
3 酶法合成Levan多糖的过程调控
通过酶法合成的过程调控,可以提高Levan多糖产量和控制其分子量。目前,国内外相关的研究主要通过温度、蔗糖浓度、pH、离子强度、合成酶的固定化及酶浓度等对酶法合成Levan多糖的过程进行调控。
3.1 温度的影响
温度影响酶活性及催化反应速率。解淀粉芽孢杆菌在4 ℃时聚合酶活性最高,而在30 ℃时水解酶活性最高[50];产左聚糖细杆菌ATCC15953的Levan蔗糖酶聚合最佳温度为30 ℃,但是水解最佳温度在45~50 ℃之间[51]。此外,通过控制温度可以调控Levan多糖的分子量分布,在50 ℃下地衣芽孢杆菌RN-01产的Levan蔗糖酶主要合成高分子量Levan多糖(612 kDa),在30 ℃时主要产低分子量多糖(11 kDa);Santos-Moriano等[52]发现运动发酵单胞菌Levan蔗糖酶,在蔗糖浓度为100 g/L时,4 ℃下蔗糖转化率为15.7%,转糖基与水解反应的比率为2.4;40 ℃时蔗糖转化率为77.2%,转糖基与水解反应的比率为0.8。因此,温度会影响水解酶活、转糖基酶活及Levan多糖分子量分布;通常Levan蔗糖酶的蔗糖水解反应的最佳温度比聚合反应的最佳温度高,在低温下(10~30 ℃)有利于聚合形成Levan多糖。
3.2 蔗糖浓度的影响
通常Levan多糖的产量随着蔗糖浓度的增加而增加,陆娟等[53]使用地衣芽孢杆菌Levan蔗糖酶在一定条件下培养,蔗糖浓度范围为10~90 g/L,合成Levan多糖的产量随着蔗糖量浓度的增大而增大。Porras-Domínguez等[54]研究发现在37 ℃时,枯草芽孢杆菌168 Levan蔗糖酶合成的低分子量分布Levan多糖随着蔗糖浓度的增加其分子量大小呈降低趋势;并且在低底物浓度下该酶仅有20%转糖基效率,而在高底物浓度下达到83%,说明Levan蔗糖酶的转移酶活性随底物浓度增加而增加。此外,Belghith K S等研究发现蔗糖浓度影响嗜热芽孢杆菌的菌体生长和Levan蔗糖酶的产量,在1%~10%(W/V)低蔗糖浓度时碳源主要供给菌体生长而非合成Levan蔗糖酶,蔗糖浓度达到30%(W/V)时Levan蔗糖酶的产量与活性均显著提高。因此,影响Levan蔗糖酶产量的重要因素是蔗糖浓度而不是菌体细胞的大小;蔗糖浓度变化使Levan蔗糖酶的水解活性和转糖基活性受到影响,同时也会改变产物Levan多糖的分子量分布状况。
3.3 pH的影响
pH影响酶蛋白的稳定性及构象,并且通过改变酶与底物的结合或解离状态来影响酶活力,改变催化速率。地衣芽孢杆菌8-37-0-1重组Levan蔗糖酶的最适pH为6.0,而pH<4.0或pH>8.5时酶活力下降50%;运动发酵单胞菌102250产的Levan蔗糖酶最适pH为6.0;肠膜明串珠菌ATCC8293产的Levan蔗糖酶最适pH为6.5~7.0,当pH超过8.0时酶活迅速下降[55]。所以,通常Levan蔗糖酶最适pH值范围为6.0~7.0左右,在大多数情况下pH值的变化不影响Levan蔗糖酶的水解酶活性和转移酶活性。
3.4 离子强度的影响
金属离子可以调控培养基的离子强度,作为某些酶蛋白分子的激活剂、抑制剂及辅助因子,影响酶的氨基酸电离、氢键及酶蛋白分子结构。枯草芽孢杆菌Levan蔗糖酶有Ca2+结合位点,可以稳定活性残基之间的关键结合区域;而谷氨酸木醋杆菌Levan蔗糖酶通过二硫键产生类似折叠稳定的作用,无Ca2+存在时酶活力高[56]。地衣芽孢杆菌RN-01产的Levan蔗糖酶,Mn2+存在时酶活增加2.4倍,而Cu2+,Zn2+,Fe3+,SDS,EDTA存在时酶轻微失活,50 ℃时加入0.5 mol/L NaCl后催化合成的Levan多糖分子量从612 kDa降到11 kDa。甲基营养芽孢杆菌SK21.002产的Levan蔗糖酶,Cu2+、Zn2+、Fe3+和N2+对水解酶活和转糖基酶活呈抑制作用;而Mg2+作为激活剂提高酶活,促进合成高产量Levan多糖;嗜热芽孢杆菌Levan蔗糖酶在50 mmol/L Fe2+存在时,酶活增加4倍。因此,通常Mg2+可提高Levan蔗糖酶酶活,Ca2+影响Levan蔗糖酶的催化结构域;NaCl会与底物竞争水分子,促进转糖基反应;此外,强离子作用可能影响酶的氢键,导致酶连续性合成能力降低,多产生低分子量的Levan多糖。
3.5 合成酶的固定化
利用酶的固定化技术提高酶的稳定性及循环利用率,使产物更容易分离纯化。Esawy等[57]证明枯草芽孢杆菌NRC33a产的Levan蔗糖酶与戊二醛共价结合到壳聚糖上可获得最高固定化率81.51%。Jang K H等[58]将运动发酵单胞菌Levan蔗糖酶通过离子结合固定在羟基磷灰石表面后,用于生产低分子量的Levan多糖。Chiang等进行运动发酵单胞菌Levan蔗糖酶的重组表达,并固定于几丁质上,在蔗糖浓度200 g/L时合成产物83 g/L,比游离酶合成产量提高了66%,并且合成高/低分子量Levan多糖的比例没有改变。对Levan蔗糖酶进行固定化处理在一定程度上不仅可以提高酶的利用率,而且可以简化后期Levan蔗糖的分离纯化程序,节省大量有机溶剂的使用。
3.6 酶浓度的影响
根据不同的酶浓度控制Levan多糖的分子量分布。Jaime R等发现枯草芽孢杆菌168的Levan蔗糖酶反应体系中,1 U/mL酶浓度下得到双峰重均分子量分布;大于5 U/mL高酶浓度下获得低分子量Levan多糖(平均7.2 kDa);0.1 U/mL低酶浓度下获得高分子量Levan多糖(大于2×103kDa)。Raga-Carbajal等[59]发现低浓度的枯草芽孢杆菌Levan蔗糖酶(0.1 U/mL)通过连续性机制合成高分子量Levan多糖(平均2.3×103kDa)。因此,酶浓度不仅影响转糖基反应,也影响Levan多糖的平均分子量和分枝数;且在反应过程中由于存在不同果糖亲和受体会产生不同分子量的Levan多糖产物。
4 结语
Levan多糖由于其多样的生理活性已经成为多糖开发的一个热点,其制备方法的研究是Levan多糖商业化利用的前提。目前Levan多糖的工业化制备还限于微生物发酵阶段,存在着诸多的不足和需要改进的地方。而酶法由于反应体系简单、制备工艺简洁、产率高等优点迅速引起广大研究者的兴趣。但是目前生产菌株产酶率不高,Levan蔗糖酶的分泌过程复杂等原因造成Levan蔗糖酶活性较低,故而酶法合成Levan多糖还处于实验研究阶段。未来酶法合成Levan多糖的研究可以集中在酶活力的提高及后期Levan多糖的分离纯化,例如可以利用基因工程制备工程菌或构建重组酶,改善酶活,并且可以通过酶的化学修饰强化酶的催化性能;而分离纯化方面,可以采用耦合其他技术,如固定化、酶耦合膜技术等。尽管目前酶法在制备Levan多糖中还面临着诸多挑战,但是随着研究的深入和创新性成果的不断涌现,酶法合成Levan多糖必将更加成熟和高效。
[1]Srikanth R,Reddy C H,Siddartha G,et al.Review on production,characterization and applications of microbial Levan[J].Carbohydrate Polymers,2014,120:102-114.
[2]朱明婧,刘博,李飞飞.天然甜味剂研究进展与开发前景分析[J].中国调味品,2015,40(11):136-140.
[3]李兴军.果聚糖的合成与利用[J].中国食物与营养,2010(2):23-26.
[4]Abdel-Fattah A M,Gamal-Eldeen A M,Helmy W A,et al.Antitumor and antioxidant activities of Levan and its derivative from the isolateBacillussubtilis,NRC1 aza[J].Carbohydrate Polymers,2012,89(2):314-322.
[5]Bondarenko O M,Ivask A,Kahru A,et al.Bacterial polysaccharide Levan as stabilizing,non-toxic and functional coating material for microelement nanoparticles[J].Carbohydrate Polymers,2015,136:710-720.
[6]Stefan O,Sehgelmeble F W.Chemical syntheses of inulin and Levan structures[J].Journal of Organic Chemistry,2002,67(24):8457.
[7]陆娟,唐俊,肖敏,等.Levan果聚糖的应用与生产研究进展[J].生物学杂志,2013,30(6):86-90.
[8]Feng J,Gu Y,Quan Y,et al.Recruiting a new strategy to improve Levan production inBacillusamyloliquefaciens[J].Scientific Reports,2015,5:13814.
[9]Silbir S,Dagbagli S,Yegin S,et al.Levan production byZymomonasmobilisin batch and continuous fermentation systems[J].Carbohydrate Polymers,2014,99(1):454.
[10]Xu X,Gao C,Liu Z,et al.Characterization of the Levan produced byPaenibacillusbovissp.nov BD3526 and its immunological activity[J].Carbohydrate Polymers,2016,144:178-186.
[11]Tian F,Karboune S.Enzymatic synthesis of fructooligosaccharides by Levansucrase fromBacillusamyloliquefaciens: specificity,kinetics,and product characterization[J].Journal of Molecular Catalysis,2012(82):71-79.
[12]陈华磊,侯殿志,于玥,等.酶法合成中合成酶的应用研究[J].中国食品添加剂,2016(6):114-124.
[13]陆娟,卢丽丽,肖敏,等.Levan蔗糖酶及其在Levan果聚糖合成中的应用[J].微生物学报,2014,54(6):601-607.
[14]Arvidson S A,Rinehart B T,Gadala-Maria F.Concentration regimes of solutions of Levan polysaccharide fromBacillussp.[J].Carbohydrate Polymers,2006,65(2):144-149.
[15]Öner E T,Hernández L,Combie J.Review of Levan polysaccharide:from a century of past experiences to future prospects[J].Biotechnology Advances,2016,34(5):827-844.
[16]Visnapuu T,Mardo K,Mosoarca C,et al.Levansucrases fromPseudomonassyringaepv.tomato andP.chlororaphissubsp.aurantiaca:substrate specificity,polymerizing properties and usage of different acceptors for fructosylation[J].Journal of Biotechnology,2011,155(3):338-349.
[17]Zhang T,Li R,Qian H,et al.Biosynthesis of Levan by Levansucrase fromBacillusmethylotrophicusSK 21.002[J].Carbohydrate Polymers,2014,101(2):975-981.
[18]Ben A Y,Matsubara T,Ito K,et al.Characterization of a thermostable Levansucrase fromBacillussp.TH4-2 capable of producing high molecular weight Levan at high temperature[J].Journal of Biotechnology,2002,99(2):111-119.
[19]Nakapong S,Pichyangkura R,Ito K,et al.High expression level of Levansucrase fromBacilluslicheniformisRN-01 and synthesis of Levan nanoparticles[J].International Journal of Biological Macromolecules,2013,54:30-36.
[20]Lu L,Fu F,Zhao R,et al.A recombinant Levansucrase fromBacilluslicheniformis8-37-0-1 catalyzes versatile transfructosylationreactions[J].Process Biochemistry,2014,49(9):1503-1510.
[21]Feng T,Inthanavong L,Karboune S.Purification and characterization of Levansucrases from in intra- and extracellular forms useful for the synthesis of Levan and fructooligosaccharides[J].Agricultural and Biological Chemistry,2011,75(10):1929-1938.
[22]Belghith K S,Dahech I,Belghith H,et al.Microbial production of Levansucrase for synthesis of fructooligosaccharides and Levan[J].International Journal of Biologycal Mcromolecules,2012,50(2):451-458.
[23]Chiang C J,Wang J Y,Chen P T,et al.Enhanced Levan production using chitin-binding domain fused Levansucrase immobilized on chitin beads[J].Applied Microbiology and Biotechnology,2009,82(3):445-451.
[24]Rairakhwada D,Seo J W,Seo M Y,et al.Gene cloning,characterization,and heterologous expression of Levansucrase fromBacillusamyloliquefaciens[J].Journal of Industrial Microbiology & Biotechnology,2010,37(2):195-204.
[25]Dahech I,Belghith K S,Belghith H,et al.Partial purification of aBacilluslicheniformis,levansucrase producing Levan with antitumor activity[J].International Journal of Biological Macromolecules,2012,51(3):329-335.
[26]Strube C P,Homann A,Gamer M,et al.Polysaccharide synthesis of the Levansucrase SacB fromBacillusmegateriumis controlled by distinct surface motifs[J].Journal of Biological Chemistry,2011,286(20):17593-17600.
[27]Inthanavong L,Tian F,Khodadadi M,et al.Properties ofGeobacillusstearothermophiluslevansucrase as potential biocatalyst for the synthesis of Levan and fructooligosaccharides[J].Biotechnology Progress,2013,29(6):1405-1415.
[28]Hijum S A,Szalowska E,Maj V D M,et al.Biochemical and molecular characterization of a Levansucrase fromLactobacillusreuteri[J].Microbiology (Reading,England),2004,150(3):621-630.
[29]宋廷富,姜腾飞,李茜,等.产大分子Levan的果糖基蔗糖转移酶的原核表达及酶学性质[J].应用与环境生物学报,2016(2):195-200.
[30]Waldherr F W,Meissner D,Vogel R F.Genetic and functional characterization ofLactobacilluspanis,levansucrase[J].Archives of Microbiology,2008,190(4):497-505.
[31]Jakob F,Mei Bner D,Vogel R F.Comparison of novel GH 68 Levansucrases of levan-overproducing gluconobacter species[J].Acetic Acid Bacteria,2012(1):2.
[32]Menéndez C,Banguela A,Caballeromellado J,et al.Transcriptional regulation and signal-peptide-dependent secretion of exoLevanase (LsdB) in the endophyte gluconacetobacter diazotrophicus[J].Applied & Environmental Microbiology,2009(75):1782-1785.
[33]Arrieta J G,Sotolongo M,Menéndez C,et al.A type II protein secretory pathway required for Levansucrase secretion by gluconacetobacter diazotrophicus[J].Journal of Bacteriology,2004,186(15):5031-5039.
[34]吴菁,刘秀敏,张维,等.枯草芽孢杆菌sacB基因的功能验证及应用[J].核学报,2008,22(5):590-594.
[35]贾凡,毛自朝,王志远,等.枯草芽孢杆菌XF1菌株中XFsacA基因的克隆及功能验证[J].华南农业大学学报,2012,33(2):154-158.
[36]Hijum S A,Kralj S,Ozimek L K,et al.Structure-function relationships of glucansucrase and fructansucrase enzymes from lactic acid bacteria[J].Microbiology & Molecular Biology Reviews,2006,70(1):157-176.
[37]Ozimek L K,Hijum S A,Koningsveld G A,et al.Site-directed mutagenesis study of the three catalytic residues of the fructosyltransferases ofLactobacillusreuteri121[J].FEBS Letters,2004,560(1-3):131-133.
[38]Lammens W,Roy K L,Schroeven L,et al.Structural insights into glycoside hydrolase family 32 and 68 enzymes: functional implications[J].Journal of Experimental Botany,2009,60(3):727-740.
[39]Meng G,Fütterer K.Structural framework of fructosyltransfer inBacillussubtilisLevansucrase[J].Nature Structural Biology,2003,10(11):935-941.
[40]李润静.产果聚糖蔗糖酶菌株筛选及酶的分离纯化、酶学性质研究和Levan果聚糖的酶法合成[D].无锡:江南大学,2013.
[41]Rye C S,Withers S G.Glycosidase mechanisms[J].Current Opinion in Chemical Biology,2000,4(5):573-580.
[42]Lee S S,Yu S,Withers S G.Detailed dissection of a new mechanism for glycoside cleavage: alpha-1,4-glucanlyase[J].Biochemistry,2003,42(44):13081-13090.
[43]Weijers C A,Franssen M C,Visser G M.Glycosyltransferase catalyzed synthesis of bioactive oligosaccharides[J].Biotechnology Advances,2008,26(5):436-456.
[44]Li W,Yu S,Zhang T,et al.Recent novel applications of Levansucrases[J].Applied Microbiology and Biotechnology,2015,99(17):6959-6969.
[45]Méndez-Lorenzo L,Porras-Domínguez J R,Raga-Carbajal E,et al.Intrinsic Levanasactivity ofBacillussubtilis168 Levansucrase (SacB)[J].Plos One,2015,10(11):143394.
[46]Ozimek L K,Kralj S,Maj V D M,et al.The Levansucrase and inulosucrase enzymes ofLactobacillusreuteri121 catalyse processive and non-processive transglycosylation reactions[J].Microbiology,2006,152(4):1187-1196.
[47]Homann A,Biedendieck R,Götze S,et al.Insights into polymer versusoligosaccharide synthesis:mutagenesis and mechanistic studies of a novel Levansucrase fromBacillusmegaterium[J].Biochemical Journal,2007,407(2):189-198.
[48]Caputi L,Nepogodiev S A,Malnoy M,et al.Biomolecular characterization of the Levansucrase of Erwinia amylovora,a promising biocatalyst for the synthesis of fructooligosaccharides[J].Journal of Agricultural & Food Chemistry,2013,61(50):12265-12267.
[49]Visnapuu T,Mardo K,Alamäe T.Levansucrases of aPseudomonassyringaepathovar as catalysts for the synthesis of potentially prebiotic oligo- and polysaccharides[J].New Biotechnology,2015,32(6):1885-1889.
[50]Rairakhwada D,Jeongwoo S,Miyoung S,et al.Gene cloning,characterization,and heterologous expression of Levansucrase fromBacillusamyloliquefaciens[J].Journal of Industrial Microbiology & Biotechnology,2010,37(2):195-204.
[51]Park H E,Na H P,Kim M J,et al.Enzymatic synthesis of fructosyl oligosaccharides by Levansucrase from microbacterium laevaniformans ATCC 15953[J].Enzyme & Microbial Technology,2003,32(7):820-827.
[52]Santos-Moriano P,Fernandez-Arrojo L,Poveda A,et al.Levan versus fructooligosaccharide synthesis using the Levansucrase fromZymomonasmobilis:effect of reaction conditions[J].Journal of Molecular Catalysis B Enzymatic,2015,119:18-25.
[53]陆娟,肖敏,卢丽丽.地衣芽孢杆菌产Levan果聚糖发酵条件的优化[J].食品科学,2011,32(7):183-187.
[54]Porras-Domínguez J R,vila-Fernández,Miranda-Molina A,et al.Bacillussubtilis168 Levansucrase (SacB) activity affects average Levan molecular weight[J].Carbohydrate Polymers,2015,132:338-344.
[55]Olvera C,Centeno-Leija S,López-Munguía A.Structural and functional features of fructansucrases present inLeuconostocmesenteroidesATCC 8293[J].Antonie van Leeuwenhoek,2007,92(1):11-20.
[56]Martinez-Fleites C,Ortiz-Lombardia M,Pons T,et al.Crystal structure of Levansucrase from the gram-negative bacterium gluconacetohacter diazotrophicus[J].Biochemical Journal,2005,390(1):19-27.
[57]Esawy M A,Mahmoud D A R,Fattah A F A.Immobilisation ofBacillussubtilisNRC33a Levansucrase and some studies on its properties[J].Brazilian Journal of Chemical Engineering,2008,25(2):237-246.
[58]Jang K H,Song K B,Kim J S,et al.Production of Levan using recombinant Levansucrase immobilized on hydroxyapatite[J].Bioprocess and Biosystems Engineering,2000,23(1):89-93.
[59]Raga-Carbajal E,Carrillo-Nava E,Costas M,et al.Size product modulation by enzyme concentration reveals two distinct Levan elongation mechanisms inBacillussubtilisLevansucrase[J].Glycobiology,2015,26(4):377.
Process Control and Mechanism Analysis of Levan Polysaccharide by Enzymatic Synthesis
HUANG Shuang-xia1,3, HOU Dian-zhi1,3, CHEN Hua-lei1,3, YU Yue1,3LAN Wei-bing1,3, WANG Shuai-jing1,3, CHEN Shan1,2,3*
(1.Research Center of Sugar Industry Engineering Technology of Guangxi University, Nanning 530004, China;2.Guangxi Sugar Industry Collaborative Innovation Center, Nanning 530004, China;3.Engineering Center of Sugar Industry and Comprehensive Utilization, Ministry of Education,Nanning 530004, China)
Levan, an extracellular polysaccharide, is composed of β-2,6 glycosidic linkage in the main chain and β-2,1 glycosidic linkage in the branch. Due to the promising physiological effects of prebiotics, reducing blood fat and anticancer, Levan exhibits great potential in food and pharmaceutical industries. Summarize the preparation methods of Levan polysaccharide, process control and mechanism analysis of Levan polysaccharide by enzymatic synthesis.Meanwhile,the existing problems in the process of enzymatic synthesis are discussed and the orientation of further research of Levan polysaccharide by enzymatic synthesis is prospected in the future.
Levan polysaccharide;enzymatic synthesis;Levansucrase;synthesis mechanism;process control
2017-03-18 *通讯作者
国家自然科学基金项目(21264003)
黄双霞(1992-),女,硕士,研究方向:糖厂副产物综合利用与糖类药物开发。
TS244
A
10.3969/j.issn.1000-9973.2017.09.036
1000-9973(2017)09-0145-08
