猪β-防御素cDNA在枯草芽抱杆菌中的高效表达
2017-09-15邹辉琴张皓然苟兴华
王 娜,李 钢,邹辉琴,温 静,陈 松,张皓然,苟兴华*
猪β-防御素cDNA在枯草芽抱杆菌中的高效表达
王 娜1,李 钢2,邹辉琴2,温 静2,陈 松2,张皓然2,苟兴华1*
(1.成都大学,四川成都 610106;2.四川华德生物工程有限公司,四川成都 610063)
【目的】猪β-防御素(β-defensin)是猪自身分泌的一种能够杀菌、调节免疫功能的小分子抗菌肽,是猪生长繁殖不可缺少的蛋白质。【方法】根据NCBI数据库中的猪防御素cDNA序列,人工合成该基因序列,同时引入相关调控序列及适当酶切位点。酶切该人工合成的DNA后,连接到表达载体pHT43中,然后转化大肠杆菌(Escherichia coli)DH5α,获得的转化子用于筛选重组表达质粒。将获得的重组表达质粒pHT43-SS-BD转化到枯草芽抱杆菌(Bacillus subtilis)WB800N中,获得基因工程菌株。使用蔗糖诱导基因工程菌表达猪β-防御素,SDS-PAGE鉴定其分子量大小,抑菌试验测定其抑菌活性。【结果】SDS-PAGE电泳结果显示在蔗糖诱导后得到约5 KDa的目的蛋白条带;平板抑菌试验结果表明,蔗糖诱导后的上清液对革兰氏阳性菌和革兰氏阴性菌都有抑菌效果,而没加蔗糖的对照组上清液无抑菌效果。【结论】该研究实现猪β-防御素cDNA在枯草芽抱杆菌中的高效表达,为解决抗菌肽来源限制及枯草芽抱杆菌的生产应用奠定了技术基础。
猪β-防御素;基因表达;活性检测;枯草芽抱杆菌
【研究意义】当今世界人们的经济水平提高,对食物的品质要求也提高,猪肉已经成为人们日常生活必不可少的食物。由此可见,猪肉具有巨大的市场。在养猪的过程中,防止其感染、生病以避免造成经济损失,控制猪的死亡率是非常重要的。通常人们在养殖过程中会对猪注射抗生素,但是由于抗生素的滥用造成的微生物的耐药性问题令科学家头痛不已。因此,开发或寻找替代抗生素的产品已经成为当今医药业、畜牧业的热点。防御素是生物体自身合成的一类多肽,由6个半胱氨形成3对二硫键。1972年由瑞典科学家首次从果蝇中分离出来并证明其具有抗菌效果[1]。动物种类分析显示防御素在动物基因复制发生物种特异性扩张,目前在猪的身上发现只含有β-防御素是可以解释的[2]。β-防御素是特异性免疫因子,功能有:细胞信号、化学引诱物、免疫、再生等[3]。【前人研究进展】目前,研究表明,β-防御素几乎存在所有生物类群体内,是生物体长期进化过程中与病原微生物斗争的产物,对部分真菌、原虫、病毒甚至是癌细胞都有明显的杀伤作用,同时参与脊椎动物的特异性和非特性免疫调节反应,对细胞没有溶血活性[4]。对于动物来说,自身组织器官产生的防御素非常重要,特别是对免疫缺陷或低的动物,可以提高其存活率[5]。到目前为止,很少发现防御素有诱导产生耐药菌株的情况,是一类具有重要潜在应用价值的活性物质。【本研究切入点】本实验采用基因工程技术,将猪的β-防御素克隆到枯草芽孢杆菌中,通过发酵得到基因工程防御素,并测定其分子量及对革兰氏阳性菌和革兰氏阳性菌的抗菌活性。【拟解决的关键问题】β-防御素基因能够在枯草芽孢杆菌中正常表达且具有抗菌活性同时不对枯草芽孢杆菌产生毒性。
1 材料与方法
1.1 供试材料
1.1.1 菌株和质粒 SS-BD、pHT43、E.Coli DH5α、B.subtilis WB800N。
1.1.2 重组质粒构建相关试剂耗材 限制性内切酶Bam H I和Kpn I,ligation试剂盒,PCR片段纯化试剂盒均购置于Takara;氨苄青霉素和氯霉素购自AMRESCO公司;质粒DNA小抽试剂盒购置于QIAUGEN。其它化学试刻均为国产试剂。
1.1.3 主要仪器和设备 DNA电泳仪、PCR仪、凝胶成像仪、超净工作台、离心机、恒温培养箱、温控摇床、蛋白电泳系统、脱色摇床、恒温水浴锅和紫外分光光度计。
1.2 试验方法
1.2.1 NCBI数据库中调取已知猪防御素(BD)序列 序列如下所示:1 GACCACTACA TATGTGCCAA GAAAGGGGGG ACCTGCAACT TCTCCCCCTG CCCG CTCTTC 61 AACAGGATTG AAGGGACCTG TTACAGTGGC AAGGCCAAGTGCTGCATCCG CTGA。
1.2.2 目的基因序列的设计 在猪防御素基因(Accession No:214442)前面加上Sac B和Samy Q序列,Sac B作为蔗糖诱导型启动子可以使宿主菌通过蔗糖诱导表达出目的蛋白。Samy Q作为一种信号肽基因可以使宿主菌表达的目的蛋白分泌到胞外。并在两端加入Kpn I和Bam HⅠ识别位点后直接由Invitrogen合成。
1.2.3 重组质粒的连接 用Kpn I和Bam HⅠ对目的基因及pHT43进行双酶切,连接并转化大肠杆菌DH5α,进行阳性克隆验证,将验证完成的阳性克隆挑选几个送检测序,待序列完全吻合以后获得重组质粒pHT-BD提取质粒备用。
1.2.4 枯草芽抱杆菌感受态细胞的制备和转化
根据MoBiTec提供的《枯草芽孢杆菌表达载体》的参考方法说明,将重组质粒pHT43-BD转入感受态枯草芽孢杆菌WB800N中。涂含5μg/mL的氯霉素平板,置于37℃培养箱中过夜。
1.2.5 目的蛋白的诱导表达 将转化板上新鲜单克隆分别接种于5 mL体积LB培养基中(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,5μg/mL氯霉素,pH自然),置于摇床,37℃,180 r/min,过夜培养。按1%的接种量将上述过夜的一级培养液分别接种于50 mL新鲜LB培养基中(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,5μg/mL氯霉素,pH自然),置于摇床,37℃,225 r/min条件下培养。当OD600达到0.8左右时加入蔗糖至终浓度10 mM,在37℃诱导,诱导时间24 h。将诱导表达的菌悬液留样备用。以不加蔗糖的作为阴性对照,处理条件同上,培养完成后收集菌悬液备用。
1.2.6 目的蛋白的的活性检测 将菌悬液12 000 r/min,离心10 min收集上清液,通过真空冷冻干燥将上清液浓缩成粉剂以后,用无菌蒸馏水将粉剂按照0.2 g/mL的浓度配置成样液,然后通过平板扩散法活性检测,指示菌:大肠杆菌;金黄色葡萄球菌。A和A2阳性对照:针对不同指示菌的2种抗生素。B2供试样品:经蔗糖诱导的真空冷冻干燥的上清液粉剂。C阴性对照:未经蔗糖诱导的真空冷冻干燥的上清液粉剂。
2 结果与分析
2.1 猪β-防御素基因的PCR鉴定
随机挑选菌落,以目的基因的上下游为引物进行菌落PCR后,跑核酸电泳。结果为:1、9泳道都为DNA Marker,2~8号泳道都是挑取进行菌落PCR扩增后的产物,2~8号泳道在含有500 bp左右的目的基因片段,说明所挑选的菌落中含有pHT43-SSBD质粒(图1)。
2.2 重组猪β-防御素的SDS-PAGE鉴定
含有猪β-防御素基因的枯草芽孢杆菌,需要通过LB培养基培养适宜时间后,蔗糖诱导,取菌液上清液,对比不添加蔗糖的阳性枯草芽孢杆菌培养后的菌液上清液。进行SDS-PAGE电泳结果为:1号泳道为蛋白Marker,在4 kDa处2~5号泳道(蔗糖诱导后的阳性枯草芽孢杆菌菌液)有清晰可见的条带,而6号(未添加蔗糖的阳性枯草芽孢杆菌)没有可见条带,说明猪β-防御素已经被成功诱导分泌表达(图2)。
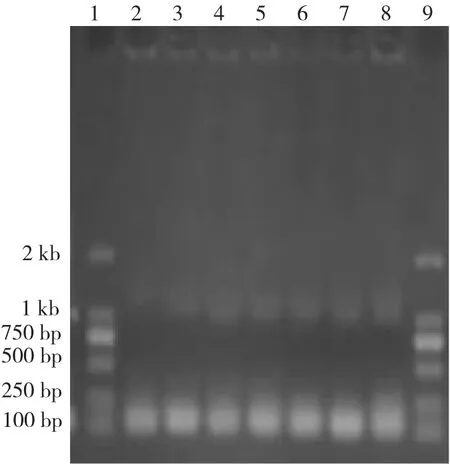
图1 猪β-防御素基因的检测Fig.1 Detection of porcineβ-defensin genes

图2 蛋白电泳结果Fig.2 Result of SDS-PAGE
2.3 平板抑菌实验
为了进一步检测防御素是否在枯草芽孢杆菌中成功表达,通过猪β-防御素对革兰氏阴性菌和革兰氏阳性菌的抑菌活性的性质进行检测。其间需要用对金黄色葡萄球菌和大肠杆菌有抑菌活性的抗生素为正对照,没经过诱导的菌液为负对照。从图3可以看出,2种抗生素分别抑制金黄色葡萄球菌和大肠杆菌,含猪β-防御素的菌液B2对金黄色葡萄球菌和大肠杆菌都具备抑菌效果,而没经过诱导的菌液则对2种指示菌都没有抑菌效果。菌液没有抗生素的抑菌效果好是因为没有进行纯化,浓缩,活性单位不够高导致的。
3 讨 论

图3 猪β-防御素活性检测Fig.3 Detection of porcineβ-defensin activity
通过密码偏爱性设计猪β-防御素基因在大肠杆菌中表达,比没有偏爱性设计的活性高了4~5倍,但作者并没有详细介绍其产量及活性[6]。同样也有在毕赤酵母中表达猪β-防御素,但是表达周期太长,需要140 h左右,时间成本过大[7]。在动物方面,转基因猪过表达猪β-防御素能抵御胸膜肺炎防线杆菌的感染[8]。本研究用枯草芽孢杆菌WB800N作为宿主,其缺少自身分泌的8种蛋白酶可以减小β-防御素被降解的概率[9-11]。枯草芽孢杆菌作为宿主菌与大肠杆菌比较有很多优点:大肠杆菌有热源性脂多糖、易致病;有噬菌体和质粒合适于用作克隆载体;分泌蛋白能力强,大大缩短提取目的蛋白的过程;具有良好发酵基础和生产技术。近十年来,枯草杆菌表达系统不断被发展和完善,许多外源蛋白获得高效表达[12]。
枯草芽孢杆菌(Bacillus subtilis)的sac B基因编码的蛋白为分泌型的蔗糖果聚糖酶,此酶能催化蔗糖水解产生葡萄糖和果聚糖[13]。Sac B基因赋予细胞的蔗糖敏感特性作为一种阴性筛选克隆的标记,在生物研究中特别是在基因克隆等遗传操作中有着广泛的应用[14-16]。Samy Q作为一种信号肽基因可以使宿主菌表达的目的蛋白分泌到胞外,减少提取工艺。枯草芽孢杆菌作为饲料添加剂以内生孢子形式存在于饲料中,能耐高温、耐酸、耐胆盐。研究表明,枯草芽孢杆菌进入动物肠道能迅速萌发成具有新陈代谢作用的营养型细菌,调节肠道菌群平衡、提高饲料利用率、增强动物机体免疫力,从而提高动物的健康水平[17]。
所有脊椎动物防御素(α-防御素、β-防御素、θ-防御素)有不同结构和不同的抗菌活性。人体存在α-防御素,pH会影响其活性[18];β-防御素一般在上皮组织表达[19],在牛舌中第一次发现他的存在,人、猿、牛、齿类动物都有,猪和鸟体内只表达β-防御素[20]。猪体内的发现β-防御素都是通过基因序列分析,除了猪β-防御素1[21]。θ-防御素是防御素家族中唯一有环状结构的多猪β-防御素2对革兰氏阳性菌和革兰氏阳性菌有很好的抑菌效果,对从病禽体内分离出来的多重耐药菌也有抑制作用[22]。
β-防御素通过6个半胱氨酸序列鉴定出来,CX6-C-X4-C-X9-C-X6-C-C,X代表任何氨基酸残基,活性中心的氨基酸序列也是鉴别方法之一。猪β-防御素由30~45个氨基酸构成,5~12个带正电荷氨基酸残基如赖氨酸和精氨酸。典型的猪β-防御素包含一个α-螺旋和3个β-折叠[23]。该结构虽然没有证明是否对其活性有影响,但是可以维持其稳定性防止被其他酶水解。许多假设认为影响β-防御素活性的是带正电荷和其等电点,这样就可以和细菌细胞膜上带负电荷的脂多糖和磷脂相互作用增强细胞膜渗透性造成细菌死亡,也可以进入细胞和DNA、RNA结合来杀死细胞。虽然猪β-防御素在动物体内免疫机理不是很明显,但是国内已经有人着手研究抗猪β-防御素的抗体,因抗体的特异性和灵敏度来研究猪β-防御素在猪体内的表达及一些机理[21]。
目前猪β-防御素的最新研究主要有:用精氨酸或赖氨酸代替猪β-防御素的个别氨基酸,来研究正电荷对猪β-防御素的抗菌活性影响[24]。Zn2+和L-异亮氨酸加入表达β-防御素的IPEC-J2细胞12 h后,表达β-防御素的mRNA和β-防御素含量明显提高,在100μmol/mL Zn2SO4和25μg/mL L-异亮氨酸表达量达到最高[25]。比较眉山本地猪和杂交猪不同组织表达β-防御素的量,大多器官中眉山猪表达量要,所以其免疫力要高一些[26]。在毕赤酵母中表达猪β-防御素,但是表达量不高,活性屏蔽[27]。从最新研究进展中可以得出:虽然有大肠杆菌做宿主但是活性并没有多理想,而毕赤酵母的生长周期太长、活性低,所以猪β-防御素在枯草芽孢杆菌中表达很有前景。未来对β-防御素的研究方向可以在基因组添加适宜的精氨酸或赖氨酸基因序列来提高其活性;在培养基中添加Zn2+和L-异亮氨酸来提高其表达量,为以后对其在体内的作用机制提供研究。
[1]Sugiarto H,PL Yu.Avian antimicrobial peptides:the defense role of bata-defensins[J].Biochemical Biophysical Research Communication,2004(3):721-727.
[2]Jones E A,Cheng Y,O′Meally D,etal.Characterization of the antimicrobial peptide family defensins in the Tasmanian devil(Sarcophilus harrisii),koala(Phascolarctos cinereus),and tammar wallaby (Macropus eugenii)[J].Immunogenetics,2016(3):133-143.
[3]Narciandi F,Fernandez-Fuertes B,Khairulzaman I,et al.Spermcoatingβ-defensin 126 is a dissociation-resistant dimer produced by epididymal epithelium in the bovine reproductive tract[J].Biology of Reproduction,2016(6):121-129.
[4]TomasGanz M E S,Dorothy Szklarek,Sylvia SL,etal.Defensins: natural peptide antibiotics of human neutrophils[J].Human Neutrophil Defensins,1985,76:1427-1435.
[5]Lee M O,Jang H J,Rengaraj D,et al.Tissue expression and antibacterial activity of host defense peptides in chicken[J].BMC Veterinary Research,2016,12:231-239.
[6]Gao C Y,Xu T T,Zhao Q J,etal.Codon optimization enhances the expression of porcineβ-defensin-2 in Escherichia coli[J].Genetics and Molecular Research,2015,14:4978-4988.
[7]Peng Z,Wang A,Feng Q,etal.High-level expression,purification and characterisation of porcineβ-defensin 2 in Pichia pastorisand its potential as a cost-efficient growth promoter in porcine feed[J].Applied Microbiology and Biotechnology,2014,98:5487-5497.
[8]Yang X,Cheng Y T,Tan M F,etal.Overexpression of porcine beta-defensin 2 enhances resistance toactinobacillus pleuropneumoniae infection in pigs[J].Infection and Immunity,2015,83:2836-2843.
[9]Sarvas M.Gene expression in recombinant Bacillus[J].Bioprocess Technol,1995,22:53-57.
[10]Wong SL,Kawamura F,DoiR H.Use of the Bacillus subtilis subtilisin sign peptide for efficient secretion of Tem betalactamase during growth[J].Journal of Bacteriology,1986,168(2):1005-1009.
[11]Wu Xu,Lee W,Tran L,et al.Engineering a Bacillus subtilis expression-secretion system with a strain deficient in six extracellular proteases[J].JBacteriol,1991,173(16):4952-4958.
[12]谢光蓉,乔代蓉,曹 毅.重组枯草芽孢杆菌α-淀粉酶基因工程菌构建与表达[J].食品与发酵科技,2012,48(3):13-17.
[13]吴 菁,刘秀敏,张 维,等.枯草芽孢杆菌sacB基因的功能验证及应用[J].核农学报,2008,22(5):590-594.
[14]Quenee L,Lamotte D.Combined sacB2based negative selection and crelox antibiotic marker recycling for efficient gene deletion in Pseudomonasaeruginosa[J].Bio Techniques,2005,38:63-67.
[15]Irani V R,Lee SH,Eckstein TM,et al.Utilization of a ts-sac B selection system for the generation of a Mycobacterium avium serovar28 specific glycopeptidolipid allelic exchangemutant[J].Annals of Clinical Microbiology and Antimicrobials,2004(3):18.
[16]Mizoguchi H,Tanaka2Masuda K,Mori H.A simple method for multiplemodification of the Escherichia coli K-12 chromosome[J]. Biosci Biotechnol Biochem,2007,71(12):2905-2911.
[17]李春凤,林显华,谷 巍.枯草芽孢杆菌在饲料生产及环境防治中的应用[J].中国饲料,2013(1):10-17.
[18]E.M.Porter E V D,E.V.Valore,T.Ganz.Broad-spectrum antimicrobial activity of human intestinal defensin 5[J].Infection and Immunity,1997,65(6):2396-2401.
[19]Dalcin D,Ulanova M.The role of human beta-defensin-2 in pseudomonas aeruginosa pulmonary infection in cystic fibrosis Patients[J]. Infectious Diseases and Therapy,2013(2):159-166.
[20]Bals R.Epithelial antimicrobial peptides in host defense against infection[J].Respiratory Research,2000(1):141-150.
[21]Bao Y Y,Li L,Zhang H,et al.Preparation of polyclonal antibody against porcine beta defensin 2 and identification of its distribution in tissues of pig[J].Genetics and Molecular Research,2015,14:18863-18871.
[22]Li J,Wu R,Chen H,etal.The cloning and characterization of the enolase2 gene of gekko japonicus and its polyclonal antibody preparation[J].International Journal of Molecular Sciences,2013,14: 8787-8800.
[23]Auvynet C,Rosenstein Y.Multifunctional host defense peptides: Antimicrobial peptides,the small yet big players in innate and adaptive immunity[J].Febs Journal,2009,276:6497-6508.
[24]Cole A M,Huang X-x,Gao C-y,etal.Antimicrobial characterization of site-directed mutagenesis of porcine beta defensin 2[J].Plos One,2015,10:e0118170.
[25]Mao X,Qi S,Yu B,et al.Zn2+and l-isoleucine induce the expressions of porcineβ-defensins in IPEC-J2 cells[J].Molecular Biology Reports,2012,40:1547-1552.
[26]Chen J,Qi S,Guo R,et al.Differentmessenger RNA expression for the antimicrobial peptidesβ-defensins between Meishan and crossbred pigs[J].Molecular Biology Reports,2009,37:1633-1639.
[27]胡 翰,于宾宾,何启盖,等.猪β防御素2成熟肽在酵母中的表达[J].微生物学报,2011,51(5):704-709.
(责任编辑 陈 虹)
High Expression of Porcineβ-defense in Bacillus subtilis
WANG Na1,LIGang2,ZOU Hui-qin2,WEN Jing2,CHEN Song2,ZHANG Hao-ran2,GOU Xing-hua1*
(1.Chengdu University,Sichuan Chengdu 610106,China;2.Sichuan Rota Bioengineering Company,Sichuan Chengdu 610063,China)
【Objective】Porcineβ-defensin(beta-defensin)is secreted by pig,and it is a smallmolecule antibacterial peptidewhich can sterilizemicrobe and regulate immunity,and also it is indispensable in pig's growth and reproduction.【Method】In this study,the orcineβ-defensin cDNA sequence based on NCBI database was synthesized,and the regulatory sequences and restriction sites were also added to the synthesized sequence.The cDNA was digested by restriction enzyme and then inserted into expression vector pHT43 for ligation,and the production of ligation was transformed into Escherichia coli DH5αfor screening of the positive expression plasmid.The pHT43-SS-BD was selected by colony PCR and gene sequencing.The recombinant plasimid was transformed into Bacillus subtilis WB800N.When recombinant strain was induced by sucrose,themolecular size of the production of inducing was identified by SDS-PAGE,and the antibacterial activity from the inducing production was determinated by inhibition test.【Result】SDS-PAGE electrophoresis results showed that the interest protein was5 KDa.Inhibition test indicated that the supernatant from the induced genetic engineering strain had antibacterial effect on both gram positive bacteria and gram negative bacteria.【Conclusion】The study achieved the high expression of porcineβ-defense in Bacillus subtilis and paved the way for overcoming source restrictions of antibacterial peptide and for application of B.subtilis.
Porcineβ-defensin;Gene expression;Antibacterial activity;Bacillus subtilis
S828
A
1001-4829(2017)8-1910-04
10.16213/j.cnki.scjas.2017.8.037
2017-01-20
成都市科技惠民技术研发项目(2015-HM01-00176-SF)
王 娜(1992-),女,四川南充人,硕士研究生,研究方向为微生物与生化药学,E-mail:865003651@qq.com,Tel: 18215525177,*为通讯作者:苟兴华,E-mail:641615043@qq. com。
