不同体成分及其他因素与高效抗逆转录病毒治疗后免疫重建不全的相关性
2017-09-08孙朋涛李太生郭伏平周晓红杜桂迎管文敏
孙朋涛,余 卫,李太生,林 强,郭伏平,周晓红,杜桂迎,徐 颖,管文敏
中国医学科学院 北京协和医学院 北京协和医院 1放射科 2感染内科 艾滋病诊疗中心,北京1007303中国人民解放军第309医院核医学科,北京 100091
·论 著·
不同体成分及其他因素与高效抗逆转录病毒治疗后免疫重建不全的相关性
孙朋涛1,余 卫1,李太生2,林 强1,郭伏平2,周晓红3,杜桂迎1,徐 颖1,管文敏1
中国医学科学院 北京协和医学院 北京协和医院1放射科2感染内科 艾滋病诊疗中心,北京1007303中国人民解放军第309医院核医学科,北京 100091
目的 分析不同体成分及其他因素与中国男性人类免疫缺陷病毒(HIV)或获得性免疫缺陷综合征(AIDS)患者接受高效抗逆转录病毒治疗(HAART)后免疫重建不全的相关性。方法 回顾性分析2007年至2015年接受HAART 1年以上并获得病毒抑制(HIV- 1 RNA<400拷贝/ml)的男性HIV/AIDS患者资料,包括患者临床、免疫学及病毒学资料,其中包括HAART开始前1个月内测量的患者体质量、身高、全身体成分。经身高校正后得到体质量指数(BMI)、肌肉指数(LMI)、脂肪指数(FMI)、骨矿含量/身高。根据患者接受HAART 1年后是否出现免疫重建不全(CD4细胞计数<350细胞/μl),将患者分为免疫学未完全应答组(CD4细胞计数<350细胞/μl)、免疫学完全应答组(CD4细胞计数≥350细胞/μl)。应用t检验、卡方检验及Wilcoxon秩和检验比较两组患者的差异,应用多因素Logistics回归分析接受HAART 1年后免疫重建不全的影响因素。结果 共纳入84例男性HIV/AIDS患者。两组患者的年龄(Z=-2.479,P=0.013)、基线BMI(t=2.030,P=0.045)、LMI(t=2.200,P=0.029)、CD4细胞计数(Z=6.416,P=0.000)差异有统计学意义。两组患者的基线病毒载量、FMI、骨矿含量/身高、HAART时间、HAART方案差异无统计学意义(P>0.05)。BMI(OR=0.742,95%CI=0.554- 0.993,P=0.044)、LMI(OR=0.459,95%CI=0.249- 0.844,P=0.012)、 HAART时间(OR=10.161,95%CI=1.110- 93.052,P=0.040)、基线 CD4 细胞计数(OR=80.051,95%CI=8.396- 762.563,P=0.000)与免疫重建不全具有相关性。年龄(OR=1.497,95%CI=0.213- 10.505,P=0.685)、病毒载量(OR=0.333,95%CI=0.071- 1.572,P=0.164)、FMI(OR=0.797,95%CI=0.546- 1.164,P=0.240)、全身骨矿含量/身高(OR=1.145,95%CI=0.037- 35.676,P=0.938)及HAART方案(OR=0.430,95%CI=0.159- 1.159,P=0.095)与免疫重建不全无相关性。结论 基线CD4细胞计数及治疗时间可影响免疫重建,基线BMI或基线LMI较高是免疫重建不全的保护因素,基线FMI和全身骨矿物质含量/身高与免疫重建不全无关。
人类免疫缺陷病毒;高效抗逆转录病毒治疗;免疫重建不全;体质量指数;体成分;肌量;脂肪量;骨矿含量
尽管高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)是诱导免疫功能恢复的有效方法,但约30%接受HAART 2年的人类免疫缺陷病毒(human immunodeficiency virus,HIV)或获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)患者存在免疫重建不全(CD4计数<350细胞/μl)[1],进而导致这些患者有较高并发症和死亡率的风险[2]。文献报道免疫重建不全的影响因素主要包括:种族、性别、年龄、基线CD4细胞计数、HAART方案等[3- 7]。最近有报道基线体质量指数(body mass index,BMI)是抗逆转录病毒治疗后免疫重建不全的一个影响因素[8]。BMI是全身各种体成分的总指标,但是它不能区分体内不同体成分。本研究旨在探讨各种体成分及其他因素对男性HIV/AIDS患者接受HAART 1年后免疫重建不全的影响。
对象和方法
对象 本研究为回顾性研究,研究对象选取2007年至2015年在北京协和医院接受HAART的男性HIV/AIDS患者。纳入标准:在此前未接受过任何抗逆转录病毒治疗的男性HIV/AIDS患者;年龄18~65岁;接受HAART达1年并在最近3个月获得病毒抑制(HIV RNA<400拷贝/ml);在开始HAART前1个月内进行CD4细胞计数测量及体成分测量者;接受HAART 9~15个月后行CD4细胞计数测量者。排除标准:基线CD4细胞计数≥350细胞/μl;随访<9个月的患者。
临床资料 从病历中收集患者的临床、免疫学及病毒学资料,这些资料包括体质量、身高、年龄、HAART时间、HAART方案、基线及HAART后CD4细胞计数、病毒载量。免疫未完全应答标准参照文献,即接受HAART后1年CD4细胞计数<350细胞/μl[9]。根据HAART 1年后CD4细胞计数恢复情况,根据应答反应将患者分为免疫学未完全应答组(<350细胞/μl)和免疫学完全应答组(≥350细胞/μl)。
双能X线骨密度测量仪检查 应用双能X线骨密度测量仪(美国GE Lunar Prodigy型)测量全身各种体成分,分析软件版本为enCORE10.50.086。测量指标包括全身肌量、全身脂肪量和全身骨矿含量。分别采用以下公式计算肌肉指数(lean mass index,LMI)、脂肪指数(fat mass index,FMI)和骨矿含量身高比:LMI=肌量/身高2、FMI=脂肪量/身高2、骨矿含量身高比=骨矿含量/身高[10- 11]。
统计学处理 采用SAS 9.1(SAS,Cary,NC)软件进行计算。应用t检验、卡方检验及Wilcoxon秩和检验比较免疫学未完全应答组与免疫学完全应答组的差异。校正年龄、病毒载量、CD4细胞计数、HAART时间、HAART方案后,应用多因素Logistics回归分别分析基线BMI、LMI、FMI、骨矿含量/身高比与免疫重建不全的关系。P<0.05为差异有统计学意义。
结 果
一般资料 本研究共纳入84例HIV/AIDS患者:免疫学未完全应答组51例(61%),免疫学完全应答组33例(39%)。两组患者在基线病毒载量、FMI、骨矿含量/身高比、HAART时间、HAART方案差异均无统计学意义(P均>0.05)。两组患者年龄(Z=-2.479,P=0.013)、基线LMI(t=2.200,P=0.029)、BMI(t=2.030,P=0.045)、CD4细胞计数(Z=6.416,P=0.000)差异有统计学意义(表1)。
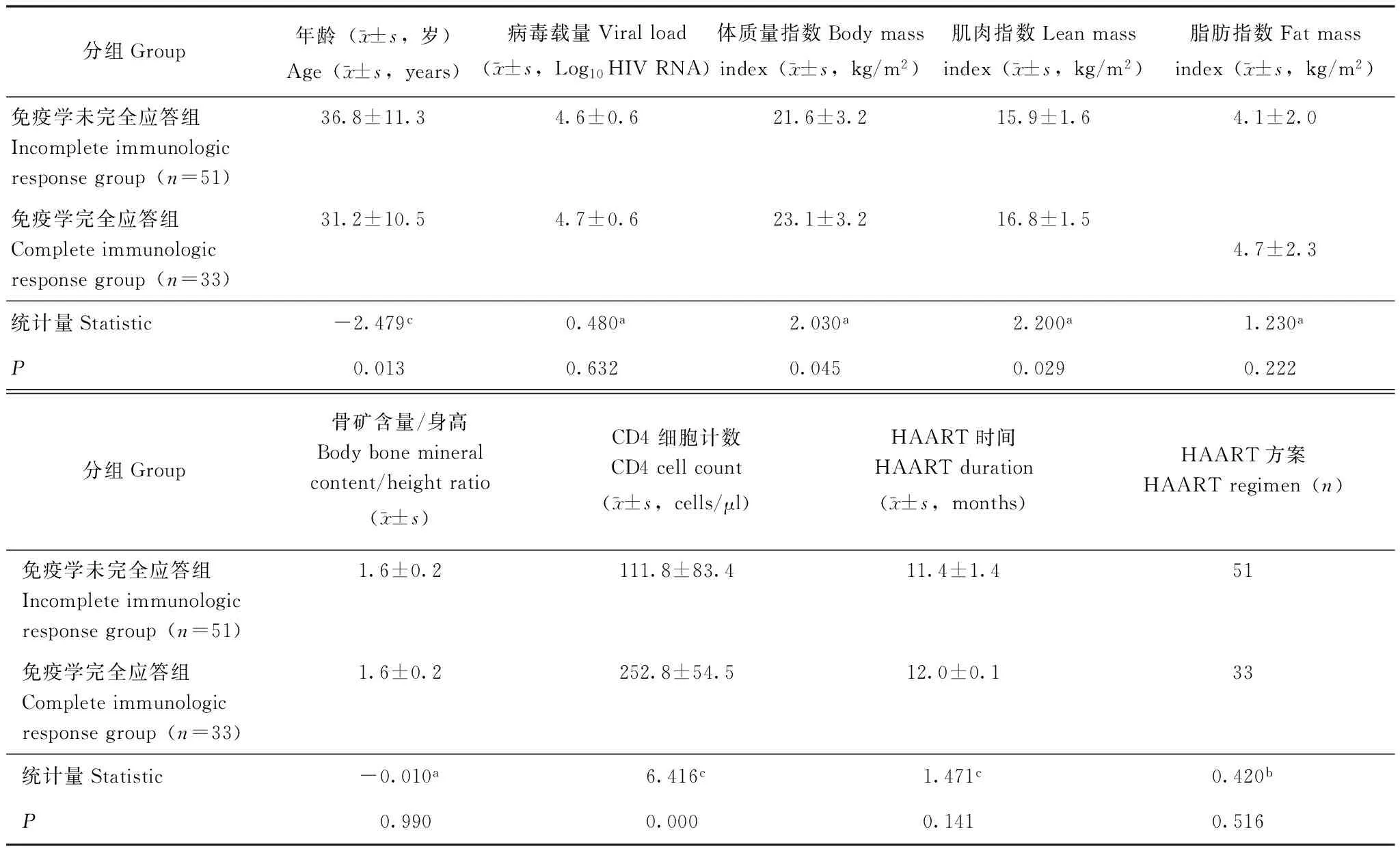
表 1 两组一般资料比较Table 1 Comparisons of the general information between two groups
HIV:人类免疫缺陷病毒;HAART:高效抗逆转录病毒治疗;a:t检验;b:χ2检验;c:非参数秩和检验
HIV:human immunodeficiency virus;HAART:highly active antiretroviral therapy;a:ttest;b:Chi- square test;c:nonparametric test
多因素Logistics回归分析结果 在多因素回归模型中,基线BMI(OR=0.742,95%CI=0.554- 0.993,P=0.044)、LMI(OR=0.459,95%CI=0.249- 0.844,P=0.012)、CD4细胞计数(OR=80.051,95%CI=8.396- 762.563,P=0.000)及HAART时间(OR=10.161,95%CI=1.110- 93.052,P=0.040)与免疫重建不全具有相关性。其他变量,包括年龄、基线FMI、骨矿含量/身高比、病毒载量及HAART方案与免疫重建不全无相关性(表2)。
讨 论
HAART在抑制病毒复制方面具有明确的疗效,然而部分接受HAART的患者出现免疫重建不全[9]。有研究表明多种因素可影响免疫重建[7]。另有研究报道,基线BMI较高的HIV/AIDS患者接受HAART后CD4细胞恢复较快[12- 14]。BMI是全身各种体成分的总指标,但是它不能区分体内不同体成分。研究免疫重建不全的影响因素具有重要意义,因为免疫重建不全患者有较高并发症和死亡率的风险[2]。
本研究分析不同体成分及其他因素与男性HIV/AIDS患者接受HAART 1年后免疫重建不全的相关性,结果显示基线BMI、LMI、CD4细胞计数及HAART时间可影响免疫重建,但年龄、基线病毒载量、FMI、骨矿含量/身高及HAART方案与免疫重建不全无关。本研究表明基线BMI较高是免疫重建不全的保护因素。有报道基线BMI较高的患者抗逆转录病毒治疗后CD4细胞计数恢复较好[15],这与本研究结果相似。本研究分析了基线BMI、LMI、FMI、骨矿含量/身高与免疫重建不全的相关性,而未直接分析体质量、全身肌量、全身脂肪量、骨矿含量与免疫重建不全的相关性,目的是减轻体型对体成分的影响[10- 11]。
有研究显示基线非脂肪组织指数与抗逆转录病毒治疗前基线CD4细胞计数具有相关性[16]。本研究表明基线LMI较高是免疫重建不全的保护因素。有报道非洲女性HIV/AIDS患者基线非脂肪组织指数与抗逆转录病毒治疗1年后CD4细胞增长无相关性[17],与本研究结果不一致。笔者通过与文献[17]报道的比较及分析,考虑研究结果不一致可能有以下原因:一是研究方法不同。本研究分析了基线LMI与HHART 1年后免疫重建不全(CD4细胞计数<350细胞/μl)相关性,而文献[17]分析了基线非脂肪组织指数与抗逆转录病毒治疗1年前后CD4细胞增长值的相关性。二是种族因素。Guillaume等[3]研究显示非洲人较白种人更容易发生免疫重建不全,不同人种对免疫重建的影响不同。三是性别因素。男性是免疫重建不全的一个危险因素[4],性别不同可影响免疫重建。基线LMI对免疫重建的影响尚需进一步研究。
脂肪组织对免疫重建的影响尚无定论。有研究表明脂肪组织中的脂肪细胞可分泌瘦素[18],瘦素可影响免疫重建[19]。也有研究表明基线FMI与抗逆转录病毒治疗后CD4细胞增长无关[17]。本研究表明基线FMI与免疫重建不全无关。基线FMI对免疫重建的影响尚需进一步研究。
骨矿含量是体成分的重要组成部分。有研究表明抗逆转录病毒治疗后骨丢失与免疫重建具有相关性,抗逆转录病毒治疗前后免疫功能的改变是骨丢失的机制之一[20]。基线骨矿含量与免疫重建不全的相关性研究报道较少,本研究表明基线骨矿含量/身高与免疫重建不全无相关性,相关机制尚需进一步研究。
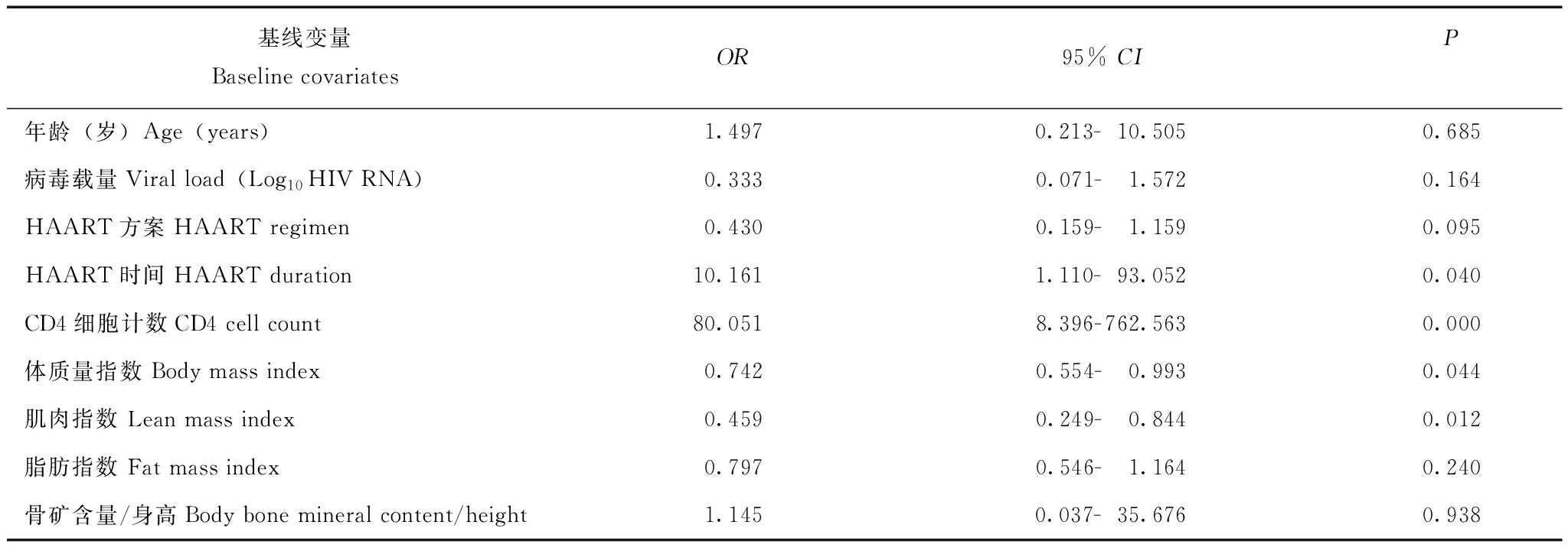
表 2 免疫重建不全(CD4细胞计数<350 细胞/μl)的影响因素Table 2 Determinants of incomplete immune response(CD4 cell count<350 cells/μl)
本研究显示HAART时间较短是免疫重建不全的危险因素。以往研究表明免疫重建主要发生在接受HAART后2年内[21]。另有研究表明接受HAART维持在4.5年内,CD4细胞计数较低的患者仍有持续增长的潜能[22]。这间接表明延长HAART时间可促进免疫重建。
本研究表明基线CD4细胞计数较低是免疫重建不全的危险因素,这与文献[22]报道一致。另有研究表明基线CD4细胞≤100细胞/μl的患者在HAART后3、6、9个月CD4细胞增长幅度均低于基线CD4细胞>100细胞/μl的患者[23]。表明基线CD4细胞计数较低不利于免疫重建,支持本研究结果。
年龄对免疫重建的影响尚无定论。有研究显示老年HIV/AIDS患者更容易出现免疫重建不全[5]。Falster等[9]研究表明年龄与免疫重建不全无关,与本研究结果一致。
不同HAART方案对免疫重建的影响尚无定论。Falster等[9]研究表明接受HAART 1年后,不同HAART方案对免疫重建无影响。也有研究表明含齐多夫定、司他夫定的HAART方案较含替诺福韦的方案发生免疫重建不全的风险高[7]。本研究表明含蛋白酶抑制剂的HAART方案与不含蛋白酶抑制剂的 HAART方案对免疫重建的影响无差异,不同于文献[7],入选病例的HAART方案不同可能是造成结果不一致的原因。
本研究有一定的局限性。研究例数较少,未能进一步比较含齐多夫定、司他夫定及替诺福韦的方案与免疫重建不全的关系。这有待于今后扩大样本量,进一步分析其他HAART方案对免疫重建的影响。
综上,基线CD4细胞计数较低可增加免疫重建不全的风险,延长治疗时间有助于免疫重建。基线BMI、LMI与免疫重建不全具有相关性。基线LMI可作为预测HAART后免疫重建不全的指标之一。
[1]Massanella M,Negredo E,Perez- Alvarez N,et al.CD4 T- cell hyperactivation and susceptibility to cell death determine poor CD4 T- cell recovery during suppressive HAART [J].AIDS,2010,24(7):959- 968.
[2]Maduna PH,Dolan M,Kondlo L,et al.Morbidity and mortality according to latest CD4+cell count among HIV positive individuals in South Africa who enrolled in project phidisa [J].Plos One,2015,10(4):1- 20.
[3]Guillaume C,N’Guyen Y,Brodard V,el al.African ethnicity can influence immunological responses to highly active antiretroviral therapy and immunological success at 48 months:a retrospective pilot study [J].Int J Infect Dis,2013,17(12):e1259- e1262.
[4]Maskew M,Brennan AT,Westreich D,et al.Gender differences in mortality and CD4 count response among virally suppressed HIV-positive patients [J].J Womens Health(Larchmt),2013,22(2):113- 120.
[5]Micheloud D,Berenguer J,Bellón JM,et al.Negative influence of age on CD4+cell recovery after highly active antiretroviral therapy in naive HIV- 1-infected patients with severe immunodeficiency [J].J Infect,2008,56(2):130- 136.
[6]García F,de Lazzari E,Plana M,et al.Long-term CD4+T-cell response to highly active antiretroviral therapy according to baseline CD4+T-cell count [J].J Acquir Immune Defic Syndr,2004,36(2):702- 713.
[7]Zhang F,Sun M,Sun J,et al.The risk factors for suboptimal CD4 recovery in HIV infected population:an observational and retrospective study in Shanghai,China [J].Biosci Trends,2015,9(5):335- 341.
[8]Koethe JR,Jenkins CA,Lau B,et al.Body mass index and early CD4 T-cell recovery among adults initiating antiretroviral therapy in North America,1998- 2010 [J].HIV Med,2015,16(9):572- 577.
[9]Falster K,Petoumenos K,Chuah J,et al.Poor baseline immune function predicts an incomplete immune response to combination antiretroviral treatment despite sustained viral suppression [J].J Acquir Immune Defic Syndr,2009,50(3):307- 317.
[10]Cruz-Jentoft AJ,Baeyens JP,Bauer JM,et al.Sarcopenia:European consensus on definition and diagnosis:Report of the European Working Group on Sarcopenia in Older People [J].Age Ageing,2010,39(4):412- 423.
[11]Ackerman KE,Davis B,Jacoby L,et al.DXA surrogates for visceral fat are inversely associated with bone density measures in adolescent athletes with menstrual dysfunction [J].J Pediatr Endocrinol Metab,2011,24(7- 8):497- 504.
[12]Blashill AJ,Mayer KH,Crane HM,et al.Body mass index,immune status and virological control in HIV-infected men who have sex with men [J].J Int Assoc Provid AIDS Care,2013,12(5):319- 324.
[13]Crum-Cianflone NF,Roediger M,Eberly LE,et al.Impact of weight on immune cell counts among HIV-infected persons [J].Clin Vaccine Immunol,2011,18(6):940- 946.
[14]Koethe JR,Jenkins CA,Shepherd BE,et al.An optimal body mass index range associated with improved immune reconstitution among HIV-infected adults initiating antiretroviral therapy [J].Clin Infect Dis,2011,53(9):952- 960.
[15]Palermo B,Bosch RJ,Bennett K,et al.Body mass index and CD4+T- lymphocyte recovery in HIV-infected men with viral suppression on antiretroviral therapy [J].HIV Clin Trials,2011,12(4):222- 227.
[16]Chantry CJ,Cervia JS,Hughes MD,et al.Predictors of growth and body composition in HIV-infected children beginning or changing antiretroviral therapy [J].HIV Med,2010,11(9):573- 583.
[17]Kiefer E,Hoover DR,Shi Q,et al.Association of pre-treatment nutritional status with change in CD4 count after antiretroviral therapy at 6,12,and 24 months in rwandan women [J].PLoS One,2011,6(12):e29625.
[18]Fantuzzi G.Adipose tissue,adipokines,and inflammation [J].J Allergy Clin Immunol,2005,115(5):911- 919.
[19]Sánchez-Margalet V,Martín-Romero C,Santos-Alvarez J,et al.Role of leptin as an immunomodulator of blood mononuclear cells:mechanisms of action [J].Clin Exp Immunol,2003,133(1):11- 19.
[20]Ofotokun I,Titanji K,Vunnava A,et al.Antiretroviral therapy induces a rapid increase in bone resorption that is positively associated with the magnitude of immune reconstitution in HIV infection [J].AIDS,2016,30(3):405- 414.
[21]Kaufmann GR,Bloch M,Finlayson R,et al.The extent of HIV- 1-related immunodeficiency and age predict the long-term CD4 T lymphocyte response to potent antiretroviral therapy [J].AIDS,2002,16(3):359- 367.
[22]杜云玲,万钢,吴焱,等.HIV/AIDS病人HAART后免疫重建相关影响因素分析[J].中国艾滋病性病,2015,21(6):470- 473.
[23]胡芳琴,吴勇,张展,等.不同CD4+基线值艾滋病患者高效抗逆转录病毒治疗后免疫重建效果观察[J].中华医院感染学杂志,2015,25(24):5521- 5523.
Association of Body Composition and Other Clinical Factors with Incomplete Immune Response after Highly Active Antiretroviral Therapy
SUN Pengtao1,YU Wei1,LI Taisheng2,LIN Qiang1,GUO Fuping2,ZHOU Xiaohong3,DU Guiying1,XU Ying1,GUAN Wenmin1
1Department of Radiology,2AIDS Diagnosis and Treatment Center,Department of Infectious Disease,PUMC Hospital,CAMS and PUMC,Beijing 100730,China3Department of Nuclear Medicine,the 309th Hospital of Chinese People’s Liberation Army,Beijing 100091,China
YU Wei Tel:010- 69159579,E-mail:weiyu5508@yahoo.com;
Objective To explore whether baseline body composition and other clinical factors are associated with incomplete immune response after highly active antiretroviral therapy(HAART)in Chinese men with human immunodeficiency virus(HIV)or acquired immunodeficiency syndrome(AIDS).Methods A retrospective study was conducted among HIV/AIDS male patients who achieved viral suppression(maintained HIV- 1 RNA levels<400 copies/ml)after a year of HAART between 2007 and 2015.Clinical,immunological,and virological data were collected from patients’ files,including weight,height,and whole body composition measured within one month prior to staring HAART.Body mass index(BMI),lean mass index(LMI),fat mass index(FMI),and body bone mineral content/height were adjusted by height.According to whether the patients experienced incomplete immune responses(CD4 cell count<350 cells/μl)after a year of HAART,the patients were divided into two groups:the complete immune response(CD4 cell count≥350 cells/μl)and the incomplete immune response(CD4 cell count<350 cells/μl),respectively.Student’sttest,chi-square test,and Wilcoxon rank test were used to assess differences between these two groups.Multiple Logistic regression analysis was used to assess factors associated with an incomplete immune response in patients with sustained viral suppression.Results Totally 84 HIV/AIDS male patients with viral suppression were included in this study.There were statistical differences between these two groups in terms of age(Z=-2.479,P=0.013),baseline BMI(t=2.030,P=0.045),LMI(t=2.200,P=0.029),and CD4 cell count(Z=6.416,P=0.000).However,there was no statistical differences in viral load,FMI,body bone mineral content/height,HAART duration,and HAART regimen(allP>0.05).BMI[OR=0.742,95% confidence interval(CI)=0.554- 0.993,P=0.044],LMI(OR=0.459,95%CI=0.249- 0.844,P=0.012),HAART duration(OR=10.161,95%CI=1.110- 93.052,P=0.040),baseline CD4 cell count(OR=80.051,95%CI=8.396- 762.563,P=0.000)were significantly associated with incomplete immune response.Age(OR=1.497,95%CI=0.213- 10.505,P=0.685),viral load(OR=0.333,95%CI=0.071- 1.572,P=0.164),FMI(OR=0.797,95%CI=0.546- 1.164,P=0.240),body bone mineral content/height(OR=1.145,95%CI=0.037- 35.676,P=0.938)and HAART regimen(OR=0.430,95%CI=0.159- 1.159,P=0.095)were not associated with incomplete immune response.Conclusions Baseline CD4 cell count and HAART duration may affect immune response.Patients with higher baseline BMI or higher LMI may be less likely to develop incomplete immune response.Baseline FMI and body bone mineral content/height ratio are not associated with incomplete immune response.
human immunodeficiency virus;highly active antiretroviral therapy;incomplete immune response;body mass index;body composition;fat free mass;fat mass;bone mineral content
459-464
国家十二五“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项资助项目(2012ZX10001003)(2012- 2015)Supported by the Science Research Project of the Twelfth Five-year Plan“AIDS and Viral Hepatitis Major Infectious Diseases Prevention and Control”(2012ZX10001003)(2012- 2015)
余 卫 电话:010- 69159579,电子邮件:weiyu5508@yahoo.com;
李太生 电话:010- 69155048,电子邮件:litsh@263.net
R512.91
A
1000- 503X(2017)04- 0459- 06
10.3881/j.issn.1000- 503X.2017.04.001
LI Taisheng Tel:010- 69155048,E-mail:litsh@263.net
2016- 03- 22)
