芎芷地龙汤不同时间预防给药对偏头痛动物模型PKCγ、PKCεmRNA的影响*
2017-08-16坤王永丽赵永烈岳广欣
胡 坤王永丽赵永烈,2△岳广欣
(1.北京中医药大学第三附属医院,北京 100029;2.北京中医药大学东方医院,北京 100078;3.中国中医科学院,北京 100053)
·研究报告·
芎芷地龙汤不同时间预防给药对偏头痛动物模型PKCγ、PKCεmRNA的影响*
胡 坤1王永丽1赵永烈1,2△岳广欣3
(1.北京中医药大学第三附属医院,北京 100029;2.北京中医药大学东方医院,北京 100078;3.中国中医科学院,北京 100053)
目的观察芎芷地龙汤不同时间预给药对偏头痛动物模型PKCγ、PKCεmRNA表达的影响。方法将健康雄性SD大鼠36只,随机分为生理盐水组、模型组、舒马普坦组、芎芷地龙汤1 d、3 d、7 d预给药组,每组6只。按照预定给药,造模结束后2 h取材,real-time PCR法测定三叉神经节、三叉神经脊束核丘脑、硬脑膜PKCγ、PKCεmRNA表达情况。结果与生理盐水组比较,模型组PKCγmRNA在三叉神经节、三叉神经脊束核、硬脑膜表达水平明显升高,在丘脑表达水平明显降低(P<0.01),给药干预后,三叉神经节、三叉神经脊束核、硬脑膜PKCγmRNA表达水平均降低,其中以预防给药7 d组和舒马普坦组降低明显(P<0.01);丘脑PKCγmRNA表达水平有所升高,以1 d组、3 d组、舒马普坦组明显((P<0.05或P<0.01)。与生理盐水组比较,模型组PKCεmRNA在硬脑膜、三叉神经节、三叉神经脊束核表达水平明显升高(P<0.01),在丘脑表达水平降低(P<0.01);给药干预后,PKCεmRNA在三叉神经节、三叉神经脊束核表达水平降低,以预防给药7 d组和舒马普坦组降低明显(P<0.01),在硬脑膜表达水平降低,以3 d组和舒马普坦组(均P<0.01)较1 d组和7 d组(均P<0.05)明显;PKCεmRNA在丘脑表达水平升高,各组升高水平均有统计学意义(P<0.01)。结论芎芷地龙汤预防给药可以减少NTG诱发的三叉神经节、三叉神经脊束核PKCγmRNA、PKCεmRNA表达,而以预防给药7 d效果好于预防给药3 d、1 d。
偏头痛 芎芷地龙汤 预防给药 PKCγmRNA PKCεmRNA
偏头痛是一种常见的神经血管性疾病,其病情特征为反复发作、一侧或双侧搏动性的剧烈头痛且多发生于偏侧头部,可合并自主神经系统功能障碍如恶心、呕吐、畏光和畏声等症状,约1/3的偏头痛患者在发病前可出现神经系统先兆症状[1]。药物治疗包括头痛发作期治疗和头痛间歇期预防性治疗[2],对患者进行预防性治疗的目的是降低发作频率、减轻发作程度、减少失能、增加急性发作期治疗的疗效[3]。本课题组前期研究了应用芎芷地龙汤预防给药对偏头痛模型痛阈及血管活性物质的影响[4],为更深入探讨相应机理,本实验拟研究芎芷地龙汤不同时间点预防给药后,三叉神经血管系统中三级神经元中PKCγ、PKCεmRNA表达情况。现报告如下。
1 材料与方法
1.1 实验动物
清洁级成年雄性SD大鼠,体质量(200±20)g;由维通利华实验动物技术有限公司提供。动物许可证号:SCXK(京)2012-0001。
1.2 药物与试剂
芎芷地龙汤(川芎、白芷、生石膏、地龙、延胡索)由北京中医药大学东方医院制剂室提取 (每毫升含生药2.0 g);硝酸甘油注射液,5mg/mL,北京益民药业有限公司生产;琥珀酸舒马普坦片,25 mg/片,海南先声药业有限公司生产;DEPC(焦碳酸二乙酯),购于北京欣经科生物技术有限公司;氯仿(三氯甲烷),购于北京化工厂;异丙醇,购于无锡县化学试剂厂;TRIZOL Reagent(Invitrogen);High Pure RNA Tissue Kit(Roche REF12033674001);Go Taq 2-Step RT-qPCRsystem(Promega A6010);Go TaqqPCR Master Mix(Promega A6002)。
1.3 实验仪器
手持电动匀浆器,KONTES;分光光度计,Nano Vue plus;三用电子恒温水箱,SHH.W21,北京中兴伟业器仪有限公司;高速低温离心机,SIGMA 3K15;恒温震荡金属浴,Bioer,MB-102;PCR仪,Bio-RAD CFX96 Real-Time System。
1.4 造模及给药
SD大鼠随机分为6组:生理盐水组、模型组、舒马普坦组、芎芷地龙汤1 d预给药组(1 d XZDLT)、芎芷地龙汤3 d预给药组(3 d XZDLT)、芎芷地龙汤7 d预给药组(7 d XZDLT)。生理盐水组:给予10mL/(kg·d)生理盐水灌胃7 d,普通饲养,末次灌胃30min后颈背部皮下注射2mL/kg生理盐水。模型组:给予10mL/(kg·d)生理盐水灌胃7 d,末次灌胃30 min后颈背部皮下注射10mg/kg(5mg/mL)硝酸甘油。芎芷地龙汤组:给予10.8 g/(kg·d)芎芷地龙汤灌胃(1 d,3 d,7 d),末次灌胃30min后颈背部皮下注射10 mg/kg(5mg/mL)硝酸甘油。舒马普坦组:给予琥珀酸舒马普坦6 mg/(kg·d)灌胃7 d,末次灌胃30min后颈背部皮下注射10mg/kg(5mg/mL)硝酸甘油。
1.5 标本采集
于造模结束后2 h,用2%戊巴比妥钠腹腔注射进行深度麻醉(40 mg/kg),迅速断头,在超净台内冰上取脑,分别剥离出丘脑,三叉神经节、三叉神经脊束核、硬脑膜分别放入1.5mL灭菌的离心管中,埋入液氮中迅速冷冻,-70℃冰箱保存备用。
1.6 大鼠组织总RNA的提取和含量的测定
1.6.1 总RNA的提取 按试剂盒 (High Pure RNA Tissue Kit)说明书严格操作:盛有标本组织的离心管中各加400μL Trizol裂解细胞,之后依次加入适量氯仿、异丙醇、75%的预冷乙醇、DEPC水,分别纯化、沉淀、洗涤、溶解总RNA。微量分光光度计测定RNA的浓度和纯度。根据A260的值计算RNA浓度(μg/μL),并根据A260/A280比值计算其纯度,要求为1.8~2.0,比值低于1.6者弃去。
1.6.2 逆转录反应(RT)步骤 按试剂盒说明书严格操作,20μL反应体系,步骤如下:取1.5 mL离心管配制模板,加入:RNA 11μL,引物(Random Primer)1μL,加入总RNA量1.1μg;放入震荡型恒温金属浴,70℃5min,迅速转至冰上至少1min;离心使液体收集于管底,加入:5×Reaction buffer 4μL,MgCl225mM 2μL,PCR,Nucleotide Mix 10 mmol/L 1μL,RNase Inhibitor 0.5μL,GoScrpt RT 0.5μL;RNA引物混合液12μL与逆转录混合液8μL充分混合,放入震荡型恒温金属浴,25℃5min,放入三用恒温电子水箱,42℃1 h,放入震荡型恒温金属浴,70℃15min,冷却;立即PCR反应,放入-20℃冰箱保存。
1.6.3 PCR引物设计 根据Genebank的序列和文献参考,设计PKCγ、PKCε、GAPDH的引物序列。引物委托生工生物工程(上海)股份有限公司合成。引物序列如下:PKCγ-F:5’TGTGGAACGAGACCTTCGTG 3’,PKCγ-R:5’CCCATCCGCACTCTCTCATAC3’,扩增长度:289bp。PKCε-F:5’GAATGTTCACCGTCGATGCG 3’,PKCε-R:5’GTTCCTGGTCACAAGGGGAG 3’,扩增长度:233 bp。GAPDH-F:5’GTTACCAGGGCTGCCTTCTC 3’,GAPDHR:5’GATGGTGATGGGTTTCCCGT3’,扩增长度:177bp。1.6.4 实时荧光定量聚合酶链式反应(real-time PCR)等量的RT反应产物,分别扩增PKCγ、PKCε、GAPDH基因。5倍稀释RT反应产物cDNA:Nuclease-FreeWa ter 40μL,cDNA原液 10μL;real-time PCR体系(20μL反应体系):cDNA稀释液 4μL,primer F(20 pmol/μL)0.5μL,primer R (20 pmol/μL)0.5μL,Mix 10μL,加Nuclease-Free Water至20μL;轻轻混匀,2000 r/min离心20 s后进行PCR扩增;在95℃30 s,95℃10 s,60℃30 s,15℃30 s下扩增共40个循环。反应结束后,读取每份样品中的相应目的基因的Ct值,减去GAPDH的Ct值,得出相对Ct值作为n值,再作1/2n运算,得到每份样品中目的基因的相对表达量即Quantity(目的基因/GAPDH),校正后得到每份样品中目的基因PKCγ、PKCε的相对表达量。
1.7 统计学处理
2 结 果
2.1 各组大鼠三叉神经节、三叉神经脊束核、丘脑、硬脑膜的pPKCγmRNA的表达
见表1。与生理盐水组比较,模型组pPKCγmRNA在三叉神经节、三叉神经脊束核、硬脑膜表达水平明显升高,在丘脑表达水平明显降低(P<0.01)。给药干预后,三叉神经节、三叉神经脊束核、硬脑膜pPKCγmRNA表达水平均降低,其中以预防给药7 d组和舒马普坦组降低明显(P<0.01);丘脑pPKCγmRNA表达水平有所升高,以1 d组、3 d组、舒马普坦组明显(P< 0.05或P<0.01)。
表1 各组大鼠不同组织中pPKCγmRNA表达水平比较(±s)
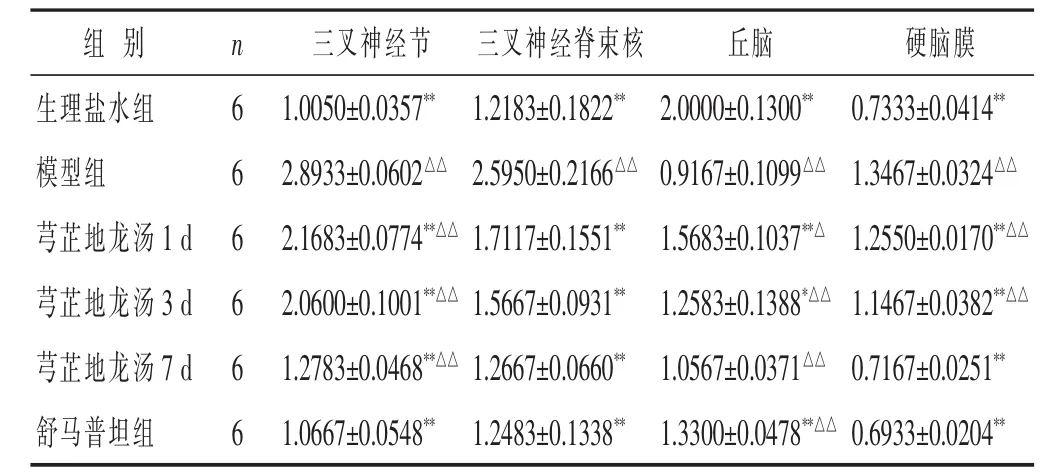
表1 各组大鼠不同组织中pPKCγmRNA表达水平比较(±s)
与模型组比较,*P<0.05,**P<0.01;与生理盐水组比较,△P<0.05,△△P<0.01。下同。
组别 n生理盐水组 6模型组 6芎芷地龙汤1d 6三叉神经节 三叉神经脊束核 丘脑 硬脑膜1.0050±0.0357**1.2183±0.1822**2.0000±0.1300**0.7333±0.0414**2.8933±0.0602△△2.5950±0.2166△△0.9167±0.1099△△1.3467±0.0324△△2.1683±0.0774**△△1.7117±0.1551**1.5683±0.1037**△1.2550±0.0170**△△芎芷地龙汤3d 6 2.0600±0.1001**△△1.5667±0.0931**1.2583±0.1388*△△1.1467±0.0382**△△芎芷地龙汤7d 6 1.2783±0.0468**△△1.2667±0.0660**1.0567±0.0371△△0.7167±0.0251**舒马普坦组 6 1.0667±0.0548**1.2483±0.1338**1.3300±0.0478**△△0.6933±0.0204**
2.2 各组大鼠三叉神经节、三叉神经脊束核、丘脑、硬脑膜的PKCεmRNA的表达
见表2。与生理盐水组比较,模型组PKCεmRNA在硬脑膜、三叉神经节、三叉神经脊束核表达水平明显升高(P<0.01),在丘脑表达水平降低(P<0.01)。给药干预后,PKCεmRNA在三叉神经节、三叉神经脊束核表达水平降低,以预防给药7 d组和舒马普坦组降低明显(P<0.01),在硬脑膜表达水平降低,以3 d组和舒马普坦组(均P<0.01)较1 d组和7 d组明显(均P< 0.05);PKCεmRNA在丘脑表达水平升高,各组升高水平均有统计学意义(P<0.01)。
表2 各组大鼠不同组织中PKCεmRNA表达水平比较(±s)

表2 各组大鼠不同组织中PKCεmRNA表达水平比较(±s)
组别 n生理盐水组 6模型组 6芎芷地龙汤1 d 6三叉神经节 三叉神经脊束核 丘脑 硬脑膜0.9800±0.0686**0.9100±0.0423**0.9233±0.0581**0.5217±0.0542**1.7100±0.0772△△1.8067±0.0406△△0.6367±0.0570△△0.7833±0.0311△△1.4700±0.1302△△1.4650±0.0784**△△1.3067±0.0789**△△0.5833±0.0656*芎芷地龙汤3 d 6 1.2817±0.1189*1.1800±0.0901**△1.1567±0.0727**△0.4233±0.0327**芎芷地龙汤7 d 6 0.9667±0.1354**1.1600±0.0398**△△0.9983±0.0633**0.6017±0.0813*舒马普坦组 6 0.5667±0.1198**△1.0400±0.0608**0.9800±0.0635**0.5483±0.0546**
3 讨 论
偏头痛发病机制复杂,目前对三叉神经血管系统研究较多[5]。蛋白激酶C(PKC)是位于调节疼痛解剖部位的家族酶,在调节疼痛中发挥着重要的作用。PKC是一种磷脂依赖性的丝氨酸/苏氨酸激酶家族,PKCγ对Ca2+和甘油二酯均依赖,属于经典型PKC,PKCε对Ca2+不依赖而对甘油二酯依赖,属于新型PKC[6]。其中PKCγ亚单位为脑、脊髓所独有,在疼痛信号处理及中枢敏感化诱导和维持中起重要作用[7-9]。
在PKC家族的各亚型中,PKCε被报道主要和特定的参与痛觉敏化过程,在初级伤害感受器和机械痛觉敏化中起重要作用[10-13]。研究表明,应用PKC阻滞剂会抑制痛觉敏化和异常性疼痛[14],同时也抑制硬脑膜PKCε和PKCγ的磷酸化表达的增加。在NO供体诱发的偏头痛模型中,PKCγ、PKCε的表达增加,其磷酸化水平也在给予硝酸甘油或硝普钠后大量升高[15]。
本实验研究观察到,注射硝酸甘油后,PKCγ(Thr514)mRNA在硬脑膜、三叉神经节和三叉神经脊束核表达水平明显升高,与既往研究结果[9]相一致。给药干预后PKCγmRNA在硬脑膜、三叉神经节和三叉神经脊束核表达水平降低,以预防给药7 d组和舒马普坦组下降明显。注射硝酸甘油后,PKCε(Ser729)mRNA在硬脑膜、三叉神经节和三叉神经脊束核表达水平明显升高。给药干预后PKCεmRNA在三叉神经节和三叉神经脊束核表达水平均降低,以预防给药7 d组和舒马普坦组下降明显,而在硬脑膜处以预防给药3 d组和舒马普坦组下降最明显。而PKCγmRNA和PKCεmRNA在丘脑部位的表达与在硬脑膜、三叉神经节、三叉神经脊束核部位的表达不一致,这可能和丘脑所介导的痛觉感知和调控中的重要作用有关。在生理状态下,其调控作用为“非紧张性存在”,在病理生理状态下其对痛觉内源性下行易化和抑制作用的强弱并不是恒定、不变的[16]。因此丘脑可能在偏头痛的痛觉传递过程中起着复杂的作用。本研究表明,芎芷地龙汤预防给药可以减少硝酸甘油诱发的硬脑膜、三叉神经节、三叉神经脊束核PKCγmRNA、PKCεmRNA表达,而且预防给药7 d的效果好于预防给药3 d、1 d。
[1] Mehrotra S,Gupta S,Chan KY,etal.Currentand prospective pharmacological targets in relation to antimigraine action[J]. Naunyn Schmiedebergs Arch Pharmacol,2008,378(4):371-394.
[2] 中国偏头痛防治指南[J].中国疼痛医学杂志,2016,22(10):721-727.
[3] 于生元,陈敏.成人偏头痛的药物治疗策略[J].中国新药杂志,2014,23(14):1631-1636.
[4] 赵永烈,刘金民,岳广欣,等.芎芷地龙汤不同时间预防给药对偏头痛动物模型痛阈及血管活性物质的影响[J].中医药学报,2016,44(5):28-35.
[5] FerrariMD,Klever RR,TerwindtGM,etal.Migraine pathophysiology:lessons from mousemodels and human gen-etics[J].LancetNeurol,2015,14(1):65-80.
[6] Way KJ,Chou E,King GL.Identification of PKC-isoformspecific biological actions using pharmacological approaches[J].Trends Pharmacol Sci,2000,21(5):181-187.
[7] Mellor H,Parker PJ.Theextended protein kinase C superfamily[J].Biochem J,1998,332(Pt2):281-292.
[8] Nishizuka Y.Protein kinase Cand lipid signaling for sustained cellμLar responses[J].FASEB J,1995,9(7):484-496.
[9] 赵永烈,胡坤,岳广欣.芎芷地龙汤对偏头痛模型三叉颈复合体PKCγ、NMDAR1作用的研究[J].中西医结合心脑血管病杂志,2016,14(19):2248-2251.
[10]ShiraiY,AdachiN,Saito N.Protein kinase Cepsilon:function in neurons[J].FEBSJ,2008,275(16):3988-3994.
[11] Joseph EK,Levine JD.MμLtiple PKCepsilon-dependent mechanisms mediating mechanical hyperalgesia[J].Pain,2010,150(1):17-21.
[12]李思颉,谢娜,邵国,等.偏头痛模型大鼠三叉神经脊束核神经元兴奋性增高及蛋白激酶Cε膜转位增加[J].中国疼痛医学杂志,2013,25(10):604-608.
[13]Ferrari LF,Araldi D,Levine JD.Distinct terminal and cell body mechanisms in the nociceptor mediate hyperalgesic priming[J].JNeurosci,2015,35(15):6107-6116.
[14]GaleottiN,GhelardiniC.Inhibition of the PKCgamma-epsilon pathway relieves from meningeal nociception in an animal model:an innovative perspective for migraine therapy[J]. Neurotherapeutics,2013,10(2):329-339.
[15]Galeotti N,Ghelardini C.St.John's wort relieves pain in an animalmodel ofmigraine[J].Eur JPain,2013,17(3):369-381.
[16]雷静,尤浩军.丘脑:痛觉内源性调控作用的“启动子”[J].中国疼痛医学杂志,2015,27(6):401-403.
E ffects of Xiongzhi Dilong Decoction Preadm inistration on PKCγand PKCεm RNA in M igraine Animal at Different Time
HU Kun,WANG Yongli,ZHAO Yonglie,et al. The Third Hospital,Beijing University ofTraditional Chinese Medicine,Beijing 100029,China.
Objective:To study the effect of Xiongzhi Dilong Decoction predministration on PKCγand PKCε mRNA in migraine animal at different time.M ethods:36 healthy male SD rats were random ly divided into six groups:saline group(n=6),migrainemodel group(n=6),sumatriptan group(n=6),1 day preadministration group(n=6),3 day preadministration group(n=6),7 day preadministration group(n=6).The drug was administered.Tissueswere collected 2 h after successfulmodeling.The expression of PKCγand PKCεmRNA in trigeminal ganglion,spinal trigeminal nucleus,thalamus and duramater were assayed with real-time PCR method.Results:Compared with saline group,the expression of PKCγmRNA in themodel group increased significantly in trigeminal ganglion,spinal trigeminal nucleus and duramater,and decreased significantly in thalamus(P<0.01). After drug intervention,the expression of PKCγmRNA decreased in trigeminal ganglion,spinal trigeminal nucleus and dura mater,and the preadministration of 7 days group and sumatriptan group decreased significantly(P< 0.01).The expression of PKCγmRNA increased in thalamus,and the preadministration of 1days group(P< 0.01),3 days group(P<0.05)and sumatriptan group(P<0.01)increased significantly.Compared with saline group,the expression of PKCεmRNA in the model group increased significantly in trigeminal ganglion,spinal trigeminal nucleus and duramater(P<0.01),and decreased significantly in thalamus(P<0.01).After drug intervention,the expression of PKCεmRNA decreased in trigeminal ganglion and spinal trigeminal nucleus,and the preadministration of 7days group and sumatriptan group decreased significantly(P<0.01).The expression ofPKCεmRNA decreased in duramater,and the preadministration of 3days group(P<0.01)and sumatriptan group(P<0.01)decreasedmore significantly than preadministration 1days group(P<0.05)and 7 days group(P<0.05). The expression of PKCεmRNA increased in thalamus,and the increase of all groups was statistically significant(P<0.01).Conclusion:Preadministration of Xiongzhi Dilong Decoction can reduce the expression of PKCγmRNA and PKCεmRNA in trigeminal ganglion,spinal trigeminal nucleus and dura mater which are induced by NTG.The prevention of 7days is better than thatof 3days and 1days.
Migraine;XiongzhiDilong Decoction;Preadministration;PKCγmRNA;PKCεmRNA
R285.5
A
1004-745X(2017)07-1134-04
10.3969/j.issn.1004-745X.2017.07.002
2017-04-07)
国家自然科学基金资助项目(81373591)
△通信作者(电子邮箱:yongy3@126.com)
