响应面法优化藜麦种皮过氧化物酶固定化条件
2017-07-31范三红田贺贺柴利萍刘欢欢
范三红,田贺贺,柴利萍,刘欢欢,李 晨
(山西大学生命科学学院,山西太原 030006)
响应面法优化藜麦种皮过氧化物酶固定化条件
范三红,田贺贺,柴利萍,刘欢欢,李 晨*
(山西大学生命科学学院,山西太原 030006)
以从藜麦种皮中提取的过氧化物酶为原材料,利用0.2%聚乙烯醇-3%海藻酸钠(PVA-CA)为载体,CaCl2溶液作固定剂,采用包埋法对藜麦种皮过氧化物酶进行固定。在单因素实验的基础上,利用响应面分析法对藜麦种皮过氧化酶固定化的影响因素进行了优化。优化后得到的最佳固定化条件如下:氯化钙浓度为7%,固定化时间为26 min,载体与酶液的比例为1.25∶1(mL/mL),在此条件下实际测得固定化酶的活性为416.5 U。实测值与理论值(417.4U)相差较小,充分验证了所建模型的可靠性。
藜麦种皮,过氧化物酶,响应面法,固定化
过氧化物酶(Peroxidase,POD)在植物界广泛存在,参与生物体中许多重要的生物反应,发挥着重要功能。例如参与植物体内防御反应[1]、分解吲哚乙酸[2]、合成木质素等[3]。由于POD来源广泛,性质相对稳定,对某些有机溶剂亦不敏感,POD作为标记酶广泛用于免疫印迹、酶联免疫及电镜等生物技术。如今,人们逐渐研究出POD的新用途,如在合成燃料中可用作脱色剂[4]、制作新型生物传感器[5]、处理酚类废水[6]等。
固定化酶是指通过物理吸附、包埋或化学结合、交联等方法将酶与不溶于水的目标载体相结合,从而将酶固定在载体上的过程。固定化的酶稳定性普遍高于游离酶,且可以重复使用,酶制剂的价格一般较化学催化剂高昂,重复使用的固定化酶有利于节约生产成本,同时将酶限定在一定的空间内,可以方便的将酶与反应液分离,有利于简化催化工艺,提高产品的纯度和生产效率[7]。目前,固定化酶技术已经广泛应用于食品[8]、环境保护[9]、生物工程[10-11]等多个领域。目前已有辣根过氧化物酶[12]、莲藕过氧化物酶[13]、空心菜过氧化物酶[14]等多种过氧化物酶固定化的报道。
藜麦(Chenopodiumquinoa),属藜科,为一年生双子叶植物,是公认的全营养谷物。由于种皮皂苷含量高,具有苦味,在藜麦的商业化生产过程中都要进行脱皮处理。目前有关藜麦的研究大多集中在对其营养成分[15-16]及黄酮类物质的分析[17],而对藜麦过氧化物酶的研究鲜有报道。藜麦是种粮食作物,与已报道的辣根、莲藕、空心菜等相比,有产量大的优势,能够为过氧化物酶的大规模工业化生产提供充足原料。另外,藜麦种皮作为一种加工副产品,深入研究开发其中的生物活性成分,可以提高藜麦的综合利用价值。因此,生产藜麦过氧化物酶具有来源广、价格低等优势,藜麦种皮是一种制备廉价过氧化物酶的理想材料。本实验以从藜麦种皮中提取的过氧化物酶为研究对象,采用物理包埋法对其进行固定化,并在单因素实验的基础上设计了Box-Behnken实验,对藜麦种皮过氧化物酶固定化条件进行优化,为进一步推动藜麦资源的开发利用提供重要理论基础。
1 材料与方法
1.1 材料与仪器
藜麦种皮 由山西华青藜麦产品开发有限公司提供;海藻酸钠,愈创木酚,聚乙烯醇 购自上海生工;其他试剂均为国产分析纯。
UV-1600紫外可见分光光度计 上海析谱仪器有限公司;精密电子天平 奥豪斯仪器(上海)有限公司;精密pH计 梅特勒-托利多仪器(上海)有限公司;高速冷冻离心机 德国艾本德股份公司。
1.2 实验方法
1.2.1 藜麦种皮过氧化物酶的制备及固定化 准确称取一定质量的藜麦糠,按1∶10(m/V)加入提取缓冲液(50 mmol/L PBS,pH7.3),4 ℃搅拌提取6 h后12000 r/min离心,取上清,加硫酸铵至80%饱和度,4 ℃盐析4 h后12000 r/min离心,取沉淀,用少量浸提缓冲液溶解并充分透析后上样于DEAE-Sepharose层析柱,洗脱液为pH7.3 NaCl-PBS缓冲液,采用线性梯度洗脱,对各洗脱峰进行过氧化物酶活性测定,收集活性洗脱峰,浓缩后进一步上样于Superdex 75 10/300 GL层析柱,洗脱液为pH7.3 50 mmol/L PBS缓冲液,内含100 mmol/L NaCl。收集活性洗脱峰,脱盐浓缩后于-20 ℃冰箱保存备用。
以从藜麦种皮中提取的过氧化物酶作为实验材料,以聚乙烯醇(PVA)-海藻酸钠(CA)为载体,采用包埋法固定。海藻酸钠不仅有良好的生物相容性,而且安全、无毒,价格低廉,材料易得,可以在比较温和的条件下实现对POD的固定[18];聚乙烯醇机械强度大,可以弥补海藻酸钠机械强度低的缺陷,因此将二者混合使用,以期达到理想的固定化效果。
配制0.2%聚乙烯醇-3%海藻酸钠溶液,作为固定POD的载体。将载体溶液与POD酶液混合均匀,用5 mL注射器匀速缓慢滴注到氯化钙溶液中,在4 ℃下固定。待酶固定后,过滤,洗涤,得球状固定化藜麦种皮过氧化物酶。
1.2.2 过氧化物酶活性测定 采用愈创木酚法测过氧化酶活性[19]。反应体系为3 mL,包括2.5 mL PBS缓冲液(pH7.0)、0.1 mL 1% H2O2,0.4 mL 1%愈创木酚。加入0.1 mL酶液后快速混匀启动反应,记录25 ℃下反应液在3 min内OD470的变化。在测定条件下,每分钟内使反应液OD470改变0.001定义为一个酶活力单位(U)。准确称取0.100 g固定化酶,加入3 mL测活反应液,反应2 min后迅速取出反应液测定OD470值,并计算酶活力。重复三次。
1.2.3 不同因素对固定化效果的影响
1.2.3.1 CaCl2浓度对固定化酶活性的影响 配制浓度为2%,4%,6%,8%,10%的CaCl2溶液,载体和酶液体积之比为2∶1,二者混合均匀,4 ℃静置30 min后,测定酶活。
1.2.3.2 载体与酶液之比对固定化酶活性的影响 将载体与酶液按照体积比为0.5∶1,1∶1,1.5∶1,2∶1,2.5∶1,混合均匀,与4%的CaCl2溶液混合均匀,4 ℃静置30 min后,测定酶活。
1.2.3.3 固定化时间对固定化酶活性的影响 将载体与酶液按体积比为2∶1混匀,与4%的CaCl2溶液混合,分别静置5,15,25,35,45 min后测定酶活性。
1.2.4 响应面优化的实验设计 根据单因素实验所得结果,设计了Box-Behnken中心组合实验,因素水平表见表1。

表1 Box-Behnken实验因素及水平设计Table 1 Independence variables and their levels for Box-Behnken design
1.2.5 数据处理与分析 1.2.3中实验所得数据采用Origin8.5软件分析作图,1.2.4响应面实验结果采用Design-Expert 8.0.6软件进行数据处理和分析。
2 结果与分析
2.1 不同因素对藜麦种皮过氧化物酶固定化的优化结果
2.1.1 CaCl2浓度对固定化酶活性的影响 如图1所示,在 CaCl2浓度为2%~6%浓度范围内,酶活力逐渐增加;当 CaCl2浓度大于6%时,酶活降低。推测是因为Ca2+浓度与形成凝胶球的孔径有关,当Ca2+浓度过高时会使凝胶球的交联太过紧密而影响酶促反应速率。因此,本实验中CaCl2的最佳浓度应选为6%。

图1 CaCl2浓度对固定化酶活性的影响Fig.1 Effects of CaCl2 concentration on activity of immobilized enzyme
2.1.2 载体与酶液比例对固定化酶活性的影响 如图2所示,随着载体与酶液比例的增加,固定化酶的活力逐渐升高,但是当二者之比大于1.5∶1之后,酶活力逐渐降低。分析其原因,是由于载体与酶液比例较低时,载体含量相对不足,不能使过氧化物酶得到充分固定,而二者之比大于1.5∶1之后酶活力降低是因为载体含量过多,导致固定化过程中Ca2+和Na+的置换时间延长,影响固定化酶的量,从而影响酶活性。因此本实验选用载体与酶液最适合的比例是1.5∶1。
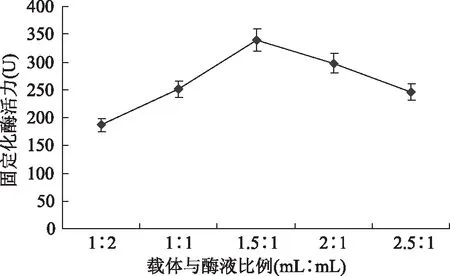
图2 载体与酶液比例对固定化酶活性的影响Fig.2 Effects of different enzyme amounts on activity of immobilized enzyme
2.1.3 固定化时间对固定化酶活性的影响 如图3所示,当固定化酶时间为25 min时,固定化酶活性最高,之后随着固定化时间的延长,酶活性逐渐降低。推测在此条件下,25 min左右时海藻酸钠对酶的包埋便已达到较充分的状态,随着包埋时间的延长,由于酶的损失等引起酶活性下降,因此本实验中酶的最佳固定化时间选为25 min。
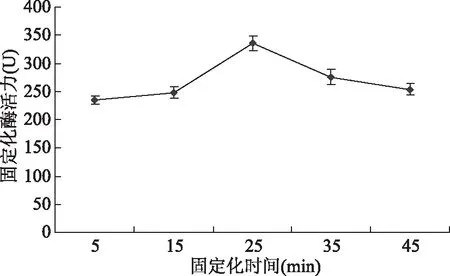
图3 固定化时间对固定化酶活性的影响Fig.3 Effects of immobilized time on activity of immobilized enzyme
2.2 响应面优化实验结果及分析
2.2.1 响应面实验的方案设计及结果 根据单因素实验的结果,由Design-Expert 8.0.6统计分析软件设计出实验方案及实验结果,如表2所示。以酶活性为响应值,氯化钙浓度(A)、载体与酶液比例(B)、固定化时间(C)为自变量,建立三因素三水平中心组合实验设计,包括17个实验方案,其中12个为分析实验点,5个为中心实验点,用以估计实验误差。
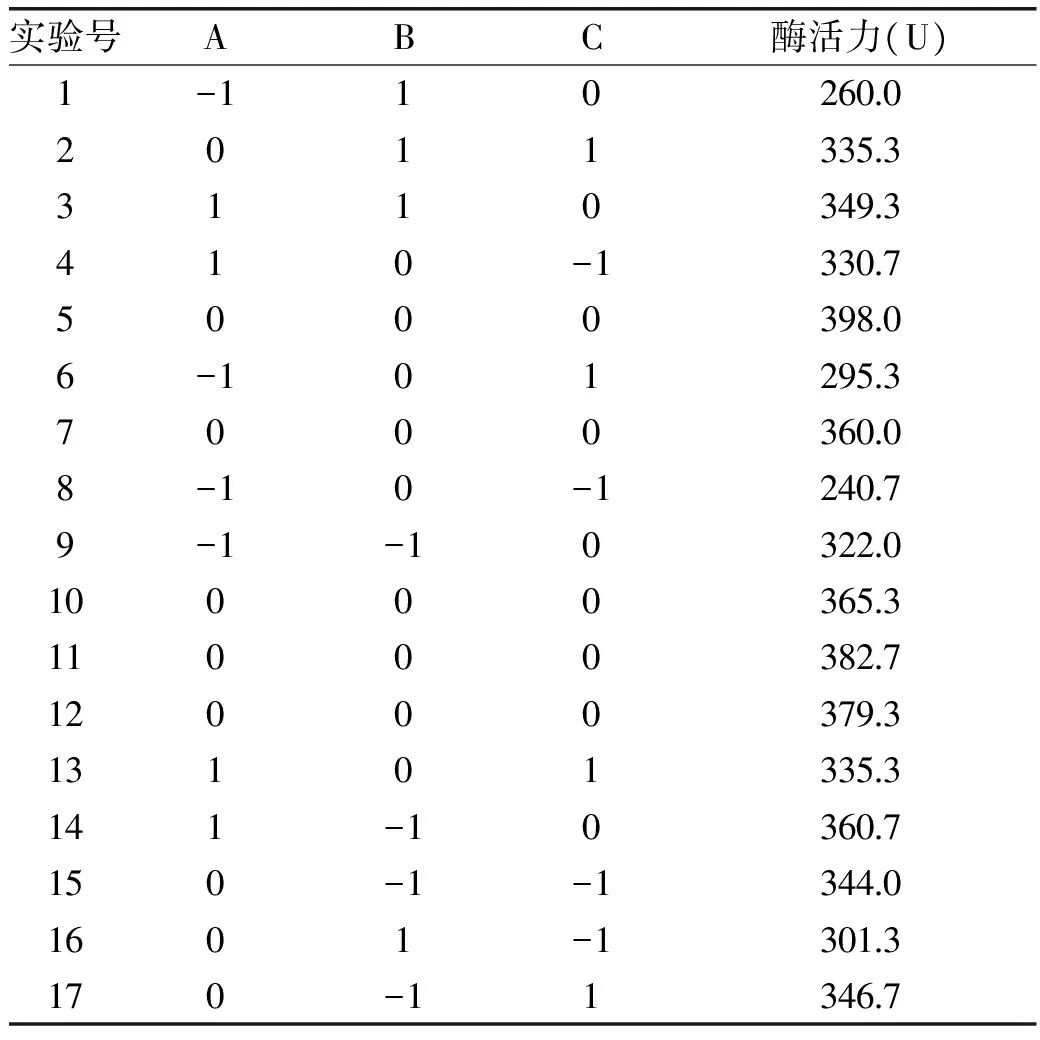
表2 响应面实验设计及实验结果Table 2 Box-Behnken design for independent variables and their corresponding immobilized enzyme activity
2.2.2 回归方程拟合及方差分析 利用Design Expert 8.0.6软件对数据进行回归分析,结果见表3,对各因素进行回归拟合后,得到的多元二次回归方程为:Y=46.5978+61.9678A+27.8517B+8.4269C+8.4333-0.2778+1.0433BC-4.7436A2-45.4700B2-0.1505C2。
由表3可知,A、B、C、A2、C2对固定化酶活性影响显著,AB,BC,AC交互作用影响不显著,表明载体与酶液比例、CaCl2浓度、固定化时间这几个因素均对固定化藜麦种皮过氧化物酶酶活有显著影响;A2、C2的影响显著,说明在固定化过程中CaCl2浓度和固定化时间对固定化酶活性的影响是非线性的。
2.2.3 响应面分析条件优化 根据表3实验结果,利用软件绘制响应面三维图,分析AB,AC,BC这3组交互作用对固定化酶的影响,所得实验结果如图4所示。
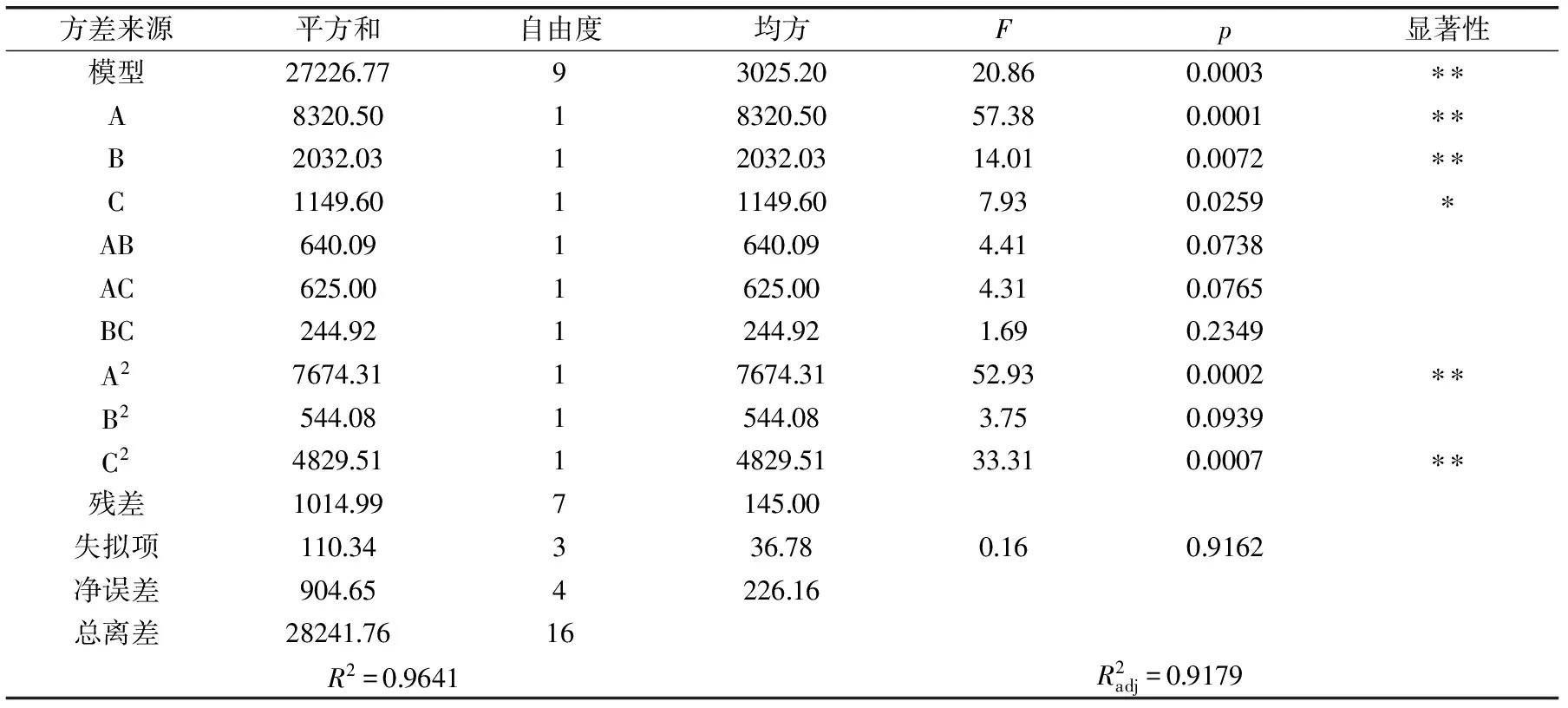
表3 回归方程方差分析表Table 3 Analysis of variance for the fitted regression equation
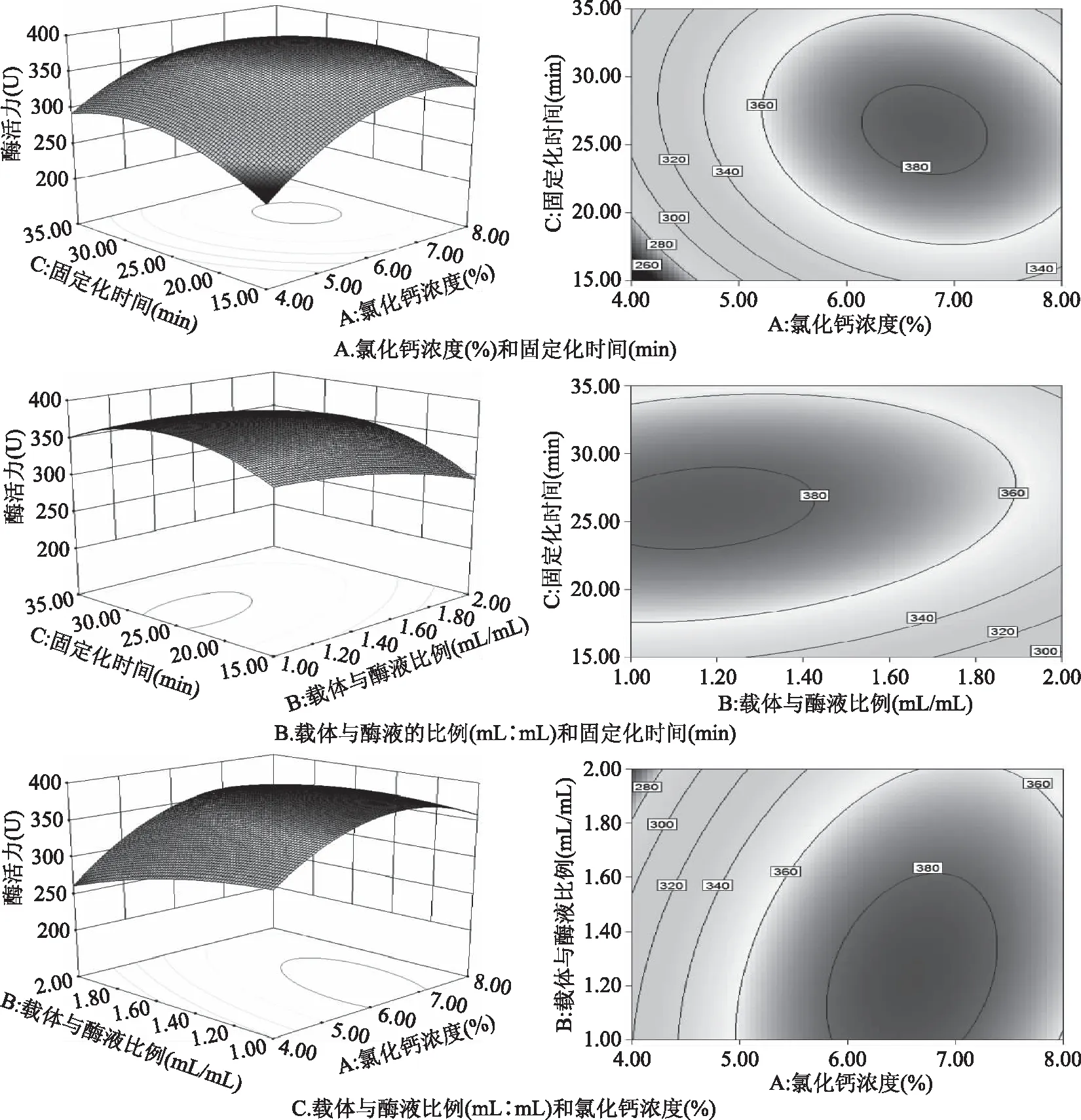
图4 两因素交互作用对固定化酶活性影响的等高线图及响应面Fig.4 Response surface and contour plots for the interactive effects of immobilized parameters on the activity of enzyme
注:**p<0.01表示差异极显著;*p<0.05为显著。由4A等高线可以看出,AC的交互作用对固定化酶活性有一定影响,在氯化钙浓度为6%~8%、时间为22~30 min条件下,酶活性达到最高值;图4B显示固定化酶活性对载体与酶液比例变化更敏感,酶活性最高值出现在时间为22~30 min、载体与酶液比例为1.0~1.2(mL/mL)条件下;图4C说明酶活性对氯化钙浓度的变化较为敏感,在氯化钙浓度为5.5%~8%、载体与酶液比例为1.0~1.6(mL/mL)时,酶活性最高。由图4可知,三维曲面在实验区域内有最高点,表明本实验所得结果Y在实验区域内有最大值。由响应面图可以分析得出,固定化酶活性随任意两个因素量的增加呈上升趋势,当两因素达到一定水平时,固定化酶活性的增加变得缓慢,最后转为下降趋势。
依据响应面实验得到藜麦种皮过氧化物酶的最佳固定化条件为,CaCl2体积分数为6.88%,载体与酶液比1.24∶1(mL/mL),固定化时间25.94 min。考虑到实验的可行性,修正了最优实验条件:CaCl2体积分数为7%,载体与酶液比1.25∶1(mL/mL),固定化时间26 min。在此工艺条件下进行了三次验证实验,所得藜麦过氧化物酶活性的平均值为416.5 U,与模型所得理论值417.4 U相近,偏差较小。表明回归方程能够较真实地反映各因素对藜麦种皮过氧化物酶固定化结果的影响,Box-Behnken实验设计得到的模型拟合程度较高,表明本实验方法可靠,将其用于优化藜麦过氧化物酶固定化工艺具有可行性。
3 结论
响应面法是一种考量多因素影响条件的优化方法,广泛应用于结构的优化设计,实验的可靠性分析等。通过固定数量的实验次数可以对实验因素进行连续分析,并得到直观的3D曲面图进而评价各因素间的交互作用[20]。
单因素实验得到过氧化物酶的最优提取条件在CaCl2浓度6%、载体与酶液比1.5∶1 (mL/mL)、固定化时间25 min。在此基础上设计了响应面实验对藜麦种皮过氧化物酶的固定化条件进行优化,建立了以固定化酶活性为响应值的回归模型,模型拟合程度较高,表明实验结果准确有效。在该模型下的固定化酶活性最高,此时的固定化条件为CaCl2浓度7%、载体与酶液比1.25∶1 (mL/mL)、固定化时间26 min,此条件下所得的固定化后的藜麦种皮过氧化物酶活性最高。经方差分析得知,CaCl2浓度、载体与酶液比例、固定化时间对固定化酶活性的影响都是显著的,而且是非线性的,但它们的交互影响不显著。实验结果表明,响应面分析法可以有效地优化藜麦种皮过氧化物酶的固定化条件,这为进一步提高藜麦的综合利用提供了理论依据。
[1]蒋选利,李振岐,康振生. 过氧化物酶与植物抗病性研究进展[J].西北农林科技大学学报(自然科学版),2001,29(6):124-129.
[2]张桂芝,谢朝良,陈钢,等. 阿魏菇中过氧化物酶特性研究[J].食品科学,2008,29(12):150-152.
[3]徐龙乾,文湘华,丁杭军. 木质素过氧化物酶在球型介孔材料上的固定化特性研究[J]. 环境科学,2010,31(10):
2493-2499.
[4]孙立水,高强. 过氧化物酶的应用研究进展[J]. 化工技术与开发,2006,35(12):13-16.
[5]冯东,李雪梅,王丙莲,等. 用辣根过氧化物酶生物传感器测定啤酒中的过氧化氢[J]. 酿酒科技,2011,12:37-39.
[6]江均平,王巧环. 大豆种皮过氧化物酶在酚类废水处理中的应用[J]. 化工环保,2006,26(5):382-385.
[7]韩志萍,叶剑英,罗荣琼 .固定化酶的方法及其在食品中的应用研究进展[J]. 保鲜与加工,2012,12(5):48-53.
[8]张超,高虹,李冀新. 固定化酶在食品工业中的应用[J]. 中国食品添加剂,2006,03:136-141.
[9]刘秀红,常雁红,罗晖. 环境领域中固定化酶的应用[J].安徽农业科学,2014,42(21):7171-7174.
[10]马俊锋,段继诚,梁振,等. 固定化酶反应器在蛋白质组研究中的应用[J]. 分析化学,2006,34(11):1649-1655.
[11]Fang S M,Wang H N,Zhao Z X,et al. Immobilized enzyme reactors in HPLC and its application in inhibitor screening:A review[J]. Journal of Pharmaceutical Analysis,2012,2(2):83-89.
[12]徐芬,王琳,张强,等. 辣根过氧化物酶在三种孔材料上的在线固定化研究[J]. 应用化工,2011,40(5):779-781.
[13]阙瑞琦,张丽丽,郭小路,等.莲藕过氧化物酶的分离纯化及性质研究[J]. 西南大学学报(自然科学版),2007,29(12):63-67.
[14]王红扬,孙才云,黄忙,等. 蕹菜过氧化物酶固定化条件分析及固定化对其理化性质影响[J]. 西南师范大学学报(自然科学版),2014,12:58-64.
[15]Vidueiros S M,Curti R N,Dyner L M,et al. Diversity and interrelationships in nutritional traits in cultivated quinoa(ChenopodiumquinoaWilld.)from Northwest Argentina[J]. Journal of Cereal Science,2015,62:87-93.
[16]Senra N V,Nevin S. Nutritional and health benefits of quinoa(ChenopodiumquinoaWilld)[J]. Journal of Cereal Science,2016,69:371-376.
[17]董晶,张焱,曹赵茹,等. 藜麦总黄酮的超声波法提取及抗氧化性[J]. 江苏农业科学,2015,43(4):267-269.
[18]张琛,张宽朝,章琛,等. 海藻酸钠包埋法制备固定化菠萝蛋白酶[J]. 生物工程加工,2009,7(6):31-34.
[19]李忠光,龚明. 愈创木酚法测定植物过氧化物酶活性的改进[J]. 植物生理学通讯,2008,44(2):323-324.
[20]Liu Y,Wei S L,Liao M C. Optimization of ultrasonic extraction of phenolic compounds from Euryale ferox seed shells using response surface methodology[J]. Industrial Crops and Products,2013,49:837-843.
Optimization of peroxidase immobilization conditionsfromChenopodiumquinoa bran using response surface methodology
FAN San-hong,TIAN He-he,CHAI Li-ping,LIU Huan-huan,LI Chen*
(College of Life Science,Shanxi University,Taiyuan 030006,China)
The peroxidase extracted fromChenopodiumquinoa bran were fixed by the method of embedment,using the peroxidase fromChenopodiumquinoa as raw materials,0.2% of polyvinyl alcohol and 3% of sodium alginate as the carrier,CaCl2solution as fixative. On the basis of single factor experiments,the response surface methodology was employed to optimize the related influential immobilization conditions of peroxidase fromChenopodiumquinoa bran. The results of optimum immobilization conditions were as follow:CaCl2concentration of 7%,immobilization time of 26 min,the ratio of carrier to peroxidase of 1.25∶1(mL/mL). With these conditions,the optimum activity of immobilization peroxidase fromChenopodiumquinoa were obtained,and the activity of the peroxidase was 416.5 U. The experimental value was in high agreement with the predicted value(417.4 U),which showed the validity of this response model.
Chenopodiumquinoa bran;peroxidase;response surface;immobilization
2016-12-23
范三红(1963-),男,硕士,教授,研究方向:食品活性成分及其功能,E-mail:fsh729@sxu.edu.cn。
*通讯作者:李晨(1981-),女,博士,副教授,研究方向:蛋白质与酶工程,E-mail:lichen@sxu.edu.cn。
山西大学科研训练项目(2015013225);山西省青年科学基金(2015021047);山西省高校科技创新项目(2016116)。
TS201.1
B
1002-0306(2017)13-0197-05
10.13386/j.issn1002-0306.2017.13.037
