响应面法优化紫山药中原花青素超声提取工艺及抗氧化性研究
2017-07-31王彦平杨会会钱志伟孙瑞琳
王彦平,杨会会,钱志伟,孙瑞琳,李 东
(河南农业职业学院,河南郑州 451450)
响应面法优化紫山药中原花青素超声提取工艺及抗氧化性研究
王彦平,杨会会,钱志伟*,孙瑞琳,李 东
(河南农业职业学院,河南郑州 451450)
以紫山药为实验材料,对紫山药中原花青素超声辅助提取的最佳工艺条件进行研究,并对其体外抗氧化活性进行评价。在单因素实验基础上,以原花青素得率为响应值,采用响应面法对超声辅助提取工艺进行优化。结果表明,紫山药原花青素的最佳提取工艺:乙醇体积分数70%、超声时间30 min、液料比19∶1(mL/g)、提取温度59 ℃、超声功率220 W,此条件下,紫山药原花青素得率达92.47 mg/g。体外抗氧化实验结果表明,紫山药原花青素具有明显的抗氧化性,对DPPH自由基(DPPH·)和羟基自由基(·OH)半数抑制率浓度IC50分别为0.182 mg/mL和0.289 mg/mL,清除能力和总还原力强于维生素C。超声辅助提取的紫山药原花青素具有良好的抗氧化性。
紫山药,原花青素,超声提取,响应面,抗氧化性
紫色山药学名参薯(DioscoreaalalaLinn),为薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)多年生草质缠绕藤本植物,与人们熟知的怀山药(DioscoreaoppositaLinn)是同科同属不同种[1]。目前主要种植区域有浙江、湖南、江西、广西等地,河南省也有少量种植,以其圆柱形或肥大的姜状、掌状块根供食用。紫山药有较高的食用和药用价值,富含淀粉、蛋白质、多种氨基酸、矿物元素、天然花青素、多糖、薯蓣皂苷、多酚、尿囊素等[2],具有抗氧化、免疫调节、耐缺氧、抗衰老等保健功能[3-6]。《本草纲目》记载,其有滋肺益肾、健脾止泻的功效[7],是我国重要的经济植物及药食同源的绿色蔬菜佳品。我国紫山药资源丰富,分布广泛,产业化种植规模正在逐年扩大。但目前,我国对紫山药的利用还多以鲜食为主,对紫山药功能成分的分析和精深加工尚处于落后阶段。因此,进一步深入研究紫山药的功能成分对促进紫山药精深加工相关产业的发展具有重要意义。
原花青素(Procyanidins),是一类在植物中广泛存在的多酚化合物的总称,由不同数量的儿茶素或表儿茶素缩合而成[8],以松树皮和葡萄籽中含量最为丰富[9]。原花青素是目前研究发现最直接、高效的抗氧化剂,其抗氧化能力是维生素C的20倍、维生素E的50倍,有明显的抑菌、抗疲劳、抗肿瘤、抗衰老、保护心血管、改善人体微循环、促进伤口愈合、改善实验小鼠肥胖、改善骨形成、改善肠道菌群和防治糖尿病等作用[10-14]。然而,紫山药原花青素的提取尚未见报道。目前,对原花青素的提取主要采用有机溶剂回流提取,但具有耗时长、温度高、提取率低、纯度低等缺点[15],而超声波辅助提取法利用超声波的空化作用、机械作用和热效应破坏生物细胞壁结构,加快原花青素释放速度,操作简单、提取时间短、提取率高[15]。自由基学说是目前公认的衰老学说之一,机体经过代谢会产生大量的自由基,自由基导致的氧化应激是导致多种慢性退化性疾病的重要因素。氧化应激可引起磷脂、蛋白质、DNA等生物大分子的氧化损伤,从而增加炎性病变、心血管疾病、肿瘤、糖尿病、阿尔兹海默症、白内障、年龄相关的功能衰退的风险[17]。因此,抗氧化活性也成为评价食物营养价值的一个重要方面。植物作为人体外源性抗氧化物质的最重要来源,其活性成分的抗氧化研究开发日益受到人们的重视并取得了许多成果[18]。
本实验首先利用响应面法对超声辅助提取紫山药原花青素的提取工艺进行优化,确定最佳工艺条件;其次通过对DPPH·和·OH的清除作用进行分析,评价其体外抗氧化活性,旨在为紫山药原花青素的研究和开发利用提供参考。
1 材料与方法
1.1 材料与仪器
紫山药 为市售广西贺州产完全成熟的紫山药。置于60 ℃恒温箱烘24 h,称恒重、粉碎,过50目筛后,在二氧化硅干燥器内常温保存备用。
1,1-二苯基-2-苦肼基(DPPH,纯度99%) Sigma公司;儿茶素(HPLC≥98%)上海金穗生物科技有限公司;香草醛(分析纯)科密欧化学试剂,分析纯;无水乙醇、甲醇、硫酸、三氯乙酸、三氯化铁、铁氰化钾、双氧水、硫酸亚铁等均为分析纯 购自国药集团。
BS224S分析天平 德国赛多利斯公司;UV power紫外可见光分光光度计 北京莱伯泰科仪器股份有限公司;HH-2数显恒温水浴锅 上海乔跃电子科技有限公司;202-3AB电热恒温鼓风干燥箱 上海乔跃电子科技有限公司;RE2000旋转蒸发仪 上海亚荣生化仪器厂;KBS-250 型数控超声波细胞粉碎机 昆山舒美超声仪器有限公司;D5-R2离心机 湖南湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 儿茶素标准曲线的绘制 以儿茶素为标准品,分别吸取 1.0 mg/mL 儿茶素标准溶液各0.04、0.08、0.12、0.16、0.20、0.24 mL至10 mL试管中,用甲醇稀释至1 mL,摇匀,再向其中加入5 mL 10 g/100 mL香草醛甲醇溶液和3 mL浓盐酸,混匀,在20 ℃水浴中反应10 min后,用甲醇作空白对照,在500 nm处测定吸光度。以质量浓度对吸光度进行回归分析,得标准曲线方程。以儿茶素浓度(μg/mL)为横坐标,吸光度为纵坐标绘制标准曲线,其线性回归方程为:y=2.2345x+0.0192,R2=0.9971。其浓度在0.04~0.24 mg/mL范围内呈现良好的线性关系。
1.2.2 原花青素的提取过程 紫山药粉与一定体积分数的乙醇溶液按一定液料比混合,在一定温度、一定超声功率下提取一定时间,将提取液离心(6000 r/min,20 min)后取上清液。用旋转蒸发仪低温减压浓缩,转入25 mL容量瓶,用甲醇定容,然后测定吸光度。
原花青素得率(mg/g)=原花青素质量(mg)/紫山药粉质量(g)
1.2.3 单因素实验 根据查阅文献[19]和预实验的结果,影响原花青素超声辅助提取的主要因子有乙醇体积分数、液料比、提取温度、超声时间、超声功率等。乙醇体积分数分别为40%、50%、60%、70%、80%,在液料比20∶1 mL/g、提取温度50 ℃、超声时间30 min、超声功率200 W条件下提取1次,考察乙醇体积分数对紫山药原花青素得率的影响。液料比分别为5∶1、10∶1、15∶1、20∶1、25∶1 mL/g,在乙醇体积分数70%、提取温度50 ℃、超声时间30 min、超声功率200 W条件下提取1次,考察液料比对紫山药原花青素糖得率的影响。提取温度分别为30、40、50、60、70 ℃,在乙醇体积分数70%、液料比20∶1 mL/g、超声时间30 min、超声功率200 W条件下提取1次,考察提取温度对紫山药原花青素得率的影响。超声时间分别为10、20、30、40、50 min,在乙醇体积分数70%、液料比20∶1 mL/g、提取温度50 ℃、超声功率200 W条件下提取1次,考察超声时间对紫山药原花青素得率的影响。超声功率分别为50、100、150、200、250 W,在乙醇体积分数70%、液料比20∶1 mL/g、提取温度50 ℃、超声时间30 min条件下提取1次,考察超声功率对紫山药原花青素得率的影响。
1.2.4 响应曲面优化实验设计 在单因素实验的基础上,采用Box-Benhnken实验设计(表1),以提取温度、超声功率、液料比为自变量,紫山药原花青素得率为响应值,建立紫山药原花青素提取工艺条件的二次模型。超声辅助提取紫山药原花青素,提取液于6000 r/min离心20 min后取上清液得原花青素粗提液,按照1.2.1的方法测定粗提液的吸光度,并计算原花青素得率,以确定超声辅助提取紫山药原花青素的最佳工艺条件。
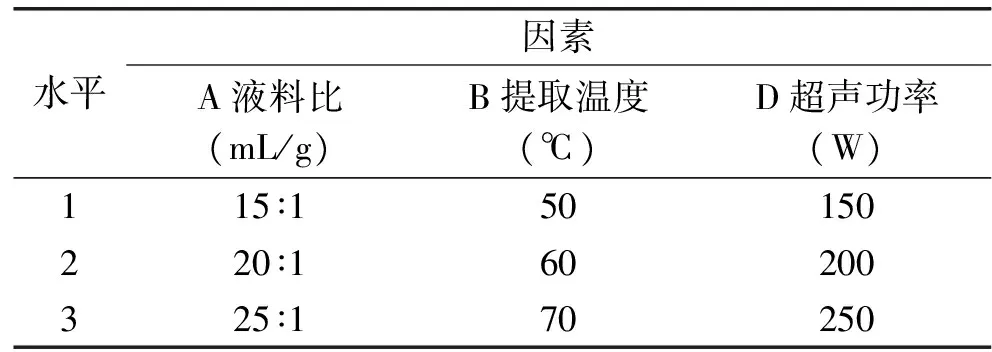
表1 响应面实验因素水平Table 1 Factors and levels of response surface test
1.2.5 紫山药原花青素体外抗氧化活性测定 称取200 g紫山药粉,按响应面实验得出的最佳提取工艺,提取液于6000 r/min的速度离心20 min,取上清液得原花青素粗提液。粗提液采用AB-8大孔树脂进行分离纯化后得紫山药原花青素粉末测定原花青素含量(原花青含量25.7%)。紫山药原花青素按照不同要求,配制不同浓度的紫山药原花青素水溶液,分别进行总还原力测定、DPPH·清除率的测定、·OH清除率的测定,体外抗氧化实验参照文献[8]的方法。
1.3 数据处理
所有数据均为3次平行实验的平均值,单因素实验和抗氧化性实验数据采用Microsoft office excel 2007 进行数据处理及图标制作,响应面实验采用Design-Expert 8.0.6软件进行方差分析,并优化出最佳提取工艺。
2 结果与分析
2.1 紫山药原花青素提取的单因素实验
2.1.1 乙醇体积分数对紫山药原花青素得率的影响 由图1可知,相同条件下,紫山药中原花青素得率随着乙醇体积分数的增加而升高。当乙醇体积分数由40%增加到70%时,原花青素得率不断升高,当乙醇体积分数大于70%时,原花青素得率反而下降,这可能与溶剂体积分数过高时小极性脂溶性溶出物太多太复杂的缘故[20]。由于乙醇体积分数为70%时优势较显著,故选择乙醇体积分数70%为最佳提取浓度。
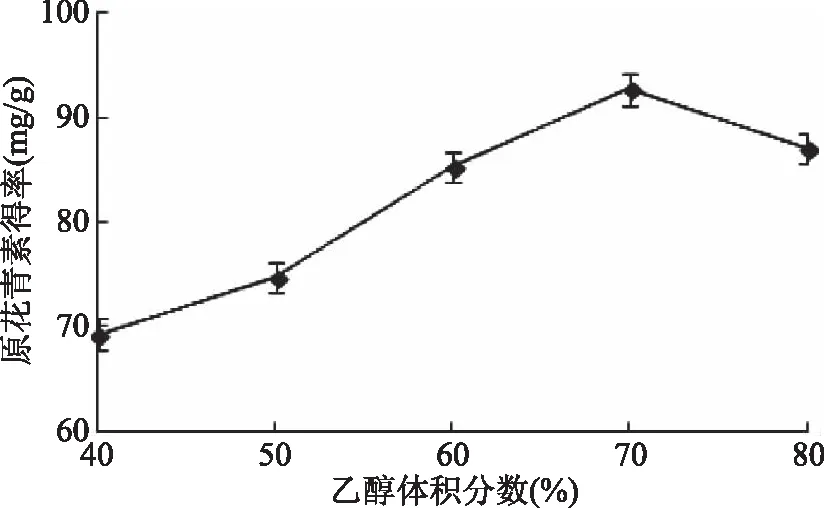
图1 乙醇体积分数对原花青素得率的影响Fig.1 Effect of ethanol volume fraction on procyanidins yield
2.1.2 液料比对紫山药原花青素得率的影响 由图2可知,当液料比由5∶1 mL/g增加到20∶1 mL/g时,原花青素得率不断升高,当液料比大于20∶1 mL/g时,原花青素得率呈下降趋势。一定范围内,提取剂剂量越大,原花青素得率越高;但当提取剂过多时由于可能影响超声的空化效应和机械振动的效果,原花青素得率反而下降[15]。故选择液料比为(15∶1~25∶1) mL/g进一步优化实验。
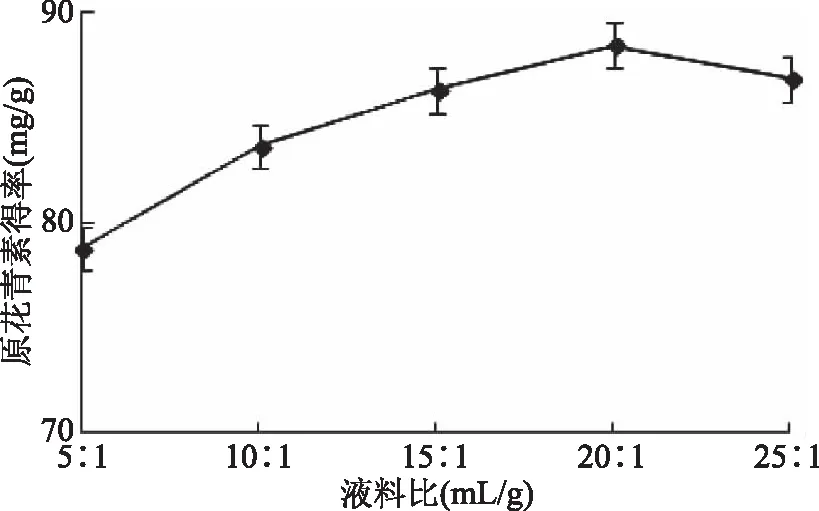
图2 液料比对原花青素得率的影响Fig.2 Effect of liquid-material ratio on procyanidins yield
2.1.3 提取温度对紫山药原花青素得率的影响 由图3可知,随着提取温度的升高,紫山药原花青素得率先升高后降低。这主要是由于温度越高分子运动越快,得率升高。但温度过高时,可能破坏原花青素的分子结构,得率反而降低。故选择提取温度为50~70 ℃进行优化。
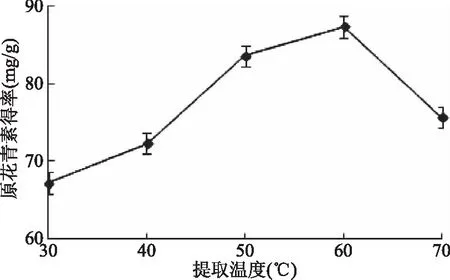
图3 提取温度对原花青素得率的影响Fig.3 Effect of extraction temperature on procyanidins yield
2.1.4 超声时间对紫山药原花青素得率的影响 由图4可知,超声时间低于30 min时,紫山药原花青素得率,随着时间延长呈现升高趋势,30~50 min范围时趋向平稳。超声时间达到一定程度,紫山药原花青素得率趋于平稳,可能由于此时细胞壁破坏较完全。故确定超声时间30 min为最佳时间。
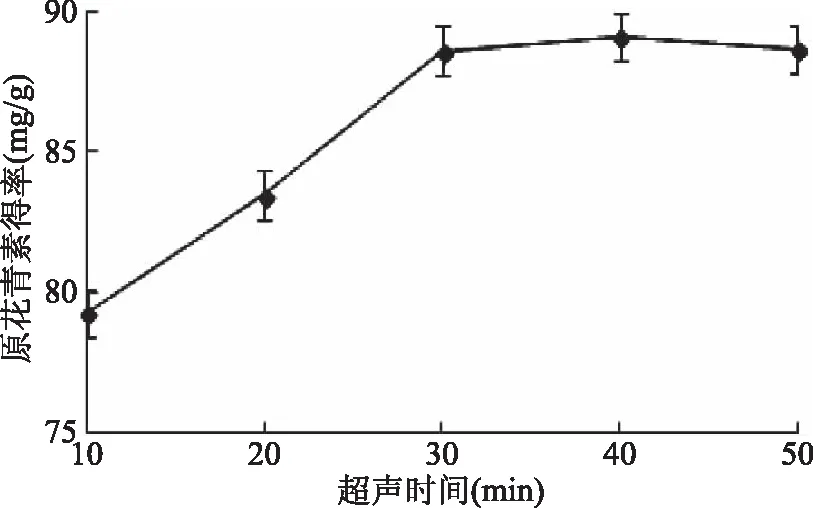
图4 超声时间对原花青素得率的影响Fig.4 Effect of ultrasonic time on procyanidins yield
2.1.5 超声功率对紫山药原花青素得率的影响 由图5可知,紫山药原花青素得率随着超声功率的提高呈现升高趋势,当超声功率为200 W时,原花青素得率最高,之后反而下降,可能由于功率过大加速了提取液的流动,使物料作用于超声波下的时间减少,细胞壁被破坏程度减弱,原花青素溶出减少[21]。故选择超声功率在150~250 W进一步优化。
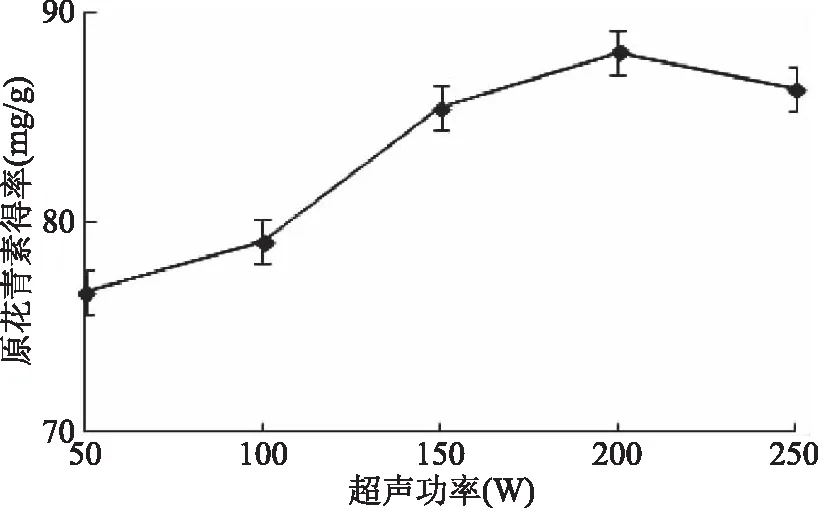
图5 超声功率对原花青素得率的影响Fig.5 Effect of ultrasonic power on procyanidins yield
2.2 紫山药原花青素提取的响应面实验
2.2.1 Box-Behnken实验设计与结果 在单因素实验基础上,以70%乙醇为提取剂、超声时间30 min,以紫山药中原花青素得率为响应值,选择液料比、提取温度和超声功率3个因素,做三因素三水平响应面设计,实验方案及结果见表2。
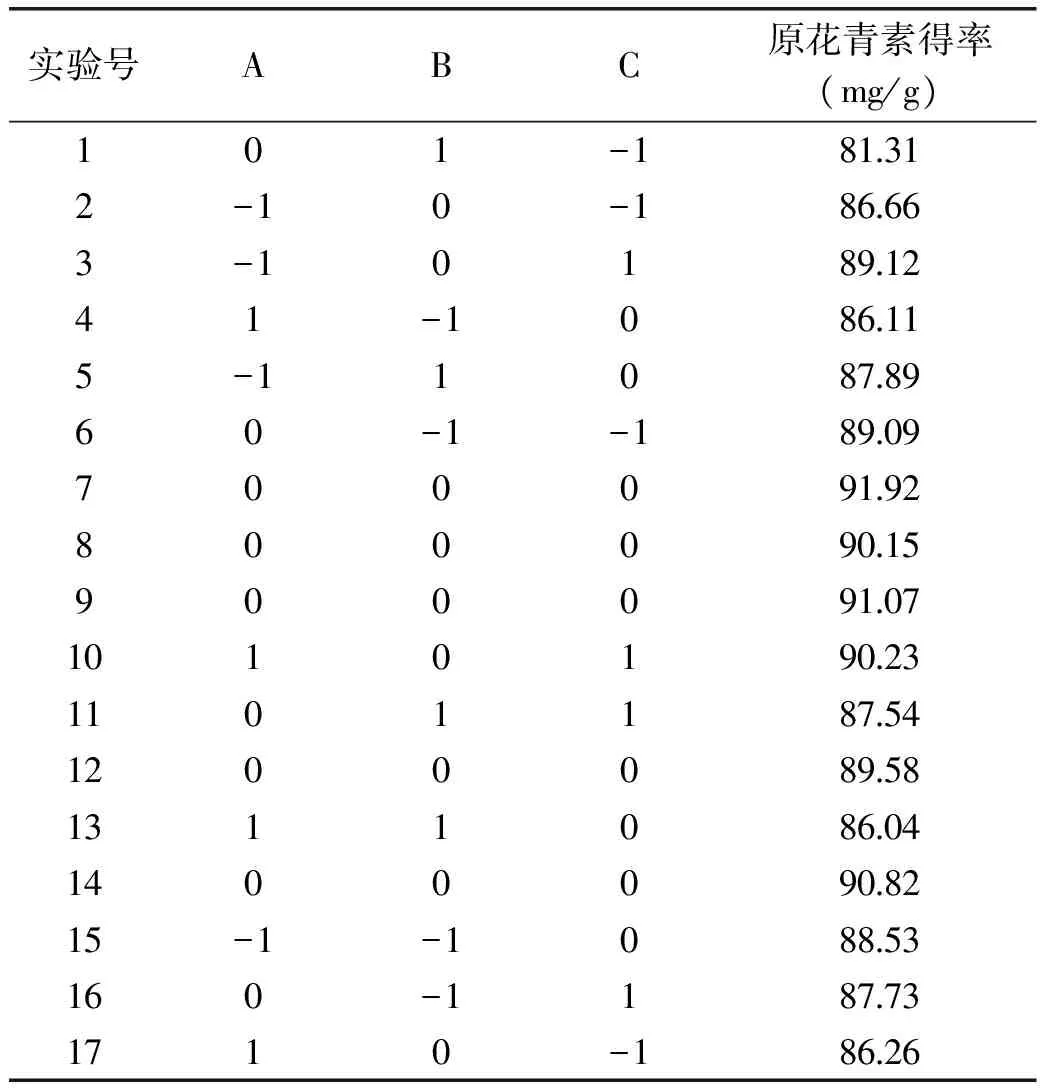
表2 紫山药原花青素提取的响应面实验设计及结果Table 2 The design and results of response surface test of procyanidins extraction
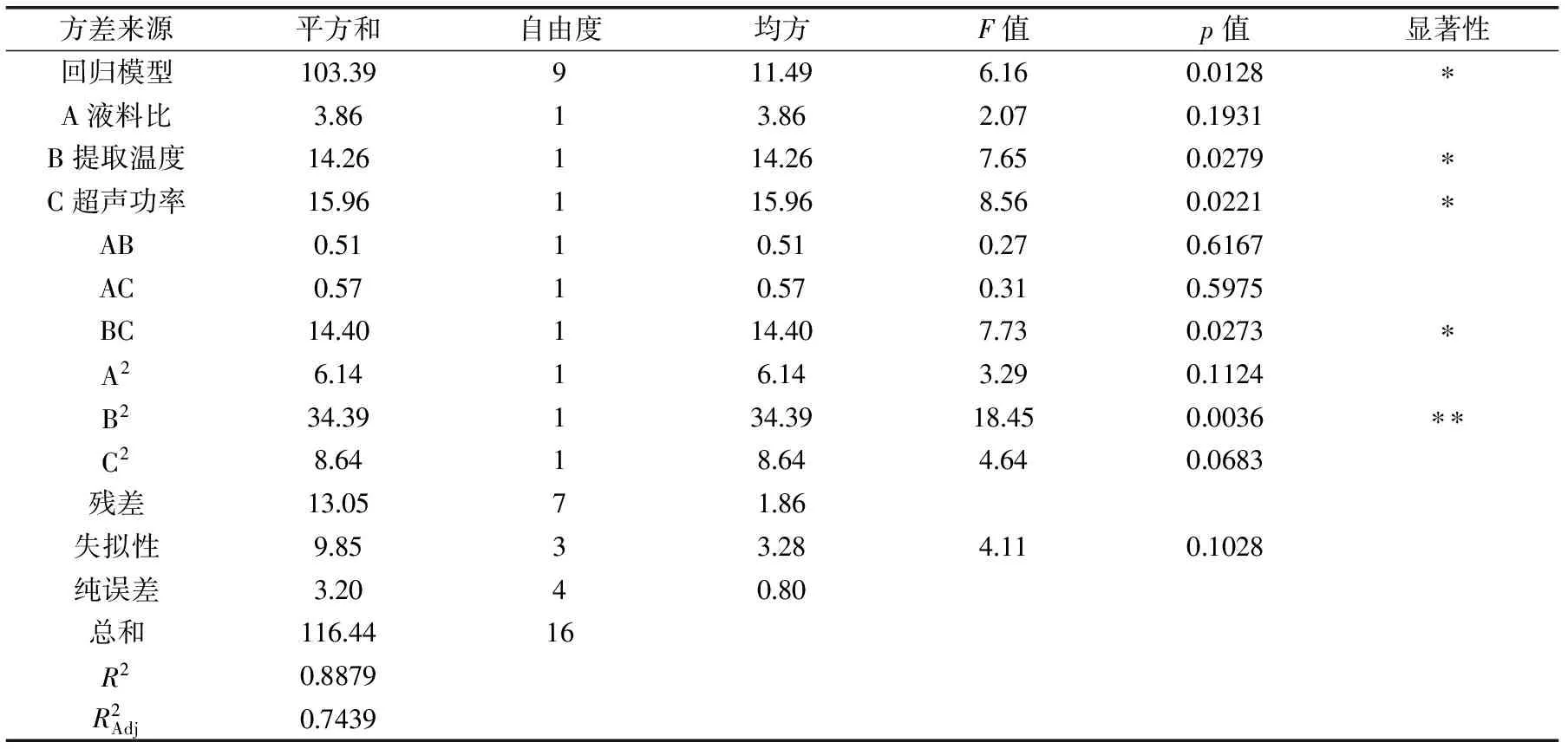
表3 回归方程各项方差分析结果Table 3 Analysis of variance for each term in the response surface regression model
注:*差异显著(p<0.05);**差异极显著(p<0.01)。2.2.2 模型的建立与显著性检验 应用Design Expert进行回归拟合分析,可得到紫山药中原花青素得率的回归模型为:
Y=90.71-0.57A-0.58B+1.29C-0.11AB+0.38AC+1.65BC-1.21A2-2.11B2-1.43C2,Y为紫山药原花青素得率的预测值。
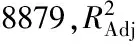
由图6可知,提取温度和超声功率交互作用的响应面坡度和等高线,说明二者相互作用对紫山药原花青素得率的影响显著,可能因为超声功率越大,所需提取温度越低,而在相同功率下提取温度过高则会引起得率下降。
图6 各因素交互作用对原花青素得率的响应面图Fig.6 Response surface graphs showing the interactions of various factors on procyanidins yield
2.2.3 最佳条件的预测及验证实验 通过回归模型预测,超声波辅助提取紫山药原花青素的最佳工艺为:液料比19∶1 mL/g、提取温度59 ℃、超声功率220 W,此时紫山药中原花青素理论得率最大为91.13 mg/g。根据所得工艺条件进行三组验证实验,得原花青素得率为(92.47±1.12) mg/g,与理论得率相接近,验证了此模型的有效性。
2.3 紫山药原花青素体外抗氧化活性
2.3.1 紫山药原花青素的总还原能力 由图7可知,在0.03~0.15 mg/mL浓度范围内,总还原能力随着紫山药原花青素浓度的增加而升高,并与样品浓度存在良好的量效关系。相同浓度下,紫山药原花青素的总还原能力明显高于维生素C。
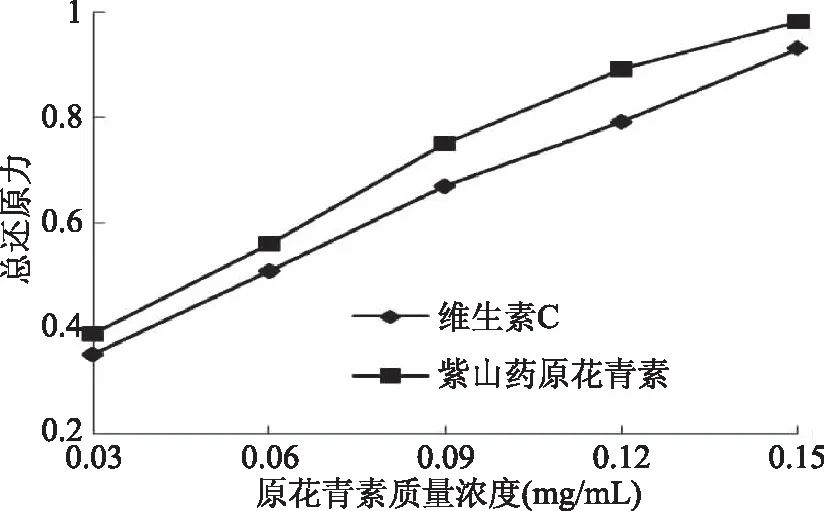
图7 紫山药原花青素的总还原能力Fig.7 The total reducing power of procyanidins from purple yam
2.3.2 紫山药原花青素对DPPH·的清除作用 由图8可知,在0.1~0.5 mg/mL浓度范围内,对DPPH·的清除能力随着紫山药原花青素浓度的提高而增强,通过线性回归方程计算得到紫山药原花青素的IC50=0.182 mg/mL,而维生素C的IC50=0.227 mg/mL,这说明在相同浓度下,紫山药原花青素对DPPH·的清除能力明显强于维生素C。
2.3.3 紫山药原花青素对·OH的清除作用 由图9可知,在·OH清除实验中,在0.1~0.5 mg/mL浓度范围内,原花青素浓度与·OH清除率之间存在良好的量效关系,通过线性回归方程计算得到紫山药原花青素的IC50=0.289 mg/mL,而维生素C的IC50=0.364 mg/mL,这说明在相同浓度下,紫山药原花青素对·OH的清除能力强于维生素C。
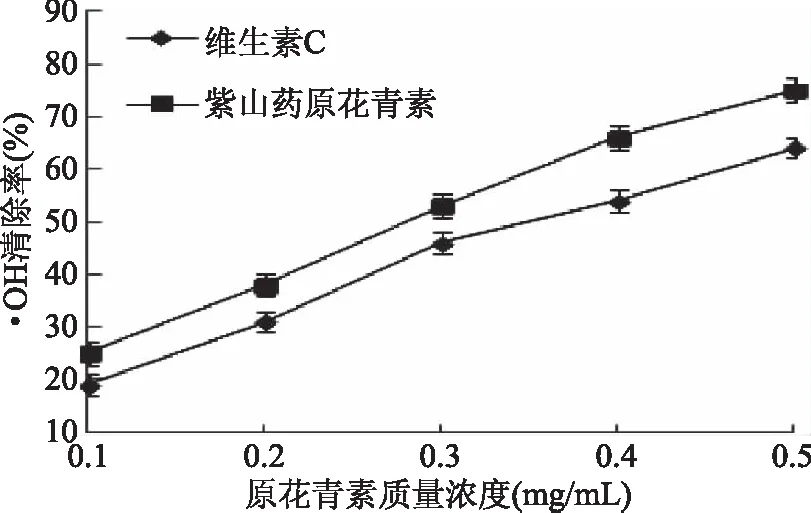
图9 紫山药原花青素对·OH的清除作用Fig.9 The scavenging effect of procyanidins from purple yam on ·OH
3 结论
采用超声辅助提取紫山药中原花青素,在单因素实验基础上,通过响应面实验设计,建立了紫山药中原花青素得率的二次回归模型,优化最佳工艺条件为:液料比19∶1 mL/g、提取温度59 ℃、超声功率220 W,在此条件下进行三组验证实验,得原花青素得率为(92.47±1.12) mg/g,与理论得率最大值91.13 mg/g相差不大。通过体外抗氧化实验发现,紫山药原花青素具有较强的抗氧化性,总还原力和对DPPH·、·OH的清除能力均强于维生素C。且在实验浓度下,紫山药原花青素的总还原力和对DPPH·、·OH的清除能力呈现良好的线性关系。为紫山药功能成分的开发利用提供一定的参考价值和理论基础。
[1]周新勇,宋曙辉,王文琪,等. 紫参薯及其同属植物铁杆山药中营养成分分析[J]. 安徽农业科学,2010,38(35):20005-20007.
[2]王彦平,汤高奇,谢克英,等. 紫山药主要活性成分提取纯化技术研究进展[J]. 食品工业科技,2016,37(17):356-359.
[3]Chiemi M,Takahiro H,Sayuri A,et al. New acylated anthocyanins from purple yam and their antioxidant activity[J]. Bioscience,Biotechnology,and Biochemistry,2015,(4):1-9.
[4]宋曙辉,刘庞源,赵霖,等. 紫山药对生长中大鼠营养生理功能的影响[J]. 安徽农业科学,2012,40(23):11624-11627.
[5]王彦平,袁贵英,曹娅,等. 紫山药提取物抗氧化与延长寿命作用的研究[J]. 食品工业科技,2017,37(1):360-363,374.
[6]刘杭达,马千苏,王傑,等. 紫山药粗多糖提取工艺的优化及其抗氧化性的研究[J]. 食品工业科技,2015,36(23):208-213.
[7]刘水英,李新生,党娅,等. 响应面法优化紫山药花青苷提取工艺及其抗氧化性[J]. 食品科学,2014,35(22):84-91.
[8]陈月英,王彦平,孙瑞琳,等. 葡萄皮渣原花青素微波辅助提取工艺的优化及其抗氧化活性研究[J]. 北方园艺,2016,(11):123-126.
[9]颜小梅,杨光,马媛,等. 葡萄籽原花青素对老年病的预防作用研究进展[J]. 食品科学,2014,35(21):339-343.
[10]董晓敏,韩瑞芳,刘天明. 葡萄籽原花青素对金黄色葡萄球菌的抑菌研究[J]. 食品工业,2015,36(8):188-192.
[11]王伟华,曹员,莫骏涛,等. 新疆慕萨莱思葡萄酒中原花青素含量测定的HPLC方法建立[J]. 北方园艺,2015(16):126-130.
[12]王华,刘霞,杨继红,等. 葡萄籽原花青素抗癌活性及其机制研究进展[J]. 安徽大学学报(自然科学版),2012,36(4):101-108.
[13]Nishizuka T,Fujita Y,Sato Y,et al. Procyanidins are potent inhibitors of LOX-1:a new player in the French Paradox[J]. Proceedings of the Japan Academy. Series B,Physical and Biological Sciences,2011,87(3):104-108.
[14]Castell-auvi A,Cedo L,Pallares V,et al. Procyanidins modify insulinemia by affecting insulin production and degradation[J]. Journal of Nutritional Biochemistry,2012,23(12):1565-1572.
[15]李钰,吴卫,苏华,等. 响应面法优化紫苏籽粕超声辅助提取原花青素工艺[J]. 食品科学,2013,35(4):50-54.
[16]Liu RuiHai,John Finley. Potential cell culture models for antioxidant research[J]. Agricultiral and Food Chemistry,2005,53,4311-4314.
[17]谭榀新,叶涛,刘湘新,等. 植物提取物抗氧化成分及机理研究进展[J]. 食品科学,2010,32(15):288-292.
[18]栾娜,刘行. 超声辅助提取紫甘蓝中原花青素工艺的优化[J]. 安徽农业科学,2012,40(30):14651-14653.
[19]陈月英,王彦平,孙瑞琳,等. 葡萄皮渣原花青素酶法提取工艺优化及其抗氧化性研究[J]. 北方园艺,2016,(16):129-132.
[20]秦菲,刘蕊,王龙. 超声辅助提取山竹果皮中原花青素[J]. 食品发教育工业,2012,38(7):157-160.
Optimization of ultrasonic-assisted extraction of procyanidins frompurple yam by response surface methodology and antioxidant activity
WANG Yan-ping,YANG Hui-hui,QIAN Zhi-wei*,SUN Rui-lin,LI Dong
(Department of Food Engineering,HenanVocational College of Agriculture,Zhengzhou 451450,China)
Taking purple yam as the experimental material,the optimum conditions of ultrasonic-assisted extraction of procyanidins from purple yam were studied and their antioxidant activitiesinvitrowere evaluated. On the basis of single factor test,response surface methodology was used to optimize the extraction yield of proanthocyanidins. Results showed the optimum condition were as follows:ethanol volume fraction 70%,ultrasonic time 30 min,liquid-material ratio 19∶1 (mL/g),extraction temperature 59 ℃,ultrasonic power 220 W.Under such conditions,the yield of procyanidins was 92.47 mg/g. Procyanidins from purple yam showed significant antioxidant capacity,and half inhibition concentrations(IC50)of DPPH· and that of ·OH were 0.182 mg/mL and 0.289 mg/mL respectively,the scavenging abilities and reducing power were stronger than vitamin C.
purple yam;procyanidins;ultrasonic-assisted extraction;response surface;antioxidant activity
2016-12-27
王彦平(1983--),女,硕士,讲师,研究方向:食品功能与营养因子,E-mail:14389487@qq.com。
*通讯作者:钱志伟(1969-),男,硕士,教授,研究方向:食品营养与检测,E-mail:1460331538@qq.com。
郑州市普通科技攻关项目(153PKJGG424);2015年度河南省高等学校优秀教学团队建设(河南农业职业学院食品营养与检测专业);2014年度河南省高等学校“专业综合改革试点”项目(河南农业职业学院食品营养与检测专业)。
TS209
B
1002-0306(2017)13-0181-06
10.13386/j.issn1002-0306.2017.13.034
