食品中黄曲霉毒素总量免疫分析方法研究进展
2017-07-31王亚楠王晓斐牛琳琳张海棠王自良
王亚楠,王晓斐,牛琳琳,雷 壮,张海棠,王自良,*
(1.河南科技学院动物科技学院,河南新乡 453003;2.动物病毒病防控与药残分析河南省高校重点学科开放实验室,河南新乡 453003;3.河南科技学院新科学院,河南新乡 453003)
食品中黄曲霉毒素总量免疫分析方法研究进展
王亚楠1,2,王晓斐3,牛琳琳1,2,雷 壮1,2,张海棠1,2,王自良1,2,*
(1.河南科技学院动物科技学院,河南新乡 453003;2.动物病毒病防控与药残分析河南省高校重点学科开放实验室,河南新乡 453003;3.河南科技学院新科学院,河南新乡 453003)
黄曲霉毒素(aflatoxins,AFs)污染食品的广泛性、严重性和危害性倍受食品行业的关注,单一黄曲霉毒素检测已不能满足行业的需求。针对食品黄曲霉毒素总量检测目前普遍采用理化分析方法,相比之下由于免疫分析技术具有高特异性、高灵敏性、简便性等技术优势,已成为今后的发展方向和重要的研究课题。本文就食品黄曲霉毒素总量免疫分析技术的研究进展作简要综述,旨在为食品AFs总量免疫分析提供新的方法和思路。
食品,黄曲霉毒素总量,免疫分析,研究进展
黄曲霉毒素(aflatoxins,AFs)是由黄曲霉(Aspergillusflavu)和寄生曲霉(Aspergillusparasiticus)经过聚酮途径所产生的含有二呋喃环和氧杂萘邻酮结构相似的一组有毒次生代谢产物,目前已发现AFs有20种,自然条件下产生的AFs主要包括B1、B2、G1、G24种[1]。AFs对人体健康具有致癌性、致突变性、致畸性和致免疫抑制性等毒性作用,尤其是AFB1毒性最强,污染广泛,比例较高(1/2以上),世界上大多数国家对食品中AFB1残留限量标准都做出了明确的规定[2]。但随着人们对食品安全问题的日益关注,对AFs毒性研究的不断深入,检测技术的不断进步,为解决多种毒素污染同时存在且具有毒性叠加效应及在在检测标准方面的相应缺失,制订AFs总量(B1+B2+G1+G2)限量标准及相应检测方法已成为发展趋势[3]。针对这一新的限量要求及在食品国际贸易中的作用,世界上许多国家都展开了AFs总量标准及检测方法的研究,至2013年已有91个国家采用了AFs总量限量标准,如国际食品法典委员会(CAC)、美国食品与药物监督管理局(FDA)等规定食品中AFs总量限量标准为15 μg/kg,日本规定食品中AFs总量限量标准为10 μg/kg,欧盟(EC)规定食品及食品的组分中AFs总量限量标准为4 μg/kg,我国现行的《GB 2761-2011 食品中真菌毒素限量》标准严格规定了AFB1的限量标准,尚未涉及AFs总量限量要求,但在《GB/T 5009.23-2006 食品中黄曲霉毒素B1、B2、G1、G2的测定》标准中规定了AFs总量限量检测方法[4]。
食品中AFs总量分析方法主要有理化分析和免疫分析两种,目前各国主要采用的理化分析方法有高效液相色谱法(high performance liquid chromatography,HPLC)[5]、液相色谱-质谱联用法(liquid chromatography-tandem mass spectrometry,LC/MS)[6]、时间分辨荧光分析法(Time resolved fluoroisnmunoassay,TRFIA)[7]等。但由于受仪器设备、技术人员、样品处理、操作场地、经济成本等方面的制约,这些理化分析方法的应用受到了限制[8]。免疫分析方法由于具有选择性强、灵敏度高、快速简便、样品筛检量大、可现场操作等优势,已成为AFs总量检测研究的热点课题[9],并在AFs总量快速检测中发挥了重要作用。本文就AFs总量免疫分析方法中人工抗原合成及抗体特性、免疫分析方法建立及优缺点、存在问题与展望等作一综述,旨在为AFs总量免疫分析方法的发展提供借鉴。
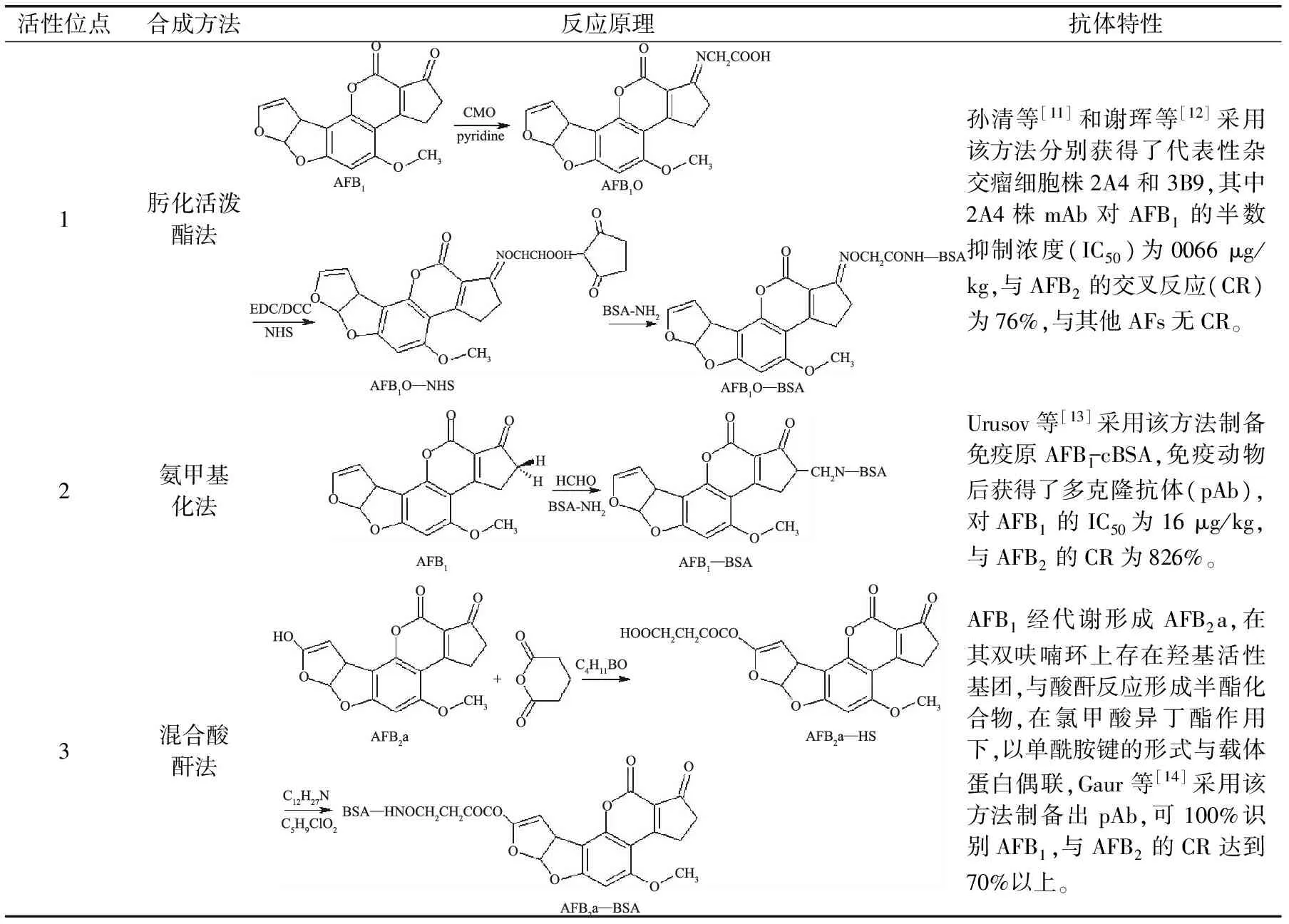
表1 B族AFs抗原合成及抗体特性Table 1 Antigen synthesis and antibody characterization of B group aflatoxins
1 AFs人工抗原合成及抗体特性
高质量的抗体是建立免疫分析方法的核心试剂,就目前的研究进展而言,实现AFs总量免疫分析的途径有两条,一是分别制备B族AFs和G族AFs灵敏度高、特异性强的单一抗体,之后混合使用的混合通用抗体;二是制备能够同时识别AFB1、AFB2、AFG1、AFG2灵敏度高、识别谱广的单一通用抗体,这是最为理想的技术方法。由于AFs是小分子化合物,不具有免疫原性,无法直接诱导机体产生抗体,无论采取哪种途径都必须通过AFs分子改造与大分子蛋白质载体结合成为人工抗原,借助T细胞表位来间接诱导B细胞的增殖及分化,制备合格抗体[10]。
1.1 AFs混合通用抗体制备
1.1.1 B族AFs灵敏、特异性抗体制备 B族AFs属多环不饱和双呋喃香豆素内酯类化合物,含有一个与基本毒性有关的双呋喃环结构和致癌性有关的氧杂萘邻酮结构(见图1),根据其分子结构上存在的活性基团和活性位点,B族AFs抗原合成方法主要有肟化活泼酯法、氨甲基化法、混合酸酐法、半缩醛法、环氧化物法、烯醇醚衍生物法等。以AFB1和载体蛋白牛血清白蛋白(bovine serum albumin,BSA)为例,B族AFs抗原合成及抗体特性见表1。
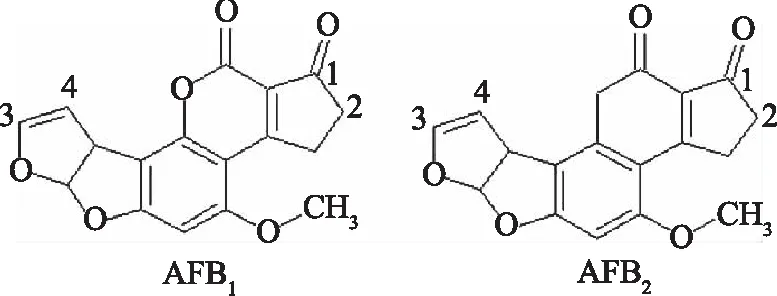
图1 AFB1和AFB2分子结构式Fig.1 Molecular structure of AFB1 and AFB2

续表
对上述B族AF半抗原分子设计、抗原合成方法及所产生抗体特性进行综合分析,作者认为,肟化活泼酯法效果最优,选择AFB1的2位羰基为活性位点,通过肟化引入活性基团羧基,以单酰胺键为间隔臂合成抗原,该方法操作步骤简单,反应条件温和,产物产率较高;同时,所产生抗体具有效价高(免疫动物易产生抗体)、敏感(IC50为0.066 μg/kg)、特异(100%识别AFB1)、广谱(同时100%识别AFB2)等特性。其次是混合酸酐法和半缩醛法,均是选择AFB2a的3位羟基为活性位点,分别以单酰胺键(混合酸酐法)、希夫氏碱(半缩醛法)为间隔臂合成抗原,两种方法易于操作,抗体特异性较好,但抗体敏感性、广谱性需要进一步提高。其他方法所制备的抗体具有较大缺陷,已很少采用。
1.1.2 G族AFs灵敏、特异性抗体制备 G族AFs与B族AFs结构相似,都含有双呋喃环和氧杂萘邻酮,不同的是B族AFs连接戊酮,而G族AFs连接六元内酯(见图2),B族AFs抗原制备可通过1、2位点进行,但G族AFs的1、2位点非常稳定,难以实现与载体蛋白偶联,G族AFs抗原合成方法主要有半缩醛法、烯醇醚衍生物法和环氧化物法等。以AFG1和BSA为例,G族AFs抗原合成及抗体特性见表2。

图2 AFG1和AFG2分子结构式Fig.2 Molecular structure of AFG1 and AFG2
由于对G族AF半抗原分子设计、抗原合成方法及所产生抗体特性研究起步较晚,综合分析上述三种方法,作者认为,半缩醛法效果最优,将AFG1酸化形成AFG2a,利用AFG2a的3位羟基活性基团,以希夫氏碱为间隔臂合成抗原,所产生抗体具有效价高、敏感性好、特异性强和识别谱广的特性。环氧化物法和烯醇醚衍生物法均存在敏感性较差的缺陷,很少应用。

表2 G族AFs抗原合成及抗体特性Table 2 Antigen synthesis and antibody characterization of G group aflatoxin
1.2 AFs单一通用抗体制备
根据目前的研究结果,均是选择AFB1为反应的起始原料,采用肟化活泼酯法制备AFs单一通用mAb。首先肟化法合成半抗原AFB1O,以甲醇水溶液为溶剂,以吡啶为催化剂,以羧甲基羟胺半盐酸盐(CMO)为半抗原肟化剂,在加热回流条件下,AFB1的羰基与CMO的氨基缩合形成N-O-甲基羧酸(-COOH),使AFB1肟化为AFB1O;其次活泼酯法合成人工抗原,使用双功能偶联剂1-乙基-3-(3-二甲基氨丙基)碳二亚胺(EDC)在水溶液中或使用N,N-二环己基碳二亚胺(DCC)在有机溶液中将AFB1O中的-COOH与载体蛋白的-NH2以单酰胺键(-CONH-)的形式实现偶联。用人工抗原免疫Balb/C小鼠,通过细胞融合技术筛选杂交瘤细胞株,体内诱生腹水法制备mAb。Chu等[23]于1977年建立该方法,AFB1O的产率为73%~83%,之后Kolosova等[24]和Cervino等[25]对该方法进行了完善,AFB1O的产率提高到90%以上,虽然获得了抗AFB1高效价、敏感、特异的抗体,但与AFB2、AFG1、AFG2的CR较低,不能用于建立AFs总量免疫分析方法。Zhang等[26]采用该方法,筛选出1D3、4F12、1C11、10G4和4F3共5株杂交瘤细胞株,均可用于AFs总量检测,其中1C11效果最好,1C11所分泌的mAb对AFB1、AFB2、AFG1和AFG2的IC50分别为1.2、1.3、2.2和18.0 pg/mg,CR分别为100%、92.3%、54.5和6.7%。Li等[27]采用该方法筛选出杂交瘤细胞株10C9,所分泌的mAb对AFB1、AFB2、AFG1和AFG2的IC50分别为2.09、2.23、2.19和3.21 μg/kg,CR分别为100%、93.6%、95.4和65.2%。Kim等[28]采用该方法筛选出杂交瘤细胞株8H10,所分泌的mAb对AFB1、AFB2、AFG1和AFG2的IC50分别为4.36、7.22、6.61和29.41 μg/kg,CR分别为100%、60.47%、65.97和14.83%。
2 AFs总量免疫分析方法及其性能
目前已建立的AFs总量免疫分析方法有酶联免疫吸附法(enzyme linked immunosorbant ssay,ELISA)、胶体金免疫层析法(gold immunochromatographic assay,GICA)、荧光免疫分析法(Fluorescence immunoassay,FIA)和免疫传感器法(immunosensor,IS)等。
2.1 酶联免疫吸附法
ELISA检测小分子半抗原的原理是:将抗原(或抗体)包被于酶标板,同时加入抗体与待测半抗原(或酶标半抗原与待测半抗原),抗原与待测半抗原(或酶标半抗原与待测半抗原)共同竞争抗体的抗原结合位点,洗板后酶标板上仅留下抗原与抗体(或酶标半抗原与抗体)反应结合的抗原抗体复合物,复合物的量与待测半抗原的量呈负相关,通过酶底物催化显色,根据颜色的深浅有无对待测半抗原进行定性和定量检测。分析方法包括间接竞争ELISA(indirect competitive ELISA,icELISA)和直接竞争ELISA(direct competitive ELISA,dcELISA)两种技术模式。ELISA的优点是快速方便、操作简单、成本较低、筛检样品量大。缺点是由于抗体与酶均属生物活性物质,需要低温保存,易受环境和反应条件影响,稳定性差;存在非特异性反应,检测结果易出现假阳性问题;样品萃取需要脱脂、脱盐、调节pH等,样品前处理复杂[29]。Li等[27]用筛选出的10C9细胞株所分泌的mAb建立了AFs总量icELISA检测方法,检测范围为2.1~3.2 μg/kg,添加回收率为87.5%~102.0%。Kim等[28]用筛选出的8H10细胞株所分泌的mAb建立了AFs总量dcELISA检测方法,检测范围为0.2~25 μg/kg,添加回收率为79.18%~91.27%。计融等[30]用自制的AFs mAb研制出食品AFs总量快速检测ELISA试剂盒,其对AFs B+G标准品的LOD为0.26 μg/kg,检测范围为0.26~20.00 μg/kg,对AFBl、AFB2、AFG1和AFG2的CR分别为100%、57.5%、104.0%和19.0%,对玉米3个加标回收率分别为98.63%、94.56%和112.05%,对花生的3个加标回收率分别为88.66%、87.50%和85.60%。目前,国内外许多公司研发出商品化、标准化的AFs总量检测ELISA试剂盒,在灵敏性、特异性、准确性、稳定性、适用性等方面均有良好的表现,已成为AFs总量检测的重要手段。如Zheng等[31]用新加坡Biomin公司的AFs总量ELISA试剂盒检测玉米、高粱、小麦、大米、大豆、花生和棉籽等样品,LOD为4.0 μg/kg,检测范围为4.0~40.0 μg/kg,试剂盒保存期为1年,其敏感度与HPLC相当。Iqbal等[32]用美国Romer Labs科技公司的AFs总量ELISA试剂盒对120个糙米样品进行检测,并用TLC、HPLC和LC/MS-MS理化检测方法进行验证,结果表明,ELISA试剂盒的LOD为1.0 μg/kg,检测范围为1.0~40.0 μg/kg,加标回收率范围为83.2%~90.4%,实际检出阳性88个,样品AFs总量值1.24~11.68 μg/kg,检测结果与TLC、HPLC和LC/MS-MS的检测结果完全一致,检测灵敏度ELISA试剂盒优于TLC,但稍低于HPLC和LC/MS-MS。
2.2 胶体金免疫层析法
GICA检测小分子半抗原的原理是:当样品中不含小分子半抗原时,游离的金标抗体与固定在膜上的半抗原结合形成红色条带,检测结果呈阴性;当样品中含有小分子半抗原时,其与游离的金标抗体结合,抑制了金标抗体与固定在膜上的半抗原结合,样品中小分子半抗原的含量决定了膜上红色条带的深浅或有无,检测结果呈阳性。GICA的优点是快速、简便、特异性强、稳定性好、可现场检测、筛检样品量大。缺点是只能定性或半定量检测,无法准确定量;检测灵敏度不及ELISA、HPLC和LC/MS-MS[33]。Anfossi等[34]利用自主研制的B族、G族混合单抗研制出AFs总量检测试纸(Test strip),LOD为1.0 μg/kg,检测范围为1.0~40.0 μg/kg,用Test strip对25个玉米样品进行检测,并用HPLC进行确证,检测结果与HPLC完全相符,相关回归方程为y=0.97x+0.07,变异系数(R2)为0.980。Zhang等[35]用自主制备的1C11杂交瘤所分泌的单一通用单抗研制出AFs总量Test strip,LOD为0.46 μg/kg,对AFB1、AFB2、AFG1和AFG2的LOD为0.03、0.06、0.12和0.25 μg/kg,用Test strip检测花生样品,对检出的20个阳性样品分别测定AFs污染组分,并用HPLC进行确证,结果表明,同时检出AFBl、AFB2、AFG1和AFG2污染样品0个,同时检出AFB1、AFB2和AFG1污染样品3个,同时检出AFB1和AFB2污染样品18个,只检出AFB1污染样品1个,只检出AFB2污染样品1个,检测与HPLC完全一致。徐振斌等[36]应用美国clover icheck公司的AFs总量Test strip对市售96个玉米样品进行筛检,检出的5个阳性样品用HPLC确证,Test strip的LOD为1.0 μg/kg,相对标准偏差(RSD)小于15.2%,加标回收率范围为82.4%~95.8%,Test strip的检测结果与HPLC的检测结果完全一致。
2.3 荧光免疫分析法
FIA原理是基于荧光未标记的抗原(Ag)和荧光标记抗原(Ag-F)共同竞争结合抗体(Ab)的有限位点而实现的免疫分析方法,目前已建立的用于AFs总量检测的FIA主要包括荧光偏振免疫分析法(Fluorescence polarization immunoassay,FPIA)和时间分辨荧光免疫分析法(Time-resolved fluoroimmunoassay,TRFIA)两种。
2.3.1 荧光偏振免疫分析法 FPIA检测小分子半抗原的原理是:用荧光物质标记抗原或抗体,抗原抗体进行特异性结合反应后,依据抗原抗体结合物荧光偏振程度的差异,用竞争性方法测量待测样品中小分子化合物的含量。分析方法包括置换(Single-Reagent FPIA)、停流FPIA(Stopped-Flow FPIA)和有机介质FPIA(Organic Medium FPIA)三种技术模式。FPIA的优点是高通量、速度快、操作简便、检测成本低、定量检测和可大批量快速筛选样本。缺点是由于存在基质效应导致有假阳性、由于需要专门荧光偏振设备导致仪器成本高、由于多采用杯式检测装置导致试剂用量大且检测效率低[37]。Nasir等[38]用研制的AFs族特异性单抗建立FPIA,检测谷物样品包括玉米、高粱、花生油、花生酱中AFs总量残留,并与HPLC比较确证,添加回收实验结果表明,AFs混合物Bl/B2/Gl/G2按重量比为7/1/3/1,FPIA的LOD为1.0 μg/kg,检测范围为1.0~32.0 μg/kg,检测结果与HPLC的检测结果完全一致,R2为0.99,研究结论为FPIA可用于AFs总量检测。Sheng等[39]用广谱性较强的抗AFB1单抗建立FPLA,其对AFB1的IC50值为23.33 μg/kg,LOD为13.12 μg/kg,对AFB1、AFB2、AFG1和AFG2的CR分别为100%、65.7%、143%和23.5%,所建立的FPLA可用于AFs的总量检测。
2.3.2 时间分辨荧光免疫分析法 TRFIA检测小分子半抗原的原理是:使用镧系元素(Eu、Tb、Sm、Dy等)长效荧光标记物,在关闭激发光后再测定荧光强度的分析方法。TRFIA的优点是操作简便、灵敏度高、检测线性范围宽、重复性好、试剂保存时间长、无污染危害等,TRFIA是目前公认的最为敏感的免疫学分析方法。缺点是试剂纯度要求较高、镧系元素离子螯合物的合成难度较大、标记多个靶标物难度大进而多元检测受到局限等[40]。Degan等[41]最早研究报道,以Eu3+标记广谱性的AF B1多克隆抗体,建立TRFIA用于AFs总量检测,并与ELISA方法进行了比较,对AFs总量的LOD为0.004 μg/kg,检测范围为0.004~4 μg/kg,其灵敏度高于ELISA。Wang等[42]用Eu3+纳米球标记广谱性的AFs单抗,建立了用于AFs总量检测的金纳米TRFIA(Eu-Nano-TRFIA),该方法检测AFs总量包括AFB1、AFB2、AFG1和AFG24种,检测时间12 min,LOD为0.16 μg/kg,检测范围为0.16~30.0 μg/kg,加标回收率为83.9%~113.9%,变异系数(CVs)为3.5%~8.8%,对397个饲料原料样本进行实际检测,阳性检出率为78.3%,阳性样本AFs总量浓度值为0.50~145.30 μg/kg,其中棉籽饼中AFs含量最高为18.48 μg/kg。该方法与HPLC、ELISA、GICA相比,具有灵敏、准确、快速等优点,LOD符合我国规定的限量标准,可较好满足食品AF总量污染残留检测的需求。
2.4 免疫传感器法
IS检测小分子半抗原的原理是:IS由抗原或抗体与换能器组成,待测样品中小分子半抗原与固化在传感器表面的特异性抗体反应形成抗原抗体结合物,结合物量的大小决定IS的电荷信号,换能器根据电荷信号的强弱变化,达到检测待检半抗原的目的。IS根据传感技术原理可分为光学免疫传感器、电化学免疫传感器、热量免疫传感器和质量免疫传感器4类[43],目前已建立了用于AFs检测的光学免疫传感器[44]和电化学免疫传感器[45]。IS用于AFs总量检测的优点是携带方便、操作简单、成本较低、可自动化检测。其缺点是抗原抗体固化技术不够成熟、灵敏度与精密度需要进一步提高、难以实现多元检测和难以实现批量生产[46]。Kong等[47]用纳米金研制出半定量和定量IS,实现了霉菌毒素的多元IS检测,可同时检测霉菌毒素20种,其中选择敏感、特异的AFs族广谱性单抗,可同时检测AFB1、AFB2、AFG1和AFG2,LOD为0.25 μg/kg,检测范围为0.25~4.0 μg/kg。
3 展望
在目前已发现的20种AFs中,自然条件下产生的AFs主要是B1、B2、G1、G24种,且这4种毒素残留对人体健康的毒性往往具有协同和加性效应,实施AFs总量检测已成为当前食品质量安全检测领域发展的必然趋势,而特异性强、识别谱广单一或混合通用抗体的制备和相应灵敏度高、快速简便检测方法的建立成为技术关键。在抗原合成及抗体制备方面,随着免疫学、计算科学、量子化学、分子动力学等学科理论的发展,以及分子模拟技术、计算机辅助技术、网络数据库分析技术等的应用,以半抗原分子空间结构的复杂程度、活性位点的选择、活性基团的引入和进入间隔臂的长度为主要研究内容的半抗原分子设计与抗原合成理论逐渐丰富与完善,对于提高半抗原分子设计与抗原合成的合理性、时效性和预见性提供了可供借鉴的理论与方法[48-50]。Kim等[28]通过计算机辅助技术,制备出了特异性强、识别谱广的AF 单一通用抗体,以ELISA技术模式实现了AF的总量检测。周茜等[51]借助分子模拟技术,成功制备了G族AF mAb,对AFG1、AFG2的IC50分别为17.18、19.75 ng/mL,建立了以G族AF ELISA检测方法。在免疫快速检测方法的选择与建立方面,随着抗体标记技术如酶标记、纳米金标记、荧光标记、量子点标记等的逐步完善和新的标记技术如镧系元素标记等的不断出现,免疫检测方法正向灵敏、快速、准确、高效、操作简单的方向发展,将在AFs总量检测中发挥重要作用,对于推动我国食品安全免疫检测技术的快速发展具有积极意义。
[1]Karaaslan M,Aarslangray Y. Aflatoxins B1,B2,G1,and G2contamination in ground red peppers commercialized in Sanliurfa,Turkey[J]. Environmental Monitoring and Assessment,2015,187(4):184.
[2]Sun D,Gu X,Li J,et al. Quality Evaluation of Five Commercial Enzyme Linked Immunosorbent Assay Kits for Detecting Aflatoxin B1 in Feedstuffs[J]. Asian Australasian Journal of Animal Sciences,2015,28(5):691-696.
[3]Aiko V,Mehta A. Occurrence,detection and detoxification of mycotoxins[J]. Journal of Biosciences,2015,40(5):943-954.
[4]马海华,孙楫舟,甄彤,等. 我国国家标准和行业标准中黄曲霉毒素测定方法综述[J]. 食品工业科技,2016,37(6):360-366.
[5]Habibipour R,Tamandegani P R,Farmany A. Monitoring of aflatoxin G1,B1,G2,and B2 occurrence in some samples of walnut[J]. Environmental Monitoring and Assessment,2016,188(12):669.
[6]Fan S,Li Q,Zhang Z,et al. Simultaneous determination of aflatoxin B1,B2,G1,and G2in corn powder,edible oil,peanut butter,and soy sauce by liquid chromatography with tandem mass spectrometry utilizing turbulent flow chromatography[J]. Journal of Separation Science,2015,38(8):1310-1317.
[7]Wang D,Zhang Z,Li P,et al. Europium Nanospheres-Based Time-Resolved Fluorescence for Rapid and Ultrasensitive Determination of Total Aflatoxin in Feed[J]. Journal of Agricultural and food chemistry,2015,63(47):10313-10318.
[8]Mak A C,Osterfeld S J,Yu H,et al. Sensitive giant magnetoresistive-based immunoassay for multiplex mycotoxin detection[J]. Biosensor and Bioelectronics,2010,25(7):1635-1639.
[9]Siahi Shabad M R,Ansarin M,Tahavori A,et al. Determination of aflatoxins in nuts of Tabriz confectionaries by ELISA and HPLC methods[J]. Advanced Pharmaceutical Bulletin,2012,2(1):123-126.
[10]Gefen T,Vaya J,Khatib S,et al. The effect of haptens on protein-carrier immunogenicity[J]. Immunology,2015,144(1):116-126.
[11]孙清,李谷丰,邓乾民,等. 高灵敏黄曲霉毒素B1酶联免疫试剂盒的研制及应用[J]. 环境化学,2015,34(10):1845-1853.
[12]谢珲,章先,王歆,等. 黄曲霉毒素B1单克隆抗体的制备及间接竞争ELISA检测技术研究[J]. 微生物学通报,2015,42(10):2033-2040.
[13]Urusov A E,Petrakova A V,Vozniak M V,et al. Rapid Immunoenzyme Assay of Aflatoxin B1Using Magnetic Nanoparticles[J]. Sensors,2014,14(11):21843-21857.
[14]Gaur P K,Lau H P,estka J J,et al. Production and characterization of aflatoxin B2a antiserum[J]. Applied and Environmental Microbiology,1981,41(2):478-482.
[15]Kononenko G,Burkin A,Soboleva N. Comparative Characterization of Immune Reagents Based on Hemiacetals of Aflatoxin B1and Sterigmatocystine[J]. Applied Biochemistry and Microbiology,2002,38(5):487-492.
[16]Groopman J D,Trudel L J,Donahue P R,et al. High-affinity monoclonal antibodies for aflatoxins and their application to solid-phase immunoassays[J]. Proceeding of the National Academy of Science of the United States of America,1984,81(24):7728-7731.
[17]Cervino C,Knopp D,Weller M G,et al. Novel aflatoxin derivatives and protein conjugates[J]. Molecules,2007,12(3):641-653.
[18]Chu F S,Steinert B W,Gaur P K. Production and characterization of antibody against aflatoxin G1[J]. Journal of Food Safety,1985,7(3):161-170.
[19]Li P W,Zhou Q,Wang T,et al. Development of an Enzyme-Linked Immunosorbent Assay Method Specific for the Detection of G-Group Aflatoxins[J]. Toxins,2016,8(1):5-15.
[20]Maryin C N,Garner R C. Aflatoxin B-oxide generated by chemical or enzymic oxidation of aflatoxin B1causes guanine substitution in nucleic acids[J]. Nature,1977,267(5614):863-865.
[21]Zhang J Y,Li P W,Zhang W,et al. Production and characterization of monoclonal antibodies against aflatoxin g(1)[J]. Hybridoma,2009,28(1):60-70.
[22]Lyer R S,Harris T M. Preparation of aflatoxin B18,9-epoxide using m-chloroperbenzoic acid[J]. Chemical research in toxicology,1993,6(3):313-316.
[23]Chu F S,Ueno I. Production of Antibody Against Aflatoxin B1[J]. Applied and Environmental Microbiology,1977,33(5):1125-1128.
[24]Kolosova A Y,Shim W B,Yang Z Y,et al. Direct competitive ELISA based on a monoclonal antibody for detection of aflatoxin B. Stabilization of ELISA kit components and application to grain samples[J]. European Journal of Human Genetics,2006,12(1):13-23.
[25]Cervino C,Weber E,Knopp D,et al. Comparison of hybridoma screening methods for the efficient detection of high-affinity hapten-specific monoclonal antibodies[J]. Journal of Immunological Methods,2008,329(1-2):184-193.
[26]Zhang D,Li P,Zhang Q,et al. Production of ultrasensitive generic monoclonal antibodies against major aflatoxins using a modified two-step screening procedure[J]. Analytica Chimica Acta,2009,636(1):63-69.
[27]Li P W,Zhang Q,Zhang W,et al. Development of a class-specific monoclonal antibody-based ELISA for aflatoxins in peanut[J]. Journal of Food and Chemistry,2009,115(1):313-317.
[28]Kim S H,Cha S H,Karyn B,et al. Production of Group Specific Monoclonal Antibody to Aflatoxins and its Application to Enzyme-linked Immunosorbent Assay[J]. Toxicological Research,2011,27(2):125-131.
[29]Bui Q A,Vu T H,Ngo V K,et al. Development of an ELISA to detect clenbuterol in swine products using a new approach for hapten design[J]. Analytical and Bioanalytical Chemistry,2016,408(22):6045-6052.
[30]计融,柳桢,江涛,等. 总黄曲霉毒素ELISA定量检测试剂盒研制[J]. 中国公共卫生,2007,23(3):331-333.
[31]Zheng Z,Humphrey C W,King R S,et al. Validation of an ELISA test kit for the detection of total aflatoxins in grain and grain products by comparison with HPLC[J]. Mycopathologia,2005,159(2):255-263.
[32]Iqbal J,Asghar M A,Ahmed A,et al. Aflatoxins contamination in Pakistani brown rice:a comparison of TLC,HPLC,LC-MS/MS and ELISA techniques[J]. Toxicology Mechanisms and Methods,2014,24(8):544-551.
[33]Guo L,Song S,Liu L,et al. Comparsion of an immunochromatographic strip with ELISA for simultaneous detection of thiamphenicol,florfenicol and chloramphenicol in food samples[J]. Biomedical Chromatography,2015,29(9):1432-1439.
[34]Anfossi L,Darco G,Calderara M,et al. Development of a quantitative lateral flow immunoassay for the detection of aflatoxins in maize[J]. Food Additives and Contaminants Part A,Chemistry,Analysis,Control,Exposure and risk,2011,28(2):226-234.
[35]Zhang D H,Li P W,Zhang Q,et al. Ultrasensitive nanogold probe-based immunochromatographic assay for simultaneous detection of total aflatoxins in peanuts[J]. Biosensors and Bioelectronics,2011,26(6):2877-2882.
[36]徐振斌,胡东青,里南,等. 胶体金免疫层析法快速定量检测玉米中黄曲霉毒素[J]. 粮食科技与经济,2013,38(3):24-26.
[37]Xu Z L,Wang Q,Lei H T,et al. A simple,rapid and high-throughput fluorescence polarization immunoassay for simultaneous detection of organophosphorus pesticides in vegetable and environmental water samples[J]. Analytica Chimica Acta,2011,708(1-2):123-129.
[38]Nasir M S,Jolley M E. Development of a fluorescence polarization assay for the determination of aflatoxins in grains[J].Journal of Agricultural and Food Chemistry,2002,50(11):3116-3121.
[39]Sheng Y J,Eremin S,Mi T J,et al. The development of a fluorescence polarization immunoassay for aflatoxin detection[J]. Boomedical and Environmental Sciences,2014,27(2):126-129.
[40]顾宏杰,郭松林,王艺磊,等. 时间分辨荧光免疫分析在兽药残留检测中的应用[J]. 生命科学,2014,26(11):1229-1235.
[41]Degan P,Montagnoli G,Wild C P.Time-resolved fluoroimmunoassay of aflatoxins[J]. Clinical Chemistry,1989,35(12):2308-2310.
[42]Wang D,Zhang Z,Li P,at al. Europium Nanospheres-Based Time-Resolved Fluorescence for Rapid and Ultrasensitive Determination of Total Aflatoxin in Feed[J]. Journal of Agricultural and Food Chemistry,2015,63(47):10313-10318.
[43]Gandhi S,Suman P,Kumar A,et al. Recent advances in immunosensor for narcotic drug detection[J]. Bioimpacts,2015,5(4):207-213.
[44]Cuccioloni M,Mozzicafreddo M,Barocci S,et al. Biosensor-based screening method for the detection of aflatoxins B1-G1[J]. Analytical Chemistry,2008,80(23):9250-9256.
[45]Micheli L,Grecco R,Badea M,et al. An electrochemical immunosensor for aflatoxin M1 determination in milk using screen-printed electrodes[J].Biosensors and Bioelectronics,2005,21(4):588-596.
[46]Hirakawa Y,Yamasaki T,Harada A,et al. Analysis of the Fungicide Boscalid in Horticultural Crops Using an Enzyme-Linked Immunosorbent Assay and an Immunosensor Based on Surface Plasmon Resonance[J]. Journal of Agricultural and Food Chemistry,2015,63(36):8075-8082.
[47]Kong D,Liu L,Song S,et al. A gold nanoparticle-based semi-quantitative and quantitative ultrasensitive paper sensor for the detection of twenty mycotoxins[J].Nanoscale,2016,8(9):5245-5253.
[48]Xu Z L,Shen Y D,Beier R S,et al. Application of computer-assisted molecular modeling for immunoassay of low molecular weight food contaminants:a review[J]. Analytica Chimica Acta,2009,647(2):125-136.
[49]Kuroda D,Shirai H,Jacobson M P,et al. Computer-aided antibody design[J]. Protein engineering design and selection,2012,25(10):507-521.
[50]Kortkhonjia E,Brandman R,Zhou J Z,et al. Probing antibody internal dynamics with fluorescence anisotropy and molecular dynamics simulations[J]. Mabs,2013,5(2):306-322.
[51]周茜,张文,张奇,等. 黄曲霉毒素G族人工抗原的合成与免疫效果研究[J]. 化学试剂,2010,32(10):869-872,876.
Advance in immunoassay of total aflatoxins in food
WANG Ya-nan1,2,WANG Xiao-fei3,NIU Lin-lin1,2,LEI Zhuang1,2,ZHANG Hai-tang1,2,WANG Zi-liang1,2,*
(1.The Animal Science and Technology College,Henan Institute of Science and Technology,Xinxiang 453003,China;2.Animal Viral Disease Control and Residual Analysis Henan HigherEducation Key Discipline Open Laboratory,Xinxiang 453003,China;3.School of Xinke,Henan Institute of Science and Technology,Xinxiang 453003,China)
Aflatoxins(AFs)contamination of food was widespread,serious and harmful to the food industry concern and a single aflatoxin detection had been unable to meet the needs of the food industry. For the detection of total aflatoxins in food commonly used physical and chemical analysis method,compared with the immunoassay with high specificity,high sensitivity,simplicity and other technical advantages,immunoassay had become the future direction of development and an important research topic. In this paper,the research progress of the total aflatoxins detection with immunoassay were reviewed and the aim was to provide new methods and ideas for the immunoassay of total aflatoxins in food.
food;total aflatoxins;immunoassay;research progress
2017-02-14
王亚楠(1989-), 女, 硕士研究生, 研究方向:食品安全免疫检测,E-mail:792176339@qq.com。
*通讯作者:王自良(1966-),男,博士,教授,研究方向:免疫学与抗体工程,E-mail:wangziliang66@126.com。
“十二五”国家科技支撑计划项目(2014BAD13B05)。
TS201.1
A
1002-0306(2017)13-0344-08
10.13386/j.issn1002-0306.2017.13.065
