硫酸酯化牡蛎多糖对3种肿瘤细胞抑制及凋亡的影响
2017-07-31赵冠华佟长青
赵冠华,佟长青,李 伟,曲 敏
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
硫酸酯化牡蛎多糖对3种肿瘤细胞抑制及凋亡的影响
赵冠华,佟长青,李 伟,曲 敏*
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
采用氯磺酸-吡啶法制备得到硫酸酯化牡蛎多糖(SCGP),通过CCK-8法检测其对人胃癌细胞AGS、人卵巢癌SK-OV-3细胞和人肝癌HepG2细胞活力的影响,并用流式细胞仪检测细胞凋亡情况。结果表明,SCGP对3种肿瘤细胞细胞活力有不同程度的抑制效应,其中对AGS细胞抑制效应最明显。流式细胞术检测结果表明,SCGP对AGS细胞有很明显的促进凋亡作用。本研究结果表明SCGP对AGS肿瘤细胞生长有一定的抑制效应。
牡蛎多糖,硫酸酯化,抗肿瘤,凋亡
牡蛎是全球最大养殖贝类,也是我国重要的经济养殖贝类之一。牡蛎肉质鲜美可口并且具有药用价值,被称为“海底牛奶”[1]。牡蛎多糖是牡蛎体内重要的活性物质之一,在抗肿瘤、抗疲劳、抗凝血和增强机体免疫等方面都具有较好的生物活性[2]。
将硫酸基团引入到多糖的羟基上使其生物活性发生强烈的变化,能使多糖表现出其修饰前所没有的生物活性[3]。硫酸酯化多糖具有抗肿瘤[4]、抗病毒[5]、抗凝血[6]、抗氧化[7]、增强免疫[8]等多种生物活性。其中其所具备的抗肿瘤能力更是引起广泛的关注。但是硫酸酯化牡蛎多糖的抗肿瘤活性筛选研究并不多,杨静峰[9]利用降解的硫酸酯化牡蛎多糖研究其对Hela细胞的影响,发现其对Hela细胞抑制作用并不明显。高蒙蒙[10]研究了硫酸酯化牡蛎多糖对HL-60细胞和K562细胞有一定的抑制作用。其他硫酸多糖也大多具有抗肿瘤活性,Wang等[3]对硫酸酯化脱脂米糠多糖抑制HepG2细胞进行研究,其具有较强的癌细胞抑制作用。Karnjanapratum等[8]研究3种礁膜硫酸多糖发现它们对AGS细胞有细胞毒性作用。Zhang J[11]发现硫酸酯化黑灵芝多糖可以显著抑制肿瘤细胞的增殖。Wei[12]研究发现红芪多糖经硫酸酯化后,抑制BGC-823细胞和A549细胞能力显著增强,并具有凋亡效果。Wang等[13]研究了硫酸化浒苔多糖抑制HepG2细胞可能的凋亡途径。
本文对实验室前期制备得到的粗牡蛎多糖[14]进行硫酸酯化修饰,制备硫酸酯化牡蛎多糖(SCGP),以人胃癌细胞AGS、人卵巢癌细胞SK-OV-3和人肝癌细胞HepG2作为受试细胞,通过CCK-8法评价其抗肿瘤活性,流式细胞仪检测细胞凋亡,以期为牡蛎的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
粗牡蛎多糖(CGP) 本实验室前期制备所得;氯磺酸、吡啶、N,N-二甲基酰胺(DMF)、硫酸钾(K2SO4)、三氯乙酸(TCA)、氯化钡(BaCl2)、溴化钾(KBr)、葡萄糖胺(Gln) 美国Sigma公司;胎牛血清(FBS) 美国Hyclone公司;DMEM高糖、F12K、青霉素/链霉素(P/S) 美国Gibco公司;CCK-8检测试剂盒 日本Dojindo公司;凋亡检测Annexin V-APC-PI Apoptosis Kit试剂盒 天津三箭生物技术有限公司;其他试剂均为分析纯;人胃癌细胞AGS、人卵巢癌细胞SK-OV-3和人肝癌细胞HepG2 中国科学院上海细胞库;AGS细胞和SK-OV-3细胞的培养基 F12K+10%胎牛血清(FBS)+1%青霉素/链霉素(P/S)+1%葡萄糖胺(Gln);HepG2细胞的培养基 DMEM高糖+10%胎牛血清(FBS)+1%青霉素/链霉素(P/S)+1%葡萄糖胺(Gln)。
660-IR红外光谱仪 美国Agilent公司;MuLTiSJAN MK3酶标仪、Microcl 17R离心机 美国Thermo公司;MCO-15AC 型CO2恒温培养箱 日本SANYO公司;DMLLLED型倒置显微镜 德国Leica公司;Accuri C6流式细胞仪 美国BD公司。
1.2 实验方法
1.2.1 硫酸酯化牡蛎多糖(SCGP)的制备 牡蛎多糖的硫酸酯化采用氯磺酸-吡啶法[9]。向放置在冰水浴中,并带有冷凝搅拌装置的250 mL三颈烧瓶中加入50 mL吡啶,充分搅拌后,缓慢加入10 mL氯磺酸,反应40 min,制得酯化试剂备用。称取2.0 g前期制备的粗牡蛎多糖,溶于40 mL DMF(N,N-二甲基甲酰胺)中,充分搅拌后加入到装有酯化试剂的三颈烧瓶中,60 ℃水浴,搅拌3 h。反应结束后冷却至室温,加入20% NaOH溶液调至pH7.0。之后加入3倍体积的95%乙醇过夜,离心(8000 r/min,10 min)得沉淀。沉淀溶解于水中,透析3 d,真空冷冻干燥得到硫酸酯化修饰产物。
1.2.2 硫酸根含量的测定及红外光谱(IR)分析 SCGP硫酸基含量的测定方法采用明胶-比浊法[15]。称取样品3 mg加入1 mL 1 mol/L盐酸,100 ℃水解6 h,冷却后挥发干燥,残渣再用1 mL蒸馏水溶解。用硫酸钾溶液制作标准曲线,以0.2 mL盐酸溶液作为空白,分别加入三氯乙酸3.8 mL、氯化钡-明胶溶液1.0 mL,室温静置15 min,OD360 nm测吸光值A1;以1.0 mL明胶溶液代替氯化钡溶液,同法测吸光值A2;以硫酸基毫克数为横坐标,纵坐标为吸光值(A1-A2)。
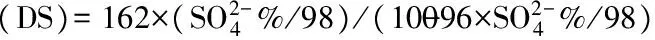
红外光谱分析:将CGP和SCGP分别与KBr混合研磨,压片后在4000~400 cm-1范围内扫描检测,以KBr为扫描背景。
1.2.3 体外抑制肿瘤细胞增殖实验 采用CCK-8法进行测定SCGP对AGS细胞等三种肿瘤细胞存活率的影响。
SCGP多糖溶解于PBS,配成10 mg/mL的母液,培养基稀释至所需浓度。将细胞悬浮液接种于96孔培养板中,AGS细胞铺板密度为8000/孔,SK-OV-3细胞和HepG2细胞铺板密度为6000/孔,37 ℃ 5% CO2培养箱培养。将SCGP加入细胞培养板中,使其终浓度分别为2、20、200 和1000 μg/mL,分别处理12、24、36、60 和84 h后,每孔加入10 μL CCK-8溶液,混匀后培养箱中孵育2 h,以不含细胞、加入药物的培养基作为空白组,测定450 nm处的OD值,按下列公式计算SCGP对细胞存活抑制率:
细胞存活抑制率(%)=(实验组OD值-空白组OD值)/(空白组OD值-培养基OD值)×100
1.2.4 流式细胞仪检测凋亡 将细胞悬浮液接种于6孔细胞培养板中,AGS细胞和HepG2细胞接种量为1×105/孔,SK-OV-3细胞接种量为8×104个/孔,37 ℃ 5% CO2培养箱培养过夜,加入SCGP至终浓度达到1000 μg/mL,空白组不做处理,溶剂组加入等体积PBS,继续培养96 h后,收样检测。用EP管分别收集各孔中的培养上清,4 ℃ 1000 r/min 离心5 min,收集培养上清中的细胞。同时,用胰酶消化底面贴壁的细胞,4 ℃ 1000 r/min 离心5 min,收集细胞,与前面离心的细胞混合。PBS洗涤细胞2次,4 ℃ 1000 r/min 离心5 min,收集细胞。每个样品用200 μL binding buffer重悬细胞,轻轻吹匀,加入藻蓝蛋白(APC)混匀,再加入液体PI染液染色,20 ℃避光孵育20 min,上机检测。
2 结果与分析
2.1 SCGP硫酸根含量及其红外光谱(IR)结果
用明胶-比浊法测得SCGP硫酸根含量为28.96%,取代值(DS)为0.66。如图1所示,牡蛎多糖CGP和SCGP的红外光谱特征峰类似。与牡蛎多糖相比,SCGP在1257.35 cm-1处存在一个不同于牡蛎多糖的特征吸收峰,这个特征峰为>S=O伸缩振动峰,说明其发生了硫酸酯化反应[16]。另外,SCGP在811 cm-1处有一强吸收,说明硫酸基取代的空间构象是平伏型[17]。

图1 牡蛎多糖CGP与SCGP红外光谱Fig.1 IR spectra of CGP and SCGP
2.2 SCGP对3种肿瘤细胞活力的抑制作用
由图2a可知,SCGP对AGS细胞具有一定的抑制效果,除培养时间60 h抑制效果较之前有所下降外,其他时间点均呈现一定的时间与剂量依赖性。低浓度(2、20 μg/mL)时,SCGP对AGS细胞活力的抑制活性不明显,高浓度时抑制活性显著。在浓度为1000 μg/mL,培养时间为84 h时,SCGP对AGS细胞的抑制率为48.99%。由图2b可知,SCGP在短时间、低浓度时,对SK-OV-3细胞没有明显的抑制作用。当SCGP浓度为1000 μg/mL,随着培养时间的增加,SK-OV-3抑制率逐渐提高,在培养时间36、60、84 h时,抑制率分别为13.03%、16.48%、24.10%。由图2(c)可知,SCGP在低浓度时对HepG2细胞的生长具有促进作用,而SCGP浓度为1000 μg/mL,培养时间84 h时,抑制率为29.42%。

图2 SCGP对3种肿瘤细胞抑制率的影响Fig.2 Effect of SCGP on the inhibition rates of three kinds of carcinoma cell
由上可知,SCGP主要对AGS肿瘤细胞具有一定程度的抑制效果。SCGP对AGS细胞的抑制作用明显比对SK-OV-3细胞和HepG2细胞强,说明AGS细胞对其更加敏感。研究表明不同的多糖对AGS细胞、SK-OV-3细胞和HepG2细胞抑制可能为直接抑制肿瘤细胞的生长、抑制肿瘤细胞的入侵和转移、调节肿瘤细胞内信号传递途径[18-21],推测SCGP可能对3种肿瘤细胞抑制机理有所不同。
2.3 流式细胞检测结果
用Annexin-V和PI染色法,在流式细胞仪检测的图3中,可分为四类:Q1象限为坏死细胞,其细胞质膜结构不完整;Q2象限内为凋亡晚期细胞,其细胞质膜渗透受到损伤;Q3象限为凋亡早期细胞;Q4象限为正常活细胞。用Q2和Q3之和计算细胞凋亡率。由图3可知,1000 μg/mL SCGP对AGS细胞处理96 h后,凋亡率从9.02%±0.39%上升到19.76%±0.27%(p<0.05),表明SCGP对AGS细胞有很明显的促进凋亡作用。1000 μg/mL SCGP对SK-OV-3细胞处理96 h后,凋亡率从17.52%±1.37%降到9.74%±0.09%(p<0.05),表明SCGP对SK-OV-3细胞有很明显的抑制凋亡的作用。而1000 μg/mL SCGP对HepG2细胞处理96 h后影响变化较小。
综上所述,SCGP对肿瘤细胞具有一定的凋亡作用,尤其对AGS细胞具有明显的凋亡诱导作用。SCGP对AGS细胞的凋亡作用明显比对其他两种肿瘤细胞的强,研究表明不同来源的多糖对AGS细胞、SK-OV-3细胞、HepG2细胞凋亡途径可能为下调抗细胞凋亡Bcl-2和Bcl-xL基因表达、激活p53基因表达和细胞凋亡线粒体途径、引起细胞色素C的释放和活化Caspase诱导细胞凋亡[19,22-24]。本实验通过CCK-8和流式细胞检测共同证明SCGP使AGS细胞增殖活性受到了明显抑制并能使细胞发生凋亡。
3 结论
肿瘤是威胁健康并且死亡率很高的疾病之一,研究表明含有硫酸基团的多糖有较好的抗肿瘤活性。本文用实验室前期制备的粗牡蛎多糖,通过氯磺酸-吡啶法制备得到了硫酸酯化牡蛎多糖SCGP,对3种肿瘤细胞表现出一定的抑制活性和凋亡作用。在1000 μg/mL SCGP对AGS细胞和HepG2细胞处理96 h后,都显现出凋亡作用。尤其是对AGS细胞的抑制、凋亡作用明显,可进一步研究。而SCGP对人卵巢癌SK-OV-3细胞凋亡效果不显著,反而起到抑制凋亡作用。

图3 SCGP对3种肿瘤细胞凋亡的影响Fig.3 The effects of SCGP on apoptosis of three kinds of carcinoma cell line
正常的细胞增殖和细胞凋亡保持一种平衡状态,当细胞过度增殖或凋亡减少就可能导致肿瘤发生[25]。目前多糖抗肿瘤的主要途径为抑制肿瘤细胞生长、促进肿瘤细胞凋亡、细胞周期阻滞、抑制肿瘤细胞的入侵、黏附、转移、增强机体免疫能力和影响肿瘤细胞信号传导等[26]。SCGP的抗肿瘤作用机理尚不清楚。因为影响硫酸酯化多糖活性的因素很多,比如取代值(DS)、分子量、硫酸根取代位、空间结构等,同时多糖分子量较大,不容易进入细胞内部,加之机体对多糖的吸收、代谢和运输效果都不佳,所以不易在细胞内达到足够的浓度[27]。随着蛋白质组学、代谢组学、分子生物学及科学技术的发展,在以后研究中,将对SCGP进行更加深入探讨,明确抗肿瘤机制及构效关系,为牡蛎多糖的开发利用提供参考。
[1]徐静. 牡蛎提取物的降血糖活性研究[D].济南:山东大学,2005.
[2]王俊,姚滢,张建鹏. 牡蛎多糖的制备和生物活性研究[J].医学研究生学报,2006,19(3):217-220.
[3]Wang L,Li X X. Chen Z X. Sulfated modification of the polysaccharides obtained from defatted rice bran and their antitumor activities[J]. International Journal of Biological Macromolecules,2009,44(2):211-214.
[4]Ji C F,Ji Y B,Meng D Y. Sulfated modification and anti-tumor activity of laminarin[J]. Experimental and Therapeutic Medicine,2013,6(5):1259-1264.
[5]Ghosh T,Chattopadhyay K,Marschall M,et al. Focus on antivirally active sulfated polysaccharides:from structure-activity analysis to clinical evaluation[J]. Glycobiology,2009,19(1):2-15.
[6]Liang W A,Mao X,Peng X H,et al. Effects of sulfate group in red seaweed polysaccharides on anticoagulant activity and cytotoxicity[J]. Carbohydrate Polymers,2014,101:776-785.
[7]Wang J L,Niu S F,Zhao B T,et al. Catalytic synthesis of sulfated polysaccharides.Ⅱ:Comparative studies of solution conformation and antioxidant activities[J]. Carbohydrate Polymers,2014,107(17):221-231.
[8]Karnjanapratum S,You S G. Molecular characteristics of sulfated polysaccharides from Monostroma nitidum and theirinvitroanticancer and immunomodulatory activities[J]. International Journal of Biological Macromolecules,2011,48(2):311-318.
[9]杨静峰. 基于牡蛎糖原硫酸酯结构的多糖构效关系研究[D].镇江:江苏大学,2013.
[10]高蒙蒙. 太平洋牡蛎多糖的提取、分离、结构及硫酸酯化修饰研究[D].青岛:中国海洋大学,2014.
[11]Zhang J,Liu Y J,Park H S,et al. Antitumor activity of sulfated extracellular polysaccharides of Ganoderma lucidum from the submerged fermentation broth[J]. Carbohydrate Polymers,2012,87(2):1539-1544.
[12]Wei D F,Wei Y X,Cheng W D,et al. Sulfated modification,characterization and antitumor activities of Radix hedysari polysaccharide[J]. International Journal of Biological Macromolecules,2012,51(4):471-476.
[13]Wang X X,Chen Y,Wang J J,et al. Antitumor activity of a sulfated polysaccharide from Enteromorpha intestinalis targeted against hepatoma through mitochondrial pathway[J]. Tumor Biology,2014,35(2):1641-1647.
[14]马慧慧. 牡蛎多糖的制备及其生物活性研究[D].大连:大连海洋大学,2015.
[15]Yang J F,Zhu B W,Zheng J,et al. Stimulation of lymphocyte proliferation by oyster glycogen sulfated at C-6 position[J]. Carbohydrate Polymers,2013,94(1):301-308.
[16]Lloyd AG,Dodgson KS,Price RG,et al. Infrared studies on sulphate esters. I. Polysaccharide sulphates[J]. Biochimica Et Biophysica Acta,1961,46(1):108-115.
[17]Zvyagintseva TN,Shevchenko NM,Nazarova IV,et al.Inhibition of complement activation by water-soluble polysaccharides of some far-eastern brown seaweeds[J]. Comparative Biochemistry and Physiology Part C:Pharmacology,Toxicology and Endocrinology,2000,126(3):209-215.
[18]Bao H,Choi W S,You S,et al. Effect of sulfated modification on the molecular characteristics and biological activities of polysaccharides from Hypsizigus marmoreus[J]. Biosci Biotechnol Biochem,2010,74(4):1408-1414.
[19]Park H S,Kim G Y,Nam T J,et al. Antiproliferative activity of fucoidan was associated with the induction of apoptosis and autophagy in AGS human gastric cancer cells[J]. Journal of Food Science,2011,76(3):77-88.
[20]Chen D,Zhang X L,Du Y,et al. Effect of gecko sulfated polysaccharide-protein complex on the defective biorheological characters of dendritic cells under tumor microenvironment[J]. Cell Biochemistry and Biophysics,2012,62(1):193-201.
[21]Liu X,Yang Y,Zhang X,et al. Compound Astragalus and Salvia miltiorrhiza extract inhibits cell invasion by modulating transforming growth factor-β/Smad in HepG2 cell[J]. Journal of Gastroenterology Hepatology,2010,25(2):420-426.
[22]张杰,杨旭东,包海花,等.桦褐孔菌多糖诱导人卵巢癌细胞凋亡的研究[J].中国食用菌,2010(4):38-39.
[23]许娜,赖一鸣,陈晓洁,等.五味子多糖诱导SKOV3细胞凋亡及分子机制研究[J].时珍国医国药,2013,24(5):1165-1166.
[24]徐晋,吴丽,徐巧芳.灵芝多糖诱导人肝癌细胞HepG2凋亡的研究[J].中国当代医药,2009,16(23):7-9.
[25]高枫,符兆英.天然产物诱导肿瘤细胞凋亡作用机制的研究进展[J].中华肿瘤预防杂志,2011,18(7):557-560.
[26]林俊,李萍,陈靠山.近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1125.
[27]卢可可,张月巧,袁娅,等.硫酸化修饰多糖抗肿瘤活性构效关系及分子机制研究进展[J].食品科学,2014,35(23):297-302.
Effect of sulfated polysaccharide fromCrassostreagigason inhibition and induction of three kinds of carcinoma cell
ZHAO Guan-hua,TONG Chang-qing,LI Wei,QU Min*
(College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China)
Sulfated polysaccharide fromCrassostreagigsa(SCGP)was derived by using the chlorosulfonic acid-pyridine method. The inhibitory effects of SCGP on AGS cells,SK-OV-3 cells,and HepG2 cells were evaluated using CCK-8 assay,and the apoptosis changes were analyzed by flow cytometry. The results showed that SCGP significantly inhibited the growth of three cell. The inhibitory effect of SCGP was better on AGS cells than other cells. The flow cytometry results showed that SCGP could effectively induce the apoptosis of AGS cells. The results suggest that SCGP has inhibitory effect on growth of AGS cells.
Crassostreagigsapolysaccharide;sulfated modification;antitumor activity;apoptosis
2017-01-13
赵冠华(1990-),男,硕士研究生,研究方向:海洋药源生物活性物质开发,E-mail:lookgo@qq.com。
*通讯作者:曲敏(1976-),女,博士,研究方向:海洋药源生物活性物质开发,E-mail:qumin2008@163.com。
海洋局公益性行业科研专项(201405017-03)。
TS254.1
A
1002-0306(2017)13-0302-05
10.13386/j.issn1002-0306.2017.13.056
