虫草素对脂多糖诱导巨噬细胞过度活化的抑制作用研究
2017-07-31孟雪莲刘莹莹郑良超高程程陈长兰
孟雪莲,刘 佳,刘莹莹,郑良超,高程程,王 丹,吕 晶,陈长兰
(辽宁大学药学院,辽宁沈阳 110036)
虫草素对脂多糖诱导巨噬细胞过度活化的抑制作用研究
孟雪莲,刘 佳,刘莹莹,郑良超,高程程,王 丹,吕 晶,陈长兰*
(辽宁大学药学院,辽宁沈阳 110036)
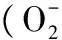
虫草素,脂多糖,巨噬细胞,过度活化
巨噬细胞(Macrophages)为吞噬细胞,参与机体的先天性免疫和细胞免疫。巨噬细胞过度激活,会显著上调多种毒性炎性因子的分泌,如 NO、TNF-α、IL-1β、IL-6、活性氧(ROS)等,引起炎症反应,使组织和细胞遭受损伤。致病原引起的感染、炎症性胃肠道疾病、神经系统疾病、心血管疾病、风湿性疾病、过敏性疾病等的发病机制均与巨噬细胞的过度活化有关[1]。研究表明,抑制巨噬细胞过度活化可能成为防治炎症相关疾病的一个重要策略。
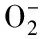

图1 虫草素的化学结构Fig.1 The chemical structure of cordycepin
1 材料与方法
1.1 材料与仪器
虫草素 纯度98%,成都曼斯特生物科技有限公司;脂多糖(lipopolysaccharides,LPS,E.coli026:B6) 美国Sigma公司;DMEM高糖培养基 美国HyClone公司;胰蛋白酶、四甲基偶氮唑盐(MTT) 美国Gibco公司;胎牛血清 日本TaKaRa公司;Mouse/Rat TNF-αValukine ELISA试剂盒、Mouse IL-1βValukine ELISA试剂盒、Mouse IL-6 Valukine ELISA试剂盒 美国R&D公司;Fluo-3/AM 美国Invitrogen公司;小鼠巨噬细胞系RAW264.7 中国医学科学院基础医学研究所北京协和医学院细胞资源中心。
CO2培养箱、超低温-80 ℃冰箱、紫外分光光度计 德国Thermo Scientific公司;倒置显微镜 日本OMYLPUS公司;酶标仪 瑞士帝肯公司;流式细胞仪 美国BD公司。
1.2 实验方法
1.2.1 细胞培养和药物配制
1.2.1.1 细胞培养 小鼠RAW264.7细胞系以DMEM高糖培养基(含5%胎牛血清、100 U/mL青霉素和100 U/mL链霉素)在37 ℃、95%空气、5% CO2条件下培养。以0.25%胰蛋白酶消化进行传代培养。
1.2.1.2 药物配制 称取虫草素完全溶于DMSO溶液制成10 mmol/L储备液,-20 ℃避光保存。使用时,用无血清无抗生素的DMEM高糖培养基稀释到最终浓度。DMSO的终浓度≤1‰。
1.2.2 细胞存活率的检测——MTT法 取对数生长期的RAW264.7巨噬细胞,以6×105cells/mL接种于96孔培养板内,每孔100 μL。细胞贴壁24 h,换成无血清无抗生素新鲜培养基,加入药物处理,设置虫草素浓度为0.1、0.3、1、3、10 μmol/L单独或与LPS(1 μg/mL)联合作用,设置空白对照,每个组别设四个平行孔。药物作用于RAW264.7巨噬细胞24 h后,每孔加入10 μL MTT溶液,37 ℃孵育3 h,去除培养液,每孔加入100 μL DMSO,室温振荡10 min,待结晶紫完全溶解后,用酶标仪测定490 nm处吸光度值,计算细胞存活率。
1.2.3 细胞NO释放水平的测定——Griess法 取对数生长期的RAW264.7巨噬细胞,以6×105cells/mL接种于96孔培养板内,每孔100 μL。细胞贴壁24 h,换成无血清无抗生素新鲜培养基,加入药物处理,设置虫草素浓度为0.1、0.3、1、3、10 μmol/L单独或与LPS(1 μg/mL)联合作用,设置空白对照,每个组别设四个平行孔。药物作用于RAW264.7巨噬细胞24 h后,取50 μL培养液上清,加入50 μL的Griess试剂(以蒸馏水配制的0.1%的萘乙二胺,以5%的磷酸配制1%的磺胺,临用前二者1∶1等体积混合)室温条件下反应15 min,在540 nm处测定其吸光度。
1.2.4 细胞TNF-α、IL-1β和IL-6 释放水平的测定——ELISA法 取对数生长期的RAW264.7巨噬细胞,以6×105cells/mL接种于96孔培养板内,每孔100 μL。细胞贴壁24 h,换成无血清无抗生素新鲜培养基,加入药物处理,设置虫草素浓度为0.1、0.3、1、3、10 μmol/L单独或与LPS(1 μg/mL)联合作用,设置空白对照,每组设三个平行孔。加药1 h后检测TNF-α释放,加药4 h后检测IL-1β和IL-6释放。每孔收集50 μL细胞培养上清液用于ELISA检测分析,按照试剂盒操作说明进行测定。根据标准曲线方程计算细胞培养上清液中TNF-α、IL-1β和IL-6含量。
1.2.5 细胞内[Ca2+]i水平的测定——流式细胞术法 取对数生长期的RAW264.7巨噬细胞,以6×105cells/mL接种于6孔培养板内,每孔2 mL。细胞贴壁24 h,换成无血清无抗生素新鲜培养基,加入药物处理,设置虫草素浓度为10 μmol/L单独或与LPS(1 μg/mL)联合作用,设置空白对照,每组设三个平行孔。加药24 h后,收集细胞,4 ℃,1000 r/min,离心5 min,再以磷酸盐缓冲液(PBS)清洗待测细胞两次;加入5 μmol/L Fluo-3/AM荧光探针,37 ℃培养箱中避光孵育30 min;4 ℃,1000 r/min,离心5 min,以PBS清洗细胞两次;加入300 μL PBS吹散细胞,采用流式细胞仪检测各组细胞的荧光强度值。
1.2.6 自由基清除能力检测
1.2.6.1 羟自由基(·OH)清除能力测定——水杨酸法 水杨酸法检测虫草素对羟自由基的清除能力,参照文献方法略做改动[5],利用fenton反应产生羟自由基,取1.5 mL 离心管,编号,依次加入无菌水96 μL、6 mmol/L FeSO4100 μL、2.4 mmol/L H2O2溶液100μL,而后加入不同浓度的虫草素PBS溶液(以磷酸盐缓冲液PBS配制的虫草素溶液)4 μL,混合均匀,虫草素终浓度为0.1、0.3、1、3、10 μmol/L,同时设置空白对照组(PBS作用组),室温条件下静置10 min,再加入6 mmol/L的水杨酸100 μL,37 ℃水浴反应30 min,取100 μL混合反应液于96孔板中,每组设三个平行孔,采用酶标仪测定510 nm波长处的吸光度值。实验重复三次。
1.2.6.2 过氧亚硝酸根离子(ONOO-)清除能力的测定——L-酪氨酸法 目前过氧亚硝酸根离子(ONOO-)的制备主要采用淬灭流动反应合成法,本实验参考文献采用改进的过氧亚硝酸根离子溶液合成工艺[6]。实验合成反应在4 ℃条件下进行。0.125 mol/L的NaOH水溶液10 mL(A液),30%的H2O2溶液0.3 mL与浓H2SO4溶液0.08 mL混合,以蒸馏水稀释至5 mL(B液)。0.6 mol/L的NaNO2水溶液5 mL(C液)。B液与C液混合均匀,立即倒入A液中。而后加入MnO20.08 g,过滤后置于-20 ℃密封、避光过夜。1.0 mol/L NaOH溶液作为参比,用紫外分光光度计检测302 nm 波长处的吸光度值,根据朗伯-比尔定律计算过氧亚硝酸根离子(ONOO-)的浓度(ε=1670)为778 μmol/L。
75 μmol/L的L-酪氨酸水溶液和96 μmol/L的ONOO-溶液与不同浓度的虫草素PBS溶液(0.1~10 μmol/L)混匀,实验同时设置空白对照(PBS作用组),于37 ℃水浴中反应30 min,取反应液点样于96孔板,每孔100 μL,每组设三个平行孔,采用酶标仪检测428 nm 处的吸光度值。实验重复三次。
2 结果与分析
2.1 虫草素对巨噬细胞存活率的影响
为了排除药物对巨噬细胞的毒性作用,实验首先采用MTT法考察虫草素对细胞存活率的影响。结果表明,0.1~10 μmol/L的虫草素单独或与LPS(1 μg/mL)共同作用于RAW264.7巨噬细胞,细胞的存活率均无显著变化。表明在0.1~10 μmol/L浓度范围内,虫草素对巨噬细胞无明显毒性作用(数据未给出)。
2.2 虫草素对多度活化的巨噬细胞NO释放的影响
Griess法研究结果表明,与空白对照组相比,RAW264.7巨噬细胞经LPS(1 μg/mL)单独处理24 h后,细胞培养液中NO含量显著升高。与模型组(LPS单独作用组)相比,不同浓度的虫草素与LPS共同作用于RAW264.7巨噬细胞,细胞释放NO水平显著降低。虫草素(0.1~10 μmol/L)单独作用于RAW264.7巨噬细胞24 h后,对细胞NO释放均无显著影响(图2)。

图2 虫草素单独或与LPS联合作用对RAW264.7 巨噬细胞NO产生的影响Fig. 2 Effect of cordycepin on NO production by unstimulated or LPS-activated RAW264.注:##.与空白对照组相比,差异显著(p<0.01);###. 与空白对照组相比,差异极显著(p<0.001);*. 与LPS组相比,差异显著(p<0.05);**. 与LPS组相比,差异极显著(p<0.01);***. 与LPS组相比,差异高度显著(p<0.001);图3、图4同。
2.3 虫草素对过度活化的巨噬细胞TNF-α、IL-1β和IL-6释放的影响
由图3可见,ELISA研究结果表明,与空白对照组相比,LPS作用1 h后,RAW264.7巨噬细胞的炎症因子TNF-α释放量显著增加;LPS作用4 h后,细胞释放IL-1β和IL-6水平显著增加。虫草素对LPS活化的巨噬细胞释放3种炎症因子(TNF-α、IL-1β和IL-6)均具有显著抑制作用,且具有一定的浓度依赖性。
2.4 虫草素对LPS过度活化的巨噬细胞内[Ca2+]i水平的影响
流式细胞仪检测结果表明,LPS(1 μg/mL)作用于RAW264.7巨噬细胞24 h,胞浆游离钙离子荧光强度显著升高。与LPS单独作用组相比,虫草素(10 μmol/L)与LPS共同作用可显著抑制巨噬细胞内胞浆游离钙离子荧光强度的异常增高(见图4)。

图4 虫草素与LPS联合作用对RAW264.7巨噬细胞内胞浆钙离子浓度[Ca2+]i的影响Fig. 4 Effect of cordycepin on[Ca2+]i level in LPS-activated RAW264.
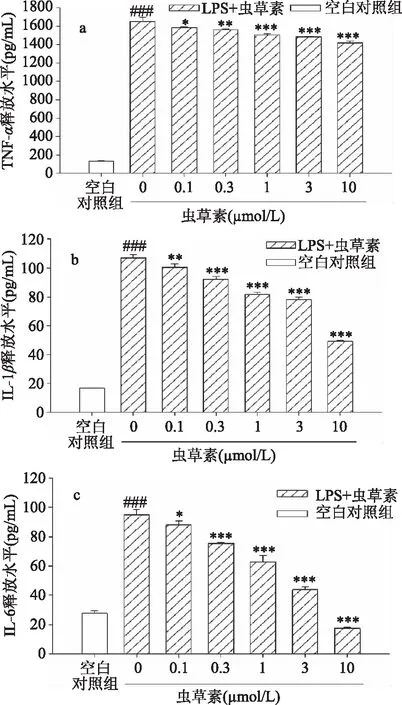
图3 虫草素与LPS联合作用对RAW264.7巨噬细胞 TNF-α、IL-1β和IL-6释放的影响Fig. 3 Effect of cordycepin on TNF-α,IL-1β, and IL-6 release by LPS-activated RAW264.



图5 虫草素对·OH自由基、ONOO-自由基清 和·自由基的清除作用Fig. 5 ·OH,ONOO-,and · free radical scavenging注:*.与模型对照组相比,差异显著(p<0.05);**. 与模型对照组相比,差异极显著(p<0.01);***. 与模型对照组相比,差异高度显著(p<0.001)。
3 讨论
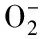
细菌及其产物脂多糖(lipopolysaceharides,LPS)可将细胞激活,诱导细胞产生大量的NO、活性氧(ROS)及多种炎症因子,如肿瘤坏死因子(TNF)、白细胞介素-1(IL-1)、IL-6、IL-12等[8]。在本实验中,采用LPS激活小鼠巨噬细胞系RAW264.7细胞的方法,使其产生炎症反应,释放大量的NO和炎症因子,从而建立起细胞炎症模型。MTT实验的结果表明(数据未给出),当浓度为0.1~10 μmol/L时,虫草素单独或与LPS 联合应用对RAW264.7细胞的存活率无显著影响。以此排除虫草素对上述细胞NO释放的作用是通过降低细胞数量所致。Griess实验的结果表明,虫草素(0.1~10 μmol/L)与LPS 联合作用于巨噬细胞,LPS诱导的NO释放水平的增高被显著抑制;而虫草素(0.1~10 μmol/L)单独作用于巨噬细胞RAW264.7后,NO释放水平无显著变化。接着,采用ELISA实验分别考察了虫草素对LPS激活的RAW264.7细胞释放TNF-α、IL-1β以及IL-6水平的变化。实验证明,虫草素(0.1~10 μmol/L)可不同程度的显著抑制LPS激活的巨噬细胞释放炎症因子TNF-α、IL-1β和IL-6,且具有明显的浓度依赖性。上述结果证明,虫草素具有显著的抗巨噬细胞过度激活及抑制相关炎症因子生成的作用。
在人体和动物体内,由于巨噬细胞过度活化产生过量的炎症因子可以导致感染、心血管疾病、风湿性疾病等一系列疾病[1]。虫草素抑制过度激活的巨噬细胞释放NO及多种炎症因子的作用,提示其有望用于上述炎症相关疾病的防治。
多项研究结果表明,激活的巨噬细胞中胞浆游离钙离子浓度([Ca2+]i)持续增高,其升高一方面来自胞内Ca2+库的释放,另一方面来自胞外Ca2+的内流。脂多糖(LPS)能够通过作用于TLR受体而诱导巨噬细胞胞内Ca2+大量增加[9],从而加强TLR配体诱导的炎性细胞因子如IL-6、TNF-α、NO的产生,表明Ca2+信号通路与TLR信号通路之间的交互作用是巨噬细胞充分活化所必需的[10]。Zhou[11]等的研究表明,在LPS激活的大鼠腹腔巨噬细胞中,[Ca2+]i的增高可使诱导型一氧化氮合酶(iNOS)表达增高,NO和TNF-α大量产生。已有研究表明,虫草素可抑制HT22神经细胞及人血小板细胞内Ca2+浓度的异常增高[12-13]。
本研究结果表明,虫草素可显著抑制LPS诱导的巨噬细胞内[Ca2+]i浓度的增高,这可能是虫草素抑制巨噬细胞过度活化并抑制其大量释放NO、TNF-α、IL-1β和IL-6的作用机制之一。
自由基是指含有一个不成对电子的原子团,具有较强氧化能力的微粒。主要是指活性氧自由基,包括羟自由基,过氧化氢分子,过氧亚硝酸根离子、超氧阴离子,烷氧基,单线态氧等等。活性氧(ROS)是炎症信号通路中的重要环节,位于多条炎症信号通路的上游。已有研究表明,在活化的巨噬细胞中可产生大量的活性氧自由基,可使NF-κB活化入核,增强iNOS、IL-1β、TNF-α和IL-6基因转录表达,促进细胞活化,使NO、IL-1β、TNF-α和IL-6的释放增加[14-15]。本研究考察了虫草素对羟自由基、过氧亚硝酸根自由基和超氧阴离子自由基的清除作用。结果显示,虫草素对三种自由基均具有显著清除作用,表明自由基清除作用可能是其抗巨噬细胞活化的作用机制之一。
4 结论
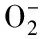
[1]Liu G,Yang H. Modulation of macrophage activation and programming in immunity[J]. J Cell Physiol,2013,228(3):502-512.
[2]张姝,张永杰,Shrestha B,等. 冬虫夏草菌和蛹虫草菌的研究现状、问题及展望[J]. 菌物学报,2013,32(4):577-597.
[3]余伯成,唐永范,唐亮,等. 虫草素的药理作用研究进展[J]. 现代药物与临床,2011,26(5):349-352.
[4]孟雪莲,陈长兰,孔维娟,等. 虫草素抑制脂多糖诱导的小胶质细胞活化及神经保护作用[J]. 食品科学,2014,35(19):224-230.
[5]陈金娥,丰慧君,张海容. 红茶、绿茶、乌龙茶活性成分抗氧化性研究[J]. 食品科学,2009,30(3):62-66.
[6]Beckman J S,Beckman T W,Chen J,et al. Apparent hydroxyl radical production by peroxynitrite:implications for endothelial injury from nitric oxide and superoxide[J]. Proc Natl Acad Sci U S A,1990,87(4):1620-1624.
[7]韩少华,朱靖博,王妍妍. 邻苯三酚自氧化法测定抗氧化活性的方法研究[J]. 中国酿造,2009,6(6):155-157.
[8]Neher J J,Neniskyte U,Zhao J W,et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death[J]. J Immunol,2011,186(8):4973-4983.
[9]Desai B N,Leitinger N. Purinergic and calcium signaling in macrophage function and plasticity[J]. Front Immunol,2014,5:580.
[10]Liu X,Yao M,Li N,et al. CaMKII promotes TLR-triggered proinflammatory cytokine and type I interferon production by directly binding and activating TAK1 and IRF3 in macrophages[J]. Blood,2008,112(13):4961-4970.
[11]Zhou X,Yang W,Li J. Ca2+-and protein kinase C-dependent signaling pathway for nuclear factor-kappaB activation,inducible nitric-oxide synthase expression,and tumor necrosis factor-alpha production in lipopolysaccharide-stimulated rat peritoneal macrophages[J]. J Biol Chem,2006,281(42):31337-31347.
[12]Jin M L,Park S Y,Kim Y H,et al. The neuroprotective effects of cordycepin inhibit glutamate-induced oxidative and ER stress-associated apoptosis in hippocampal HT22 cells[J]. Neurotoxicology,2014,41:102-111.
[13]Lee D H,Kim H H,Cho H J,et al. Cordycepin-Enriched WIB801C from Cordyceps militaris Inhibits Collagen-Induced[Ca2+]i Mobilization via cAMP-Dependent Phosphorylation of Inositol 1,4,5-Trisphosphate Receptor in Human Platelets[J]. Biomol Ther(Seoul),2014,22(3):223-231.
[14]Dröge W. Free radicals in the physiological control of cell function[J]. Physiol Rev,2002,82(1):47-95.
[15]Jung H A,Jin S E,Choi R J,et al. Anti-amnesic activity of neferine with antioxidant and anti-inflammatory capacities,as well as inhibition of ChEs and BACE1[J]. Life Sci,2010,87(13-14):420-430.
Inhibitory effect of cordycepin on macrophagehyperactivation induced by lipopolysaccharide
MENG Xue-lian,LIU Jia,LIU Ying-ying,ZHENG Liang-chao,GAO Cheng-cheng,WANG Dan,LV Jing,CHEN Chang-lan*
(School of Pharmaceutical Science,Liaoning University,Shenyang 110036,China)

cordycepin;lipopolysaccharide;macrophage;hyperactivation
2017-02-14
孟雪莲(1978-),女,博士,副教授,研究方向:抗炎与免疫药理学,E-mail:rubymxl@163.com。
*通讯作者:陈长兰 (1963-),男,博士,教授,研究方向:遗传学与生物制药,E-mail:chenchanglanbio@aliyun.com。
国家自然科学基金项目(81503085,31371085)。
TS201.4
A
1002-0306(2017)13-0297-06
10.13386/j.issn1002-0306.2017.13.055
