高效液相色谱-串联质谱法同时测定减肥类保健食品中27种违法添加化学药品
2017-07-31吴鸳鸯寿林均周明昊
许 立,吴鸳鸯,寿林均,周明昊,,*
(1.浙江工业大学化学工程学院,浙江杭州 310014;2.浙江省食品药品检验研究院,浙江杭州 310052)
高效液相色谱-串联质谱法同时测定减肥类保健食品中27种违法添加化学药品
许 立1,吴鸳鸯2,寿林均1,周明昊1,2,*
(1.浙江工业大学化学工程学院,浙江杭州 310014;2.浙江省食品药品检验研究院,浙江杭州 310052)
目的:建立一种高效液相色谱-串联质谱(HPLC-MS/MS)同时测定减肥类保健食品中27种违法添加化学药品的方法。方法:采用Agilent Eclipse Plus C18色谱柱(2.1 mm×100 mm,1.8 μm),以10 mmol/L乙酸铵(用甲酸调节pH至4.0)溶液为流动相A,乙腈为流动相B,梯度洗脱,流速为0.2 mL/min。通过HPLC-MS/MS系统中多反应监测模式(MRM)对减肥类保健食品中27种违法添加化学药品进行定性和定量分析。结果:该方法线性R2均大于0.99,精密度相对标准偏差小于8.0%,不同质量浓度样品平均回收率为74.5%~106.7%,检出限为0.2~204.2 ng/g。结论:此方法测定快速、准确、灵敏度高、分离度高,可用于减肥类保健食品中27种违法添加化学药品的检测。
高效液相色谱-串联质谱,减肥类保健食品,违法添加,化学药品
随着人们生活品质的不断提高,肥胖逐渐成为一种社会性问题。肥胖患者通常患有糖尿病、高血压、脂代谢紊乱和冠心病等并发症[1]。减肥类保健食品作为一种具有辅助减肥功能的食品,市场需求量较大,但同时也出现了一系列问题[2]。一些不法厂家为了使他们的减肥类保健食品的功效显著,在其中添加具有减肥作用的化学药品。这些化学药品通常具有较大的副作用,不知情下长期服用,会严重损害人体健康。

图1 27种化学药品的化学结构式Fig.1 Chemical structures of the 27 chemical drugs
目前,减肥类保健食品违法添加的主要检验方法有薄层色谱法[3,4]、毛细管电泳法[5]、高效液相色谱法[6-8]、气相色谱-质谱法[9]、高效液相色谱-质谱法[10-13]等。国家食品药品监督管理局药品检验补充检验方法和检验项目批准件(批准件编号2006004)采用液质法检测西布曲明、麻黄碱、芬氟拉明;国家食品药品监督管理局食药监办许[2010]114号文附件2采用液质法同时检测咖啡因、呋塞米、盐酸芬氟拉明、酚酞、盐酸西布曲明;国家食品药品监督管理局药品检验补充检验方法和检验项目批准件(批准件编号2012005)采用液质法检测酚酞、西布曲明、N-去甲基西布曲明、N,N-双去甲基西布曲明;上述方法检测的化学药品共计8种,种类、数量都比较少,已不能满足实际监管需要。因此,根据药品的疗效、重新筛选保健食品中违法添加的化学药品,建立一种较大容量、能够同时检测减肥类保健食品中多种违法添加化学药品的检测方法非常有必要。
依据相关文献[2,8,14-18]及药品的药理性质,选择了27种具有减肥作用的化学药品(化学结构式见图1)作为研究对象,这些药品包括食欲抑制剂(西布曲明、N-去甲基西布曲明、N,N-双去甲基西布曲明、芬氟拉明、利莫那班、安非拉酮、绿卡色林、苯佐卡因);抗抑郁剂(氟西汀、安非他酮、帕罗西汀、氢溴酸西酞普兰、奈法唑酮)、泻药(酚酞、大黄素)、利尿剂(呋塞米、螺内酯、氢氯噻嗪、吲达帕胺、布美他尼、氨苯蝶啶)、能量消耗剂(茶碱、麻黄碱、咖啡因、甲基安非他明、克伦特罗)、降糖类(苯乙双胍)等。本文建立了液质法同时测定减肥类保健食品中27种违法添加化学药品的方法。并采用该法对120批减肥类保健食品进行了测定。
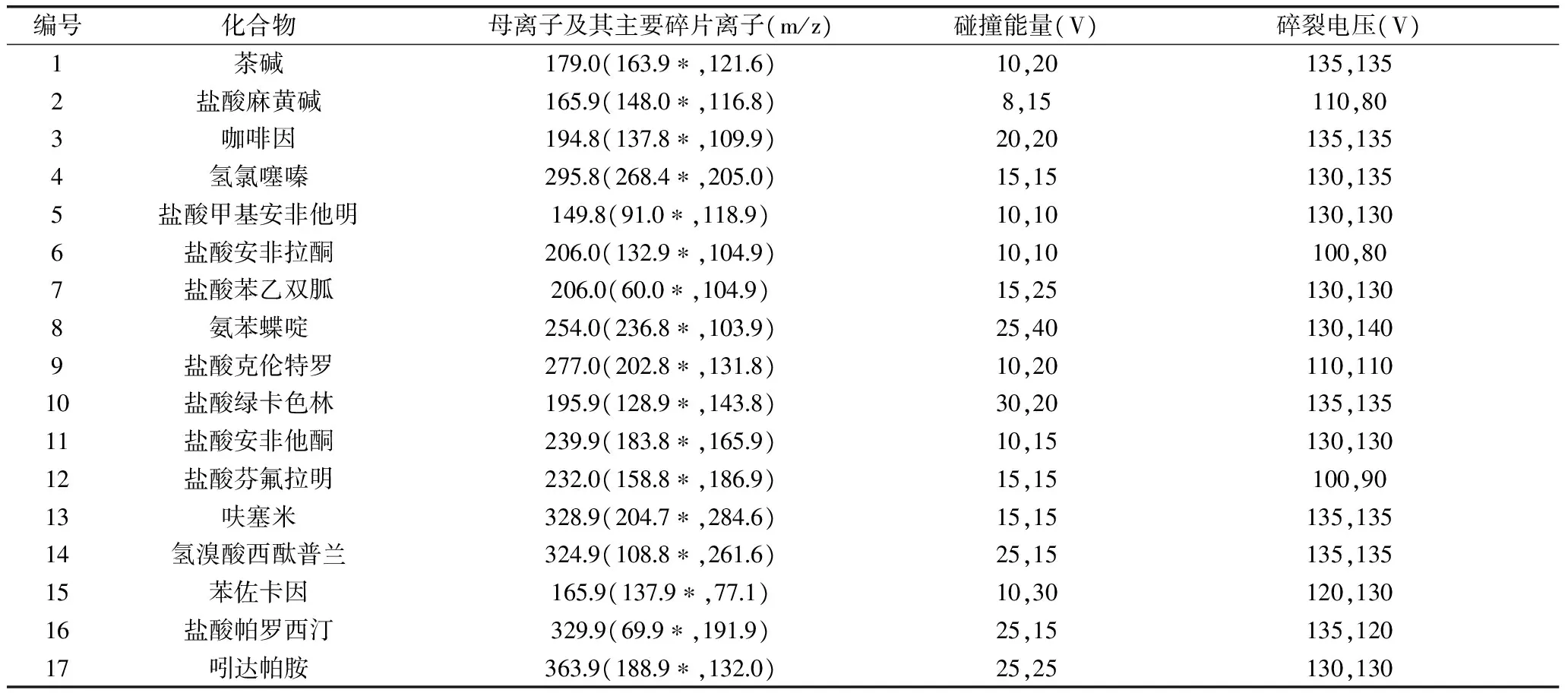
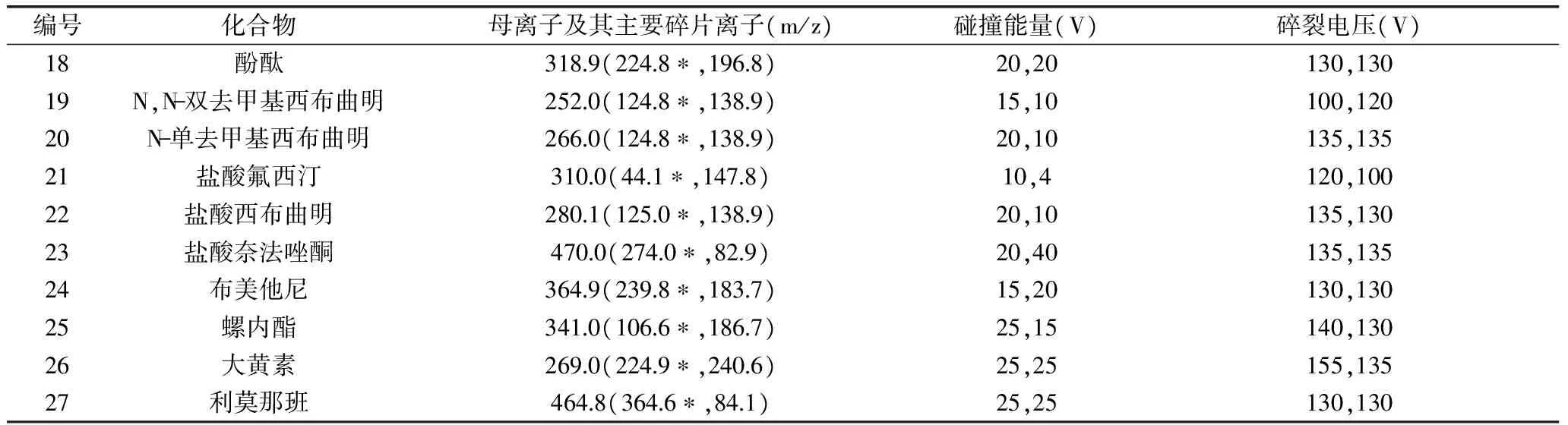
表1 27种化学药品多反应监测离子对及质谱参数Table 1 MRM ions pair and MS patameters of the 27 chemical drugs
1 材料与方法
1.1 材料与仪器
盐酸西布曲明(纯度100%)、盐酸麻黄碱(纯度99.7%)、盐酸芬氟拉明(纯度100%)、酚酞(纯度100%)、呋塞米(纯度99.7%)、咖啡因(纯度99.9%)、氨苯蝶啶(纯度100%)、盐酸氟西汀(纯度100%)、氢溴酸西酞普兰(纯度100%)、盐酸帕罗西汀(纯度96.4%)、茶碱(纯度100%)、盐酸甲基安非他明(纯度100%)、盐酸安非他酮(纯度100%)、螺内酯(纯度100%)、氢氯噻嗪(纯度99.8%)、吲达帕胺(纯度99.8%)、布美他尼(纯度99.3%)、大黄素(纯度98.7%)、盐酸克伦特罗(纯度100%)、盐酸苯乙双胍(纯度99.7%)、苯佐卡因(纯度100%) 中国食品药品检定研究院;N,N-双去甲基西布曲明(纯度100%)、N-单去甲基西布曲明(纯度100%) 英国LGC有限公司;盐酸安非拉酮(纯度97.0%) 上海陶素生化科技有限公司;盐酸绿卡色林(纯度98.0%)上海阿拉丁生化科技有限公司;盐酸奈法唑酮(纯度98.0%) 美国SIGMA公司;利莫那班(纯度95.0%) 百灵威科技有限公司;甲醇、乙腈(均为色谱纯) 德国Merck公司;乙酸铵、甲酸(均为色谱纯) 美国Sigma公司。120批减肥类保健食品:包括减肥茶(颗粒剂)、胶囊及片剂 来源于浙江省市场抽检样品。
1290-6460QQQ HPLC-MS/MS联用仪(配有电喷雾离子源及MassHunter数据处理系统) 美国Agilent公司;Genpure UV/UF超纯水仪 美国热电公司;Elmasonic P300H超声波清洗器 德国Elma公司;Delta 320pH计、XPE 205分析天平 瑞士梅特勒公司。
1.2 实验方法
1.2.1 色谱条件 色谱柱:Agilent Eclipse Plus C18柱(2.1 mm×100 mm,1.8 μm);流速:0.2 mL/min;柱温:30 ℃;进样量:1 μL;流动相A:10 mmol/L乙酸铵溶液(用甲酸调节pH至4.0);流动相B:乙腈;梯度洗脱程序:0~6.0 min,12% B;6.0~6.1 min,12%~30% B;6.1~10.0 min,30%~32% B;10.0~10.1 min,32%~33% B;10.1~19.0 min,33% B;19.0~19.1 min,33%~40% B;19.1~22.0 min,40% B;22.0~22.1 min,40%~80% B;22.1~23.0 min,80% B;23.0~23.1 min,80%~98% B;23.1~26.0 min,98% B;26.0~26.1 min,98%~12% B;26.1~30.0 min,12% B。
1.2.2 质谱条件 离子化方式:电喷雾(ESI)离子源;扫描方式:多反应监测(MRM),正(ESI+)、负(ESI-)离子模式;干燥气(N2)温度250 ℃,干燥气流量6.0 L/min;鞘气(N2)温度350 ℃,鞘气流量11 L/min;毛细管电压:正3500 V,负4000 V;喷嘴电压:正1500 V,负1500 V。各化学药品监测离子对及质谱参数见表1。
续表
注:*.定量离子;其中,茶碱、氢氯噻嗪、呋塞米、吲达帕胺、大黄素采用负离子模式,其他目标化合物均采用正离子模式。1.2.3 对照品溶液制备 精密称取各对照品约10 mg,用100%甲醇超声(10 min,37 kHz)溶解并定容至10 mL容量瓶(其中盐酸绿卡色林用乙腈溶解并定容),得到每1 mL各含1 mg的对照品储备液,置于-4 ℃冰箱中保存备用。精密吸取各对照品储备液适量混合,用甲醇稀释成一系列不同浓度的对照品混合溶液。
1.2.4 供试品溶液的配制 胶囊:取出内容物,必要时研细,混合均匀后,精密称取样品适量(约一次服用量);片剂及减肥茶(实为颗粒剂):取待测样品研细并混匀后,精密称取粉末适量(约一次服用量);液体:精密量取样品适量(约一次服用量);将上述所取样品置50 mL容量瓶中,加入适量甲醇,在室温,37 kHz频率条件下超声10 min,用甲醇定容至刻度,混匀,过0.22 μm有机滤膜后待测。
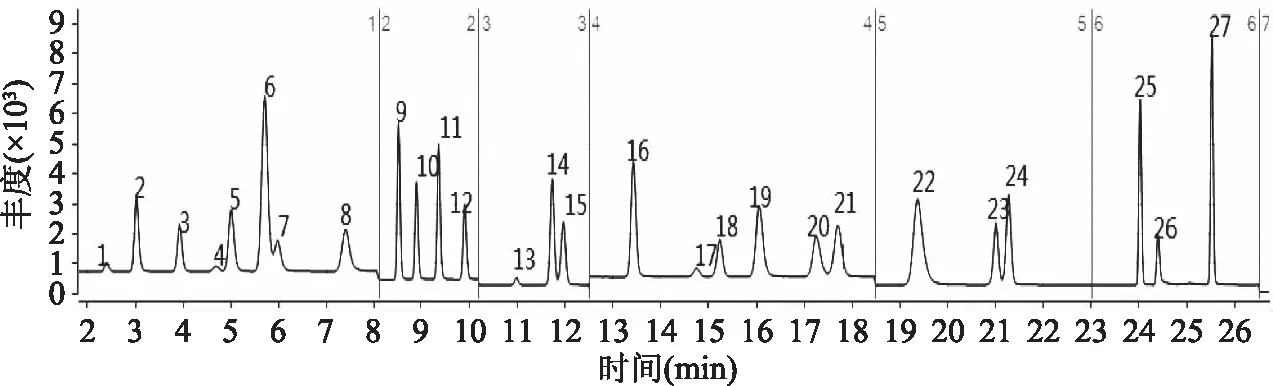
图2 27种化学药品(混标线性最高点)的总离子流图Fig.2 Total ion chromatogram of the 27 chemical drugs (mixed standard linear highest point)注:图2中色谱峰编号1~27对应的目标化合物见表1。
1.2.5 定性测定 在1.2.1和1.2.2的色谱、质谱条件下测定对照品溶液和样品溶液,按照欧盟委员会指令2002/657/EC对质谱定性分析的要求,如果样品溶液检出的色谱峰的保留时间与对照品溶液中的对应色谱峰的保留时间一致,并且所选择的两对子离子的质荷比相同,且相对离子丰度的相对偏差不超过表2规定的范围,则可确定样品中含有该物质。

表2 定性时相对离子丰度的最大允许偏差Table 2 Maximum allowable deviation of the relative ion abundance when determining
1.2.6 定量测定 在1.2.1和1.2.2的色谱、质谱条件下,对1.2.3制备的对照品溶液进样,以各目标物质的响应信号强度(y,峰面积)为纵坐标,对应物质的浓度(x,ng/mL)为横坐标绘制标准工作曲线。样品溶液中各待测物质响应值均应在测定的线性范围内。
2 结果与分析
2.1 色谱柱
根据文献报道[6-8,10-13],上述目标化合物通常采用反相色谱柱(C18柱)进行分离分析。因此,本课题选择了填料粒径较小的色谱柱进行优化,如:A柱为Agilent SB C18柱(2.1 mm×100 mm,1.8 μm);B柱为Agilent Extend C18(2.1 mm×100 mm,1.8 μm);C柱为Agilent Eclipse Plus C18(2.1 mm×100 mm,1.8 μm)。结果表明:使用A柱分离时整体出峰较少且多个色谱峰出现拖尾;使用B柱分离时安非拉酮和苯乙双胍不能分离,呋塞米和安非他酮色谱峰重叠;使用C柱分离时27种目标化合物分离效果良好,且峰形对称(见图2),所以选择C柱为本实验的色谱柱。
2.2 流动相的选择
本实验分析的目标化合物较多,极性差异较大,文献[8,11-12]中所采用的流动相也各有不同,如以乙腈-0.1%甲酸10 mmol/L乙酸铵溶液为流动相测定茶碱、咖啡因、螺内酯、氢溴酸西酞普兰等25种药品的含量[8],以乙腈-0. 1%甲酸溶液为流动相测定西布曲明、芬氟拉明等六种化学药品的含量[11],以甲醇-10.0 mmol/L乙酸铵溶液为流动相测定利莫那班的含量[12];国家食品药品监督管理局药品检验补充检验方法和检验项目批准件(批准件编号2012005)采用了乙腈-10 mmol/L乙酸铵溶液(用乙酸调节pH至4.0)检测酚酞、西布曲明、N-去甲基西布曲明、N,N-双去甲基西布曲明的含量。参考以上情况,首先对乙腈-水二元流动相进行考察,发现分离效果较差,且较多组分的色谱峰出现严重拖尾现象。考虑到质谱条件的影响,选择乙酸铵(挥发性缓冲盐)溶液为水相,抑制色谱峰拖尾,改善峰形。故考察了乙腈-5、10、15、20 mmol/L乙酸铵(乙酸铵溶液会抑制某些化合物的电离,且高浓度的乙酸铵溶液在高比例乙腈中容易析出)溶液为流动相,发现当采用10 mmol/L乙酸铵为流动相时,整体峰形良好,但是大黄素、N-单去甲基西布曲明和N,N-双去甲基西布曲明的色谱峰重叠。进一步考察10 mmol/L乙酸铵(用甲酸调节pH=3.0、3.5、4.0、4.5)为流动相水相条件对27种化合物的分离情况,结果表明:当pH≤3.5时,严重抑制负离子响应;当pH=4.0和pH=4.5时,整体响应良好,相比之下,pH=4.0时27种化合物的分离效果更好。最终,该实验采用乙腈-10 mmol/L乙酸铵(用甲酸调pH至4.0)为流动相。
2.3 柱温的选择
本实验考察了柱温(30、35、40、45 ℃)对分离度的影响。结果表明:在30 ℃时,安非拉酮和苯乙双胍实现良好分离,且其他目标化合物的色谱峰也保持良好的分离状态。随着柱温的升高安非拉酮和苯乙双胍这对色谱峰保留时间逐渐接近,当柱温大于40 ℃时,两峰完全重叠。因此本实验柱温最终定为30 ℃。
2.4 质谱条件的选择
本实验所采用的电喷雾离子源是质谱常见的一种离子源,可适用于极性小分子化合物的分析。呋塞米、氢氯噻嗪、吲达帕胺、大黄素、茶碱在负离子模式下易失去氢形成带负电荷的[M-H]-离子峰,螺内酯在正离子模式下易脱去乙酰基硫基生成m/z为341.0的带正电荷的稳定离子峰[19-20],其余21种目标化合物在正离子模式下均易得到氢形成带正电荷的[M+H]+离子峰,故该实验采用正、负离子模式进行分析。为了提高实验的灵敏度和准确度,在确定母离子的前提下,采用子离子扫描,分别对各目标化合物进行了碰撞能和碎裂电压的优化,得到两个稳定性好、响应高、质量较大的二级离子碎片(见表1)。其中响应较高的离子作为定量离子,再根据保留时间和离子丰度比来对各目标物质进一步定性。
2.5 样品前处理条件的优化
本实验研究的27种化学药品中盐酸麻黄碱、盐酸绿卡色林、大黄素、盐酸克伦特罗等多种药品难溶或不溶于水,易溶于极性有机溶剂甲醇、乙醇、乙腈等。通常片剂、胶囊等口服制剂添加有淀粉(淀粉在水中的溶解性较好)作为辅料。根据以上因素,考察不同体积分数的甲醇-水、乙醇-水、乙腈-水溶液对减肥类保健食品(减肥茶、胶囊、片剂)的提取效果。并对超声时间(10、15、20 min)和超声频率(37、80 kHz)进行比较。结果表明:当采用50%、70%、90%和100%乙醇-水溶液为提取溶剂时,盐酸麻黄碱、咖啡因、氢氯噻嗪、氨苯蝶啶、呋塞米和利莫那班的提取效率低于采用同比例的甲醇-水溶液为提取溶剂时的提取效率,因为上述几种化合物在甲醇中的溶解性更好;当采用70%、90%和100%乙腈-水溶液提取时,出峰较早的茶碱和氢氯噻嗪出现色谱峰分叉甚至出现双峰,可能是提取溶剂与流动相初始比例的差异,出现了严重的溶剂效应。当采用甲醇-水溶液(10 min,37 kHz)提取时,随着甲醇比例的提高,减肥茶和片剂中麻黄碱、克伦特罗和绿卡色林的回收率逐渐增大,胶囊和片剂中甲基安非他明和大黄素的回收率也有所提高。70%、90%和100%甲醇-水溶液对于不同基质的部分目标化合物的提取效率见图3(选取部分提取效率差异较大的目标化合物)。结果表明:甲醇作为两性有机溶剂,对该实验27种化合物(极性差异较大)的整体提取效果较好。另外,超声时间为10 min时的提取效率与15、20 min的提取效率基本一致;与超声频率为80 kHz相比,当超声频率为37 kHz时的整体提取效率较好。故片剂、胶囊和颗粒剂均用100%甲醇超声(10 min,37 kHz)提取。
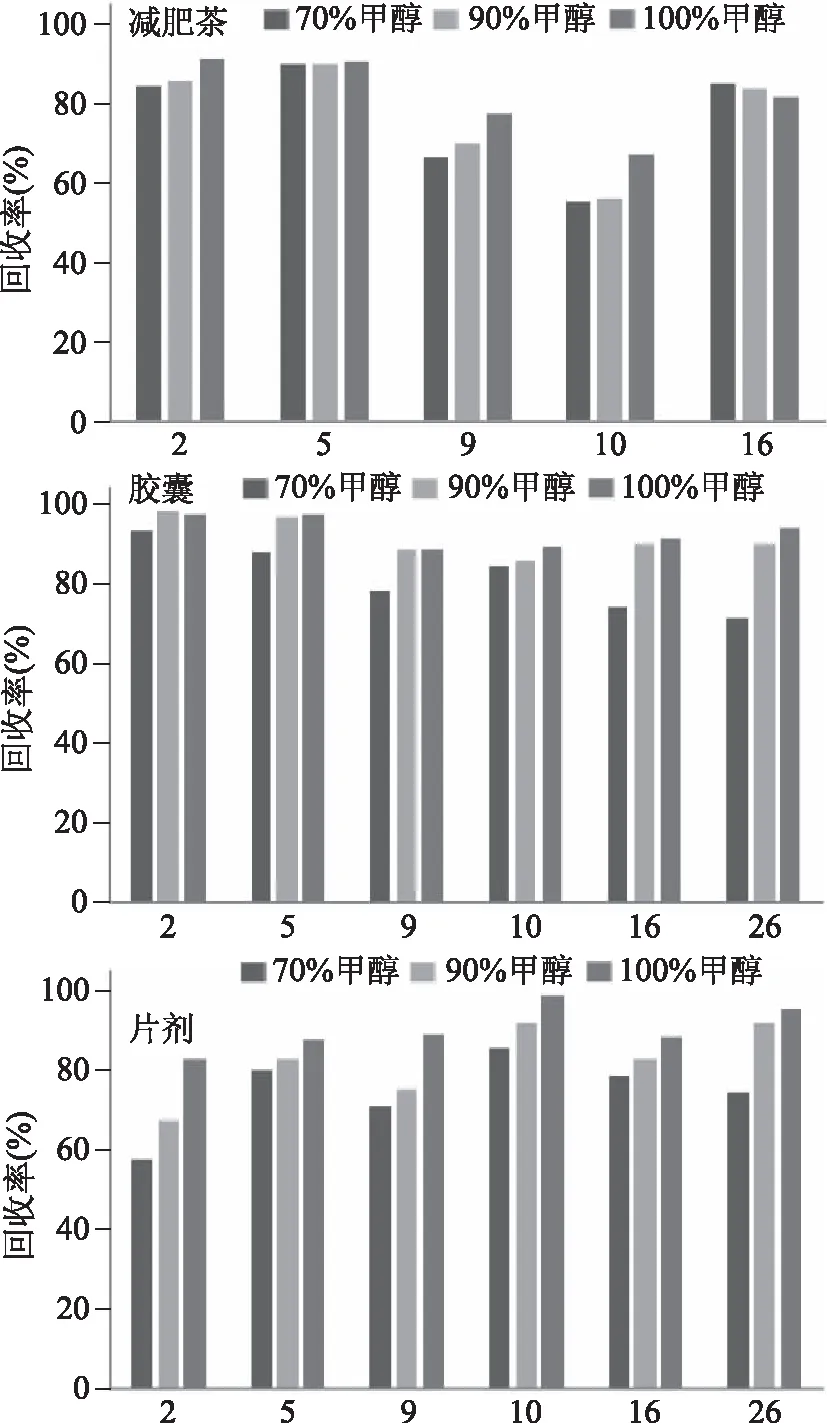
图3 不同浓度甲醇对回收率的影响Fig.3 Effect of different concentrations of methanol on the recovery rate注:图中横坐标编号2,5,9,10,16,26对应目标化合物见表1。
2.6 方法学考察
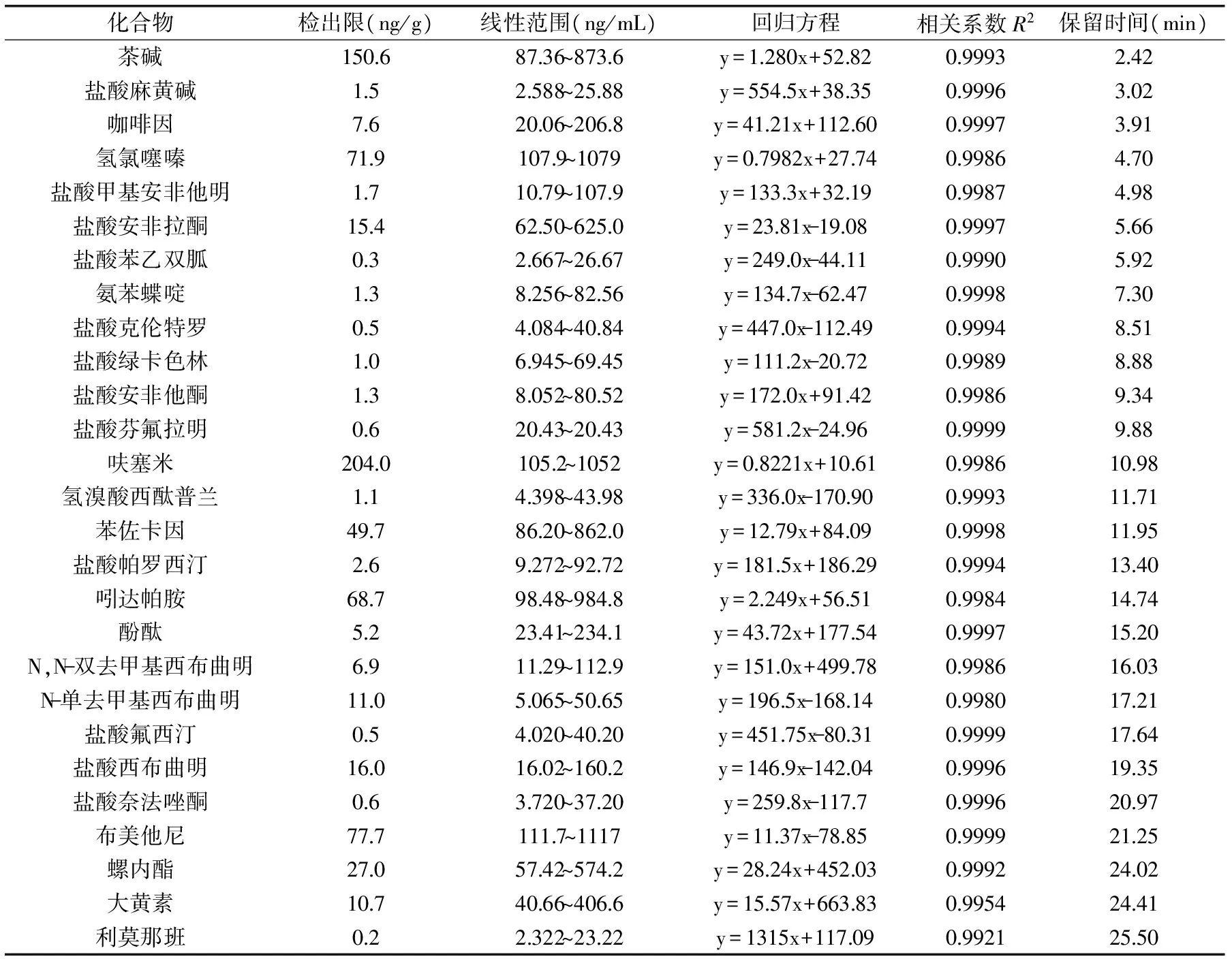
表3 27种化学药品的检出限、线性范围、回归方程、相关系数及保留时间Table 3 Limits of detection(LODs),linear ranges,linear equations, correlation coefficients(R2)and retention times of the 27 chemical drugs
2.6.1 检出限及线性范围 取胶囊阴性样品为空白基质,分别加入适量对照品,按1.2.4制备方法制备供试品,以信噪比为3(S/N=3)计算方法检出限(LOD);采用1.2.3制备的系列混合标准溶液,在1.2.1和1.2.2的色谱、质谱条件下,分别以各目标物质的响应信号强度(y,峰面积)对其质量浓度(x,ng/mL)作标准曲线,记录相关系数。结果见表3。
2.6.2 精密度 取1.2.3制备的系列混合标准溶液,配制标准曲线内较低、中、较高3种浓度水平的混合标准溶液,按1.2.1和1.2.2的色谱、质谱条件重复测定6次,27种目标化合物的相对标准偏差(RSD)为0.5%~7.3%。
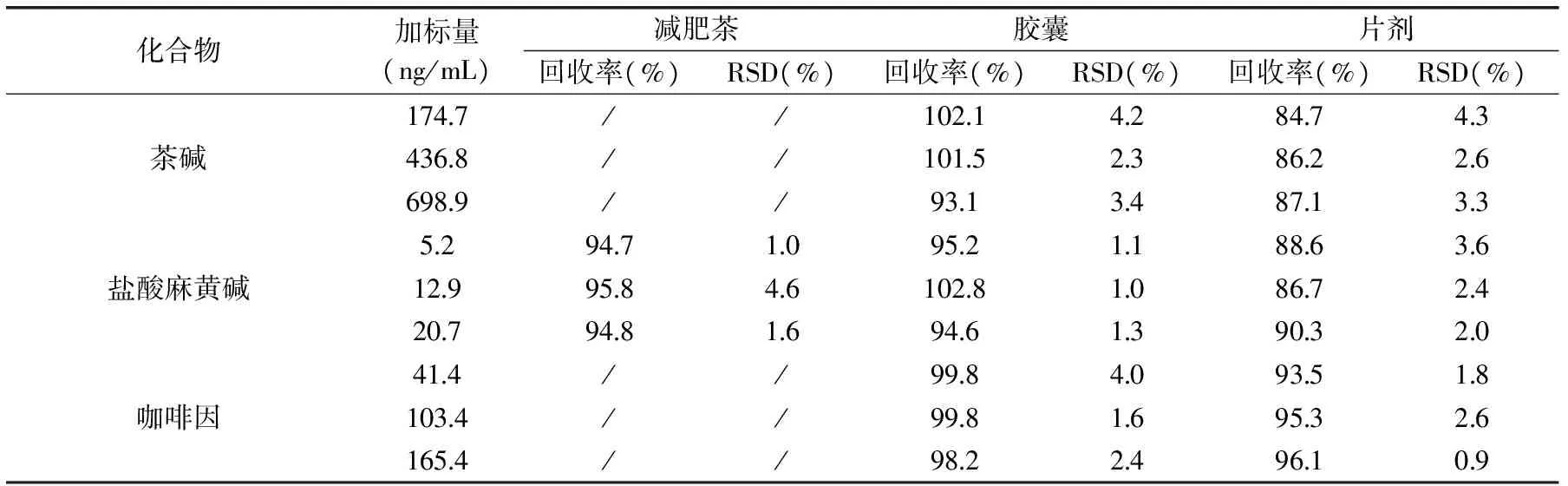
表4 不同空白样品中3个加标水平下的27种化学药品的回收率及精密度(n=3)Table 4 Recoveries and repeatablities of the 27 chemical drugs spiked in different blank samples at 3 levels(n=3)

续表

续表
2.6.3 准确度 因减肥茶的原料中通常含有茶叶和决明子(中药材),其中茶叶中含有茶碱和咖啡因;决明子中含有蒽醌类化合物——大黄素,故本实验采用减肥茶(不含24种(除茶碱、咖啡因、大黄素)目标化合物)、减肥胶囊和片剂样品(不含27种目标化合物)作为空白基质,(供试品制备见1.2.4),添加标准曲线内较低、中、较高三个浓度水平的标准溶液平行测定3次,分别计算加标回收率,结果见表4。
2.7 样品测定
本实验通过检测120批减肥类保健食品(减肥胶囊样品称量时,将胶囊壳粉碎同内容物一起称量,以防胶囊壳中有违法添加物),
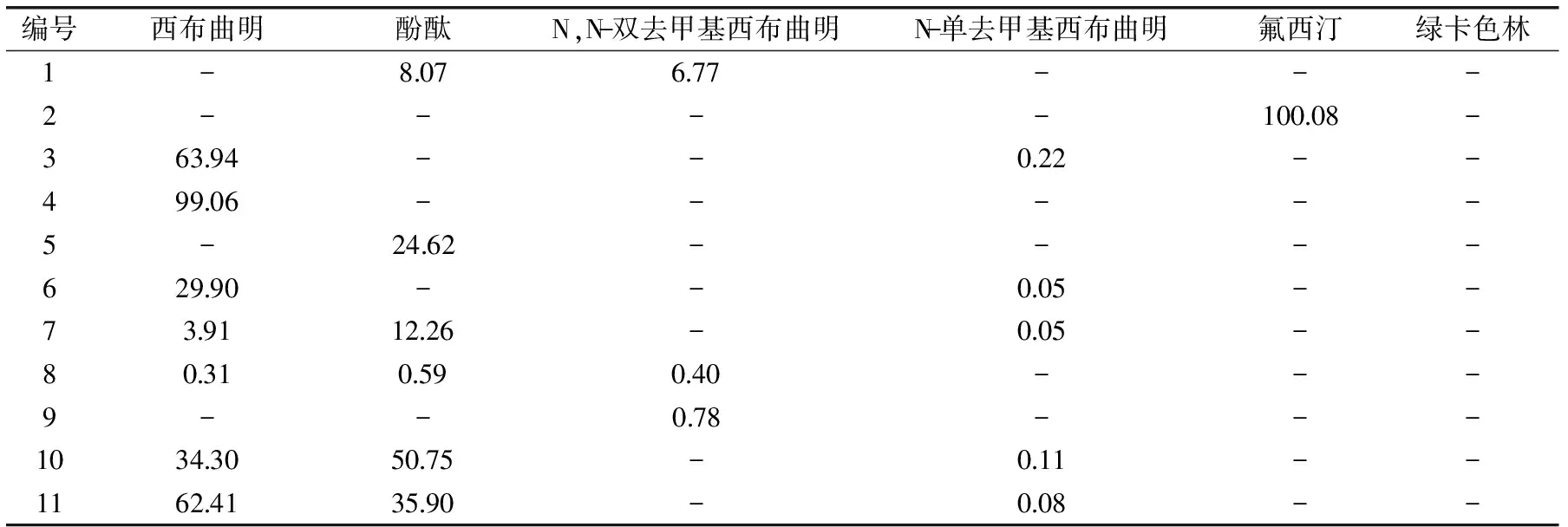
表5 部分阳性样品的检验结果(mg/g)Table 5 Detection results of some positive samples(mg/g)
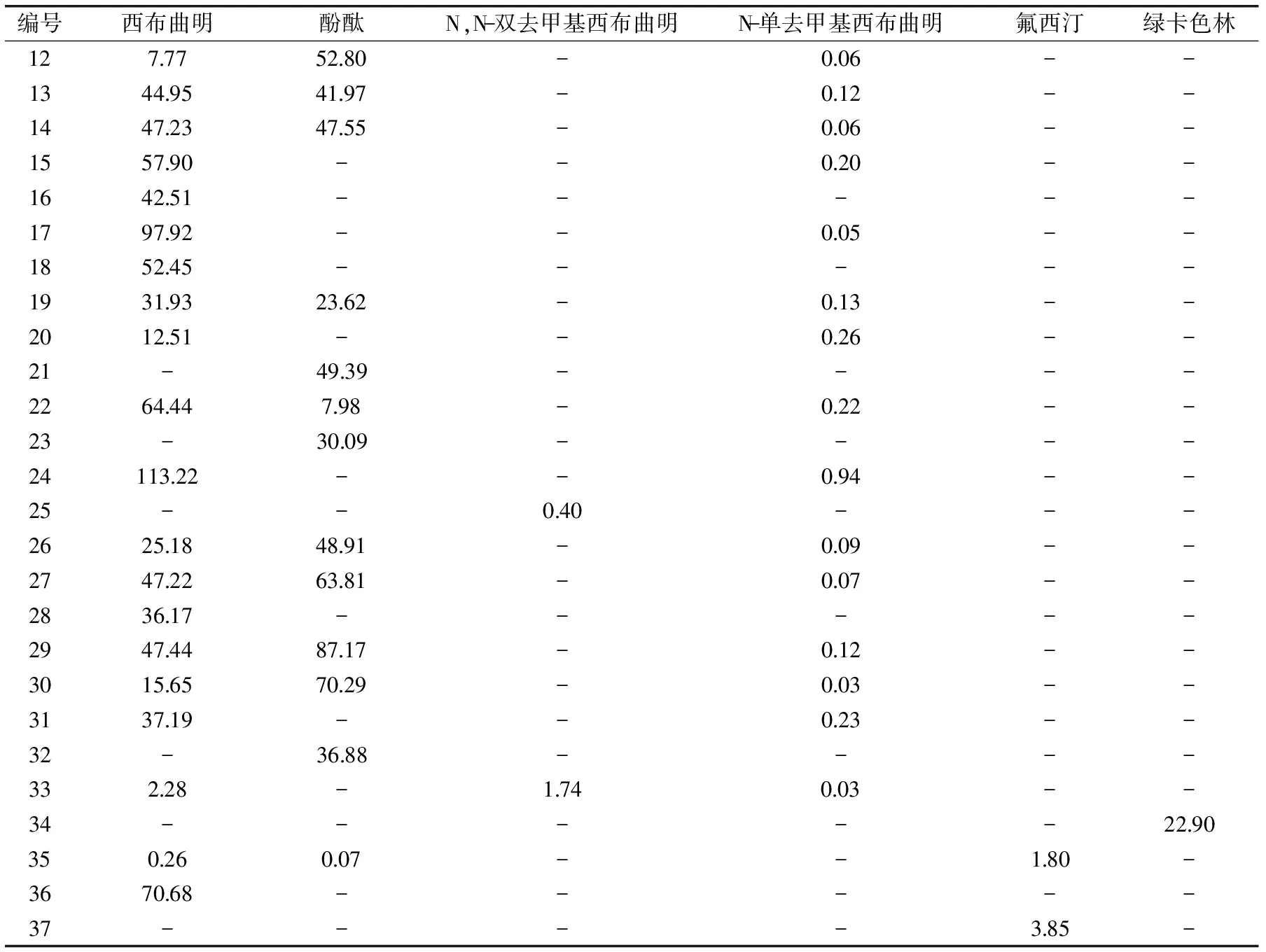
续表
注:-:未检出。结果表明:检出率较高的是西布曲明(54批,含量为0.26~113.22 mg/g)、酚酞(30批,含量为0.07~87.17 mg/g)、N,N-双去甲基西布曲明(10批,含量为0.40~1.74 mg/g)和N-单去甲基西布曲明(38批,含量为0.03~0.94 mg/g),另外氟西汀(3 批,含量为1.80~100.08 mg/g)和绿卡色林(1批,含量为22.90 mg/g)也有检出。部分阳性样品(根据样品检出化学药品的种类及检出含量范围,列举了37批样品的检出情况)的检验结果见表5。
3 结论
减肥类保健食品中违法添加化学药品的情况较为复杂,本文从化合物的药理特性(包括副作用)出发,重新确定并扩大了目标化合物范围。除检出已有国家标准的违法添加物外,在120批样品中还检出的盐酸氟西汀(抗抑郁药,有抑制食欲的副作用)和盐酸绿卡色林(新型食欲抑制剂),这两种化合物目前尚无针对性的国家标准。本法能在30 min内完成对27种目标化合物的分离定量,与现有国家标准方法(仅能检测8种)相比,本法的检测容量更大,适用范围更广,具有更好的应用前景。
[1]鞠传慧,余芝,徐斌.针灸对肥胖及其并发症的调节作用[J].中医药学报,2010,38(3):44-48.
[2]鞠瑞秀,王慎田. 减肥药的副作用及合理应用[J]. 实用医技杂志,2004,11(5):804-805.
[3]李萍,高向军,周娟. 薄层色谱法测定止咳平喘胶囊中麻黄碱的含量[J]. 华西药学杂志,1999,14(2):60-61.
[4]Etil Ariburnu,Mehmet FazliUludag,Huseyin Yalcinkaya,et al.Comparative determination of sibutramine as an adulterant in natural slimming products by HPLC and HPTLC densitometry[J],Journal of Pharmaceutical and Biomedical Analysis,2012,64-65:77-81.
[5]于海霞,李露,马慧芬,等. 毛细管电泳法测定螺内酯片剂中螺内酯的含量[J]. 山西医科大学学报,2015,46(10):995-998.
[6]葛宝坤,张群谦,赵孔祥. 高效液相色谱法同时测定减肥类保健食品中盐酸西布曲明和酚酞[J]. 药物分析杂志,2012,32(11):2034-2037.
[7]薛丰,李阳,王媛. 高效液相色谱法同时测定功能食品中6种违禁成分[J]. 四川大学学报(医学版),2013,44(1):135-138.
[8]王静文,黄湘鹭,曹进,等. 超高效液相色谱法同时测定减肥类保健食品中非法添加的25种药物[J]. 色谱,2014,32(2):151-156.
[9]朱志鑫,吴惠勤,黄晓兰,等. 气相色谱-质谱法检测减肥食品中芬氟拉明和西布曲明[J]. 现代食品科技,2012,28(10):1419-1422.
[10]陈稚,吴都督. HPLC/ESI-MS测定减肥保健食品中的双去甲基西布曲明[J]. 中国食品卫生杂志,2010,22(1):24-26.
[11]钮正睿,张庆生,曹进. 超高效液相色谱-串联质谱法快速检测保健食品中非法添加的6种减肥类化学成分的研究[J]. 中国实验方剂学杂志,2014,20(18):91-94.
[12]马微,马强,付丽,等. 高效液相色谱-串联质谱法同时测定减肥保健食品中非法添加的药物利莫那班和奥利司他[J]. 色谱,2010,28(1):43-48.
[13]王柯,胡青,崔益冷,等.液相色谱-离子阱质谱联用检测减肥类中药及保健食品中28种非法掺家药物的研究[J]. 药物分析杂志,2008,28(8):1268-1274.
[14]康银花,晋展.新型减肥药Lorcaserin Hydrochloride[J].药学进展,2008,32(9):423-425.
[15]马微,马丽卿,付丽,等.减肥类保健食品中添加违禁药物的研究现状[J].中国卫生检验杂志,2009,19(12):3023-3026.
[16]徐耿明,韦莉萍.减肥药的研究进展[J].第一军医大学分校学报,2004,27(2):212-214.
[17]Leandro M. de Carvalho,Mariele Martini,Ana Paula L. et al.Presence of synthetic pharmaceuticals as adulterants in slimming phytotherapeutic formulations and their analytical determination[J]. Forensic Science International,2011,204:6-12.
[18]蔡亚玲,Clive Barwell,阮金兰. 高效液相色谱法对氨苯蝶啶等7种利尿药的分离测定[J]. 医药导报,2004,23(6):413-414.
[19]陈海滨,吴春敏,胡敏,等. LC-MS/MS检测降压类中药制剂中非法添加的9种化学药物[J]. 海峡药学,2012,24(9):47-50.
[20]刘萍,王本杰,魏春敏,等. 人血浆中螺内酯及其代谢物坎利酮的LC-MS测定[J]. 中国医药工业杂志,2008,39(11):842-845.
Simultaneous determination of 27 chemical drugs illegally addedin slimming health food by high performance liquidchromatography-tandem mass spectrometry
XU Li1,WU Yuan-yang2,SHOU Lin-jun1,ZHOU Ming-hao1,2,*
1.College of Chemical Engineering,Zhejiang University of Technology,Hangzhou 310014,China;2.Zhejiang Institute for Food and Drug Control,Hangzhou 310052,China)
Objective:To develop detection method for the simultaneous screening and confirmation of 27 illegally added in slimming health food using high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS).Methods:The chemical drugs were separated on an Agilent Eclipse Plus C18chromatographic column(2.1 mm×100 mm,1.8 μm)with acetonitrile and aqueous solution of 10 mmol/L ammonium acetate(adjust to pH4.0 with formic acid)as mobile phase under gradient elution at a flow rate of 0.2 mL/min.The 27 illegally added in slimming health food were conducted qualitatively and quantitatively analysis by tandem mass spectrometry under multiple reaction monitoring(MRM)mode. Results:The method was linear with correlation coefficients(R2)which were not less than 0.99,and the precision expressed as relative standard deviations(RSDs)were not more than 8.0%.The recoveries of 27 drugs illegally added in slimming health food at different spiked concentrations ranged from 74.5% to 106.7%.The limits of detection(LODs)were in the range of 0.2~204.2 ng/g. Conclusion:This method is rapid,accurate and sensitive with a high degree of separation,and can be used for the detection of the 27 illegally added chemicals in slimming health foods.
high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);slimming health food;illegally added;chemical drugs
2017-02-14
许立(1991-),男,硕士,研究方向:保健食品及化妆品质量分析,E-mail:1460151279@qq.com。
*通讯作者:周明昊(1971-),男,硕士,主任药师,研究方向:保健食品、化妆品及药品质量分析,E-mail:zmh888@hotmail.com。
TS207.3
A
1002-0306(2017)13-0248-10
10.13386/j.issn1002-0306.2017.13.047
