真菌Simplicilliumlanosoniveum抗生素的分离纯化和初步表征
2017-07-31董庆霖董荣真邢向英苗佳旭李玉宽
董庆霖,董荣真,邢向英,苗佳旭,李玉宽
(河北工业大学化工学院,代谢工程实验室,天津 300130)
真菌Simplicilliumlanosoniveum抗生素的分离纯化和初步表征
董庆霖,董荣真,邢向英,苗佳旭,李玉宽
(河北工业大学化工学院,代谢工程实验室,天津 300130)
以蓝藻的共生真菌Simplicilliumlanosoniveum为研究对象,对其代谢产生的抑制革兰氏阳性菌的抗生素进行发酵条件的筛选、分离纯化和初步表征。通过单因素实验确定真菌Simplicilliumlanosoniveum产生抗生素的最佳培养基为改良的沙氏培养基:蔗糖30.0 g/L和蛋白胨12.0 g/L;发酵曲线表明该抗生素的合成与菌体的生长关系为生长非偶联型;通过样品液的分离纯化以及初步表征确定该抗生素在254 nm处有最大吸收峰,以乙腈:0.02 mol/L的碳酸盐缓冲溶液(体积比为5∶95)为流动相时,其保留时间为4.1031 min,分子量为163.0182;双缩脲和茚三酮反应均呈阴性。该抗生素的发现为Simplicillium属的分类提供了理论依据。
抗生素,Simplicilliumlanosoniveum,纯化,表征
抗生素是生物活性物质的主要类别。目前发现的12 000种抗生素大约有30%来自真菌[1],并且主要集中在丝状真菌的曲霉属、青霉属和头孢霉属[2],但是对青霉属和头孢属的近亲Simplicillium属[3]的研究相对较少。
Simplicilliumlanosoniveum作为Simplicillium属中的一大类,通常以寄生真菌和昆虫病原真菌的身份出现在人们的视野中[4-5]。有关Simplicillium属的研究和报道也主要集中在大豆锈病菌的生物防治方面[6-8],但是对其在抗菌活性方面的研究鲜有报道。目前已发现的Simplicillium属中的抑真菌化合物主要有:simplifungin[9]、simplicilliumtides[10]和二酮哌嗪生物碱[11];S.lanosoniveum产生的抗生素主要有:吡咯烷生物碱preussin B[12]和苦参碱[13]。
本文所使用的真菌DT06(Simplicilliumlanosoniveum)[14-15]是从蓝藻培养液中分离得到的一株Simplicillium属的共生真菌。据研究报道,该菌株代谢产生的抗生素对金黄色葡萄球菌、枯草芽孢杆菌、藤黄微球菌等革兰氏阳性菌具有较强的抑制作用,而对大肠杆菌和鼠伤寒沙门氏菌等革兰氏阴性菌无抑制作用[15]。因此,本文通过对该抗生素合成条件中最佳碳氮源的筛选和其代谢过程的简单分析,应用大孔树脂和离子交换树脂层析对该抗生素进行了分离纯化,应用紫外可见扫描光谱、高效液相色谱、质谱、茚三酮和双缩脲实验对该抗生素进行初步表征。
1 材料与方法
1.1 材料与仪器
真菌DT06(Simplicilliumlanosoniveum) 中国科学院微生物研究所菌物标本馆保藏,保藏编号为HMAS 242045(北京,中国);金黄色葡萄球菌(Staphylococcusaureus) 由河北工业大学生物工程系菌种保藏室提供;PDA培养基 土豆200 g、葡萄糖20 g、蒸馏水1000 mL;沙氏培养基 葡萄糖40 g、蛋白胨10 g、蒸馏水1000 mL;LB培养基 蛋白胨10 g、酵母粉5 g、NaCl 10 g、蒸馏水1000 mL、pH为7.0;大孔树脂CT-12和离子交换树脂 D301T南开合成公司;头孢菌素C的锌盐标样 Sigma公司(美国);乙腈、乙醇和其他试剂 金海华星生物科技有限公司。

表1 质谱条件Table 1 Parameters of mass spectrometric analysis
HZQ-QG型卧式空气恒温振荡器 北京东联哈尔仪器制造有限公司;Model 868 pH计 上海Thermo公司;CARy300型紫外光谱分析仪 上海精科仪器厂;Agilent-1200高效液相色谱 美国Agilent公司;Bruker-6310质谱仪 Bruker公司。
1.2 发酵条件
将菌株DT06通过斜面划线法接种于新鲜的PDA培养基上,于25 ℃的培养箱中培养5 d。在无菌条件下配成孢子悬浮液后接种于液体沙氏培养基中,于25 ℃、120 r/min条件下在回转式恒温调速摇床里培养36 h,制成种子液。
取80 μL种子液接种到含有80 mL液体沙氏培养基的250 mL锥形瓶中,25 ℃、120 r/min培养7 d,同时做两组平行实验。
1.3 碳源和氮源的筛选实验
以液体沙氏培养基为基础培养基进行最优碳源和氮源的筛选实验。
碳源:葡萄糖、蔗糖、果糖、乳糖、淀粉,浓度:40 g/L。
氮源:硝酸钠、硝酸铵、尿素浓度、酵母膏、蛋白胨,浓度:10 g/L。
筛选出该抑真菌剂的最适碳氮源后,醇沉除去多糖[16],于最适条件下测量真菌DT06液态发酵过程中生物量[16]、残糖[17]、pH以及抑菌圈大小[18]的变化曲线。
1.4 抗生素的分离与纯化
将发酵液经过离心(8000 r/min,10 min,4 ℃)除去菌体,取上清液,加入2倍体积无水乙醇,充分搅拌,静置2 h,离心,除去析出的杂多糖与杂蛋白,旋蒸除去乙醇。
将预先经过盐酸、氢氧化钠和去离子水处理过的大孔树脂CT-12湿法装入玻璃柱(2 cm×30 cm)中。使所得的样品粗提液缓慢流经离子交换树脂进行动态吸附和解吸实验:吸附床体积(BV)为31.4 mL,流速为0.8 mL/min,选用体积分数为50%~100%的乙醇溶液作解吸剂,流速1.0 mL/min。将不同浓度的乙醇洗脱液进行旋蒸,除去乙醇,再将样品稀释至初始发酵液的浓度,进行抑菌性实验,观察抑菌圈大小并记录数据。比较抑菌圈直径的大小,以确定目标产物的回收率R。
式(1)
式(1)中:a为纯化液抑菌圈直径,mm;b为原始发酵液抑菌圈直径,mm。
由于真菌DT06发酵液呈现淡黄色,因此我们采用乙酸预处理过的弱碱性阴离子交换树脂D301T静态吸附除去样品液中的色素,并比较去除色素前后样品液的抑菌活性。
将得到的上清液经0.22 μm滤膜过滤处理,备用。
1.5 抗生素紫外可见扫描检测
将经过离子交换树脂层析所得样品纯化液用蒸馏水稀释,使用紫外可见扫描分光光度计在200~800 nm范围内进行扫描,确定其最佳吸收波长。
1.6 抗生素的液相色谱分析
采用Agilent-1200高效液相色谱仪。
条件参数:C18(Kromasil)色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈和0.02 mol/L碳酸盐缓冲溶液(pH为7.5),流速为1.0 mL/min;进样量:20 μL;柱温:25 ℃。在上述分析条件下确定检测该抗生素的最佳流动相比例。
建构良好国家形象是时代发展的需要。国家形象是一个国家在人们头脑中的存在,是大多数人认识这个国家的起点,这些认识一旦形成普遍共识又会转化为这个国家的国家形象本身。全球化时代,一个国家的发展是在与越来越多的国家、组织、个人的交往中实现的,而国家形象在很大程度上决定着交往的可能性、广泛性和合意性。国家形象已经成为影响国际关系和交往的重要因素,成为国家利益的重要内容。建构良好的国家形象,对于促进国家发展、维护国家安全、增强综合国力和国际竞争力意义重大。
1.7 双缩脲和茚三酮实验
双缩脲显色实验[19]检测抗生素是否为多肽类物质或者含有酰胺键;茚三酮显色实验[20]检测抗生素结构中是否含有-NH2和-COOH。
1.8 抗生素的液质联用分析
采用Agilent-1200高效液相色谱仪和Bruker-6310质谱仪;
液相条件:同1.6;质谱条件:见表1。
2 结果与讨论
2.1 碳源和氮源筛选实验
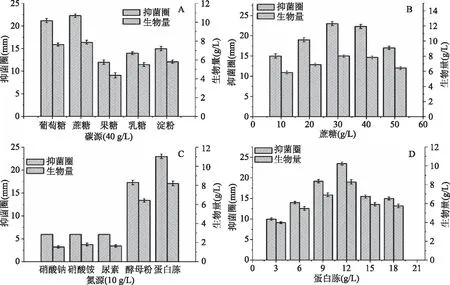
图1 碳氮源对真菌DT06生物量和抗生素合成的影响Fig.1 The influence of carbon and nitrogen sources on fungus DT06 biomass and antibiotic synthesis注:A:碳源;B:蔗糖浓度;C:氮源;D:蛋白胨浓度。
如图1所示,蔗糖是该抗生素合成的最佳碳源,最适浓度为30 g/L。在此条件下,真菌DT06的生物量和抑菌活性均高于其他实验组,生物量和抑菌圈直径最大值分别为22.5 mm和8.05 g/L。蛋白胨是该抗生素合成的最佳氮源,当蛋白胨浓度为12 g/L时,抑菌圈直径和生物量均达到最值,分别为23.5 mm和8.3 g/L。在酵母膏、蛋白胨这两种有机氮源上真菌DT06生物量较高,但是在无机氮源(硝酸钠、硝酸铵和尿素)上长势不好,并且几乎检测不到抗菌活性。因此,有机氮源利于该抗生素的合成,并且可能主要是通过增加菌体的生物量而增加目标产物的产量。
如图2所示,在发酵初期真菌DT06处于一个缓慢适应环境的生长迟缓期,碳源消耗缓慢,大约60 h后开始进入指数期。在110 h左右菌体达到稳定期,碳源(蔗糖)耗尽,生物量达到相对稳定值。抗生素在指数期后期(约100 h)开始合成,并在140 h左右抑菌圈和生物量达到最大值,分别为24 mm和8.3 g/L。由发酵曲线趋势可知,该抗生素的合成与菌体的生长关系为生长非偶联型。在整个发酵过程中,pH虽略有上升,但几乎保持恒定,最后稳定在6.2左右,这说明在菌体的发酵过程中有机酸的产量很少或几乎没有。
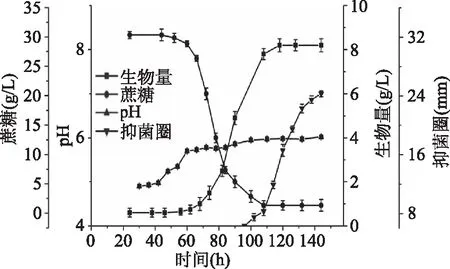
图2 菌株DT06的生物量、还原糖、 抑菌活性以及pH的变化曲线Fig.2 Time courses of biomass,reducing sugar, antibacterial activity and pH of strain DT06
2.3 抗生素的分离与纯化
发酵液经大孔树脂CT-12吸附后,吸附余液抑菌圈直径为7 mm,如图3a所示,几乎检测不到抑菌活性,说明大孔树脂CT-12对该抗生素表现出良好的吸附性能。将不同浓度的乙醇洗脱液分别稀释至初始发酵液浓度后,95%乙醇的洗脱液抑菌圈直径最大,为21 mm(图3b),说明95%的乙醇对该抗生素表现出良好的解析能力。因为初始发酵液抑菌圈直径为24 mm,所以,经式(1)计算可得大孔树脂柱层析分离纯化得到的抗生素回收率R高达87.5%(图4)。
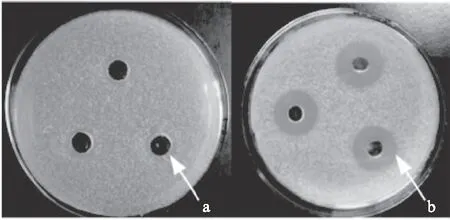
图3 大孔树脂CT-12吸附实验结果Fig.3 The results of absorption on macroporous resins CT-12注:a:大孔树脂吸附余液抑菌活性; b:95%乙醇洗脱液的抑菌活性。
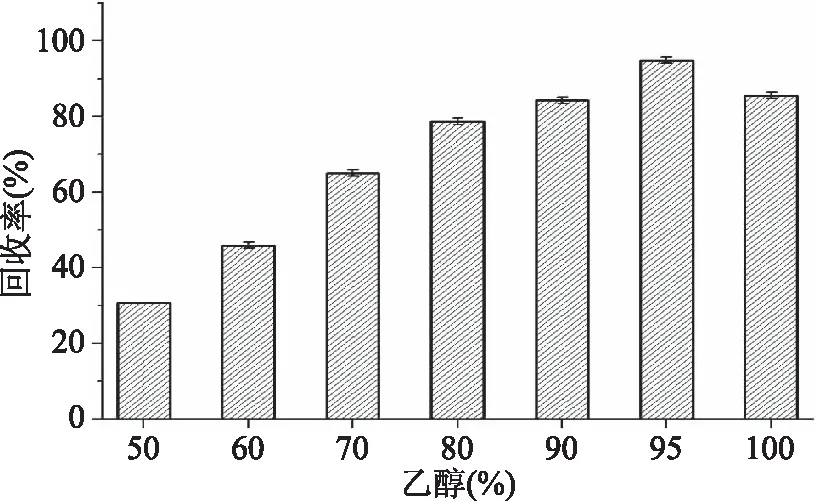
图4 乙醇浓度对抗生素回收率的影响Fig.4 Effect of ethanol concentration on the antibiotic recovery rate
如图5所示,样品液经离子交换树脂D301T吸附处理后,淡黄色液体变为无色,可知D301T可以有效去除真菌DT06发酵液中的淡黄色色素。

图5 色素去除前后样品液Fig.5 Solutions before and after removing of pigments注:a:除色素之前的样品液;b:除色素之后的样品液,图6同。
将去除色素前后的样品液分别进行抑菌性实验,结果如图6所示,可知色素去除前后样品液的抑菌活性几乎没有变化,同时也验证了真菌DT06代谢产生的淡黄色色素不是抗生素。
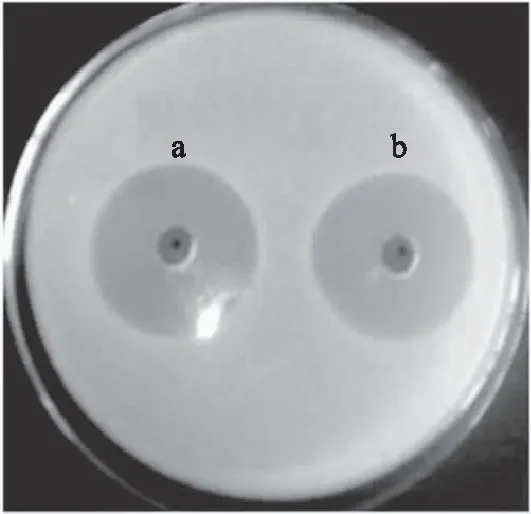
图6 除色素前后的样品液的抑菌性图片Fig.6 Antibacterial activity of solutions before and afterremoving of pigments
2.4 抗生素紫外可见扫描检测分析
抗生素溶液紫外可见扫描结果如图7所示,抗生素水溶液在254 nm有特征吸收峰,故高效液相色谱检测波长采用254 nm。
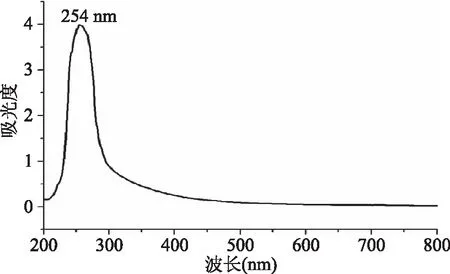
图7 抗生素的紫外可见吸收扫描光谱图Fig.7 Ultraviolet visible spectrum of antibiotic
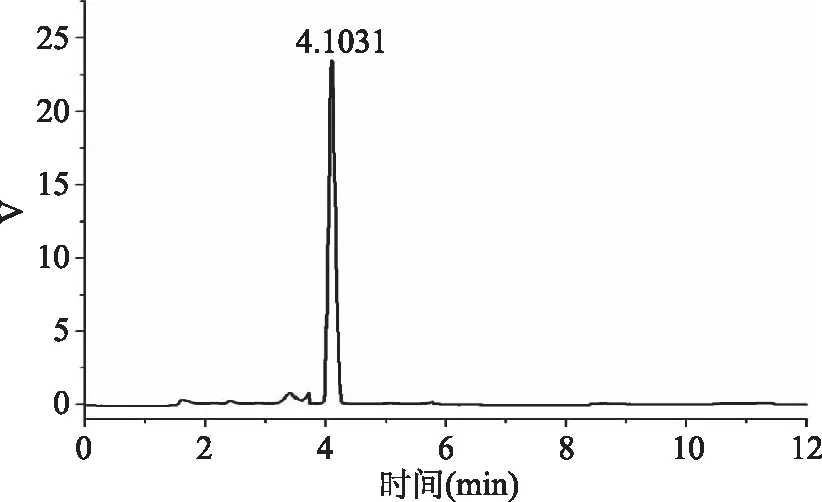
图8 抗生素的液相色谱图Fig.8 HPLC chromatogram of antibiotic
2.5 抗生素的高效液相色谱分析
高效液相色谱分析过程中根据该物质的极性来选择合适的流动相。通过多次调整流动相及其组成,最终确定乙腈:0.02 mol/L碳酸盐缓冲溶液(体积比为5∶95)的分离效果最佳。
如图8所示,在该色谱图4.1 min左右出现一个信号强烈的单峰,峰形较好,分离度高,表明该抑菌性物质在254 nm处信号较强,在反相C18色谱柱中保留时间较短说明该物质极性高。
2.6 双缩脲和茚三酮实验
如图9所示抗生素纯化液的双缩脲实验结果呈现阴性,表明该抗生素是非肽类物质。

图9 双缩脲实验结果Fig.9 The results of biuret tests注:a:样品液;b:低浓度酪蛋白溶液;c:高浓度酪蛋白溶液。
与双缩脲实验结果一致,茚三酮实验结果(图10)呈现阴性,表明该抗生素的结构中缺少-NH2和-COOH。
2.7 抗生素的质谱分析
图11是保留时间为4.1 min化合物的质谱图。在2.5确定的液相条件及正离子电离条件下,质谱图中出现两个主要的离子峰,m/z分别为150.9696和192.9791,根据质谱系统分析报告(表2)可得该抗生素的[M+H]+为163.0182,

表2 抗生素的质谱数据分析报告Table 2 Report of antibiotic mass spectra analysis

图10 茚三酮实验结果Fig.10 The results of ninhydrin tests注:a:抗生素样品液;b:头孢菌素C锌盐标准溶液。
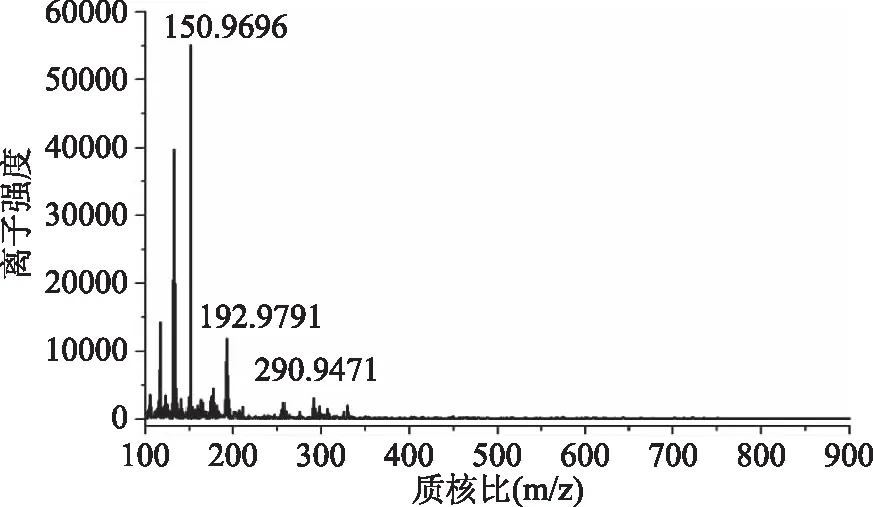
图11 抗生素的质谱分析Fig.11 Mass spectrum of antibiotic
说明该物质为小分子化合物。值得注意的是,实验过程中使用碳酸盐缓冲溶液不仅可以调节流动相的pH,并且使得分析检测灵敏度高、特异性强。
3 结论与讨论
真菌DT06发酵液对革兰氏阳性菌的抑制作用,为Simplicilliumlanosoniveum产生抗生素提供了可能。在本文中,我们得到该抗生素与菌体的关系为生长非偶联型,最适培养基为改良的沙氏培养基(蔗糖30.0 g/L和蛋白胨12.0 g/L),通过大孔树脂CT-12和95%乙醇对抗生素进行了分离,随后用酸化的离子交换树脂D301T除去淡黄色色素。紫外可见光谱分析表明该抗生素在254 nm处有强烈吸收峰。阴性双缩脲和茚三酮实验结果表明该抗生素中缺少-NH2和-COOH。较短的液相保留时间和质谱分析说明该抗生素的分子量较小(163.0182),极性较强。因此,初步研究分析和抑菌性实验结果表明,该抗生素是一个含有较多不饱和键的小型非肽类物质。
由于该抗生素的分子量、理化性质和生物活性的不同,因此我们认定该抗生素是一个新型抗生素,不同于Simplicillium属已经发现的生物活性代谢产物吡咯烷生物碱preussin B,苦参碱和Aogacillins A and B[12-13,21]。由于Simplicilliumlanosoniveum与蓝藻共生,它代谢产生的抗生素只对革兰氏阳性菌有抑制作用,而蓝藻属于革兰氏阴性菌,因此该抗生素可以保护蓝藻不受革兰氏阳性菌的侵害,并且有助于解释光能自养型和非自养型微生物在水生生态系统中的复杂关系。Zare等[3]曾提出Simplicilliumlanosoniveum与Cephalosporiumlanosoniveum同种异名,但是Cephalosporium属和Simplicillium属的分类仍存在争议,所以该抗生素的发现丰富了来自于S.lanosoniveum的天然活性产物,可为Simplicillium属的分类提供理论依据。
[1]Pandey A,Kumar S. Antibiotic activity of antimicrobial metabolites produced from soil microorganisms:an overview[J]. International Journal of Pharmaceutical Research & Allied Sciences,2015,4(4):28-32.
[2]Elander RP. Industrial production ofβ-lactam antibiotics[J]. Applied Microbiology and Biotechnology,2003,61(5-6):385-392.
[3]Zare R,Gams W. A revision ofVerticilliumsection Prostrata. IV. The generaLecanicilliumandSimplicilliumgen. nov[J]. Nova Hedwigia,2001,73(1/2):1-50.
[4]Chen RS,Huang CC,Li JC,et al. First report ofSimplicilliumlanosoniveumcausing brown spot onSalviniaauriculataandS.molestain Taiwan[J]. Plant Disease,2008,92(11):1589-1589.
[5]Baiswar P,Ngachan S,Rymbai H,et al.Simplicilliumlanosoniveum,a hyperparasite onAecidiumelaeagni-latifoliae in India[J]. Australasian Plant Disease Notes,2014,9(1):1-5.
[6]Ward N,Robertson C,Chanda A,et al. Effects of Simplicillium lanosoniveum onPhakopsorapachyrhizi,the soybean rust pathogen,and its use as a biological control agent[J]. Phytopathology,2012,102(8):749-760.
[7]Gauthier NW,Maruthachalam K,Subbarao KV,et al. Mycoparasitism ofPhakopsorapachyrhizi,the soybean rust pathogen,bySimplicilliumlanosoniveum[J]. Biological Control,2014,76:87-94.
[8]Shen XY,Zheng DQ,Gao J,et al. Isolation and evaluation of endophytic fungi with antimicrobial ability from Phyllostachys edulis[J]. Bangladesh Journal of Pharmacology,2012,7(4):249-257.
[9]Uchida R. Simplifungin,a new antifungal antibiotic produced bySimplicilliumminatenseFKI-4981,San Diego,January 11-14,2015[C]. Natural Product Discovery & Development in the Post Genomic Era. 2015.
[10]Liang X,Zhang XY,Nong XH,et al. Eight linear peptides from the deep-sea-derivedfungusSimplicilliumobclavatumEIODSF 020[J]. Tetrahedron,2016,72(22):3092-3097.
[11]Yan BF,Fang ST,Li WZ,et al. A new minor diketopiperazine from the sponge-derived fungusSimplicilliumsp. YZ-11[J]. Natural Product Research,2015,29(21):2013-2017.
[12]Fukuda T,Sudoh Y,Tsuchiya Y,et al. Isolation and biosynthesis of preussin B,a pyrrolidine alkaloid fromSimplicilliumlanosoniveum[J]. Journal of Natural Products,2014,77(4):813-817.
[13]余永涛,何生虎,赵清梅. 宁夏苦豆子中产苦参碱内生真菌的分离与鉴定[J]. 中国农业科学,2013,46(13):2643-2654.
[14]Dong QL,Lin TY,Xing XY,et al. Identification of a symbiotic fungus from blue-green alga and its extracellular polysaccharide[J]. Letters in Applied Microbiology,2014,58(4):303-310.
[15]董庆霖,陈博,邢向英,等. 一株蓝藻内生真菌的鉴定及其产物抑菌活性[J]. 化工学报,2011,62(6):1656-1661.
[16]邢向英,陈敬宇,董庆霖,等. 真菌Simplicilliumlanosoniveum胞外多糖合成条件的优化及其动力学分析[J]. 食品工业科技,2016,18(37):185-191.
[17]毛善巧,杨锋,黄永春. 基于高效液相色谱法分析水力空化对蔗糖的影响[J]. 食品工业科技,2017,38(1):189-192,199.
[18]董庆霖,管瑞静,邢向英,等. 一种抑菌性色素的分离表征及合成条件的优化[J]. 现代化工,2016,36(8):96-100.
[19]Yang QH,Zhao XX,Zhang J,et al. Components of a bioflocculant for treating tannery wastewater[J]. Journal of Residuals Science & Technology,2015,12(2):99-103.
[20]Chen CC,Yu YC,Lee HC,et al. Latent fingerprint development on thermal paper using traditional ninhydrin and 1,2-indanedione[J].Journal of Forensic Sciences,2016,61(1):219-225.
[21]Takata K,Iwatsuki M,Yamamoto T,et al. Aogacillins A and B produced bySimplicilliumsp. FKI-5985:new circumventors of arbekacin resistance in MRSA[J]. Organic Letters,2013,15(18):4678-4681.
Isolation,purification and preliminary characterization ofantibiotic fromSimplicilliumlanosoniveum
DONG Qing-lin,DONG Rong-zhen,XING Xiang-ying,MIAO Jia-xu,LI Yu-kuan
(School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin 300130,China)
The cyanobacterium-symbiotic fungusSimplicilliumlanosoniveumwas used as materials,and the objective of this study was to optimize the culture condition,purify and characterize a novel antibiotic which exhibitied antibacterial activity against the gram-positive bacteria fromSimplicilliumlanosoniveum.The suitable medium for this antibiotic production was the modified sabouraud medium containing sucrose 30 g/L and peptone 12 g/L and antibiotic production ofSimplicilliumlanosoniveumwas non-growth-associated. This antibiotic displayed a characteristic absorption peak at 254 nm.The molecular weight of this antibiotic was 163.0182 with a retention time of 4.1031 min when the mobile phase of this antibiotic was a 0.02 mol/L carbonate buffer(pH7.5)containing 5% acetonitrile.Biuret and ninhydrin tests of this antibiotic were negative.The founding of this antibiotic provide the feasibility for the classification ofSimplicilliumlanosoniveum.
antibiotic;Simplicilliumlanosoniveum;purification;characterization
2017-02-14
董庆霖(1964-),男,博士,教授,研究方向:代谢工程,E-mail:qldong@hebut.edu.cn。
河北省自然科学基金项目(B2008000029)。
TS201.3
A
1002-0306(2017)13-0119-06
10.13386/j.issn1002-0306.2017.13.022
