产顺式-4-羟脯氨酸枯草芽孢杆菌工程菌的构建及发酵优化
2017-07-31张博文陈可泉曹伟佳
张博文,陈可泉,曹伟佳,王 昕
(南京工业大学生物与制药工程学院,江苏南京 211816)
产顺式-4-羟脯氨酸枯草芽孢杆菌工程菌的构建及发酵优化
张博文,陈可泉,曹伟佳,王 昕*
(南京工业大学生物与制药工程学院,江苏南京 211816)
顺式-4-羟脯氨酸(CHOP)是一种重要的手性结构物质,可广泛用于药物以及香料制造。本研究为开发CHOP的生物合成方法,将来源于中华根瘤菌(Sinorhizobiummeliloti)的L-脯氨酸-4-羟化酶在枯草芽孢杆菌WB800N中实现了成功表达,构建获得了能够以L-脯氨酸为底物合成CHOP的工程菌株,进而对该菌株的发酵条件以及发酵组分进行了优化研究。结果表明:工程菌株的最适发酵温度为25 ℃,最适诱导剂浓度为1 mmol/L,最适发酵pH为5;在发酵体系中加入5 mmol/L硫酸亚铁和2.5 g/L L-脯氨酸时最有利于合成CHOP。在最优发酵体系下发酵60 h后,顺式-4-羟脯氨酸的产量可以达到120.2 mg/L。本文成功的构建了羟脯氨酸生产菌株枯草杆菌WB800 pHT-P4H,而研究结果为枯草杆菌工程菌发酵生产顺式-4-羟铺氨酸提供了基础。
L-脯氨酸顺式-4-羟化酶,枯草杆菌WB800N,发酵,顺式-4-羟脯氨酸
L-羟脯氨酸(L-hydroxyproline)不属于20种常见的氨基酸,作为胶原蛋白的主要组成成分,羟脯氨酸广泛应用于医药、化工、动物饲料和美容业等方面[1]。在医药方面,羟脯氨酸作为原料可用于合成消炎药、碳青霉烯类抗生素等药物。在化工方面,羟脯氨酸可作为手性原料合成多种聚合物[2]。顺式-4-羟脯氨酸(CHOP)是羟脯氨酸四种立体异构体中的一种,该物质作为一种重要的手性结构物质,可以用于药物以及香料制造,具有很高的药用价值,用于治疗各种癌症[3]。另外,羟脯氨酸具有独特的风味,苦中带着甜味,能改善果汁饮料风味,而且还具有皮肤修复功能[2],常作为饮料添加剂。
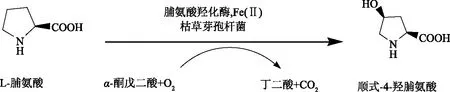
图1 顺式-4-羟脯氨酸生物合成的路线图Fig.1 Scheme of the biochemical reaction involved in cis-4-hydroproline production
目前,顺式-4-羟脯氨酸的生产主要以酸水解胶原蛋白得到反式-4-羟脯氨酸为原料,通过化学法差向异构合成[4-5]。但该方法存在工艺繁琐、污染严重、生产成本高,产量较低和分离纯化困难等缺点[6]。近几年,随着生物技术的迅猛发展,人类改造微生物作为细胞工厂进行生物制造的能力显著提高[7],生物合成以其操作简便、反应条件温和、副产物少、无环境污染、成本低等多种优点受到人们的广泛关注[8]。因此开发顺式-4-羟脯氨酸的生物合成法具有重要意义。
2009年,Kino课题组首次在百脉根中慢生根瘤菌以及苜蓿中华根瘤菌发现了L-脯氨酸顺式-4-羟化酶(P4H)[9],该酶以L-脯氨酸、α-酮戊二酸为底物生成丁二酸和顺式-4-羟脯氨酸[7](图1)。研究发现P4H具有较高的立体选择性[10],可有效生成顺式-4-羟脯氨酸,不需要化学差向异构[6]。P4H 属于α-酮戊二酸依赖型的双加氧酶家族,酶催化反应需要非血红素亚铁离子以及O2的参与[8]。现有研究中主要以大肠杆菌为宿主细胞,通过构建表达P4H的工程大肠杆菌,进而通过全细胞催化方法或发酵法合成顺式-4-羟脯氨酸[8]。如Francesco等人在大肠杆菌E.coliBL21(DE3)(pLysS)过表达P4H羟化酶基因,发酵生产了89.33 mg/L顺式-4-羟脯氨酸[11]。赵利维等人构建过表达P4H的工程大肠杆菌,全细胞转化60 h后,L-脯氨酸的转化率达到83.33%[12]。
枯草芽孢杆菌(Bacillussubtilis)同样是当今工业酶的主要生产菌种之一,由于其营养需求简单、产酶量高、种类多、安全性好等优点,在现代工农业生产领域广泛应用[13]。本研究选源于中华根瘤菌的L-脯氨酸顺式-4-羟化酶P4H作为生产酶,优化基因序列后将该基因首次在枯草芽孢杆菌中表达,得到工程菌株。进而通过优化发酵培养基和发酵条件,确定了发酵培养基的最佳培养基组成和浓度以及发酵条件,为以后的工业化生产提供了初步探索。
1 材料与方法
1.1 材料与仪器
菌株及质粒 本实验使用发酵菌株为枯草芽孢杆菌WB800N,本实验室提供;大肠杆菌TransT1 全式金生物技术有限公司,用于质粒构建和克隆;克隆表达载体为pHT-01 本实验室提供;限制性内切酶EcoR I、BamH I、HindIII、XbaI以及DNA Marker、T4连接酶 Takara公司;DNA胶回收试剂盒和质粒销量抽提试剂盒 北京全式金生物技术公司;顺式-4-羟脯氨酸标准品 色谱级,Sigma;L-脯氨酸 食品级,郑州天顺食品添加剂有限公司;其它常用试剂 分析纯,国药集团化学试剂有限公司;三氟丁酸及七氟乙酸 色谱级,阿拉丁试剂上海有限公司;酵母粉和蛋白胨 OXOID公司;氯霉素 上海生工生物工程有限公司。
M9液体培养基 葡萄糖10 g/L,NH4Cl 10 g/L,NaCl 0.5 g/L,Na2HPO4·12H2O 17.1 g/L,KH2PO43 g/L,MgSO40.12 g/L,CaCl21.1×10-2g/L,(NH4)6Mo7O243.71×10-3g/L,H3BO32.47×10-2g/L,CoCl2·6H2O 7.14×10-3g/L,CuSO4·5H2O 2.51×10-3g/L,MnCl2·4H2O 1.60×10-2g/L,ZnSO4·7H2O 2.8×10-3g/L;LB液体培养基 蛋白胨10 g/L,酵母粉5 g/L,氯化钠5 g/L,12l ℃高压蒸汽灭菌15 min;使用前加入合适浓度的抗生素;LB固体培养基 蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠5 g/L,琼脂糖25 g/L,121 ℃,15 min高压蒸汽保温灭菌;使用前加入合适浓度的抗生素。
SW-CJ-1FD生物净化工作台 苏州净化设备有限公司;BS124S电子天平 Sartourius公司;Eporator电转化仪 Eppendorf;HVE-85高压蒸汽锅 HIRAYAMA公司;H2050R-1离心机 湘仪离心机有限公司;THZ-D台式恒温振荡器 太仓市实验设备厂;721B1210792凝胶成像仪 BIO-RAD;GO-1510全波长酶标仪 Thermo;ALLtech Series1500 ELSD2000液相 Alltech。
1.2 实验方法
1.2.1 菌株构建 根据已公布的苜蓿中华根瘤菌中的P4H 基因序列(NCBI Gene ID:14808181)以枯草芽孢杆菌为宿主进行密码子优化,并由Genscript(金唯智)公司进行基因合成。将合成的基因(见下文)两端加入BamH I和Xba I酶切位点,酶切连接至载体pHT-01中,转化连接后的连接液进入全式金公司大肠杆菌Trans-T1中,并在含有氯霉素(Cm)的LB固体培养基上进行筛选,取单菌落进行菌落PCR验证后,验证并得到质粒pHT-P4H,随后将pHT-01-P4H电转化进WB800N菌种中[14],并在含有氯霉素(Cm)的LB固体培养基上进行筛选,菌落测序验证正确后,得到工程菌株WB800N-P4H。同时将空质粒pHT-01转入菌株WB800N中,得到的菌株作为对照菌株。
脯氨酸羟化酶的基因序列:


GGATCC为BamH I的酶切位点,TCTAGA为XbaI的酶切位点。
1.2.2 菌株培养 种子培养:将10 μL的工程菌WB800N-P4H甘油冻存菌接种于含有5 mL的LB液体培养基的50 mL摇管中,加入终浓度为25 mg/L的Cm抗生素。置于37 ℃摇床中,200 r/min过夜培养;
发酵培养:将1 mL上述种子液接种于含有50 mL M9液体培养基的500 mL摇瓶中,加入36.7 μL的34 g/L Cm抗生素使其浓度为25 mg/L,37 ℃,200 r/min条件下进行培养,当OD600值达到0.3~0.6时加入异丙基-β-D-硫代半乳糖苷(IPTG),使其终浓度为1 mmol/L,于30 ℃发酵36 h。
1.2.3 发酵培养条件优化
1.2.3.1 发酵温度的影响 初始发酵温度37 ℃,细胞OD600生长到0.3~0.5时加入IPTG,使其终浓度达到1 mmol/L,将细胞分别在20、25、28、30、34 ℃下培养36 h。
1.2.3.2 IPTG的影响 细胞OD600生长到0.3~0.5时加入IPTG,使其终浓度分别为0.50、0.75、1.00、2.00 mmol/L,之后在25 ℃条件下培养36 h。
1.2.3.3 pH的优化 通过调节磷酸氢二钠和磷酸二氢钾的配比配制不同pH(4、5、6、7、8)的缓冲液,磷酸盐终浓度为100 mmol/L,细胞量生长到0.3~0.5 g/L时加入终浓度为1 mmol/L IPTG,25 ℃条件下培养36 h。
1.2.4 发酵组分优化
1.2.4.1 铁离子类型的影响 细胞OD600生长到0.3~0.5时加入IPTG,使其终浓度达到1 mmol/L,之后分别加入硫酸亚铁(FeSO4)、三氯化铁(FeCl3)使得加入铁离子终浓度为5 mmol/L,25 ℃条件下培养36 h。
1.2.4.2 铁离子浓度的优化 细胞OD600生长到0.3~0.5时加入IPTG,使其终浓度达到1 mmol/L,同时分别加入不同浓度的硫酸亚铁使加入铁离子终浓度分别为1.25、2.5、5、7.5、10 mmol/L,25 ℃条件下培养36 h。
1.2.4.3 底物浓度对顺式-4-羟脯氨酸产量的影响 细胞OD600生长到0.3~0.5时加入IPTG使其终浓度达到1 mmol/L,同时向培养基中加入不同浓度的脯氨酸使其终浓度分别为1、2.5、5、10、20 g/L,并加入终浓度为5 mmol/L的硫酸亚铁,25 ℃条件下培养36 h。
1.2.5 最优底物浓度及最优发酵条件下顺式-4-羟脯氨酸的生产 在M9培养基中接种1 mL种子液,在pH为5 的条件下培养,当细胞OD600值达到0.3~0.5 时,加入2.5 g/L脯氨酸,加入终浓度为1 mmol/L的IPTG,并加入终浓度为5 mmol/L的硫酸亚铁,在25 ℃条件下进行发酵。
1.2.6 分析方法 顺式-4-羟脯氨酸和L-脯氨酸的测定采用液相色谱法(ALTECH ELSD 2000)进行。色谱柱为C18分析柱(5 μm,250 mm×4.6 mm,GRACE),流动相为0.7%的三氟乙酸和0.0653%七氟丁酸,流速 1 mL/min,进样体积10 μL,柱温28.5 ℃,所使用的蒸发光测器检测漂移管温度为115 ℃,气体流速为3.2 L/min。
制作标准曲线:取15~500 mg/L的标准羟脯氨酸样品,然后分别进样10 μL。通过液相测定相应峰高峰面积,制作出的标曲线性相关系数达到0.998以上,该方法重复率较高,稳定性好。
样品测定:样品羟脯氨酸,当样品含量高时,可用蒸馏水稀释至标曲氨基酸标曲范围内。当样品浓度高于15 mg/L且低于500 mg/L时样品浓度检测线性较好。不同的蒸发光检测器灵敏度不同,对于检测值也有一定的影响。
1.3 数据统计分析
每个实验都至少进行三次平行实验。运用Excel 2007对实验数据进行统计分析,比较实验数据中的标准误差,采用Excel 2007做图。
2 结果与讨论
2.1 产顺式-4-羟脯氨酸枯草芽孢杆菌工程菌的构建和验证
为构建获得生产顺式-4-羟脯氨酸的工程枯草芽孢杆菌,本研究将来源于中华根瘤菌的编码L-脯氨酸顺式-4-羟化酶基因的序列进行密码子优化,酶切连接到枯草芽孢杆菌胞内表达质粒pHT01中得到质粒pHT01-P4H(图2A),转化枯草芽孢杆菌WB800N获得工程菌株WB800N-P4H。经菌落PCR验证后发现质粒已成功转入枯草芽孢杆菌中(图2B)。为了验证该菌株中的重组羟化酶是否具有活性,对工程菌株进行发酵培养,如图2C所示,对照菌株没有产物生成,而工程菌株WB800N-P4H可以生产19.28 mg/L的CHOP,表明了L-脯氨酸顺式-4-羟化酶能够在枯草芽孢杆菌中获得表达,所构建的工程菌株可用于后续CHOP的生产。
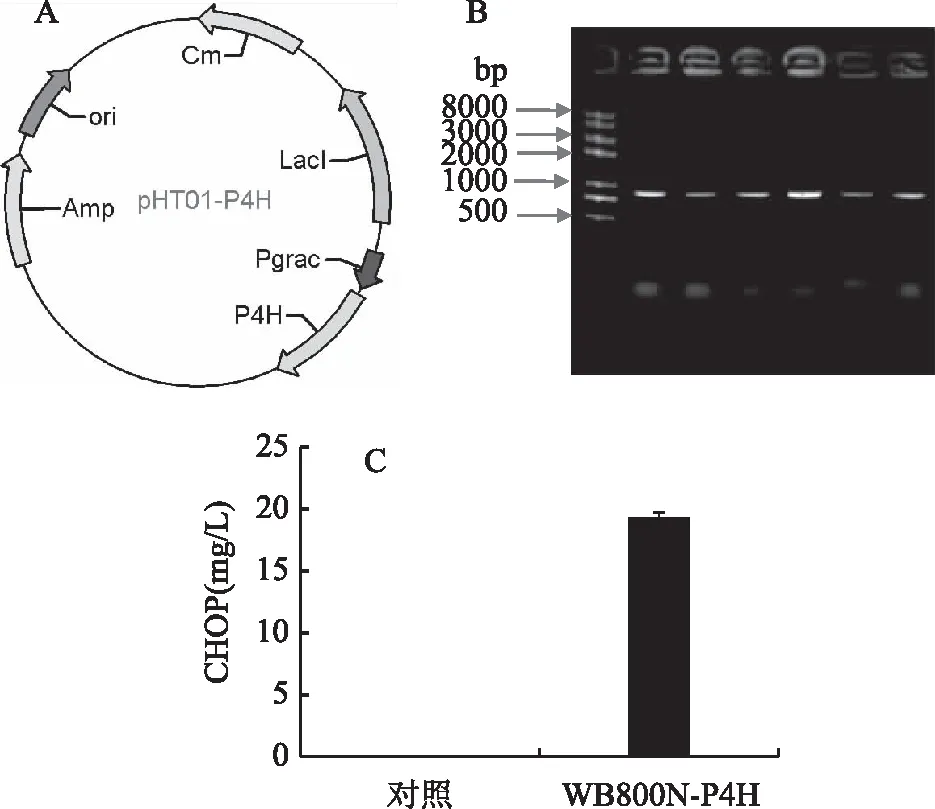
图2 产顺式-4-羟脯氨酸枯草芽孢杆菌 工程菌的构建和验证Fig.2 The construction and identification of engineered Bacillus subtilis producing CHOP注:(A)质粒pHT01-P4H的图谱; (B)WB800N-P4H菌落PCR验证图谱; (C)重组枯草芽孢杆菌WB800N-P4H的活性检测。
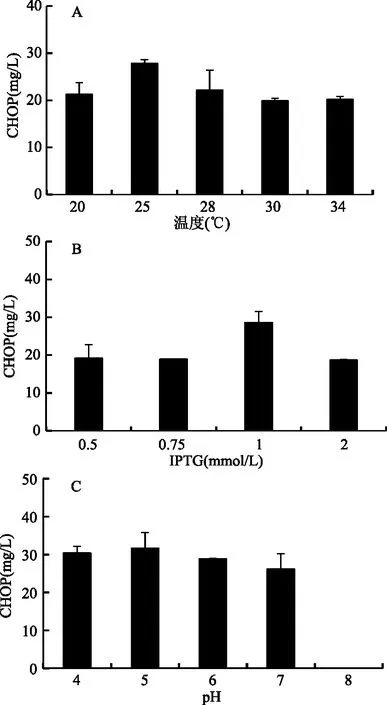
图3 发酵条件对工程菌株WB800N-P4H生产CHOP的影响Fig.3 The effect of fermentation conditions on the CHOP production by the recombinant strain WB800N-P4H注:(A)温度对工程菌株生产CHOP的影响; (B)诱导剂IPTG添加对工程菌株生产CHOP的影响; (C)发酵pH对工程菌株生产CHOP的影响。
2.2 顺式-4-羟脯氨酸的发酵条件的优化
发酵的培养条件作为发酵过程的重要因素之一,影响着菌株的生长代谢,从而调节微生物的生长和代谢产物的合成[15]。因此优化工程菌株的发酵条件,选择最优的培养环境,对于提高工程菌株WB800N-P4H的顺式-4-羟脯氨酸产量具有重要作用。
2.2.1 温度对工程菌株WB800N-P4H合成顺式-4-羟脯氨酸的影响 各种微生物都有其最适宜的生长温度,发酵本身就是微生物生长代谢及物质转化的过程,因此温度控制是发酵过程的关键[16]。本文研究了不同培养温度对菌体生产顺式-4-羟脯氨酸的影响[17]。如图3A所示,当温度为25 ℃时,CHOP的产量达到了最大值,随着温度的进一步提高,CHOP的产量有所下降。温度不仅影响重组基因的表达和蛋白质的折叠[11],也影响菌株本身的代谢途径。因此从图中可以看出,当工程菌株在25 ℃条件下进行发酵培养时,最有利于CHOP的生成。
2.2.2 IPTG浓度对工程菌株生产顺式-4-羟脯氨酸的影响 诱导剂IPTG的浓度对目标基因的表达水平具有显著的影响作用[18]。为了研究IPTG浓度对发酵合成顺式-4-羟脯氨酸的影响。如图3B所示,随着IPTG浓度有所增加,CHOP的生成量有所增加。IPTG浓度达到1 mmol/L时,CHOP的产量达到最高值,随着IPTG浓度的继续提高,CHOP的产量有所下降。这可能是由于IPTG浓度过高时,将会作为毒性物质,影响细胞的繁殖和生长[19]。上述结果表明,工程菌株发酵生产CHOP的最适IPTG浓度为1 mmol/L。
2.2.3 pH对工程菌株生产顺式-4-羟脯氨酸的影响 为了研究发酵pH对顺式-4-羟脯氨酸合成的影响,将培养基的pH分别调节在4~8。如图3C所示,随着发酵液中pH的增加到5时,CHOP产量达到最大值,随着发酵液pH的进一步提高,CHOP的产量开始下降,在pH为8时,在发酵液中无法检测到CHOP的生成。这些结果表明工程菌株发酵生产CHOP的最适pH为5,在偏碱性的条件下工程菌株的CHOP生产能力受到显著抑制。
2.3 顺式-4-羟脯氨酸发酵培养基组分的优化
在工业化生产中,发酵培养基组分很大程度上影响着目标产品的产量。培养基组分的优化有利于降低大规模工业化生产的成本[20]。本研究通过优化CHOP发酵生产过程中的培养基组分,探索影响CHOP发酵生产的关键因素等,以提高发酵水平,为CHOP的工业化生产奠定基础。
2.3.1 铁离子对菌体合成顺式-4-羟脯氨酸的影响 研究表明,L-脯氨酸顺式-4-羟化酶属于α-酮戊二酸双加氧酶家族,二价铁离子能够促进该酶所催化的羟化反应效率[21]。为了研究不同铁离子对工程菌株发酵生产CHOP的影响,在发酵培养基中加入不同种类的5 mmol/L的铁离子。如图4所示,加入硫酸亚铁时,顺式-4-羟脯氨酸产量最高,是对照的1.25倍。加入三氯化铁时,顺式-4-羟脯氨酸和对照相比并没有提高,说明在工程菌株发酵过程中加入硫酸亚铁能促进CHOP生产。
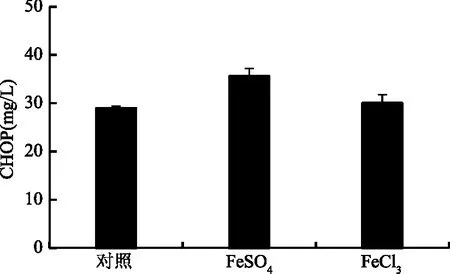
图4 不同铁离子添加对工程菌发酵生产CHOP的影响Fig.4 The effect of different iron ions on CHOP production
2.3.2 二价铁离子浓度对菌体合成顺式-4-羟脯氨酸的影响 不同的二价铁离子浓度对目标产物的生产有着不同的影响[22]。因此,通过在培养基中添加不同浓度的二价铁离子来研究铁离子浓度对CHOP生产的影响。结果如图5所示,随着Fe2+浓度的增加,CHOP的产量也不断地增加,当添加5 mmol/L的铁离子,CHOP的产量达到了最大值。继续增加Fe2+浓度,随着Fe2+浓度的提高,CHOP的产量随着Fe2+的增加而减少。
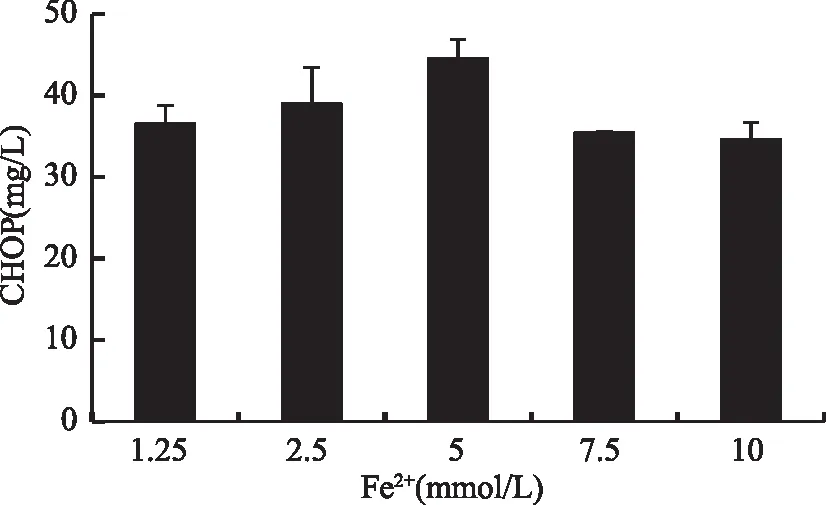
图5 二价铁离子浓度对工程菌发酵生产CHOP的影响Fig.5 The effect of Fe2+ concentration on the CHOP production
2.3.3 底物浓度对工程菌株生产顺式-4-羟脯氨酸的影响 发酵初始时不同的底物浓度对于CHOP的生产有着不同的影响[22]。为了研究底物浓度对工程菌株发酵生产CHOP的影响,在不同的底物浓度下将工程菌株发酵36 h,检测CHOP的生成。结果如图6所示,随着底物浓度的增加,CHOP的产量也有所提高。当添加2.5 g/L的脯氨酸时,CHOP的产量达到最高为103.3 mg/L。当继续增加底物浓度时,羟脯氨酸产量有所下降。这可能是由于过高的底物浓度抑制了CHOP的生产,该反应存在底物抑制现象[23]。所以底物浓度为2.5 g/L,最有利于羟脯氨酸的生成,并且后期可以通过分批补料的方式提高CHOP的生成。
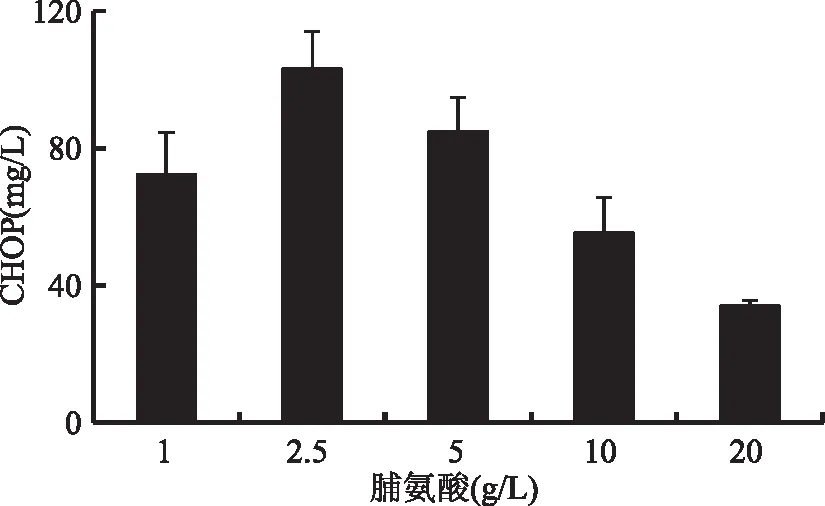
图6 底物浓度对工程菌发酵生产CHOP的影响Fig.6 Effect of substrate concentration on CHOP production
2.4 最优培养基组分和最优发酵条件下的发酵结果
根据上述研究,我们确定了工程菌株WB800N-P4H发酵生产CHOP的最优反应条件以及培养基组分浓度。因此我们将菌株WB800-P4H在最优条件下进行发酵,每隔12 h取样观察CHOP的产量。结果如图7所示,同未优化的发酵条件相比,CHOP的产量明显提高。同时在最优发酵条件下,随着发酵时间的增加,CHOP的产量也不断地增加,当发酵时间为60 h时,CHOP的产量达到了最大值。当发酵60 h后CHOP的产量并没有提高反而有所下降,这表明枯草芽孢杆菌WB800N中可能存在CHOP的降解途径,使得发酵后期菌体开始降解产物CHOP。所以枯草发酵合成羟脯氨酸最适时间为60 h,羟脯氨酸产量达120.2 mg/L,相比对照提高了约6.3倍。在后续的研究工作中,如果能够解析细胞中的CHOP降解途径,并进一步对该途径进行敲除,则有利于提高脯氨酸生成CHOP的转化率。
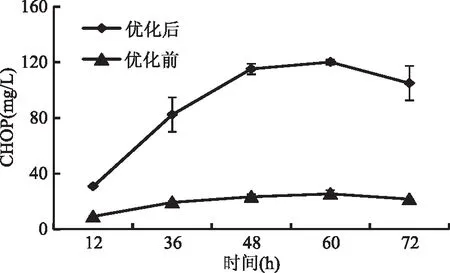
图7 在优化条件下工程菌WB800N-P4H 发酵生产CHOP的特性Fig.7 The CHOP production by the recombinant strain WB800N-P4H in the optimized fermentation conditions
3 结论
生物法生产顺式-4-羟脯氨酸不仅大大降低了生产成本,也对于生产顺式-4-羟脯氨酸具有重要意义。本研究从苜蓿中华根瘤菌中获取L-脯氨酸顺式-4-羟化酶基因,首次成功在枯草杆菌WB800N中表达,并发酵合成顺式-4-羟脯氨酸。本实验通过单因素优化实验,得到生产顺式-4-羟脯氨酸的最佳发酵条件:其中Fe2+的添加对于羟脯氨酸生产有促进作用,Fe2+浓度为5 mmol/L,发酵温度为25 ℃,发酵pH为5,IPTG浓度为1 mmol/L,脯氨酸底物浓度为2.5 g/L。经过优化后,发酵60 h时,CHOP的产量达到120.2 mg/L。然而枯草杆菌发酵生产羟脯氨酸还有待提高,可能和枯草杆菌本身的代谢途径及枯草杆菌对于脯氨酸及羟脯氨酸的转运也有一定的关系。在后续研究中计划尝试改变枯草杆菌的代谢途径以进一步提高底物脯氨酸转化率,为CHOP的工业化生产奠定基础。
[1]张自强,赵东旭,杨新林. 羟脯氨酸的研究与开发[J]. 氨基酸和生物资源,2006,28(1):55-58.
[2]刘合栋,袁春伟,张震宇.高产反式-4-羟脯氨酸重组大肠杆菌的构建以及发酵条件优化[EB/OL].[2013-01-23]
[3]Hara R,Kino K. Characterization of novel 2-oxoglutarate dependent dioxygenases converting L-proline to cis-4-hydroxy-L-proline[J]. Biochemical & Biophysical Research Communications,2009,379:882-886.
[4]Theodosiou E,Frick O,Bühler B,et al. Metabolic network capacity of Escherichia coli,10for Krebs cycle-dependent proline hydroxylation[J]. Microbial Cell Factories,2014,14(1):1-12.
[5]Klein C,Hüttel W. A Simple Procedure for Selective Hydroxylation of L-Proline and L-Pipecolic Acid with Recombinantly Expressed Proline Hydroxylases[J]. Advanced Synthesis & Catalysis,2011,353(8):1375-1383.
[6]王付才,张震宇,孙付保,等. 1株产顺式-4-羟基-L-脯氨酸基因工程菌的构建及发酵初步优化[J]. 食品与发酵工业,2016,42(2):7-12.
[7]李寅,曹竹安. 微生物代谢工程:绘制细胞工厂的蓝图[J].化工学报,2004,55(10):1573-1580.
[8]刘伟伟. 高产乳链菌肽菌种选育及发酵培养基优化[D]. 天津:天津大学,2010.
[9]姚雪娜. 产顺式-3-羟脯氨酸重组大肠杆菌的构建及发酵优化[D]. 无锡:江南大学,2015.
[10]Smith J A,Savage G P,Hutt O E. Studies on the Synthesis of cis-4-Hydroxy-L-proline[J]. Australian Journal of Chemistry,2011,64(11):1509-1514.
[11]Falcioni F,Blank L M,Frick O,et al. Proline availability regulates proline-4-hydroxylase synthesis and substrate uptake in proline-hydroxylating recombinant Escherichia coli.[J]. Applied & Environmental Microbiology,2013,79(9):3091-3100.
[12]赵利维,燕瑾,韩蕊,等. 产顺式-4-L-羟脯氨酸工程菌的构建及转化条件的优化[J]. 微生物学通报,2016(9):1887-1894.
[13]张芙华. 重组枯草芽孢杆菌生产角质酶发酵条件优化[D]. 无锡:江南大学,2008.
[14]王晶. 枯草芽孢杆菌表达检测载体的构建与生物素合成酶(BioB)的表达检测[D]. 杨凌:西北农林科技大学,2008.
[15]周海岩. L-苯丙氨酸生产菌株的构建、代谢调控和发酵条件优化[D]. 无锡:江南大学,2011.
[16]刘中利. 白酒酿造发酵中基于智能策略的温度优化控制[J]. 重庆理工大学学报:自然科学版,2014(7):92-96.
[17]李恬. 蔗糖为底物双酶法合成直链糊精的研究[D]. 无锡:江南大学,2013.
[18]宋建民. 乳酸片球菌素的表达纯化与高密度发酵研究[D]. 上海:华东理工大学,2011.
[19]王水兴,李燕萍,许杨,等. 基因工程菌E.coli BL21/pET-DsbA-MalQ发酵产麦芽糖转糖基酶的研究[J]. 食品科学,2007,28(8):285-289.
[20]曹丹玥. 微生物谷氨酰胺转胺酶发酵培养基的优化[D]. 上海:华东师范大学,2006.
[21]张迎君,曾顺德,眭顺照,等. 柑桔皮发酵生产柠檬酸[C]. 中国海峡两岸菌物学学术研讨会,2004:96-99.
[22]袁林,左瑞雨,王朋朋,等. 乳酸菌富铁的研究[J]. 中国兽医学报,2011,31(2):241-244.
[23]赵红英,张健,刘宏娟,等. 1,3-丙二醇发酵过程中底物抑制及其对策的研究[J]. 现代化工,2002,22(7):34-38.
Construction and optimization of fermentation ofBacillussubtiliscis-4-hydroxyproline engineering bacteria
ZHANG Bo-wen,CHEN Ke-quan,CAO Wei-jia,WANG Xin*
(Biotechnology and Pharmaceutical Engineering of Nanjing Tech University,Nanjing 211816,China)
Cis-4-hydroxyproline(CHOP)is an important chiral structure material,which can be widely used in pharmaceuticals and perfume manufacturing. In this study,in order to develop the new way to produce the cis-4-hydroxyproline by biological method,L-proline-4-hydroxylase gene derived fromSinorhizobiummelilotiwas first successfully expressed inBacillussubtilisWB800N,which converts L-proline to cis-4-hydroxyproline. The fermentation conditions and fermentation components of the strain were optimized. The results showed that adding 5 mmol/L sulfuric acid ferrous inBacillussubtilisfermentation were favourable for the formation of cis-4-hydroxyproline. The optimum fermentation temperature of cis-4-hydroxyproline was 25 ℃. The optimum concentration of inducing agent and pH were 1 mmol/L and 5,respectively. After induction,the optimum substrate L-proline concentration was 2.5 g/L. After 60 h ofBacillussubtilisferment cis-4-hydroxyproline,cis-4-hydroxyproline concentration of 120.2 mg/L was achieved. This study construct a strain ofBacillussubtilisWB800N pHT-P4H to produce CHOP,and microbial fermentation byBacillussubtilisWB800N is a potential approach for cis-4-hydroxy-L-proline production by fermentation.
L-proline-4-hydroxylase;BacillussubtilisWB800N;fermentation;cis-4-hydroxyproline
2016-12-08
张博文(1992-),男,硕士在读,研究方向:系统代谢工程及酶催化,E-mail:1113071788@qq.com。
*通讯作者:王昕(1988),女,博士,中级,研究方向:系统代谢工程及酶催化,E-mail:xinwang1988@njtech.edu.cn。
国家自然科学基金(21576134)。
TS
A
1002-0306(2017)13-0101-06
10.13386/j.issn1002-0306.2017.13.019
