食用合成色素胭脂红对胰蛋白酶光谱性质的影响
2017-07-31张东霞
张东霞
(西京学院 应用统计与理学系,陕西西安 710123)
食用合成色素胭脂红对胰蛋白酶光谱性质的影响
张东霞
(西京学院 应用统计与理学系,陕西西安 710123)
应用荧光光谱法、紫外可见吸收光谱法、傅立叶变换红外光谱和圆二色光谱法,研究了食用合成色素胭脂红与胰蛋白酶的结合性质,明确胭脂红与胰蛋白酶之间的结合常数、结合位点数(n)、作用力类型、结合距离(r)等信息。结果表明,胭脂红对胰蛋白酶内源荧光强度有较强的猝灭能力,荧光猝灭机制属于形成复合物的静态猝灭,由实验计算得出的热力学参数熵变和焓变均为负值,表明氢键和范德华力是驱动胭脂红-胰蛋白酶复合物形成的主要作用力,胭脂红与胰蛋白酶的结合常数达到104mol/L数量级,存在中等强度的亲和力。光谱分析表明胭脂红与胰蛋白酶结合引起胰蛋白酶的氨基酸残基微环境发生改变,胰蛋白酶的二级结构α-螺旋和无规则卷曲含量增加,β-折叠和β-转角的含量降低,多肽链有所收缩。
胭脂红,胰蛋白酶,荧光猝灭,结合性质
在食品生产中,为了改善食品的品质、外观而加入着色剂、护色剂等物质。为了全面了解着色剂对生物体的作用和反应机理,开展着色剂分子与蛋白质结合的研究就非常有必要。
胭脂红(Ponceau 4R),又名丽春红4R,结构见图1,是一种常见的人工合成着色剂,在食品、药品、化妆品等领域都有广泛的应用,然而,如果过量食用,会诱发中毒,损害人体健康,也会对环境造成一定的污染[1]。有研究表明,胭脂红不经过还原而直接被氧化,氧化产物可造成DNA损伤[2]。
胰蛋白酶(trypsin),是人和动物肠道中一种重要的消化酶。在食品、纺织、化妆品、医疗等中有广泛应用[3],临床上主要用于抗炎症和消化类药物的制备。当小分子进入人体胃肠道,消化蛋白酶可能会成为小分子间接的结合靶标。胭脂红被摄入后,将不可避免的与其内体的消化酶发生作用,目前,已有相关文献研究了胭脂红与大分子的相互作用,刘志栋等[4]采用紫外-可见光吸收光谱法、荧光发射光谱法研究了 BSA 与柠檬黄、日落黄、胭脂红之间的相互作用机理,马明明等[5]采用荧光发射光谱研究了牛血清白蛋白与胭脂红的相互作用,但关于胭脂红进入胃肠道,对胃肠道消化酶结构及生物功能影响的测定研究很少,因此,本文在模拟人体生理酸度下(pH7.4),以胰蛋白酶为蛋白模型,联合应用荧光光谱法、紫外-可见吸收光谱法、圆二色光谱法及红外光谱法,研究了食用着色剂胭脂红在不同浓度、不同温度对胰蛋白酶光谱性质的影响,本文在生理pH条件下研究胭脂红与胰蛋白酶的相互作用,有助于深入了解胭脂红在体内的转运、代谢过程及其对胰蛋白酶结构和功能性质的影响,为进一步研究人工合成食品添加剂潜在的毒性建立理论基础。为从分子水平上理解胭脂红与胰蛋白酶相互作用机制提供了非常有价值的信息,对于开发更安全的食用着色剂有重要价值。
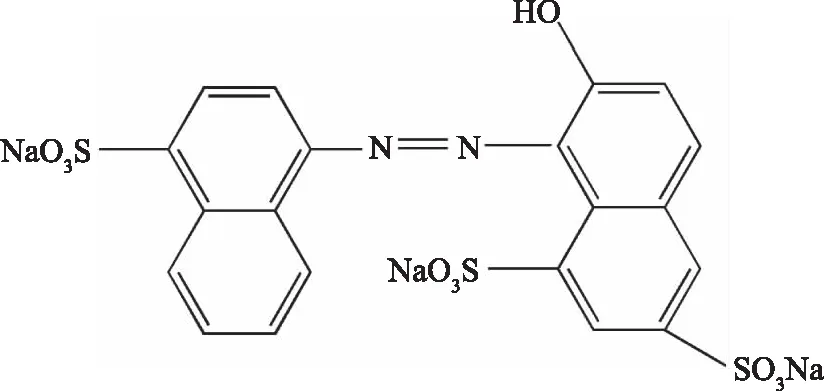
图1 胭脂红的结构式Fig.1 Molecular structure of ponceau 4R
1 材料与方法
1.1 材料与仪器
UV-2550型紫外-可见分光光度计 日本SHIMADZU公司;F-4500型荧光光度计 日本Hitachi公司;J-810型圆二色谱仪 日本JASCO公司;Nicolet 380傅里叶红外光谱仪 美国Thermo Fisher Scientific公司;pH211型精密pH计 意大利HANNA公司;胭脂红[1-(4-磺酸-1-萘偶氮)-2-羟基-6,8-萘二磺酸三钠盐],纯度≥85%,标准溶液浓度为2.0×10-3mol/L(用超纯水配制)、胰蛋白酶 Aladdin Chemistry公司:用pH7.4的标准Tris-HCl缓冲溶液(0.10 mol/L Tris,0.10 mol/L HCl和0. 1 mol/L的NaCl)配制成浓度为1.0×10-4mol/L的储备液,使用前稀释到最佳浓度;N-苯甲酰-L-精氨酸乙酯盐酸盐(BAEE)标准品 阿拉丁试剂公司,用上述缓冲溶液配制成浓度为5.0×10-3mol/L的贮备液;保存于4 ℃冰箱中备用;实验用水为二次蒸馏水,其他试剂均为分析纯。
1.2 实验方法
1.2.1 荧光光谱测定 在荧光测量皿中加入3 mL 2.0×10-6mol/L的胰蛋白酶工作液,先扫描其荧光光谱,随后再逐次加入相同体积浓度为2.0×10-4mol/L的胭脂红溶液,混合均匀并静置3 min,测量(292,298,304 K)三个温度下,290~500 nm范围内的荧光发射光谱(激发波长为280 nm)。随后取波长差Δλ=15 nm和60 nm进行同步荧光扫描,荧光激发和发射狭缝均设置为2.5 nm。
1.2.2 紫外-可见吸收光谱测定 室温条件下,在石英比色皿中准确加入2.0×10-6mol/L的胰蛋白酶溶液3 mL,扫描190~350 nm范围的吸收光谱,然后用移液枪依次加入相同体积的胭脂红溶液(2.0×10-4mol/L),混合均匀并静置3 min后扫描190~350 nm范围的吸收光谱,并扫描对应游离浓度的胭脂红的吸收光谱。
1.2.3 圆二色(CD)光谱测定 在室温条件下,配制不同浓度比([胭脂红]∶[胰蛋白酶])分别为5∶1和10∶1的胭脂红-胰蛋白酶混合溶液,扫描190~250 nm波长范围内混合溶液的CD光谱。通过在线Dichroweb软件中SELCON3程序计算与胭脂红作用前后的胰蛋白酶各二级结构的含量。
1.2.4 红外光谱法(FT-IR)测定 在一定条件下,分别测定浓度为2.0×10-5mol/L游离胰蛋白酶和摩尔比为5∶1 的胭脂红-胰蛋白酶混合物在1800~1400 cm-1红外光谱,并扣除背景峰。
1.2.5 胰蛋白酶活力的测定 胰蛋白酶在催化底物N-苯甲酰-L-精氨酸乙酯盐酸盐(BAEE)后,生成了产物N-苯甲酰-L-精氨酸(BA),BA在253 nm处的紫外吸收能力大大超越了底物BAEE,通过测定胰蛋白酶加入前后253 nm处吸收峰值的波动值从而测定胰蛋白酶的活性[6]。利用抑制动力学方法,在pH7.4的Tris-HCl缓冲体系中,胰蛋白酶(2.0×10-6mol·L-1)和不同浓度的胭脂红在37 ℃孵化2 h后,加入BAEE(5.0×10-3mol L-1),每隔20 s测定体系在253 nm处的吸光值,并通过关系式(1),计算不同浓度胭脂红存在时胰蛋白酶的相对活性[7]。
相对活性(%)=(R/R0)×100
式(1)
式(1)中R0、R分别为不加抑制剂和添加不同浓度抑制剂时反应体系的吸光度随时间的变化率。
2 结果与讨论
2.1 胭脂红对胰蛋白酶的荧光猝灭及机理
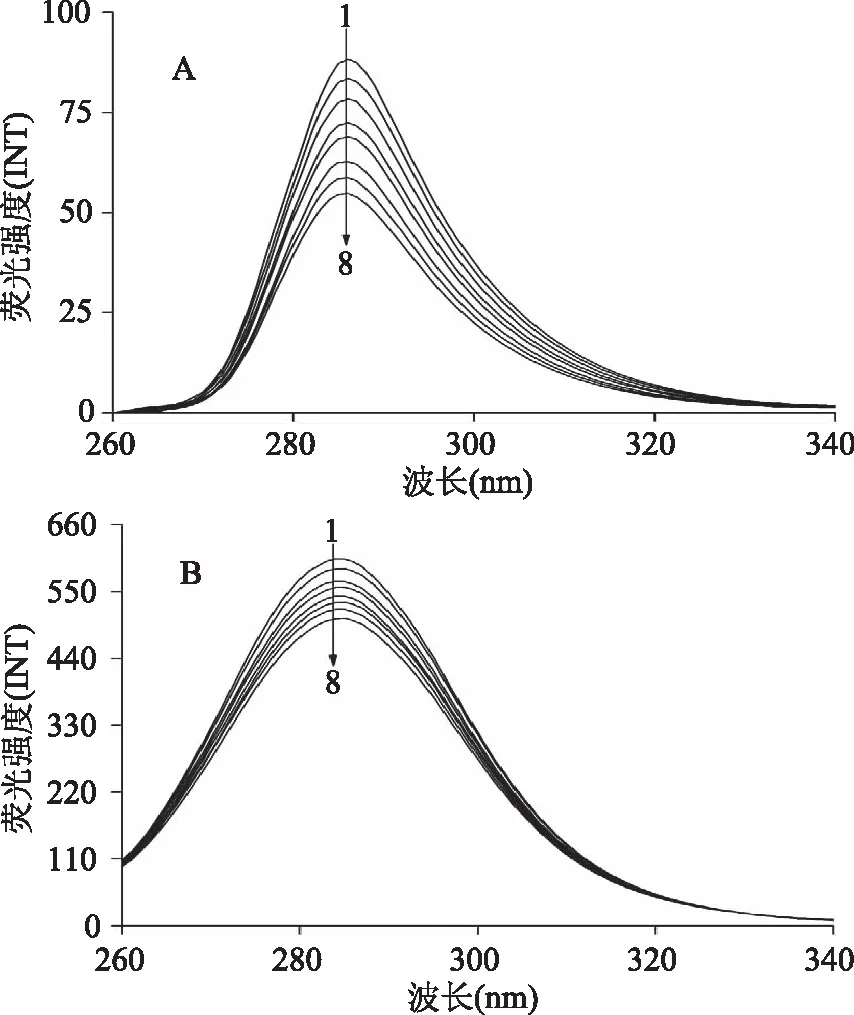
荧光光谱法是一种非常有效的光谱分析手段,常被用在小分子与大分子相互作用研究中。图2是胭脂红-胰蛋白酶体系在25 ℃时的荧光猝灭光谱,从图中可以明显看出,胭脂红的加入导致了胰蛋白酶在350 nm处的荧光发射峰的强度呈现有规律的降低,且峰位发生明显红移(移动到358 nm),表明胭脂红可以和胰蛋白酶发生相互作用猝灭其内源荧光且胰蛋白酶的荧光发色团(色氨酸和酪氨酸)周围的微环境受到胭脂红的影响而改变,极性增大,疏水性减小[8]。
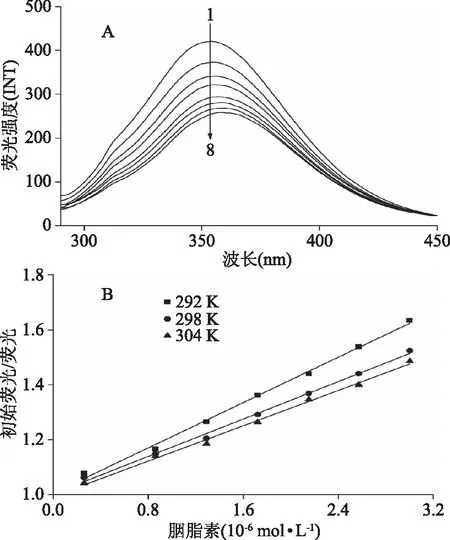
图2 胭脂红对胰蛋白酶的 荧光猝灭光谱(A)及Stern-Volmer图(B)Fig.2 Fluorescence quenching spectra of trypsin in the presence of ponceau 4R(A) and the Stern-Volmer plots for the trypsin-ponceau 4R system(B)注:Ctrypsin=2.0×10-6 mol/L;cponceau 4R/(×10-6 mol/L), 1~8:0,0.26,0.86,1.29,1.72,2.15,3。
一般情况下,小分子物质猝灭蛋白质荧光的主要机理大致分为以下两种:一种是小分子与蛋白质之间形成复合物导致蛋白质分子内源性荧光值降低的静态猝灭[9];第二种是小分子物质撞击蛋白质导致蛋白质内源荧光值降低的动态猝灭[10]。一般遵从Stern-Volmer方程[11]:
式(2)
式(2)中F0和F分别代表加入胭脂红前后胰蛋白酶的荧光强度,Kq为猝灭速率常数,Ksv为猝灭常数,τ0为不含有猝灭物时荧光分子的平均寿命且生物大分子荧光寿命约为2.80×10-9s[12],[Q]为胭脂红的浓度,通过F0/F对[Q]线性方程可以计算出Ksv值。观察图2可以发现,随着温度的升高Ksv值明显的减小,说明胭脂红对胰蛋白酶的猝灭属于形成复合物的静态猝灭[13],具体详见表1。
2.2 作用力类型的确定
一般情况下,小分子化合物和生物大分子之间的相互作用力主要为氢键、范德华力、疏水作用以及静电引力等[14]。实验测定了292,298,304K三个温度下的荧光数据,胭脂红与胰蛋白酶结合反应的驱动力可通过反应的焓变ΔH°和熵变ΔS°的大小进行判断。
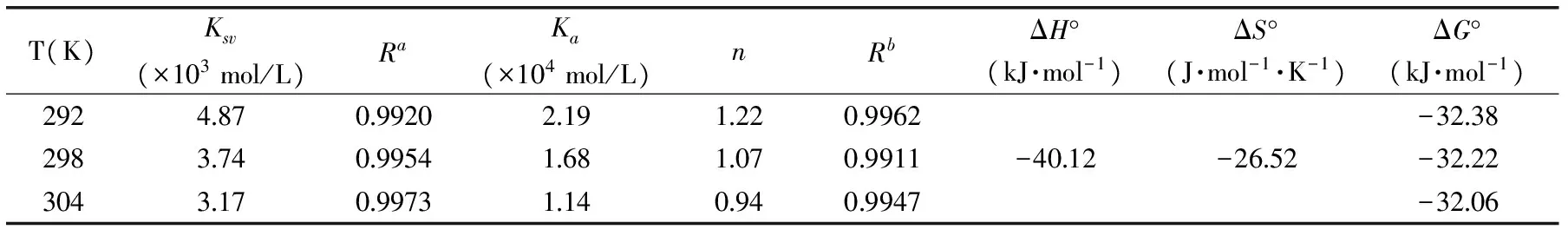
表1 不同温度下胭脂红与胰蛋白酶作用的猝灭常数、结合常数、结合位点数及各热力学参数Table 1 The quenching constants(KSV), association constants(Ka), number of binding sites(n) and relativethermodynamic parameters for the interaction of ponceau 4R with trypsin at different temperatures

式(3)
ΔG°=ΔH°-TΔS°
式(4)
式(3)中R为气体常数,由式(3)和式(4)可计算出ΔH°、ΔS°和ΔG°(表1)。从表1可以看出,ΔG°<0,说明该反应在实验条件下是自发进行的,同时,ΔS°<0、ΔH°<0,说明胭脂红与胰蛋白酶之间的作用力主要是氢键和范德华力。
2.3 结合常数和结合位点的确定
为了进一步获得胭脂素与胰蛋白酶相互作用的结合常数及结合位点数,可假设蛋白质与药物之间有n个相同并且独立的结合位点,由式(5)[15]来确定:
lg(F0-F)/F=lgKa+nlg[Q]
式(5)
式(5)中Ka为结合常数,n代表结合位点数。以lg[(F0-F)/F]为纵坐标,lg[Q]为横坐标作图,根据斜率和截距可分别求出n和Ka的值(表1)。可以看出,随着温度的升高,Ka值不断降低,说明温度的升高会降低胭脂红-胰蛋白酶复合物的稳定性[16]。结合位点数分别为1.22,1.07,0.94,即n值近似等于1,表明胭脂红在胰蛋白酶分子上只有一个结合位点。
2.4 非辐射能量转移
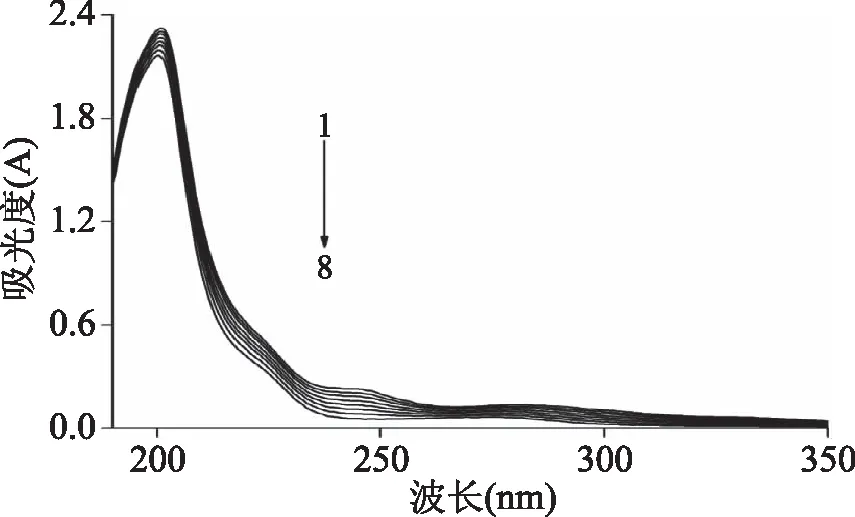
Föster能量转移理论[17]指出:当供体可以发射出荧光,它的荧光发射光谱和受体的紫外吸收光谱有充分的重叠,且二者最大距离不超过8 nm时,很可能会出现供体与受体发生非辐射能量的现象,导致荧光分子的荧光猝灭。本实验中,供体(胰蛋白酶的色氨酸)的发射峰和受体(胭脂红)的吸收峰有重叠(见图3)。根据重叠图的面积,胰蛋白酶与胭脂红之间的结合距离(r)和临界能量转移距离R0通过公式(6)~式(8)计算得到:
式(6)
式(7)
式(8)
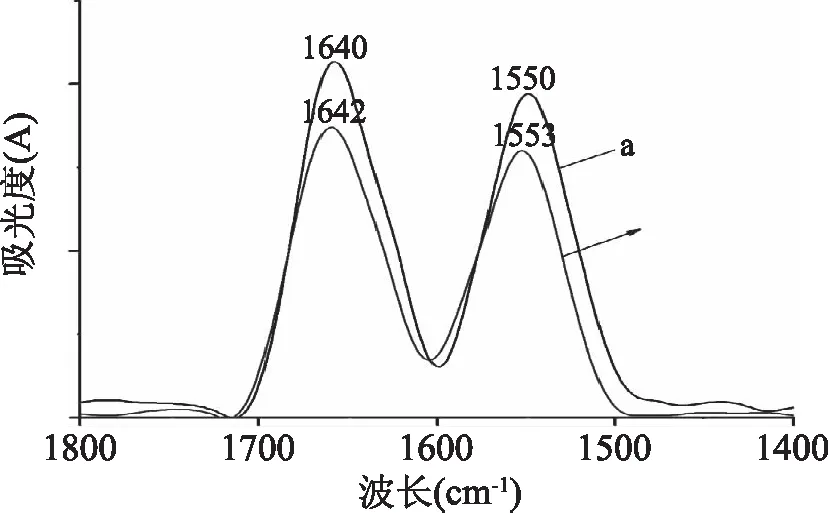
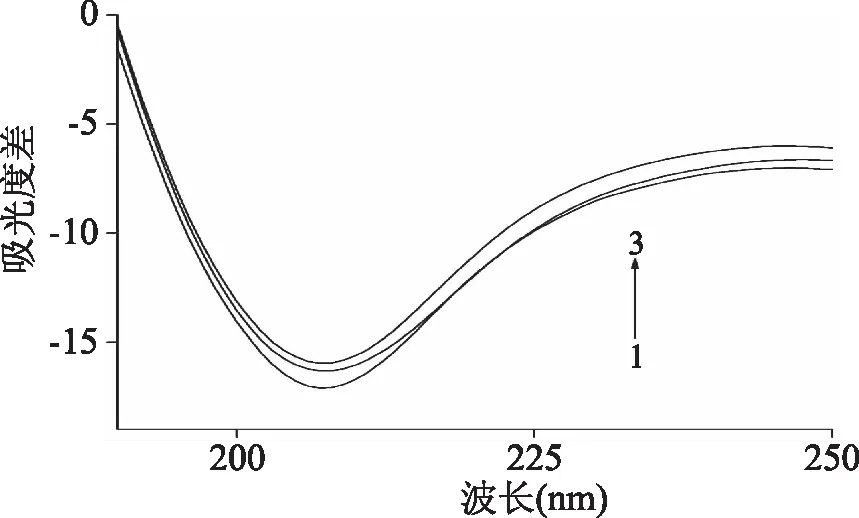
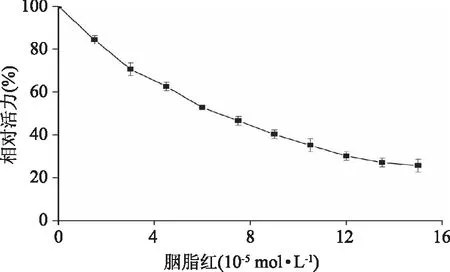
式中,F0和F分别代表着无/有胭脂红存在下胰蛋白酶的荧光强度,r是胭脂红与胰蛋白酶的色氨酸的结合距离,R0是当能量转移效率达50%时的临界距离,κ2为供体(胰蛋白酶)-受体(胭脂红)各项随机分布的取向因子,此处n为介质的折射指数,Φ为胰蛋白酶的荧光量子产率,J是胰蛋白酶的荧光发射光谱和胭脂红的吸收光谱之间的重叠光谱积分,F(λ)为胰蛋白酶在波长λ处的荧光强度,ε(λ)为胭脂红在波长λ处的摩尔吸光系数。在该实验中,κ2=2/3,n=1.336,Φ=0.118[18],计算得到J=1.29×10-13cm3·L·mol-1,R0=3.91nm,E=0.399和r=4.18nm,可以看出r<8nm,且0.5R0 图3 胰蛋白酶的荧光发射光谱(a)与胭脂红的 紫外可见吸收光谱(b)的重叠图谱Fig.3 The spectral overlaps of the fluorescence spectrum of trypsin(a)with the absorption spectrum of ponceau 4R(b)注:ctrypsin=cPonceau=2.0×10-6 mol/L。 2.5 胭脂红对胰蛋白酶构象的影响 2.5.1 同步荧光光谱 固定激发波长与发射波长的间距Δλ,扫描同步荧光光谱,同步荧光光谱法具有简化谱图、干扰少、选择性高等特点,可以分析在小分子存在下,蛋白质构象的变化。其中,Δλ=15nm 和60 nm时的同步荧光光谱分别代表的是蛋白质中酪氨酸(Tyr)和色氨酸(Trp)残基的荧光光谱特征[20]。由图4可以看出,在实验条件下,随着胭脂红浓度的不断增加,Tyr(图4A)和Trp(图4B)残基的荧光强度均明显降低,酪氨酸残基的最大发射波长没有发生变化,但色氨酸的最大发射波长发生了红移(284 nm移至286 nm),表明胭脂红与胰蛋白酶结合后导致胰蛋白酶上色氨酸残基所处微环境的疏水性减小,极性增大[21],引起胰蛋白酶的构象变化。 图4 胭脂红存在下胰蛋白酶的同步荧光光谱 Fig.4 The synchronous fluorescence spectra of trypsin in the presence of ponceau 4R注:(A)Δλ=15 nm,(B)Δλ=60 nm, Ctrypsin=2.0×10-6 mol/L;cponceau 4R/(×10-6 mol/L), 1~8:0,0.26,0.86,1.29,1.72,2.15,3,图5同。 2.5.2 胭脂红对胰蛋白酶紫外吸收光谱的影响 图5为T=298 K,胰蛋白酶与不同浓度的胭脂红结合之后体系的紫外吸收光谱,一般情况下,蛋白质分子中的色氨酸,酪氨酸和苯丙氨酸残基均有紫外吸收,但是蛋白质的吸收波长一般在280 nm附近。由图4可知,在205 nm附近胰蛋白酶有一个较强的吸收峰,代表的是蛋白质中肽键的特征峰,能够反映出蛋白质多肽链的变化情况。当向胰蛋白酶中不断加入胭脂红之后,肽键特征峰的强度逐渐降低同时产生微弱蓝移现象,而且280 nm的吸收峰也出现微弱蓝移,说明胭脂红与胰蛋白酶之间发生了相互作用,改变了胰蛋白酶的构象[22]。 图5 胭脂红-胰蛋白酶体系的紫外吸收光谱Fig.5 UV-vis spectra of the ponceau 4R-trypsin system 2.5.3 红外光谱分析 红外光谱技术是一种常用的研究蛋白质二级结构的强有力手段[23]。蛋白质红外光谱的酰氨Ⅰ带(1700~1600 cm-1)主要是氨基酸残基的C=O伸缩振动吸收;酰氨Ⅱ带(1600~1480 cm-1)包含了C-N伸缩振动和N-H变形振动的信息,但对二级结构变化的敏感程度次于酰氨Ⅰ带[24-25]。图6为胰蛋白酶与胭脂素结合前后的红外光谱图。从图中可以看到,胰蛋白酶酰氨Ⅰ带、酰氨Ⅱ带的吸收峰分别由1640 cm-1移至1642 cm-1,1550 cm-1移至1553 cm-1,表明胭脂红与胰蛋白酶发生了结合反应,对胰蛋白酶二级结构产生了一定影响。 图6 胭脂红与胰蛋白酶的红外光谱图Fig.6 FT-IR spectra of the ponceau 4R-trypsin system注:ctrypsin=2.0×10-5 mol/L, 胭脂红∶胰蛋白酶=0∶1(a),5∶1(b)。 2.5.4 圆二色谱分析 胰蛋白酶是光学活性物质,本实验中通过扫描其圆二色谱图,可以了解其构象及各种二级结构的含量。不同浓度的胭脂红存在下胰蛋白酶的CD光谱如图7所示,图中出现一个负峰,位于220 nm,属于β-sheet特征峰[26]。 表2 胭脂红对胰蛋白酶二级结构的影响(CD光谱)Table 2 Secondary structure of free trypsin and ponceau 4R-trypsin system(CD spectra) 图7 不同胭脂红浓度下胰蛋白酶的圆二色谱Fig.7 CD spectra of trypsin in the presence of increasing amounts of ponceau 4R注:Ctrypsin=2.0×10-6 mol/L, 胭脂红∶胰蛋白酶=0∶1(1),5∶1(2),10∶1(3)。 随着胭脂红浓度的增加,胰蛋白酶的CD强度减弱,但峰形和峰位均无明显变化。利用在线Dichroweb软件计算出胰蛋白酶的二级结构含量(表2),当胭脂红与胰蛋白酶的摩尔比分别为5∶1和10∶1时,胰蛋白酶的β-turn(β-转角)、和β-sheet(β-折叠)含量减少,而α-helix 和random coil(无规则卷曲)的含量增加,表明胭脂红与胰蛋白酶结合后会导致蛋白质结构发生了变化,具体信息详见表2。 2.5.5 胭脂红对胰蛋白酶活性的影响 图8分别显示加入不同浓度胭脂红对胰蛋白酶相对活性的影响。从图中可以看出,随着胭脂红浓度的逐渐增加,胰蛋白酶的活性逐渐降低。求得胭脂红对胰蛋白酶的半抑制浓度IC50为(4.73±0.02)×10-5mol/L(n=3),表明胭脂红与胰蛋白酶结合会导致酶部分失活,从而影响其生理功能。 图8 胭脂红对胰蛋白酶的抑制作用Fig.8 Inhibitory effect of ponceau 4R on trypsin注:ctrypsin=2.0×10-6 mol/L;cBAEE=5.0×10-3 mol/L。 胭脂红对胰蛋白酶的荧光猝灭是形成基态复合物的静态猝灭,氢键和范德华力是胭脂素与胰蛋白酶结合作用的主要驱动力。且胭脂红与胰蛋白酶的结合距离为4.18 nm。胭脂红降低了胰蛋白酶色氨酸残基附近微环境的疏水性,诱导胰蛋白酶的二级构象发生了变化。近年来,由于着色剂等的广泛使用,对于此类添加剂毒性的研究也日益成为热点问题。然而,对胭脂红与人体胃肠道内消化酶的研究信息很少,本文是在模拟人体生理酸度下,通过对胭脂红与胰蛋白酶的结合作用的光谱学研究,为了解人工合成着色剂在人体内的代谢情况提供了一定理论基础,本研究旨在提供一种体外快速评估着色剂对人体内生物大分子结构和功能影响的方法,从而为更好的利用这类着色剂及新着色剂的设计提供帮助。 [1]Tabara A,Yamane C,Abe M,et al. Adsorption of xanthene food additive dyes to cellulose granules[J]. Cellulose,2011,18(1):45-55. [2]曾盈,蔡智鸣,王振,等. 胭脂红对 3T3 细胞 DNA 损伤的 SCGE 检测[J]. 同济大学学报:医学版,2008,29(1):41-44. [3]倪逸声,张龙翔. 胰蛋白酶工程研究进展[J]. 生物工程进展,1992,12(1):2-8. [4]刘志栋. 荧光法研究胭脂红,柠檬黄及日落黄与 BSA 相互作用机理[D]. 哈尔滨:黑龙江大学,2014. [5]马明明,同帜. 几种光谱法研究牛血清白蛋白与胭脂红作用[J]. 光谱实验室,2011,28(5):2188-2193. [6]Mu Y,Lin J,Liu R. Interaction of sodium benzoate with trypsin by spectroscopic techniques[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,83(1):130-135. [7]Yan J,Zhang G,Hu Y,et al. Effect of luteolin on xanthine oxidase:Inhibition kinetics and interaction mechanism merging with docking simulation[J]. Food Chemistry,2013,141(4):3766-3773. [8]丁琼,倪永年. 荧光光谱法研究丙烯酰胺与牛血清白蛋白的相互作用[J].南昌大学学报:理科版,2012,36(6):543-547. [9]段晓燕. 金纳米粒子猝灭 CdTe 量子点荧光的研究[D]. 西安:陕西师范大学,2013. [10]Wang Z,Li Y,Wang J,et al. Spectroscopic analyses on sonocatalytic damage to bovine serum albumin(BSA)induced by ZnO/hydroxylapatite(ZnO/HA)composite under ultrasonic irradiation[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,94:228-234. [11]Wu D,Yan J,Wang J,et al. Characterization of interaction between food colourant Allura Red AC and human serum albumin:multispectroscopic analyses and docking simulations[J]. Food Chemistry,2014,170:423-429. [12]Lakowicz J R,Weber G. Quenching of fluorescence by oxygen. Probe for structural fluctuations in macromolecules[J]. Biochemistry,1973,12(21):4161-4170. [13]Wu X,He W,Wang W,et al. Investigation of the interaction between(-)-epigallocatechin-3-gallate with trypsin andα-chymotrypsin[J]. International Journal of Food Science & Technology,2013,48(11):2340-2347. [14]张秋兰,倪永年. 光谱和伏安法研究沙丁胺醇与牛血清白蛋白的相互作用[J]. 南昌大学学报:理科版,2014,38(1):69-73. [15]Wang R,Dou H,Yin Y,et al. Investigation of the interaction between isomeric derivatives and human serum albumin by fluorescence spectroscopy and molecular modeling[J]. Journal of Luminescence,2014,154:8-14. [16]Hu Y,Zhang G,Yan J. Detection of interaction between lysionotin and bovine serum albumin using spectroscopic techniques combined with molecular modeling[J]. Molecular Biology Reports,2014,41(3):1693-1702. [17]Förster T,Sinanogly O. Modern quantum chemistry[M]. New York:Academic Press,1966. [18]Xiang Y,Wu F. Study of the interaction between a new Schiff-base complex and bovine serum albumin by fluorescence spectroscopy[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2010,77(2):430-436. [19]Kalanur S S,Seetharamappa J,Kalalbandi V K A. Characterization of interaction and the effect of carbamazepine on the structure of human serum albumin[J]. Journal of Pharmaceutical and Biomedical Analysis,2010,53(3):660-666. [20]Ding F,Huang J L,Lin J,et al. A study of binding of C.1 mordant red 3 with bovine serum albumin using fluorescence spectroscopy[J]. Dyes and Pigments. 2009,82(1):65-70. [21]Khodarahmi R,Karimi S A,Ashrafi Kooshk M R,et al. Comparative spectroscopic studies on drug binding characteristics and protein surface hydrophobicity of native and modified forms of bovine serum albumin:Possible relevance to change in protein structure/function upon non-enzymatic glycation[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,89:177-186. [22]Song W,Yu Z,Hu X,et al. Dissection of the binding of hydrogen peroxide to trypsin using spectroscopic methods and molecular modeling[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,137:286-293. [23]Kaur G,Tripathi S K. Investigation of trypsin-CdSe quantum dot interactions via spectroscopic methods and effects on enzymatic activity[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2015,134:173-183. [24]Zhang G W,Wang L,Pan J H. Probing the Binding of the Flavonoid Diosmetin to Human Serum Albumin by Multispectroscopic Techniques[J]. Journal of Agricultural and Food Chemistry. 2012,60:2721-2729. [25]Otsuka M,Fukui Y,Ozaki Y. Comparative evaluation of bioactivity of crystalline trypsin for drying by Fourier-transformed infrared spectroscopy[J]. Colloids and Surfaces B:Biointerfaces,2009,69(2):194-200. [26]Sarkar D,Mahata A,Das P,et al. Deciphering the perturbation of serum albumins by a ketocyanine dye:a spectroscopic approach[J]. Journal of Photochemistry and Photobiology B:Biology,2009,96(2):136-143. Effect of ponceau 4R on the spectral properties of trypsin ZHANG Dong-xia (Department of Applied Statistics and Science,Xijing University,Xi’an 710123,China) The binding characteristics between ponceau 4R and trypsin was investigated by fluorescence,UV-vis absorption,Fourier transform infrared(FT-IR)and circular dichroism(CD)spectroscopy,to obtain the binding constant,binding sites(n),the types of forces,the binding distance(r)between ponceau 4R and trypsin,and other information. The results showed that ponceau 4R had a strong ability to quench the intrinsic fluorescence of trypsin,the quenching mechanism of trypsin by the ponceau 4R was a static process. The calculated thermodynamic parameters showed that the binding process was primarily driven by hydrogen bonds and van der Waals forces. The binding constant between them was 104orders of magnitude,revealing that ponceau 4R can bind to trypsin with moderate affinity. Moreover,analysis of synchronous fluorescence,UV-vis absorption,Fourier transform infrared(FT-IR)and CD spectra demonstrated that the binding interaction induced the microenvironment changes and conformational alteration of trypsin with increases inα-helix and random coil contents,and reduction ofβ-sheet andβ-turn structures,resulting in partial shrinkage of the polypeptides of protein. ponceau 4R;trypsin;fluorescence quenching;binding characteristic 2016-04-08 张东霞(1981-),女,硕士,讲师,研究方向:电化学分析,E-mail:zhangdongxia@xijing.edu.cn。 陕西省教育厅科研项目(15JK2184)。 TS201.1 A 1002-0306(2017)13-0058-06 10.13386/j.issn1002-0306.2017.13.011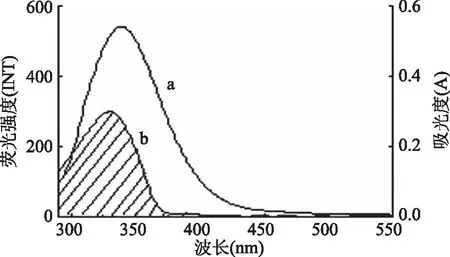

3 结论
