酶法制备硫酸软骨素寡糖及其抗氧化活性
2017-07-31张京良朱常亮姜言晖沈照鹏江晓路
张 静,张京良,朱常亮,姜言晖,沈照鹏,江晓路,3,4,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.中国海洋大学医药学院,山东青岛 266003;3.青岛海洋生物医药研究院,山东青岛 266071;4.青岛明月海藻集团有限公司海藻活性物质国家重点实验室,山东青岛 266400)
酶法制备硫酸软骨素寡糖及其抗氧化活性
张 静1,张京良2,3,朱常亮2,姜言晖1,沈照鹏2,3,江晓路1,3,4,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.中国海洋大学医药学院,山东青岛 266003;3.青岛海洋生物医药研究院,山东青岛 266071;4.青岛明月海藻集团有限公司海藻活性物质国家重点实验室,山东青岛 266400)
采用硫酸软骨素酶对硫酸软骨素进行酶法降解,制备硫酸软骨素寡糖。通过红外分析降解前后的硫酸软骨素以及利用质谱技术对该酶解产物进行分析,并检测酶解前后硫酸软骨素的DPPH自由基的清除能力、羟自由基清除能力和还原能力。结果显示,酶法降解硫酸软骨素对其基本结构影响不大,质谱分析结果表明,该酶解产物是二糖和四糖。抗氧化活性实验表明,硫酸软骨素寡糖对DPPH自由基、羟自由基的清除能力及其还原能力均高于硫酸软骨素。推测其可能是由于硫酸软骨素降解成硫酸软骨素寡糖后,分子量的减小、不饱和双键的形成以及还原糖的含量增加使得其活性增加。
酶法,硫酸软骨素,寡糖,抗氧化活性
硫酸软骨素(chondroitin sulfate,CS)是一种酸性粘多糖,是以D-葡萄糖醛酸和N-乙酰-D-半乳糖胺通过β-1,3糖苷键相结合的双糖为基本单位[1],聚合而成的一类大分子多糖,其广泛分布于动物组织的细胞外基质和细胞表面[2],如动物喉骨、鼻骨、软骨,肌膜和血管壁等。因此,工业生产中的CS主要是从动物的软骨里面提取和纯化[3],比如猪[4],牛[5],鲨鱼[6],鱿鱼[7],鲟鱼[8]等。CS具有多种生物活性和药用价值[9],如:抗凝血、降血脂、抗动脉粥样硬化、治疗关节炎、抗肿瘤等。
CS的相对分子质量大小对其发挥生物活性有着重要的影响。由于大分子的多糖体积较大,较难透过细胞膜从而不能很好的在机体内发挥其多种药理功能,而低分子量的CS具有溶解性好、粘度小、易吸收和生物利用度高等特点[10],因此,近年来低分子量CS的制备及其用途已逐步成为热点。目前,CS低聚糖的制备方法主要有酸解法[11]、过氧化氢氧化降解法[10]和酶解法[11]。酶法降解相对于其它的降解方法,具有反应条件温和、无污染、工艺简单,适合于CS低聚糖的工业化生产,具有较大的优势。但是不同来源的酶对硫酸软骨素降解的机理可能不同,导致最后产生的CS寡糖的结构和功能可能也会有所不同,张莲[11]等人通过动物来源的透明质酸酶对硫酸软骨素进行降解,得到的CS低聚糖为饱和寡糖。而本文采用的是细菌来源的硫酸软骨素酶降解CS,制备得到的CS低聚糖为不饱和寡糖,同时利用红外光谱、电喷雾电离质谱(electrospray ionization mass spectrometry,ESI-MS)分析该酶解产物,并对所得的CS寡糖与CS做了体外抗氧化活性的比较,为CS寡糖的进一步研究及其应用提供理论基础。
1 材料与方法
1.1 材料与仪器
市售的CS 购于青岛贝尔特生物科技有限公司;硫酸软骨素酶(11.96 U/mL) 分子质量约76 kDa,由本实验室保存的产酶菌株Acinetobactersp.C26发酵制得;DPPH、FeSO4、无水乙醇、水杨酸、双氧水、铁氰化钾、三氯乙酸、氯化铁、KBr等试剂均为分析纯。
冷冻干燥机 北京博医康实验仪器有限公司;GL-20G-II型离心机 上海安亭科学仪器厂;电热恒温水浴锅 上海新苗医疗器械制造有限公司;UV-6000PC型紫外可见分光光度计 上海元析仪器有限公司;Nexus470红外光谱仪 Nicolet公司;高效液相-三重四级杆质谱联用仪 Agilent公司。
1.2 CS寡糖的酶解工艺
1.2.1 不同加酶量对硫酸软骨素寡糖降解的影响 配制2%的硫酸软骨素溶液100 mL,分别加入5、10、20、30 U的硫酸软骨素酶液,在37 ℃酶解反应6 h,将反应后的溶液稀释成一定的倍数在OD232处检测吸光值的大小。
1.2.2 不同反应时间对硫酸软骨素寡糖降解的影响 配制2%的硫酸软骨素溶液100 mL,按照最佳的加酶量添加,分别在37 ℃酶解反应1、2、4、6、8 h,将反应后的溶液稀释成一定的倍数在OD232处检测吸光值的大小。
1.3 CS寡糖的制备
配制2%的硫酸软骨素溶液500 mL,按照最佳的加酶量和反应时间在37 ℃水浴中进行酶解,反应结束后加热煮沸10 min,灭酶活,离心取上清,冻干,即得CS寡糖。
1.4 CS降解前后理化性质的测定
还原糖:DNS法[12];硫酸根:氯化钡-比浊法[13]。
1.5 红外光谱分析
分别称取充分干燥的CS寡糖和CS各1 mg与烘干至恒重的KBr 100 mg混合研磨压片,上机扫描分析,扫描范围在400~4000 cm-1。
1.6 酶解产物的ESI-MS分析
取少量的CS酶解产物,加水溶解后,取5 μL样品进行高分辨率负离子模式质谱分析。毛细管电压:-3500 V;质量扫描范围:m/z 100~2000。
1.7 CS寡糖与CS抗氧化能力的测定
1.7.1 DPPH自由基的清除能力 方法参照文献[14],分别将CS寡糖与CS配制成不同浓度的溶液,各取2 mL加入DPPH·溶液2 mL(0.2 mmol/L,甲醇配制),混匀后室温避光静置30 min,在517 nm处测定吸光值。每个样品重复三次,求平均值。从而计算不同浓度的CS寡糖和CS对DPPH自由基的清除作用。
清除率(%)=[1-(Ai-Aj)/A0]×100
式中:A0表示2 mL DPPH·溶液+2 mL甲醇溶液的吸光值;Ai表示样品吸光值;Aj表示样品的本底吸收值。
1.7.2 羟自由基的清除能力 方法参照文献[15],分别将CS寡糖与CS配制成不同浓度的溶液,各取1 mL样品溶液加1 mL 9 mmol/L的FeSO4溶液、1 mL 9 mmol/L水杨酸-乙醇溶液,随后加1 mL 8 mmol/L的H2O2溶液启动反应,37 ℃水浴30 min,在510 nm处测定吸光值Ai。以蒸馏水代替H2O2的体系测定样品的本底吸收值Aj。每个样品重复三次,求平均值。从而计算不同浓度的CS寡糖和CS对羟自由基的清除作用。
清除率(%)=[1-(Ai-Aj)/A0]×100
式中:A0表示蒸馏水代替样品溶液测得的对照;Ai表示样品吸光值;Aj表示样品本底吸收值。
1.7.3 还原力的测定 参照文献[16]的方法,取不同浓度的CS寡糖和CS溶液1 mL,向其加入2.5 mL 0.2 mol/L磷酸缓冲液(pH6.6),铁氰化钾[K3Fe(CN)6]溶液(1%)2.5 mL,混合均匀,50 ℃水浴20 min。加入10%的三氯乙酸溶液终止反应。混合物离心10 min,取上清2.5 mL,加入去离子水2.5 mL和0.5 mL的0.1%的FeCl3。在700 nm下测吸光值。每个样品重复三次,求平均值。
1.8 数据统计分析
所得数据采用Excel处理软件进行统计分析。
2 结果与分析
2.1 CS寡糖的酶解工艺
2.1.1 不同加酶量对CS寡糖降解的影响 由于CS被硫酸软骨素酶降解后会产生不饱和二糖,该二糖在232 nm处有紫外吸收,故通过检测反应溶液中的紫外吸收值的大小可以判断反应的进行程度。由图1可知,当加酶量从5 U增加到20 U时,紫外吸收值逐渐增大,说明CS正处于有效的降解过程中,但当加酶量增加到30 U时,紫外吸收值不再增大,可能的原因是在该反应阶段内,加酶量已经达到饱和;故考虑到实际的生产应用,加酶量为20 U为最佳。
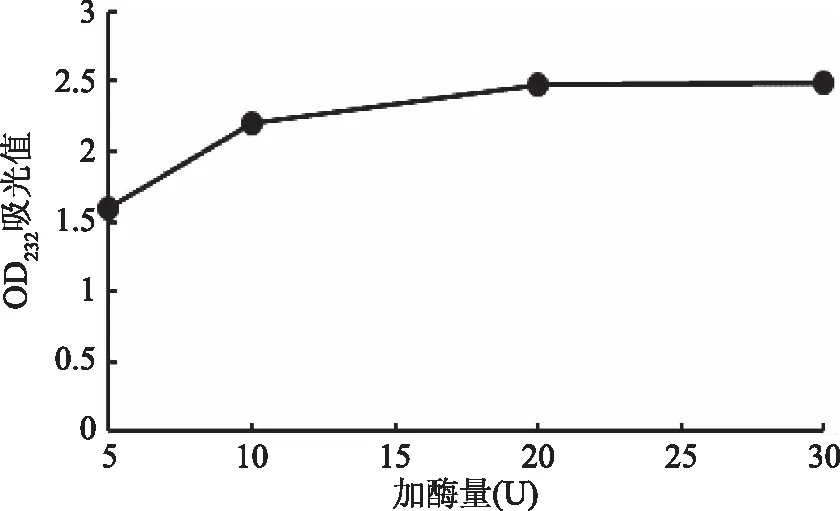
图 1 加酶量对CS寡糖降解的影响Fig.1 Effect of enzyme dosage on hydrolysis of CS oligosaccharides
2.1.2 不同反应时间对硫酸软骨素寡糖降解的影响 由图2可知,酶解反应在1~4 h内,酶解液的吸光值明显增加,说明其降解效率较高,当超过4 h时,吸光值不再上升,趋于平缓。推测其可能的原因在于随着反应时间的延长,硫酸软骨素酶活的稳定性逐渐降低,考虑到实际生产效率,确定4 h为最佳酶解时间。
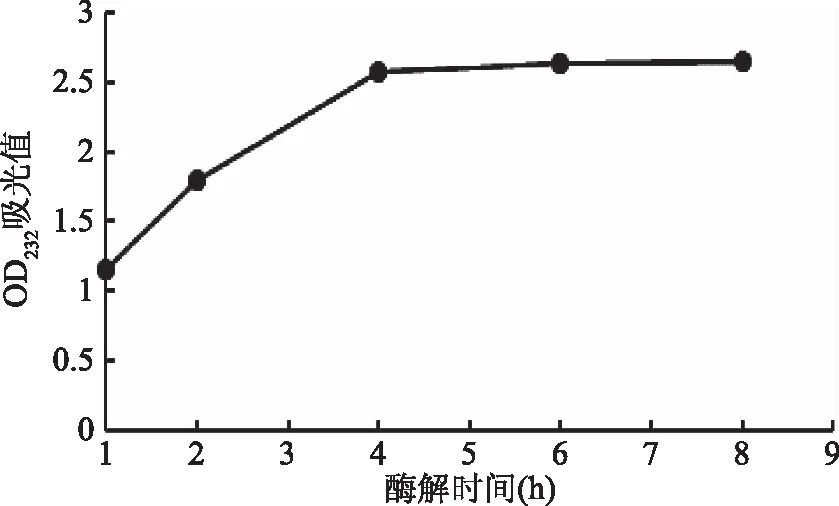
图 2 酶解时间对CS寡糖降解的影响Fig.2 Effect of time on hydrolysis of CS oligosaccharides
2.2 CS降解前后基本理化性质分析
从表1可以看出,经酶法降解CS后得到CS寡糖,其还原糖的含量从7.37%升高至24.96%,而硫酸根的质量分数变化不大,说明酶法降解不会造成CS中硫酸根的脱除。通过对CS和CS寡糖的溶解性能做了对比,结果表明CS寡糖的溶解性能得到了很大的提高,在水中稍微搅拌即可很快溶解,而CS则需更长的时间去搅拌溶解。这种溶解性能的提高能够给CS寡糖的进一步开发应用提供良好的基础。
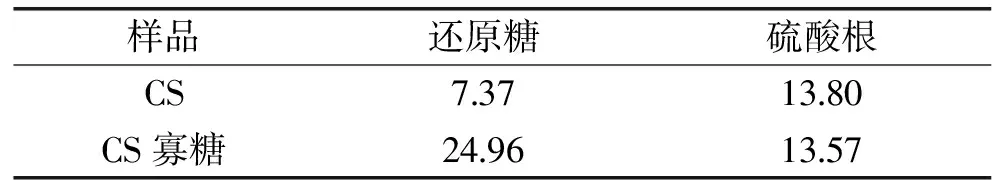
表1 CS降解前后基本理化性质分析比较(%)Table 1 Comparison of basic physicochemical properties of CS before and after degradation(%)
2.3 酶法降解对CS红外光谱的影响
由图3可知,经酶解得到的CS寡糖与未降解的CS的红外光谱吸收曲线基本一致,说明酶解未对CS的基本结构造成较大的影响。其中3700~3100 cm-1之间的吸收峰是由羟基伸缩振动引起的,二者在此波长期间均有较强的吸收峰;在2930 cm-1处的吸收峰是由C-H伸缩振动引起的;1646 cm-1是羰基中的C=O伸缩振动引起的强吸收峰;1416.99 cm-1和1397.84 cm-1处的吸收峰是羧基中的C-O的伸缩振动峰;1259 cm-1和856 cm-1的强吸收峰分别是硫酸基中的S=O的伸缩振动峰和C-O-S的轴向配位的伸缩振动峰;1056 cm-1和1037 cm-1处的吸收峰是C=O=C的主要吸收峰;在926 cm-1处的吸收峰是D-葡萄吡喃糖的环伸缩振动峰。

图3 CS和CS寡糖的红外光谱比较Fig.3 Comparison of infrared spectra of CS and CS oligosaccharides注:a.CS;b.CS寡糖。
2.4 酶解产物的ESI-MS分析
将酶解产物进行质谱分析,结果如图4所示,根据分子量可推测该酶解产物是二糖和四糖。硫酸软骨素二糖是由一分子的D-葡萄糖醛酸GlcA和一分子的N-乙酰氨基半乳糖GalNAc组成,其中m/z为342和458的是二糖,其结构分别为[M-SO3-2H2O-H]-和[M-H]-,其中M为dGlcAGalNAc1S1;分子量为939的是四糖,即两个硫酸软骨素二糖组成,失去两个质子且含加钠峰,其结构为[2M+Na-2H]-。从而说明该酶能够有效降解CS,并且产生的CS寡糖专一性好,这将为后续CS寡糖的分离纯化提供了原料及其理论基础。

图4 酶解产物的ESI-MS谱图Fig.4 ESI-MS spectrum of enzymatic product
2.5 抗氧化能力的测定
2.5.1 DPPH自由基的清除能力 从图5可以看出,CS寡糖和CS对DPPH自由基均有一定的清除能力,且呈现一定的剂量关系,随着浓度的增加清除能力逐渐增大。且从中可以发现,CS寡糖对DPPH自由基的清除能力强于硫酸软骨素。当浓度为20 mg/mL时,CS寡糖对DPPH自由基的清除能力达到90%,而此时CS对DPPH自由基的清除能力还未达到30%。王俊[10]等人研究发现,CS分子量越低,其清除DPPH自由基的能力越来越强;而本文通过酶法降解CS产生CS寡糖,其分子量减小,DPPH自由基清除能力也增强,故可能也说明CS分子量的大小对DPPH自由基清除能力有一定的关系。
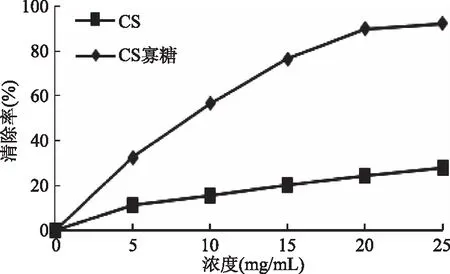
图5 CS和CS寡糖对DPPH自由基的清除能力Fig.5 DPPH scavenging activity of CS and CS oligosaccharides
一般而言,硫酸基含量的多少对其表现出的生物活性大小有一定关系[17],但由之前对酶解CS产物的硫酸基含量测定得知,降解前后硫酸基的含量并未降低;Alkrad[18]等人报道透明质酸糖胺聚糖在降解的过程中形成双键对自由基毒性的减小有很重要的作用,所以我们推测通过酶法降解CS得到的CS寡糖中含有更多的不饱和双键对DPPH自由基的清除能力也起到一定的作用。
2.5.2 羟自由基的清除能力 羟自由基是氧自由基中最活跃的,会引诱邻近的生物分子遭到严重的氧化损伤[14]。如图6所示,不同浓度的CS寡糖与CS对羟自由基的清除能力均呈明显的线性关系。清除率随着样品溶液浓度的增加而增大,说明不同分子量的CS对羟自由基都有一定的清除能力。当浓度为20 mg/mL时,CS寡糖对羟自由基的清除能力可达56%,而CS清除率仅为40%。

图6 CS和CS寡糖对羟自由基的清除能力Fig.6 Hydroxy free radical scavenging activity of CS and CS oligosaccharides
王俊等[10]人利用过氧化氢氧化降解和盐酸降解CS得到两个不同分子量的CS寡糖,同样表明其分子量较低的CS寡糖清除羟自由基的能力高于分子量较高的CS寡糖。丁鹏等[15]研究了黑莓果胶寡糖的抗氧化活性,当浓度同样为20 mg/mL时,其·OH的清除率仅为40%左右,低于CS寡糖在此浓度下的清除率,与未降解的CS清除率相当。目前有报道认为多糖清除羟自由基的方式可能不是直接对羟自由基进行清除,而是通过螯合产生·OH反应中所需的金属离子,如Fe2+,Cu+,促使它们在Fenton体系中不活跃,从而抑制羟自由基的生成[19]。
2.5.3 还原力的测定 物质的还原力测定是根据抗氧化剂自身的还原作用,给出电子而清除自由基的,还原力越强,表明其抗氧化性越强[16]。不同浓度的CS寡糖和CS溶液在700 nm处的吸光值如图7所示。在5~25 mg/mL的浓度范围内,CS寡糖和CS其吸光值的大小与浓度均呈现一定的线性关系。从中可以看出,当浓度为15 mg/mL时,CS寡糖的吸光值为0.587,而此时CS的吸光值仅为0.092,表明CS寡糖的还原力明显的强于CS的还原力。
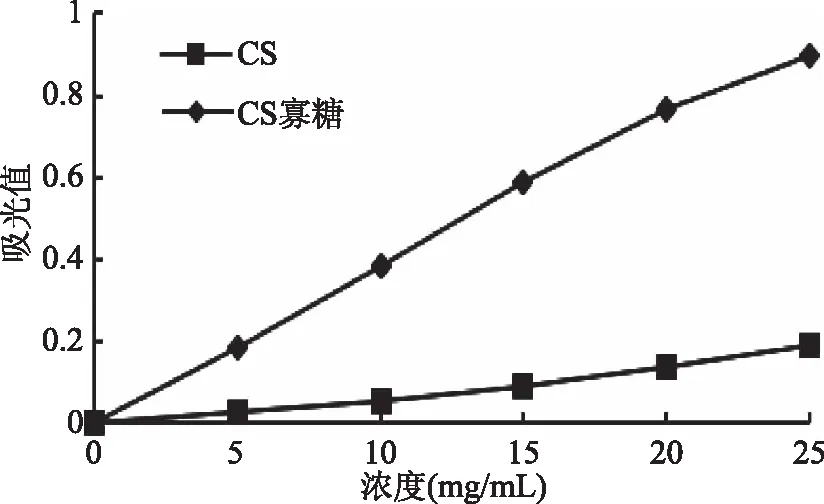
图7 CS和CS寡糖的还原能力Fig.7 Reducing power of CS and CS oligosaccharides
Abad[20]等人认为还原力可能与还原糖的存在多少有一定的关系;由本文中酶解得到的CS寡糖中还原糖的含量为24.96%,而CS的还原糖含量为7.37%可知,CS寡糖的还原糖含量明显大于CS中的还原糖含量,所以可能也证实了Abad这一观点。
3 结论
经酶法降解CS制备CS寡糖,其降解产物中硫酸基的含量并未出现明显降低,且通过红外光谱分析表明酶法降解CS对所得的产物的基本结构未造成较大影响;说明该酶解工艺良好、不会造成产品的破坏,适合于CS寡糖的工业化生产。ESI-MS分析表明该酶解产物的主要成分是二糖和四糖。对降解前后的CS做了体外抗氧化活性的对比,分析结果表明CS寡糖的体外抗氧化活性高于CS。这可能是由于在酶解的过程中产生了不饱和二糖,里面含有不饱和双键,以及还原糖含量的增加、分子量的减小对DPPH自由基、羟自由基的清除能力和还原力的提高起到了一定的作用。因此,通过酶法制备得到的CS寡糖在保健食品、药品和化妆品等领域将具有较好的应用前景。
[1]Maccari F,Ferrarini F,Volpi N. Structural characterization of chondroitin sulfate from sturgeon bone[J]. Carbohydrate research,2010,345(11):1575-1580.
[2]凌沛学,何兆雄. 硫酸软骨素[M]. 北京:中国轻工业出版社,2012:14-17.
[3]Maccari F,Galeotti F,Volpi N. Isolation and structural characterization of chondroitin sulfate from bony fishes[J]. Carbohydrate polymers,2015,129:143-147.
[4]Volpi N. Analytical aspects of pharmaceutical grade chondroitin sulfates[J]. Journal of Pharmaceutical Sciences,2007,96(12):3168-3180.
[5]Volpi N. Quality of different chondroitin sulfate preparations in relation to their therapeutic activity[J]. The Journal of Pharmacy and Pharmacology,2009,61(10):1271-1280.
[6]Sim J-S,Im AR,Cho SM,et al. Evaluation of chondroitin sulfate in shark cartilage powder as a dietary supplement:Raw materials and finished products[J]. Food Chemistry,2007,101(2):532-539.
[7]Kinoshita A,Yamada S,Haslam SM,et al. Isolation and structural determination of novel sulfated hexasaccharides from squid cartilage chondroitin sulfate E that exhibits neuroregulatory activities[J]. Biochemistry-Us,2001,40(42):12654-12665.
[8]Zhao T,Zhou Y,Mao G,et al. Extraction,purification and characterisation of chondroitin sulfate in Chinese sturgeon cartilage[J]. Journal of the Science of Food and Agriculture,2013,93(7):1633-1640.
[9]Huskisson E C. Glucosamine and chondroitin for osteoarthritis[J]. Journal of International Medical Research,2008,36(6):1161-1179.
[10]王俊,曾凡新,程微,等. 不同降解方式对硫酸软骨素寡糖抗氧化活性的影响[J].湖北农业科学,2015,55(22):5707-5710.
[11]张莲,王金鹏,孔子青,等. 硫酸软骨素的降解及其降解产物抗氧化活性的测定[J].食品工业科技,2011,32(12):180-183.
[12]赵凯,许鹏举,谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008,29(8):534-536.
[13]邱芳萍,张玲,于健. 硫酸钡比浊法对鹿茸多糖中硫酸基含量的测定[J].长春工业大学学报:自然科学版,2005,26(4):268-270.
[14]Yujiao Sun,Bingying Yang,Yanmin Wu,et al. Structural characterization and antioxidant activities of j-carrageenan oligosaccharides degraded by different methods[J]. Food Chemistry,2015,178:311-318.
[15]丁鹏,沈照鹏,张京良,等. 酶法制备黑莓果胶寡糖及其抗氧化活性研究[J].食品工业科技,2016,37(11):76-79.
[16]Xiaoying Xiong,Ming Li,Jing Xie,et al. Preparation and antioxidant activity of xanthan oligosaccharides derivatives with similar substituting degrees[J]. Food Chemistry,2014,164:7-11.
[17]Deepa S S,Kalayanamitra K,Ito Y,et al. Novel Sulfated Octa- and Decasaccharides from Squid Cartilage Chondroitin Sulfate E:Sequencing and Application for Determination of the Epitope Structure of the Monoclonal Antibody MO-225[J]. Biochemistry,2007,46(9):2453-2465.
[18]Alkrad J A,Mrestani Y,Stroehl D,et al. Characterization of enzymatically digested hyaluronic acid using NMR,Raman,IR,and UV-vis spectroscopies[J]. Journal of Pharmaceutical and Biomedical Analysis,2003,31:545-550.
[19]Huamao Yuan,Weiwei Zhang,Xuegang Li,et al. Preparation andinvitroantioxidant activity of K-carrageenan oligosaccharides and their oversulfated,acetylated,and phosphorylated derivatives[J]. Carbohydrate Research,2005,340(4):685-692.
[20]Abad L V,Relleve L S,Racadio C D T,et al. Antioxidant activity potential of gamma irradiated carrageenan[J]. Applied Radiation and Isotopes,2013,79:73-79.
Chondroitin sulfate oligosaccharides preparedby chondroitinase and its antioxidant activities
ZHANG Jing1,ZHANG Jing-liang2,3,ZHU Chang-liang2,JIANG Yan-hui1,SHEN Zhao-peng2,3,JIANG Xiao-lu1,3,4,*
(1.College of Food Science and Engineering of Ocean University of China,Qingdao 266003,China;2.School of Medicine and Pharmacy of Ocean University of China,Qingdao 266003,China;3.Marine Biomedical Research Institute of Qingdao,Qingdao 266071,China;4.State Key Laboratory of Bioactive Seaweed Substances,Qingdao Brightmoon Seaweed Group Co Ltd,Qingdao 266400,China)
Chondroitin sulfate oligosaccharides were prepared by chondroitinase degradation. Infrared analysis of chondroitin sulfate before and after degradation and the enzymatic product was analyzed by electrospray ionization mass spectrometry,and the DPPH radicals,hydroxyl radical scavenging activity and reducing power of chondroitin sulfate and the chondroitin sulfate oligosaccharides were evaluated. Infrared spectra showed that enzymatic degradation of chondroitin sulfate had no effect on its basic structure,the results of mass analysis showed that the enzymatic product was chondroitin sulfate disaccharide and tetrasccharide. The antioxidant activities experiments showed that the DPPH radicals,hydroxyl radical scavenging activity and reducing power of chondroitin sulfate oligosaccharide were higher than chondroitin sulfate. It is speculated that the result may be because of the decrease of the molecular weight and the formation of unsaturated double bond in the chondroitin sulfate oligosaccharide,also reducing sugar content increased its activity.
enzymatic method;chondroitin sulfate;oligosaccharides;antioxidant activities
2016-12-02
张静(1991-),男,硕士,研究方向:应用微生物工程,E-mail:zjys1991@163.com。
*通讯作者:江晓路(1959-),女,本科,教授,研究方向:应用微生物工程,E-mail:jiangxl@ouc.edu.cn。
山东省科技攻关;基于海藻工具酶分子动力学的褐藻胶精深加工关键技术(2015GSF115002)。
TS241
A
1002-0306(2017)13-0048-05
10.13386/j.issn1002-0306.2017.13.009
