基质金属蛋白酶-26在人脑胶质瘤血管新生中的作用
2017-07-31张玉辉李香香常晓娜唐辰晨张丽红李一雷
张玉辉,李 伟,李香香,房 波,常晓娜,唐辰晨,张丽红,李一雷
基质金属蛋白酶-26在人脑胶质瘤血管新生中的作用
张玉辉1,2,李 伟1,李香香1,房 波1,常晓娜1,唐辰晨1,张丽红1,李一雷1
目的 探讨MMP-26在人脑胶质瘤血管新生中的作用及可能的作用机制。方法 用MMP-26质粒和pc-DNA3.1空质粒稳定转染人胶质瘤细胞株U251,构建裸鼠异种移植瘤模型,进而构建体外基于人肿瘤组织块的三维血管生成模型,观察MMP-26转染组(U251-MMP-26)、空载组(U251-pcDNA3.1)和未转染组(U251)的新生血管,统计有血管生成孔所占的百分比(I%),以及根据新生血管的长度和密度用半定量法对新生血管进行评分(血管生成分数AI,0~16分);采用RT-PCR法和免疫组化法测定U251-MMP-26、U251-pcDNA3.1和U251中MMP-26和VEGF mRNA和蛋白的表达;免疫组化法测定CD31在纤维蛋白-凝血酶胶基质血管内皮细胞中的定位。结果 免疫组化检测内皮细胞标志物CD31为阳性,证明侵入纤维蛋白原-凝血酶胶基质中的成分为内皮细胞来源;U251-MMP-26组血管长、密度大,所占面积大,而U251-pcDNA3.1组和U251组血管短,密度小,所占面积小;U251-MMP-26组在第14天的I%和AI高于U251-pcDNA3.1组和U251组(P<0.05);U251-MMP-26组在14天中I%和AI的发展趋势较U251-pcDNA3.1组和U251组明显;MMP-26的mRNA和蛋白在U251-MMP-26中高表达,VEGF的mRNA和蛋白在U251-MMP-26中的表达水平明显强于U251-pcDNA3.1组和U251组(P<0.01)。结论 MMP-26可能通过增强VEGF的表达促进人脑胶质瘤的血管新生,可作为抗肿瘤治疗的靶点。
脑肿瘤;人脑胶质瘤;MMP-26;VEGF;血管新生
胶质瘤是中枢神经系统最常见的恶性肿瘤,尽管现在可采取手术、放疗、化疗等综合治疗,但疗效仍不理想,尤其是高级别胶质瘤,预后较差[1]。而血管新生是恶性肿瘤演进过程中最关键的因素,能促进肿瘤的快速生长及转移[2]。其中基质金属蛋白酶(matrix metallo proteinase, MMP)家族通过介导细胞外基质(extracellular matrix, ECM)不同成分的降解参与血管新生[3]。MMP-26是MMPs家族的新成员,广泛表达于上皮组织源性的恶性肿瘤,已有实验[4]表明,MMP-26在体外能促进U251细胞的侵袭和迁移,体内能促进U251的局部浸润和血管生成;MMP-26的过表达能促进乳腺癌细胞的生长、浸润及诱导血管生成[5]。因此,MMP-26可能有效诱导了恶性肿瘤的血管生成,但其机制尚不明确。本实验用MMP-26-pcDNA3.1质粒稳定转染人胶质瘤细胞U251,建立裸鼠异种移植瘤模型,进而构建体外基于肿瘤组织块的三维血管生成模型,通过相应的指标评价MMP-26对肿瘤血管生成的影响,旨在为临床抗肿瘤血管生成治疗提供一定的理论依据。
1 材料与方法
1.1 细胞株及试剂 人脑胶质瘤细胞系U251(吉林大学病理生物学教育部重点实验室),脂质体2000(美国Invitrogen公司);BALB/c-nu裸小鼠(北京华阜康实验动物公司);UltraSensitive SP超敏试剂盒(福州迈新公司);MMP-26、VEGF和GAPDH引物(上海生物公司;Trizol试剂盒(美国Gibco公司);RNA PCR Kit(Fermentas公司)。
1.2 U251细胞稳定转染及扩大培养 U251培养于IMDM(10%FBS)培养基中,当达到80%~90%汇合度时,按照脂质体2000转染试剂操作说明,将MMP-26-pcDNA3.1(MMP-26全长基因)和pcDNA3.1(pcDNA3.1空质粒)稳定转染人胶质瘤U251细胞,并将细胞分为3组:U251组、U251-pcDNA3.1组和U251-MMP-26组。
1.3 裸鼠异种移植瘤模型 鉴定稳定转染的细胞株并扩大培养,待细胞生长至80%~90%融合时,将4×106细胞接种于4~6周龄雌性裸鼠背部皮下,每组3~5只,SPF环境培养30天。
1.5 RT-PCR检测肿瘤组织中MMP-26和VEGF mRNA的表达 按Trizol试剂盒说明书操作方法提取总RNA。用紫外分光光度计测吸光度(A)值,A260/A280=1.8~2.0为其纯度要求。根据A260值计算RNA浓度。按逆转录试剂盒进行操作,得到cDNA后,分别用MMP-26、VEGF和GAPDH的引物进行PCR扩增。MMP-26引物序列:上游5′-ACCATGCAGCTCGTCATCTTAAGAG-3′,下游5′-AGGTATGTCAGATGAACATTTTTCTCC-3′,扩增产物为501 bp;VEGF引物序列:上游5′-CTCACCGCCTCGGCTTGTCACA-3′,下游5′-CCTGGTGGACATCTTCCAGGAGTA-3′,扩增产物为265 bp、407 bp、479 bp;GAPDH引物序列:上游5′-TGTTGCCATCAATGACCCCTT-3′,下游5′-CTCCACGACGTACTCAGCG-3′,扩增产物为202 bp。RT-PCR终产物进行1.5%琼脂糖凝胶电泳,溴化乙啶(EB)显色,在凝胶成像仪下观察,照相,并对产物片段进行灰度扫描,结果为目的基因与内参基因的比值。
1.6 免疫组化法检测肿瘤组织中MMP-26和VEGF蛋白的表达 标本经10%中性福尔马林固定,常规脱水、石蜡包埋、切片。MMP-26和VEGF分别用枸橼酸盐缓冲液(pH 6.0)和Tris-EDTA缓冲液进行热修复,免疫组化步骤按照UltraSensitive SP超敏试剂盒进行,PBS缓冲液(pH 9.0)代替一抗作为空白对照,苏木精对比染色。结果判定:MMP-26和VEGF蛋白表达于细胞质,以细胞质出现黄色或棕黄色染色为阳性细胞。每张切片随机观察10个高倍视野,依阳性细胞占所观察细胞的百分比及细胞着色强度综合计分做半定量分析。(1)按阳性细胞百分率计分:无阳性细胞为0分;阳性细胞数≤10%为1分;11%~50%为2分;51%~75%为3分;>75%为4分。(2)按细胞染色强度计分:弱染色为1分;中度染色为2分;强染色为3分。将两项得分结果相乘:0分为阴性(-),1~4分为弱阳性(+),5~8分为中等强度阳性(),9~12分为强阳性(),由两名病理学专家进行双盲阅片[7]。
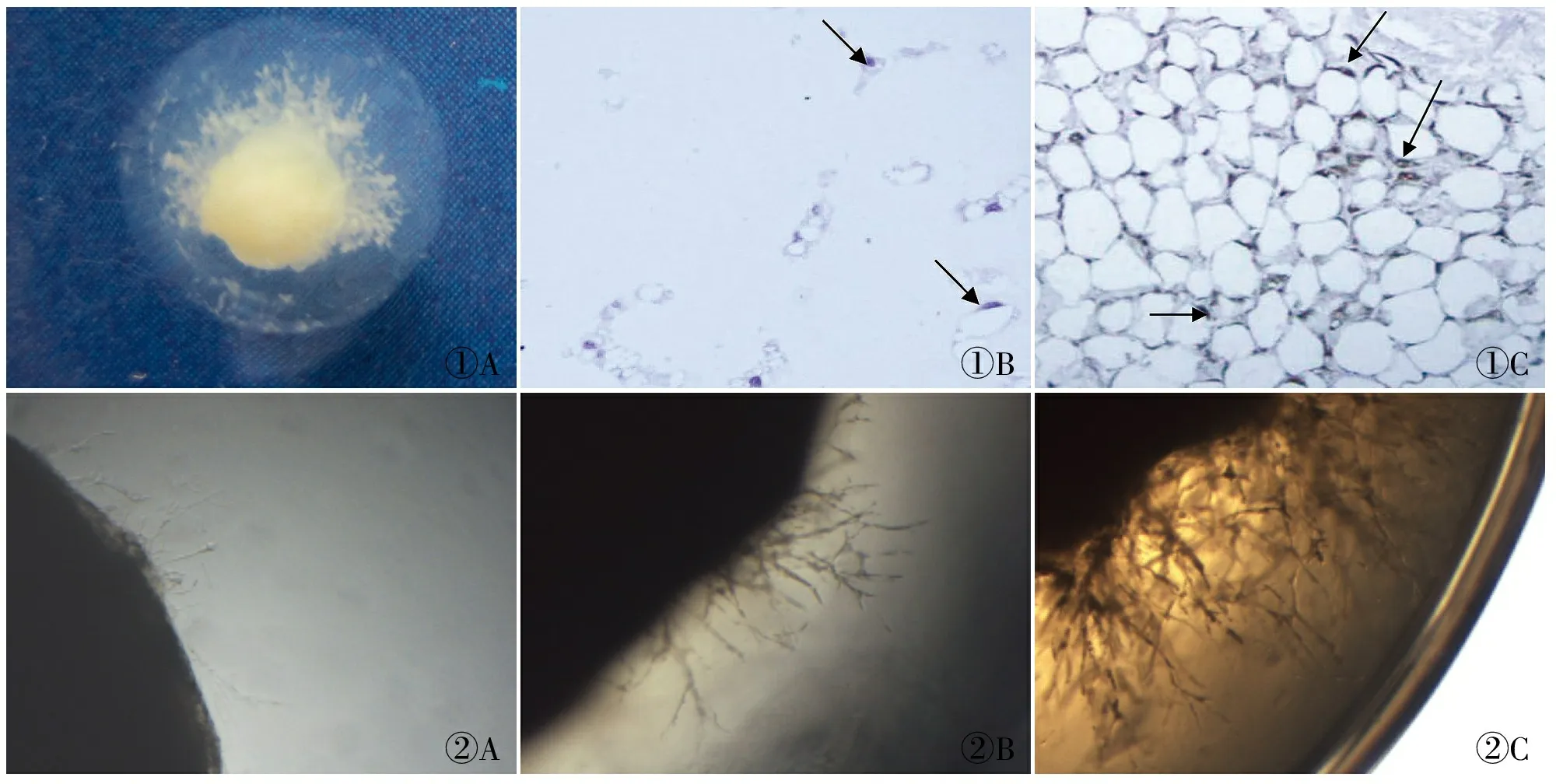
1.7 免疫组化法测定CD31在纤维蛋白-凝血酶胶基质血管内皮细胞中的定位 10%中性福尔马林固定,将胶块完整取出(图1),石蜡包埋切片,用Tris-EDTA缓冲液(pH 9.0)进行热修复,PBS缓冲液代替一抗作为空白对照,其余步骤同上,苏木精对比染色。结果判断:在胞膜/胞质内出现棕黄色颗粒为阳性标准。
2 结果
2.1 胶中成分的鉴定 免疫组化检测胶中的血管样结构CD31的表达,苏木精对比染色。结果显示为阳性,说明其为内皮细胞来源,因此确定胶中的结构为血管(图1)。
2.2 血管生成情况 倒置相差显微镜×4下观察各组血管生成情况,结果显示(图2),U251-MMP-26组血管长,分支多,密度大,所占面积大,呈多层分布;而U251组和U251-pcDNA3.1组血管短,分支少,密度小,所占面积较小,分布稀疏。
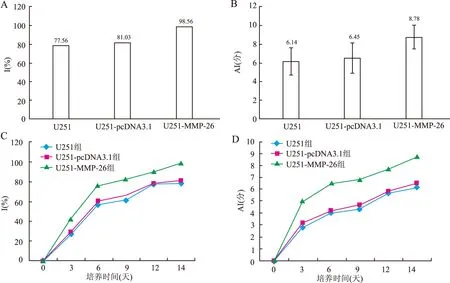
2.3 各组I%和AI 统计第14天各组的I%和AI,结果显示(图3A、B),U251-MMP-26组I%和AI均较空白组U251和空载组U251-pcDNA3.1明显(P均<0.05);随着时间的发展,14天中U251-MMP-26组的I%(图3C)和AI(图3D)的发展趋势也较U251组和U251-pcDNA3.1组明显。
2.4 RT-PCR检测肿瘤组织中MMP-26、VEGF mRNA的表达 VEGF有多种不同的mRNA拼接产物,本实验选用引物可扩增出VEGF121(265 bp)、VEGF165(407 bp)和VEGF189(479 bp)3条扩增带(图4)。MMP-26 mRNA在U251-MMP-26组高表达(1.26±0.02),而在空白组U251(0.26±0.03)和空载组U251-pcDNA3.1(0.27±0.03)中弱表达;而VEGF mRNA在U251-MMP-26组(1.21±0.01)的表达水平明显强于空白组U251(0.64±0.00)和空载组U251-pcDNA3.1(0.66±0.00)(t=0.008,P<0.01),而U251组和U251-pcDNA3.1组之间的表达差异无统计学意义(P>0.05)。
①A①B①C②A②B②C
图1 胶中的血管样结构及成分鉴定:A.胶中的血管样结构;B.HE对比染色(箭头所指为内皮细胞);C.血管样结构表达CD31(箭头所指为内皮细胞),SP法 图2 肿瘤组织块血管长入胶中的情况:A.U251;B.U251-pcDNA3.1;C.U251-MMP-26
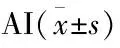
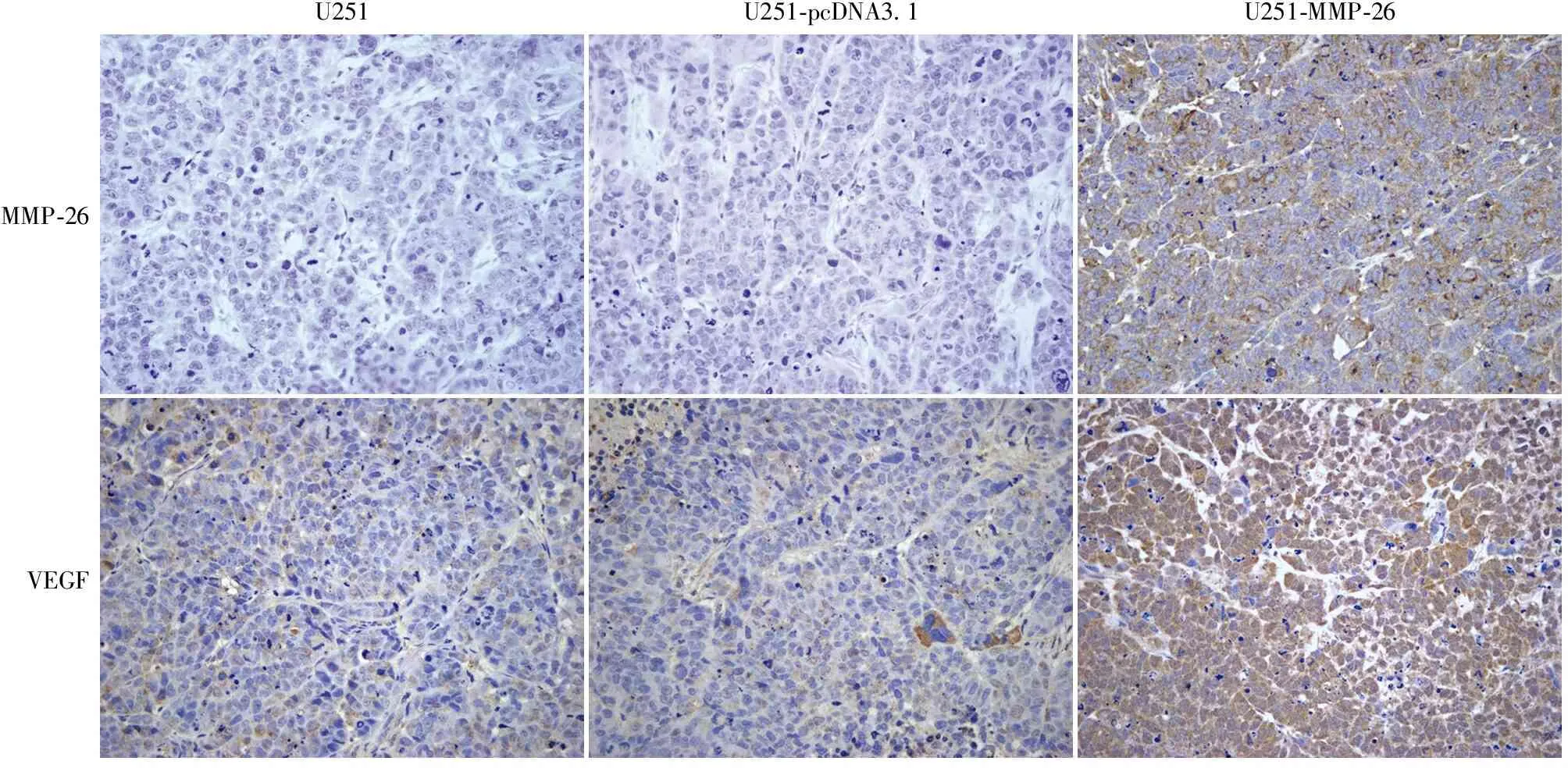
2.5 免疫组化法检测肿瘤组织中MMP-26、VEGF蛋白的表达 MMP-26蛋白在U251-MMP-26组中呈强阳性,在空白组U251和空载组U251-pcDNA3.1中几乎无表达(图5);VEGF蛋白在U251-MMP-26组中的表达明显强于空白组U251和空载组U251-pcDNA3.1(t=0.005,P<0.01,图5),而U251组与U251-pcDNA3.1组之间差异无统计学意义(P>0.05)。
3 讨论
肿瘤血管新生是恶性肿瘤的特征,也是其演进过程中最关键的因素,能促进肿瘤的快速生长及转移[2]。恶性肿瘤细胞的转移是一个复杂的、多阶段的过程,包括肿瘤细胞从原发部位脱离、侵入淋巴管或血管,然后在远处形成新的肿瘤[8-9]。阻碍恶性肿瘤细胞侵袭和转移的主要屏障是ECM和基膜,参与降解ECM和基膜的蛋白裂解酶包括多种,其中MMPs家族发挥了重要作用。MMPs家族是一组锌离子依赖的蛋白水解酶,有广泛的底物特异性,并通过降解ECM和基膜参与血管新生、淋巴管生成及恶性肿瘤的侵袭和转移[3,10]。

图4 异种移植瘤组织中MMP-26、VEGF mRNA的表达
M.Marker DL2000标志物;1.U251;2.U251-pcDNA3.1;3.U251-MMP-26
截至目前,MMPs家族至少包括28个成员,其中,MT1-MMP通过纤维蛋白原的裂解活性促进肿瘤血管新生[11],而MMP-26以与MT1-MMP非常相似的方式降解纤维蛋白原。因此,MMP-26可能参与血管新生的过程。MMP-9是重要的明胶酶,具有裂解基膜成分的活性,并通过诱导癌细胞释放VEGF促进肿瘤血管生成,而MMP-26通过激活MMP-9促进肿瘤生长[8,11-14]。MMP-26是MMPs家族的新成员,广泛表达于上皮组织源性的恶性肿瘤,已有实验[4]表明,MMP-26在体外能促进U251细胞的侵袭和迁移,体内能促进U251的局部浸润和血管生成;MMP-26的过表达能促进乳腺癌细胞的生长、浸润及诱导血管生成[5]。众所周知,内皮细胞生长因子(vascular endothelial growth factor, VEGF)是最强的引起内皮细胞活化增殖的因子之一,可刺激内皮细胞分裂、迁移,降解原始血管的基膜及形成新的毛细血管[15]。由于前mRNA的切割位点不同,一种VEGF基因会表达出多种亚型,如VEGF121、VEGF165和VEGF189(数字代表VEGF蛋白的氨基酸数目),其中VEGF165在缺氧诱导的血管生成中发挥了重要作用[16],对于VEGF121和VEGF165亚型,其氨基酸链越短,其促内皮细胞有丝分裂活动越活跃,即VEGF121 较其他长链的亚型有更强的促血管生成作用[17]。
对血管生成的研究,体外主要应用内皮细胞的迁移实验及小管形成实验,由于两者只能反映单层内皮细胞的增殖,不能反映静止的内皮向增殖表型的转化,因此不能更好地反映抗血管药物应用后的作用。此外,两者均无肿瘤细胞,并不能反应肿瘤细胞与内皮细胞之间的相互作用,缺乏体内的微环境,尤其是肿瘤微环境,因此不能代表体内情况。体内实验主要采用肿瘤细胞诱导血管生成模型观察裸鼠背部皮肤及裸鼠异种移植瘤模型计数各种肿瘤组织中的微血管密度,这两种实验方法只能体现肿瘤细胞与血管之间的二维关系,并不能体现肿瘤微环境中两者之间的空间立体关系。因此,为进一步明确MMP-26在肿瘤血管新生中的作用,以及更直观地观察MMP-26对肿瘤血管生成的影响,本实验应用稳定转染MMP-26的人脑胶质瘤细胞系U251构建裸鼠异种移植瘤模型,建立体外基于人肿瘤组织块(2 mm×1 mm)的三维血管生成模型,该模型保持了完整的肿瘤组织微环境,而纤维蛋白-凝血酶胶为血管及肿瘤组织生长提供了网架结构,由于胶中只含有几种特定的血管生长因子,因此其低血清环境使得血管生长速度明显高于肿瘤组织,明显地减少了肿瘤生长的干扰,利于血管生成的测定。
U251U251⁃pcDNA3 1U251⁃MMP⁃26MMP⁃26VEGF
图5 MMP-26蛋白、VEGF蛋白在各组异种移植瘤组织中的表达,SP法
倒置相差显微镜观察结果显示:U251-MMP-26组的血管生长情况较空白组U251和空载组U251-pcDNA3.1组血管长,分支多,密度大,所占面积大;而I%和AI的结果也显示,U251-MMP-26组较空白组U251和空载组U251-pcDNA3.1明显(P<0.05),说明MMP-26能有效诱导肿瘤微环境中的血管新生及促进肿瘤组织中的微血管侵入周围间质组织(纤维蛋白-凝血酶胶),这样,既为胶质瘤的生长提供了丰富的营养物质,同时也为胶质瘤的浸润、侵袭和转移提供了途径。RT-PCR及免疫组化结果显示:U251-MMP-26组中MMP-26和VEGF的mRNA和蛋白表达明显强于未转染组U251和空载组U251-pcDNA3.1 (P<0.01),说明MMP-26转染可在mRNA水平和蛋白水平明显增强VEGF的表达,因此,MMP-26诱导肿瘤组织中的血管新生可能是最终通过增强VEGF的表达水平实现的,然而具体的机制尚不明确,需进一步实验证明。
目前,抗肿瘤血管生成疗法在临床上效果甚微,因此,需要一种更好的模型对血管生成进行全面、透彻的观察和理解,进而为抗肿瘤药物的研制和疗效观察提供更有效地方法。
[1] 范耀东, 边 慧, 瞿家桂, 等. 咖啡因对体外培养U251人胶质瘤细胞的影响[J]. 临床与实验病理学杂志, 2016,32(5):544-547.
[2] Rouasari L C, West J L. Studying the influence of angiogenesis in vitro cancer model systems[J]. Adv Drug Deliv Rev, 2016,97:250-259.
[3] Abdelfattah N S, Amgad M, Zayed A A,etal. Molecular underpinnings of corneal angiogenesis: advances over the past decade[J]. Int J Ophthalmol, 2016,9(5):768-779.
[4] Deng Y P, Li W, Li Y L,etal. Expression of Matrix Metalloproteinase-26 promotes human glioma U251 cell invasion in vitro and in vivo[J]. Oncol Rep, 2010,23(1):69-78.
[5] Yang H F, Li Y L, Li W,etal. Roles of matrixmetalloproteinase-26 in the growth, invasion and angiogenesis of breast cancer[J]. Oncol Lett, 2012,4(4):832-836.
[6] Gulec S A, Woltering E A. A new in vitro assay for human tumor angiogenesis: three-dimensional human tumor angiogenesis assay[J]. Ann Surg, 2004,11(1):99-104.
[7] 赵瑞君, 谢春伟, 陈 戈, 等. PTP1B在ER阳性乳腺癌中的表达及临床预后意义[J]. 临床与实验病理学杂志, 2016,32(5):492-495.
[8] Wang J J, Sanderson B J, Zhang W. Significant anti-invasive activities of mangostin from the mangosteen pericarp on two human skin cancer cell lines[J]. Anticancer Res, 2012,32(9):3805-3816.
[9] Kessenbrock K, Wang C Y, Werb Z. Matrix metalloproteinases in stem cell regulation and cancer[J]. Matrix Biol, 2015,44:184-190.
[10] Sbardella D, Fasciglione G F, Gioia M,etal. Human matrix metalloproteinases: an ubiquitarian class of enzymes involved in several pathological processes[J]. Mol Aspects Med, 2012,33(2):119-208.
[11] Pittayapruek P, Meephansan J, Prapapan O,etal. Role of matrix metalloproteinases in photoaging and photocarcinogenesis[J]. Int Mol Sci, 2016,17(6):868-887.
[12] Poswar F O, Fraga C A, Farias L C,etal. Immunohistochemical analysis of TIMP-3 and MMP-9 in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma[J]. Pathol Res Pract, 2013,209(11):705-709.
[13] Oliveira Poswar de F, Carvalho Fraga de C A, Gomes E S B,etal. Protein expression of MMP-2 and MT1-MMP in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma[J]. Int Surg Pathol, 2015,23:20-25.
[14] Xia Y H, Li M, Fu D D,etal. Effects of PTTG down-regulation on proliferation and metastasis of the SCL-1 cutaneous squamous cell carcinoma cell line[J]. Asian Pac Cancer Pre, 2013,14(11):6245-6248.
[15] Shibuya M. VEGF-VEGFR signals in health and disease[J]. Biomol Ther (Seoul), 2014,22(1):1-9.
[16] Zhang H T, Scott P A, Morbidelli L,etal. The 121 amino acid isoform of vascular endothelial growth factor is more strongly tumorigenic than other splice variantsinvivo[J]. Br Cancer, 2000,83(1):63-68.
[17] Imamura T. Physiological functions and underlying mechanisms of fibroblast growth factor (FGF) family members: recent findings and implications for their pharmacological application[J]. Bio Phar Bull, 2014,37(7):1081-1089.
Effect of matrix metalloproteinase-26 on human glioma angiogenesis
ZHANG Yu-hui1,2, LI Wei1, LI Xiang-xiang1, FANG Bo1, CHANG Xiao-na1, TANG Chen-chen1, ZHANG Li-hong1, LI Yi-lei1
(1TheKeyLaboratoryofPathobiology,MinistryofEducation,NormanBethuneCollegeofMedicine,JilinUniversity,Changchun130021,China;2DepartmentofPathology,FenyangCollegeofShanxiMedicalUniversity,Fenyang032200,China)
Purpose To investigate the effect of MMP-26 on human glioma angiogenesis and the possible mechanism. Methods The MMP-26 plasmid and empty plasmid pcDNA3.1 were stably transfected into U251 cells to establish a nude mice xenograft model, and then an in vitro human tumor tissue-based three-dimensional angiogenic model. Tissue disks were visually assessed over time to determine the percentage of wells that developed an angiogenic response(I%) and the density and length of neovessel growth were graded at intervals using a semiquantitative visual growth-rating scheme (angiogenic index, AI, 0-16 scale) in groups of MMP-26 transfected U251 cells (U251-MMP-26), pcDNA3.1 vector-transfected U251 cells (U251-pcDNA3.1) and non-transfected U251 cells(U251). RT-PCR and immunohistochemistry were used to detect the expression of mRNA and protein of MMP-26 and VEGF in groups of U251-MMP-26, U251-pcDNA3.1 and U251. Immunohistochemical localization of CD31 was determined in the endothelial tubes invading the fibrin-thrombin clot matrix. Results Immunohistochemical endothelial cell markers CD31 was positive in the vascular tubes invading the fibrin-thrombin clot matrix, confirming their endothelial origin. The angiogenesis results showed that difference of length of micro capillaries, density of branches, and the area occupied between U251-MMP-26 groups and control groups were significant. The percentage of tumor implants that developed invasion (I%) and the angiogenic index AI in U251-MMP-26 group on day 14 were higher than those of U251-pcDNA3.1 group and U251 group (P<0.05). The trends of I% and AI in 14 days were significant compared with those in control groups. The expression of mRNA and protein of MMP-26 and VEGF in U251-MMP-26 group was significantly higher in U251-MMP-26 group than those in U251-pcDNA3.1 group and U251 group(P<0.01). Conclusion The effect of MMP-26 on promoting glioma angiogenesis may be related to the increased expression of VEGF, which can be used as targets for anti-tumor therapy.
brain neoplasms; human brain glioma; MMP-26; VEGF; angiogenesis
国家自然科学基金(30870970)
1吉林大学病理生物学教育部重点实验室,长春 1300212山西医科大学汾阳学院病理教研室,汾阳 032200
张玉辉,女,硕士,助教。E-mail: 790322454@qq.com 李一雷,男,博士,教授,硕士生导师,通讯作者。Tel: (0431)856191021,E-mail: liyl@jlu.edu.cn
时间:2017-6-20 11:18 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.007.html
R 739.41
A
1001-7399(2017)06-0623-06
10.13315/j.cnki.cjcep.2017.06.007
接受日期:2017-03-02
