胃癌组织microRNA表达谱检测及生物信息学分析
2017-07-31黄幼生张艺馨罗志飞薛逢贵
黄幼生,解 娜,张艺馨,罗志飞,薛逢贵
·论 著·
胃癌组织microRNA表达谱检测及生物信息学分析
黄幼生,解 娜,张艺馨,罗志飞,薛逢贵
目的 探讨微小RNA(microRNA, miRNA)在胃癌组织中的表达特征。方法 采用Exiqon miRNA芯片检测3对胃癌组织及其配对正常胃黏膜组织中miRNA差异表达情况,随机选取10个上调或下调差异表达的miRNA应用qPCR技术验证;应用生物信息学分析差异表达的miRNA及其靶向基因在胃癌发生、发展中的作用。结果 芯片结果显示,在3对胃癌组织中有111个miRNA出现差异表达(差异倍数>2,P<0.05),其中上调表达95个,下调表达16个。进一步行qPCR验证的10个miRNA的表达情况与miRNA芯片结果一致(P=0.040)。聚类分析显示胃癌组织与癌旁组织存在明显的差异表达,基因本体(gene ontology, GO)及pathway分析显示差异表达的miRNA涉及胃癌的凋亡、周期转换、分化、侵袭、转移及各种肿瘤通路的激活等。结论 胃癌组织中miRNA存在异常表达,可能涉及胃癌的发生、发展。
胃肿瘤;miRNA;差异表达;生物信息学;miRNA芯片
胃癌是全球最常见的恶性肿瘤之一,在我国发病率及病死率均位居恶性肿瘤的第2位[1-2]。胃癌组织学上存在高度的异质性,阐明胃癌发病的分子机制是改善治疗、提高患者预后的关键。微小RNA(microRNA, miRNA)是一类大小21~25个核苷酸的非编码RNA(noncoding RNAs, ncRNAs),一般来源于染色体的非编码区域,由约70 nt大小的可形成发夹结构的前体加工而来,其作用是在转录水平上对基因表达产生抑制性作用[3]。越来越多的资料显示,miRNA具有表达的特异性,能够准确区分组织的来源,其结构或表达异常与肿瘤的发生密切相关,涉及肿瘤的浸润、转移、分期及预后等[3-6]。这些研究表明,miRNA在肿瘤组织中的异常表达具有辅助诊断及靶向开发治疗药物的潜力。本实验应用Exiqon miRNA寡核苷酸芯片检测3对胃癌及其配对正常胃黏膜组织中的miRNA表达特征,行qPCR验证。应用生物信息学分析差异表达的miRNA生物学功能及其对胃癌发生、发展中所起的作用,为进一步阐明胃癌的发病机制及探索开发胃癌分子靶标奠定分子理论基础。
1 材料与方法
1.1 材料 收集海南医学院第一附属医院2014年1月新鲜切除的标本,切除后立即液氮保存,选择3对胃癌及其配对正常胃黏膜组织(距离肿瘤边缘5 cm)。患者信息包括年龄、性别、发生部位等均从临床病例信息中心获取,患者术前均未接受化疗或放疗,病例诊断、分期、分型由两位高级职称病理专家根据石蜡组织HE切片确诊。标本使用已获得患者知情同意并经过海南医学院第一附属医院伦理委员会讨论通过。
1.2 主要试剂 TRIzol Reagent为Invitrogen Life Technologies产品;RNasey Mini试剂盒购自QIAGEN公司;miRCURYTM Array Power标记试剂盒(Cat #208032-A)、miRCURYTM LNA芯片(v.18.0)为Exiqon公司产品。miRcute miRNA第一链cDNA合成试剂盒、miRcute miRNA荧光定量检测试剂盒购自北京天根生物公司。
1.3 组织总RNA提取及纯化 对胃癌及其配对组织中加入适量TRIzol(1 mL/20 mg),使用BioPulverizer进行组织破碎匀质,随后RNA提取及纯化步骤按TRIzol及RNasey Mini试剂盒使用说明书进行。使用NanoDrop ND-1000测量纯化后的RNA浓度,凝胶电泳检测RNA完整性。
1.4 RNA标记与芯片杂交 抽提的RNA通过质检后,使用miRCURYTM Array Power标记试剂盒对miRNA进行标记。具体操作由上海康成生物公司完成,简而言之,1 μg的RNA加水至2 μL,加1 μL的CIP Buffer和CIP酶(Exiqon)。混合后置于37 ℃下30 min。随后,将样品置于95 ℃下5 min终止反应。加入3 μL Labeling Buffer,1.5 μL Fluorescent Label (Hy3),2.0 μL DMSO,2.0 μL Labeling Enzyme。在16 ℃下反应1 h后将样品置于65°C下15 min终止反应。标记完成后,将样品与miRCURYTM LNA Array (v.18.0)芯片杂交,根据Exiqon的实验方法进行:(1)25 μL样品与25 μL杂交缓冲液混合,95 ℃下变性2 min,然后置于冰上2 min。(2)与芯片在56 ℃下杂交16~20 h,杂交系统为Nimblegen Systems, Inc., Madison, WI, USA。(3)杂交完成后,使用Wash Buffer Kit (Exiqon公司)清洗芯片,应用Axon GenePix 4000B芯片扫描仪扫描芯片。
1.5 数据分析 使用GenePix Pro 6.0读取芯片扫描图像,并提取探针的信号值。相同的探针取中值合并。保留在所有样品中均≥30.0的探针,对全部芯片进行中值标准化,筛选差异表达探针。使用Fold change(>2.0)和P值(P<0.05)筛选两组样品间差异表达的miRNA。最后,对差异表达miRNAs进行聚类并绘制聚类图。差异表达的miRNA Raw 数据提交上传至美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的基因表达综合数据库(Gene Expression Omnibus database, GEO数据库),通过号为GSE78091。
1.6 qPCR检测 选取10个差异表达的miRNA进行qPCR验证,模版为上述3对胃癌及其配对正常胃黏膜组织标本。应用Primer 6.0引物设计软件设计miRNA引物,引物合成由英骏生物公司完成,通用引物序列为5′-GTGCGTGTCGTGGAGTCG-3′,miRNA特异性引物序列见表1。应用ABI ViiA7 Real-time PCR仪进行逆转录及PCR反应:miRNA逆转录采用miRcute miRNA第一链cDNA合成试剂盒,具体操作按试剂盒说明书进行。PCR反应试剂盒采用miRcute miRNA 荧光定量检测试剂盒。反应体系:2×SYBR Green mix 10 μL,通用引物(10 μmol/L)0.4 μL,特异引物(10 μmol/L)0.4 μL,cDNA 1 μL,50×ROX Reference Dye 1 μL,RNase-free水补充至体积20 μL。反应条件:94 ℃预反应2 min,94 ℃ 20 s、60 ℃ 34 s,共40个循环。采用2-ΔΔCt法计算miRNA相对表达值,U6 snRNA为内参。PCR结果应用SPSS 18.0软件Studentt检验进行统计学分析,显著性检验水准α=0.05。
1.7 生物信息学分析 检索miR2Disease与miRCancer数据库,查询癌症相关miRNA, BioVenn软件在线分析,查找本文中的差异表达miRNA与miR2Disease与miRCancer数据库肿瘤相关miRNA三方重叠数据。利用在线miRTarBase软件(http://mirtarbase.mbc.nctu.edu.tw/)下载差异表达miRNA实验已验证的靶向基因,并应用在线DAVID系统(http://david.ncifcrf.gov/)将获得的靶向基因进行基因本体(gene ontology, GO)及KEGG pathways富集分析。

表1 miRNA特异性引物及U6引物列表
2 结果
2.1 总RNA提取质量分析 为尽可能保持组间数据的一致性,本组实验选择了病理信息及临床资料相对接近的3对胃癌病例。3例均为男性,55~58岁(平均56.7岁),TNM分期ⅢA的弥漫性胃癌(Lauren分类)患者。
3对胃癌及其配对组织提取的总RNA经NanoDrop ND-1000检测,各标本总RAN OD260/280在1.97~2.01之间,总含量均超过30 μg;凝胶电泳鉴定显示,各标本均有3条清晰的泳带,28S、18S清晰明亮(图1)。这些结果表明提取的总RNA含量充足,可用于下一步芯片检测及qPCR分析。
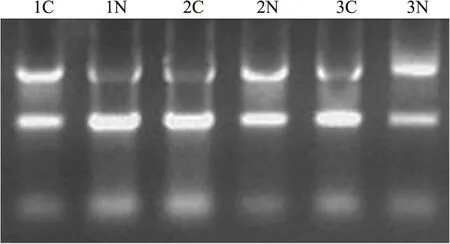
图1 总RNA琼脂糖凝胶电泳图1C~3C.胃癌组织;1N~3N.正常胃黏膜组织
2.2 胃癌组织miRNA表达芯片结果分析 3对病例经芯片杂交,GenePix Pro 6.0读取芯片扫描图像,SAM软件数据分析筛选。有超过2 000个miRNA检测到表达,400个miRNA在胃癌组织及其正常胃黏膜组织间出现不同程度的差异表达(具体请查询GEO:GSE78091)。其中,相对正常胃黏膜组织,有95个miRNA在胃癌组织内出现显著的上调表达,16个出现显著的下调表达(差异倍数>2,P<0.05)(图2A),前10个上调及下调表达的miRNA见表2。
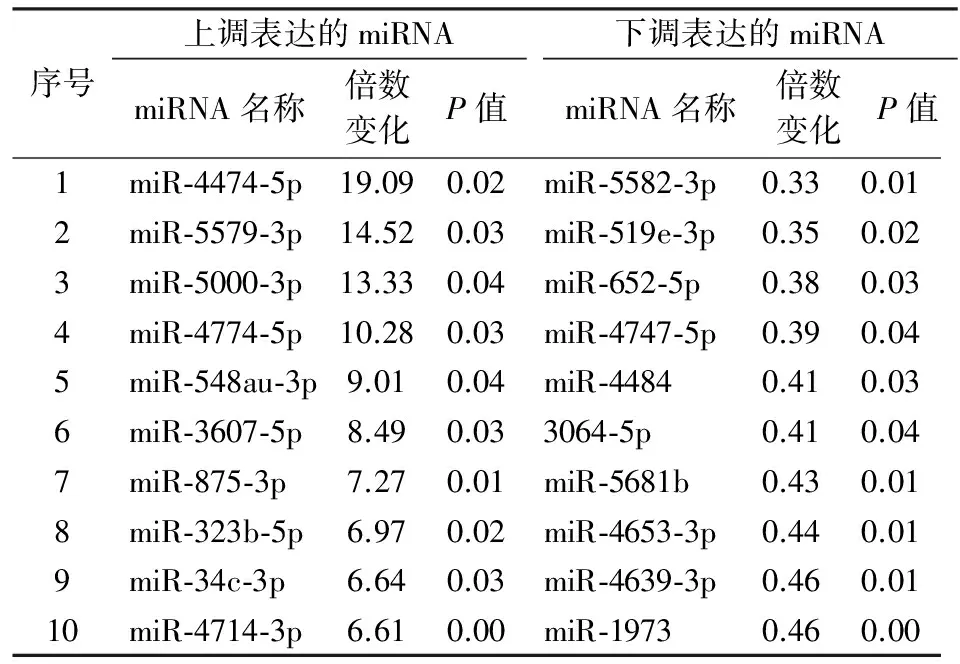
表2 差异表达的前10个miRNA(胃癌/配对正常胃黏膜组织)
为观察胃癌及其正常胃黏膜组织中miRNA表达谱是否具有显著差异性,根据芯片中所有miRNA的表达特征,无监督层次聚类与相关分析被执行。结果显示6组miRNA很清晰的分为两大组,对应胃癌组及其配对组(图2B),表明大量的miRNA在胃癌组织中出现了明显的表达变化。
2.3 qPCR验证 为验证miRNA芯片数据的可靠性,10个差异表达的miRNA(7个上调表达,3个下调表达)被随机选取执行qPCR检测。结果显示,在这3对胃癌组织中,有7个miRNA出现上调表达,2个出现下调表达,1个未检测出差异性表达。与芯片检测的结果基本一致(P=0.040),表明miRNA芯片检测结果真实有效(图3)。
2.4 生物信息学分析 检索miR2Disease与miRCancer数据库,共获得780个癌症相关miRNA,其中与胃癌相关的miRNA共256个。将本组中的差异表达miRNA与这两群数据相比较,通过BioVenn在线软件分析发现有24个miRNA与两大数据库肿瘤相关miRNA重叠,其中与胃癌相关的17个,有8个miRNA表达与其它已验证的数据一致,包括:hsa-miR-106b、hsa-miR-1284、hsa-miR-138、hsa-miR-191、hsa-miR-20a、hsa-miR-23b、hsa-miR-543、hsa-miR-98。
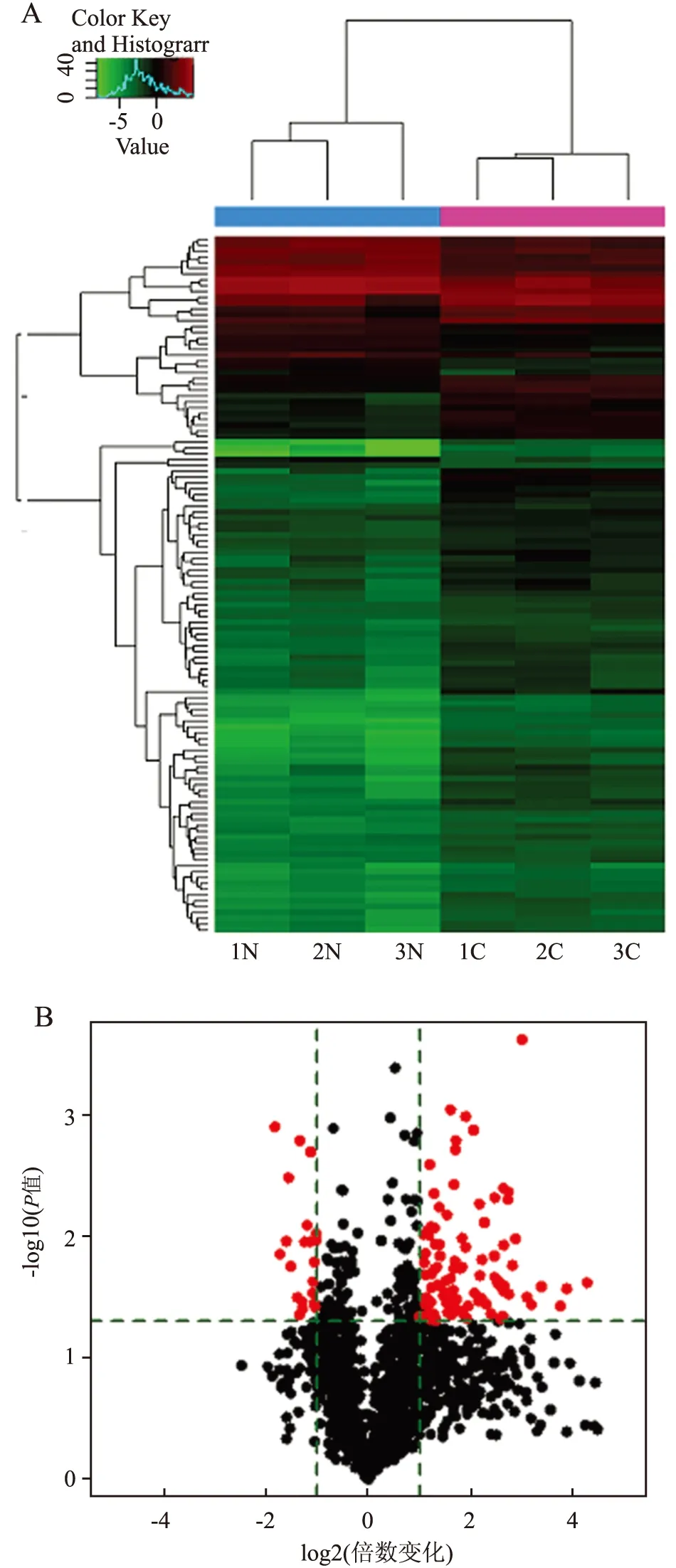
图2 胃癌组织miRNA差异表达谱分析图
A.聚类分析图:1N~3N.配对的正常胃黏膜组织;1C~3C.胃癌组织;红色表示高表达miRNA,绿色表示低表达miRNA;B.相对配对组织胃癌miRNA表达变化火山图:左侧为下调表达,右侧为上调表达的miRNA;竖绿线以外点为差异表达超过2倍数量的miRNA,横绿线以上表示P>0.05的miRNA,红色点代表差异有统计学意义的差异表达miRNA
从mitarBASE数据库[7]下载已验证的这8个miRNA的靶向基因(至少有两种方法证实),共获得93个基因。利用DAVID数据库提供的基因功能注释工具(GO及KEGG pathways富集分析)对这93个靶基因进行功能和调控通路分析,结果表明,这些miRNA的异常表达可能与基因表达、DNA转录、细胞周期、细胞凋亡、细胞增生等调控失常有关,涉及miRNA肿瘤相关、p53及Akt等信号途径的激活(图4)。
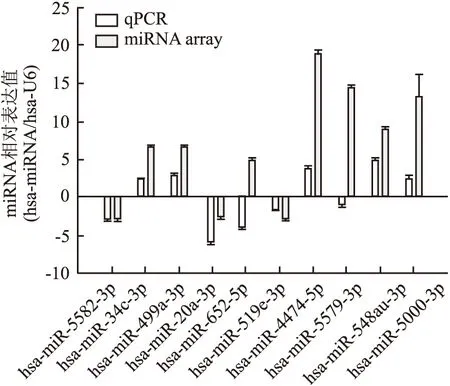
图3 miRNA差异表达qPCR及芯片结果对比图(胃癌/配对组织)
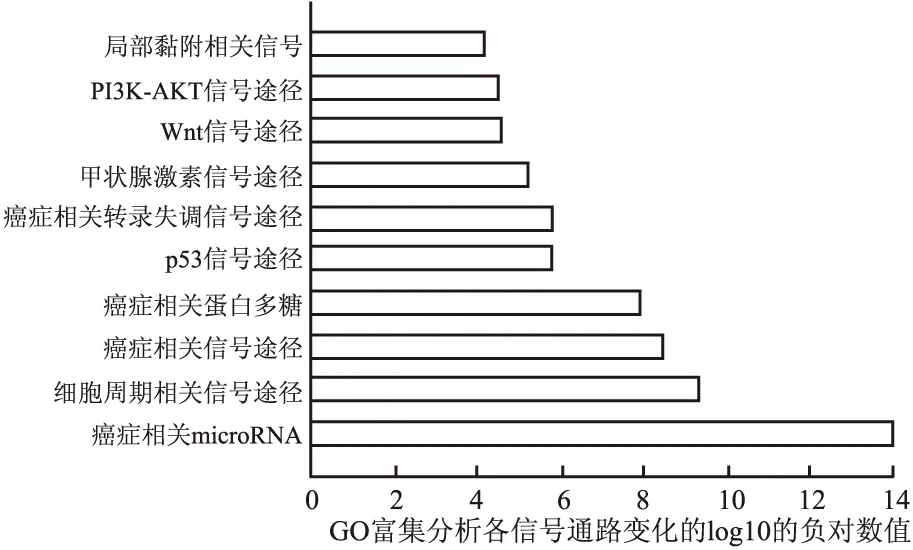
图4 KEGG分析P值前10个信号途径
3 讨论
目前在人类组织中发现近2 000个miRNA,调控大概1/3的人类基因表达。miRNA对靶基因mRNA的作用取决于其与靶基因转录体序列互补的程度,通过与靶基因完全互补结合,切割靶mRNA,或与靶基因不完全互补结合,抑制靶基因的翻译,与靶基因互补结合时,直接靶向切割mRNA;当与靶基因不完全结合时,起调节基因表达的作用[3-4]。随着对miRNA研究和认识的加深,异常表达的miRNA可引起相关癌基因的激活或抑癌基因的失活,促进肿瘤的发生、发展被证实,参与调控肿瘤细胞凋亡、血管生成、细胞周期调节及肿瘤的浸润、转移等[3-4]。
基因芯片是筛选疾病相关miRNA最常用的方法之一,应用该项技术发现人类大部分常见恶性肿瘤均有miRNA的表达异常[3-5,8]。Volinia等[6]应用基因芯片研究540例肿瘤组织标本的miRNA表达模式,发现miRNA在不同肿瘤组织中的表达具有组织特异性,上调表达的miRNA-191、miRNA-59、miRNA-17、miRNA-20a、miRNA-92、miRNA-15、miRNA-106a等21个miRNA组合性检测能正确区分胃癌、胰腺癌、乳腺癌、前列腺癌、结肠癌和肺癌组织。本实验利用Exiqon miRNA芯片检测3对胃癌组织及其配对正常胃黏膜组织,发现在胃癌组织中有88个miRNA表达上调,21个表达下调,qPCR的验证结果与芯片一致,表明胃癌组织中存在miRNA的表达异常。
近年来,关于胃癌组织miRNA异常表达的报道逐渐增多[3,9-11]。Guo等[9]用芯片扫描分析发现,在胃癌组织中有12个miRNA表达增高。Ueda等[10]分析353对胃癌组织miRNA表达特征发现,有22个miRNA表达上调,13个表达下调,与胃癌的分型、预后、转移等有关。阳圣等[11]分析21对胃癌病例,发现有88个miRNA表达异常。最近研究显示,miR-340[12]、miR-181a-5p[13]、miR-196b-5p[14]、miR-375[14]等在胃癌中也出现异常表达,与胃癌的发生、发展有关。这些研究显示胃癌组织中存在多量miRNA的异常表达,但不同的研究表达异常的miRNA重合率较低,重复性差。本文通过检索miR2Disease与miRCancer数据库,共获得256个胃癌相关miRNA,来源于400篇文献。本文芯片分析发现的111个miRNA只有24个先前有过报道,仅17个曾报道与胃癌相关,该17个miRNA中有8个与本文数据完全一致。造成重复性差的原因在文献中没有得到很好的阐明,作者认为可能与胃癌组织高度异质性、个体、种族的差异性及采用的研究方法不同有关。
miRNA虽只有短短22个核苷酸,却通过靶向序列的互补性调控大量的靶基因,发挥其生物学功能,因而挖掘miRNA的靶向基因是研究miRNA功能的重要手段[3-5,8]。目前,预测miRNA靶向基因的在线工具多种多样,比较有名的有Targetscan、miRbase和pictar等[15]。然而这些软件预测的靶向基因重复性较差,预测出来的靶向基因数量庞大,验证效果并不是很理想,说明依据miRNA和基因结构互补性预测靶向基因的方式还需要很大的提高。目前,有不少miRNA数据库可以检索已被实验证实的miRNA靶向基因,利用这些数据库分析miRNA的功能更加简单易行。本文通过检索mitarBASE数据库[7]获得93个至少通过两种方法验证的胃癌相关miRNA(hsa-miR-106b、hsa-miR-1284、hsa-miR-138、hsa-miR-191、hsa-miR-20a、hsa-miR-23b、hsa-miR-543、hsa-miR-98)靶向基因,随后应用DAVID 数据库提供的基因功能注释工具发现这些miRNA的表达涉及基因表达、DNA转录、细胞周期、细胞凋亡、细胞增生等调控,可能与miRNA肿瘤相关、p53及Akt等信号途径激活有关,且这些调控功能及涉及的信号途径大多已被文献证实[3-5,8]。
综上所述,胃癌组织中存在多量的miRNA表达异常,这些异常表达的miRNA涉及胃癌的发生、发展过程。更进一步的实验证实已发现的差异表达miRNA的作用方式及功能有助于阐明胃癌发生、进展的分子机制。
[1] Tan P, Yeoh K G. Genetics and molecular pathogenesis of gastric adenocarcinoma[J]. Gastroenterology, 2015,149(5):1153-1162.e3.
[2] Chen W, Zheng R, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] Jiang C, Chen X, Alattar M,etal. MicroRNAs in tumorigenesis, metastasis, diagnosis and prognosis of gastric cancer[J]. Cancer Gene Ther, 2015,22(6):291-301.
[4] 龚 勇, 谢海龙. 肿瘤中miRNA异常表达的分子调控机制及研究进展[J]. 临床与实验病理学杂志, 2014,30(10):1152-1155.
[5] He M, Zhou W, Li C,etal. MicroRNAs, DNA damage response, and cancer treatment[J]. Int J Mol Sci, 2016,17(12):2087-2101.
[6] Volinia S, Calin G A, Liu C G,etal. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl Acad Sci USA, 2006,103(7):2257-2261.
[7] Chou C H, Chang N W, Shrestha S,etal. miRTarBase 2016: updates to the experimentally validated miRNA-target interactions database[J]. Nucleic Acids Res, 2016,44(D1):D239-D247.
[8] 周 学, 杜宜兰, 金 萍, 等. 癌症相关microRNA与靶基因的生物信息学分析[J]. 遗传, 2015,9:855-864.
[9] Guo J, Miao Y, Xiao B,etal. Differential expression of microRNA species in human gastric cancer versus non-tumorous tissues[J]. J Gastroenterol Hepatol, 2009,24(4):652-657.
[10] Ueda T, Volinia S, Okumura H,etal. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis[J]. Lancet Oncol, 2010,11(2):136-146.
[11] 阳 圣, 张 雯, 杨燕青, 等. 胃癌组织miRNA差异表达的初步分析[J]. 上海交通大学学报(医学版), 2010,30(11):1317-1323.
[12] Yu J, Wang R, Chen J,etal. miR-340 inhibits proliferation and induces apoptosis in gastric cancer cell line SGC-7901, possibly via the AKT pathway[J]. Med Sci Monit, 2017,23:71-77.
[13] Mi Y, Zhang D, Jiang W,etal. miR-181a-5p promotes the progression of gastric cancer via RASSF6-mediated MAPK signalling activation[J]. Cancer Lett, 2016,389:11-22.
[14] Lee S W, Park K C, Kim J G,etal. Dysregulation of MicroRNA-196b-5p and microRNA-375 in gastric cancer[J]. J Gastric Cancer, 2016,16(4):221-229.
[15] Agarwal V, Bell G W, Nam J W,etal. Predicting effective microRNA target sites in mammalian mRNAs[J]. Elife, 2015,4:e05005.
Expression profile of microRNAs and bioinformatics analysis in human gastric cancer tissues
HUANG You-sheng, JIE Na, ZHANG Yi-Xin, LUO Zhi-fei, XUE Feng-gui
(DepartmentofPathology,theFirstAffiliatedHospitalofHainanMedicalUniversity,Haikou570102,China)
Purpose This experiment was designed to investigate the expression profile of miRNAs (microRNA) in human gastric cancer tissues. Methods The expression profiles of miRNAs were compared between 3 pairs of GC and adjacent normal tissues using an Exiqon miRNA array, following which quantitative PCR (qPCR) was employed to confirm the results of the miRNA array, and 10 miRNAs were selected. Bioinformatics was used to analyze the biological function of the differentially expressed miRNAs and its target genes in gastric cancer. Results Compared with adjacent mucosal tissues, 95 miRNAs were up-regulated and 16 miRNAs were down-regulated in GC(>2 folds,P<0.05). The qPCR results were consistent with microarray-based expression analysis (P=0.049). Furthermore, the online GO and pathway analysis revealed that miRNAs might involve RNA transcription, RNA metabolism, gene expression, gene silencing, and other biological functions in GC. Conclusion There is abnormal expression of miRNAs in gastric cancer, and the abnormal expression of miRNAs may be related to GC tumorigenesis.
gastric neoplasms; microRNA; differential expression; bioinformatics; microRNA array
国家自然科学基金(81260321)
海南医学院第一附属医院病理科,海口 570102
黄幼生,男,副教授,副主任医师。Tel: (0898)66723333,E-mail: hys768811@163.com
时间:2017-6-20 11:17 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.001.html
R 735.2
A
1001-7399(2017)06-0591-05
10.13315/j.cnki.cjcep.2017.06.001
接受日期:2017-04-14
