β-catenin不同表达模式与结直肠癌临床病理因素的关系
2017-07-31陈顺华曹立宇
金 雯,陈顺华,尹 玉,张 聪,曹立宇
β-catenin不同表达模式与结直肠癌临床病理因素的关系
金 雯1,2,陈顺华1,3,尹 玉1,3,张 聪1,3,曹立宇1,3
目的 探讨β-catenin不同表达模式与结直肠癌组织临床病理因素之间的关系及意义。方法 应用免疫组化法检测181例结直肠癌组织和30例正常结直肠黏膜中β-catenin的表达状况。结果 181例结直肠癌组织中,β-catenin(细胞核)异位表达率为56.9%(103/181),高于正常结直肠黏膜组(P<0.05)。β-catenin细胞核表达与组织分化程度、淋巴结转移及临床Dukes分期有关(P<0.05),与患者年龄、性别、浸润深度等均无关(P>0.05)。β-catenin细胞膜不完整表达与组织分化、肿瘤浸润深度、淋巴结转移状况及Dukes分期等均有关(P<0.05);β-catenin高表达与结直肠癌分化程度、Dukes分期有关(P<0.05)。82例随访病例中,β-catenin细胞核阳性患者的5年生存率均明显低于β-catenin阴性组(P<0.05)。结论 β-catenin在结直肠癌发生中起重要作用,其不同表达模式与结直肠癌进展有关,并有助于预后判断,β-catenin有望成为结直肠癌基因诊断及基因治疗的新靶点。
结直肠肿瘤;β-catenin;表达模式;免疫组织化学
结直肠癌是消化系统常见的恶性肿瘤之一。其发生与一系列癌基因、抑癌基因的改变有关[1]。近年来,有关细胞信号传导通路异常与结直肠癌的关系越来越受到关注,如Wnt/β-catenin信号通路;该信号通路可调节细胞的增殖和分化;β-catenin是Wnt/β-catenin信号通路的关键调节因子,其基因突变与结直肠癌等多种肿瘤有关。β-catenin可表达于细胞膜、细胞质及细胞核[2]。本实验应用免疫组化法检测结直肠癌组织及正常结直肠黏膜中β-catenin的表达状况及表达模式,探讨它们在结直肠癌的发生、发展中的作用及与临床病理学特征的关系。
1 材料与方法
1.1 标本来源 收集安徽医科大学第一附属医院病理科2007年11月~2013年12月手术切除的结直肠癌标本共181例。其中男性112例,女性69例;年龄31~89岁,中位年龄57.5岁。高分化腺癌44例,中分化腺癌105例,低分化腺癌32例;原始病理切片中有明确淋巴结转移者82例(除外影像学、PET-CT诊断及孤立性癌细胞),无明确淋巴结转移者99例;Dukes分期:A期26例;B期53例,C+D期102例。另取30例距癌灶边缘5 cm以上切缘的结直肠黏膜组织作为正常对照。所有病例临床资料齐全,随访信息通过电话或其它途径获得,截止目前,其中82例已随访5年以上。
1.2 试剂及方法 标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片,分别行HE及免疫组化染色。β-catenin多克隆抗体均购自Abcam公司,PBS缓冲液、枸橼酸盐抗原修复液及SP试剂盒均购自福州迈新公司。免疫组化染色步骤按SP染色试剂盒说明书操作,每次实验均设阳性及阴性对照。
1.3 结果判断 β-catenin可定位于细胞膜、细胞质及细胞核内,阳性细胞呈淡黄~棕黄色颗粒,细胞核阳性即为异常表达,若β-catenin≤50%细胞核阳性即判定为低表达,β-catenin>50%细胞核阳性即判定为β-catenin高表达。
1.4 统计学分析 应用SPSS 21.0软件进行统计学分析。率的差异显著性采用χ2检验或Fisher精确概率计算法,两者相关性检验用Spearman相关分析。生存期分析采用Kaplan-Meier法,α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
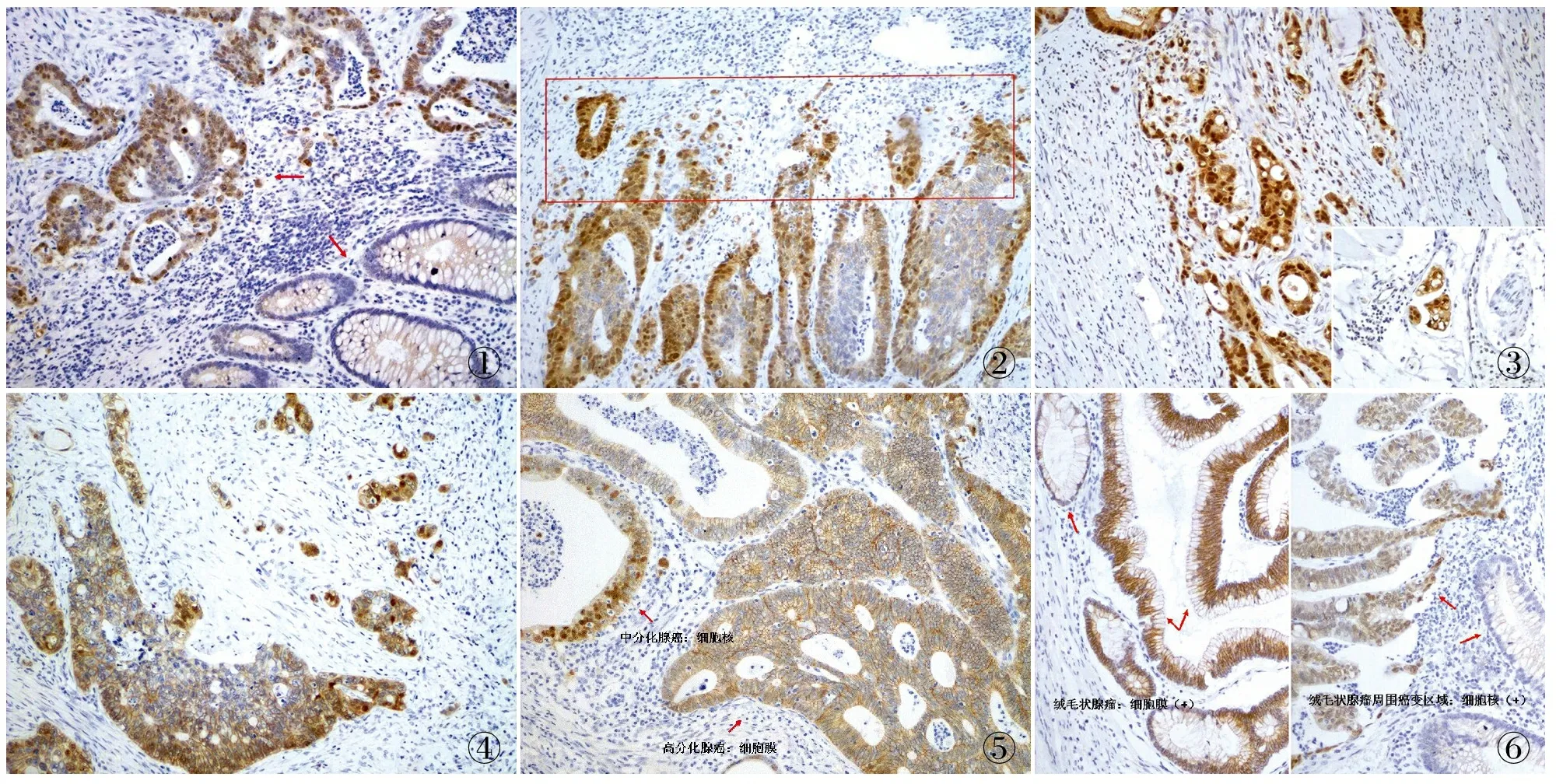
2.1 β-catenin在结直肠癌组织中的表达及意义 β-catenin定位于细胞膜、细胞质及细胞核,正常结直肠黏膜中见细胞膜完整的弱阳性表达,未见细胞质、细胞核或核/质等异常表达;结直肠癌组织中可见细胞膜不同程度的表达(细胞膜部分表达或完全丢失)及细胞质、细胞核或核/质等异位表达(图1~6),核异位表达率为56.9%(103/181),明显高于对应的正常结直肠黏膜组织(P<0.05,表1)。
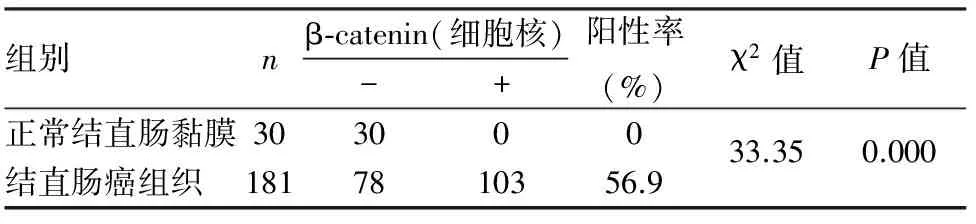
表1 β-catenin在结直肠癌组织和正常结直肠黏膜中的表达
2.2 β-catenin及其不同表达模式与结直肠癌临床病理因素的关系 β-catenin在正常结直肠黏膜中仅见细胞膜完整的弱阳性表达,未见细胞质、细胞核或核/质等异常表达;结直肠癌组织中β-catenin表现为不同程度的细胞膜表达丢失及细胞质、细胞核或核/质等异位表达,在结直肠高分化腺癌中可见较多细胞膜表达,随着组织分化越来越差(高分化腺癌→中分化腺癌→低分化腺癌),细胞膜表达减少或细胞膜表达不完整,细胞核或细胞质/核表达增加(图1~6)。β-catenin在结直肠癌组织中的阳性表达模式可分为:细胞核阳性、细胞膜阳性、细胞核及核/质阳性、细胞膜阳性及细胞膜/质/核同时阳性(图1~6);其中β-catenin细胞核表达与组织分化程度、淋巴结转移及临床Dukes分期有关(P<0.05),与患者年龄、性别、浸润深度等其它临床病理因素无关(P>0.05,表2);β-catenin细胞膜不完整表达与组织分化程度、浸润深度、淋巴结转移及临床Dukes分期等均有关(P<0.05),与其它临床病理因素无关(P>0.05)。本组181例中,包括4例结直肠绒毛状腺瘤癌变病例,腺瘤区域仅见细胞膜阳性,未见细胞质、细胞核或核/质等异常表达,癌变区域可见细胞核阳性,随着结直肠癌组织分化越差,细胞膜表达减少,易发生浸润、转移,临床分期较晚。根据β-catenin细胞核表达量可分为:低表达,≤50%的细胞核阳性;高表达;>50%的细胞核阳性;β-catenin高表达与结直肠癌组织分化程度、Dukes分期有关(P<0.05),低分化组β-catenin高表达率明显高于高分化组(P<0.05),临床Dukes C+D期患者β-catenin高表达率明显高于A期(P<0.05);β-catenin低表达率与患者年龄、性别、组织浸润深度、淋巴结转移及Dukes分期等临床病理因素均无关(P>0.05,表3~5)。
①②③④⑤⑥
图1 β-catenin在结直肠高分化腺癌中细胞核阳性,正常结直肠黏膜组织中未见异常表达(箭头),SP法 图2 β-catenin在结直肠中~低分化腺癌中阳性,低分化区域表达明显强于中分化腺癌(上侧方框:低分化腺癌,下方:中分化腺癌),SP法 图3 β-catenin在结直肠低分化腺癌中细胞核阳性(右下图示脉管侵犯),SP法 图4 β-catenin在结直肠中分化腺癌区域中细胞膜部分阳性(表达减少),在低分化腺癌区域中细胞核及核/质阳性,SP法 图5 β-catenin在结直肠高分化腺癌中细胞膜阳性,在中分化腺癌中细胞核阳性(箭头),SP法 图6 β-catenin在结直肠绒毛状腺瘤中细胞膜部分阳性(表达减少),在癌变区域细胞核阳性(箭头),SP法
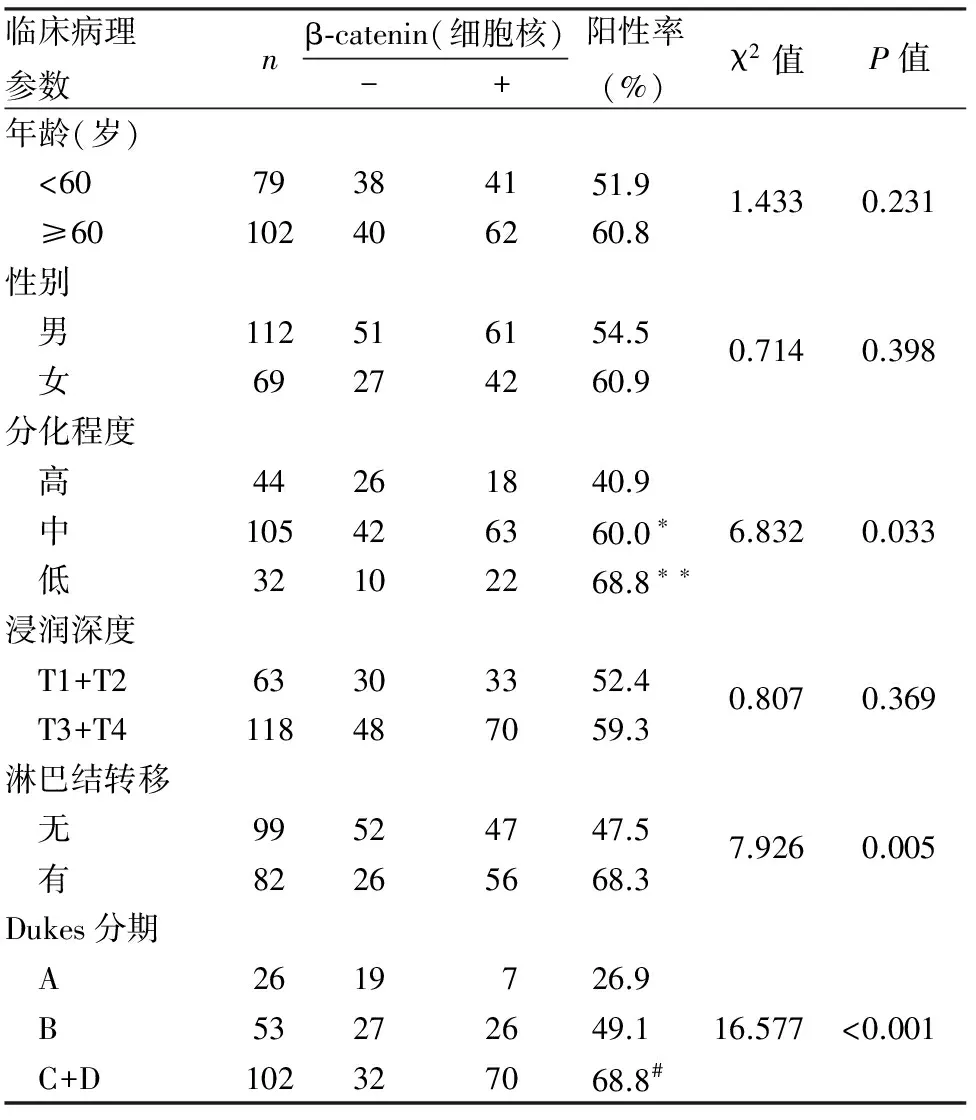
表2 β-catenin蛋白表达与结直肠癌临床病理特征的关系
与高分化组相比,*χ2=4.555,P=0.033,**χ2=5.760,P=0.016;与A期相比,#χ2=15.034,P=0.000,与B期相比,χ2=5.666,P=0.017
2.3 结直肠癌组织中β-catenin表达与患者生存期的关系 本组181例结直肠癌患者临床资料齐全,其中82例患者已随访5年;按Dukes分期:A期19例;B期33例;C+D期30例;5年总生存率为50.0%(41/82),其中A期为68.4(13/19);B期为54.5%(18/33),C+D期为33.3%(10/30),差异有显著性(P<0.05,表6)。43例β-catenin细胞核阳性组患者5年生存率明显低于β-catenin细胞核阴性组(P<0.05,图7)。
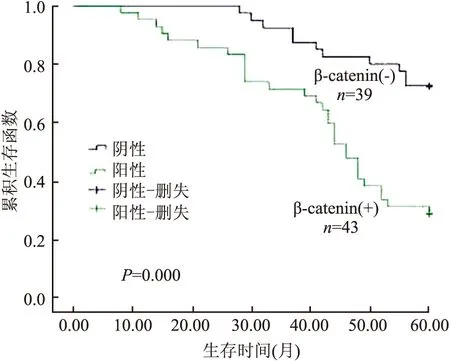
图7 β-catenin细胞核表达与患者生存期的关系
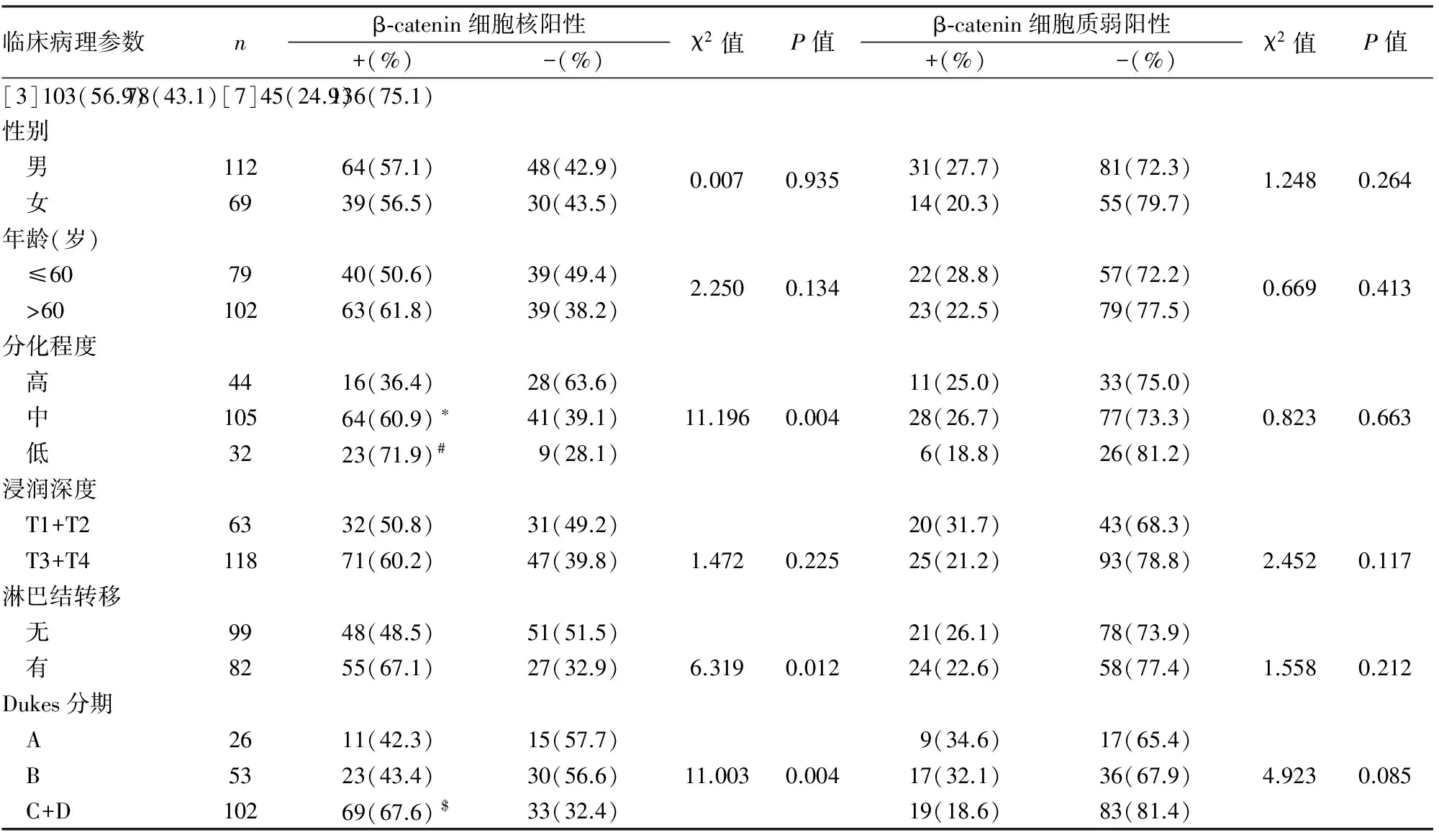
表3 结直肠癌组织中β-catenin不同表达定位与临床病理特征的关系
与高分化组相比,*χ2=7.540,P=0.006;#χ2=9.352,P=0.002;与A期相比,$χ2=5.676,P=0.017;与B期相比,χ2=8.502,P=0.004
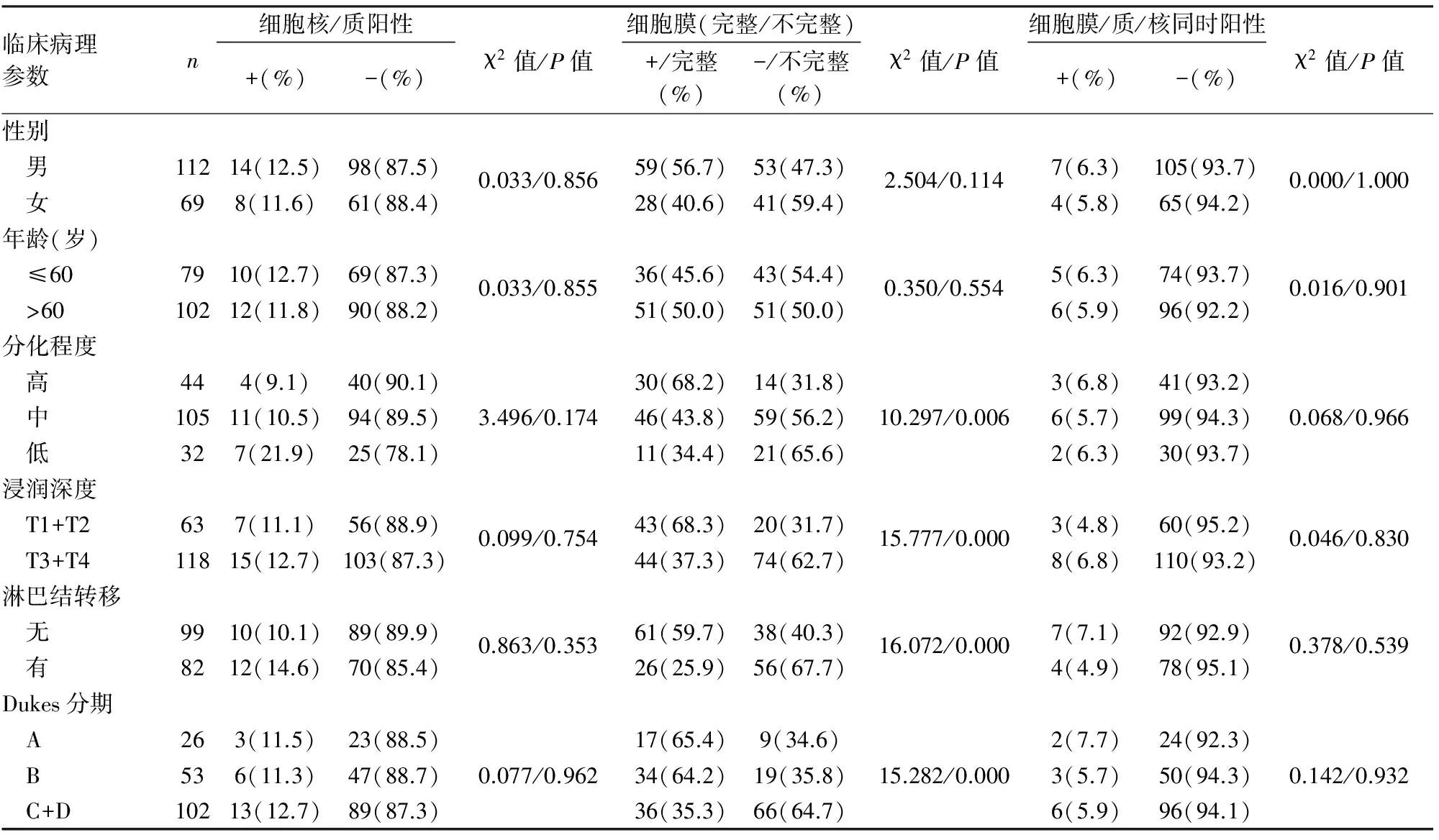
表4 结直肠癌组织中β-catenin不同表达定位与临床病理因素之间的关系
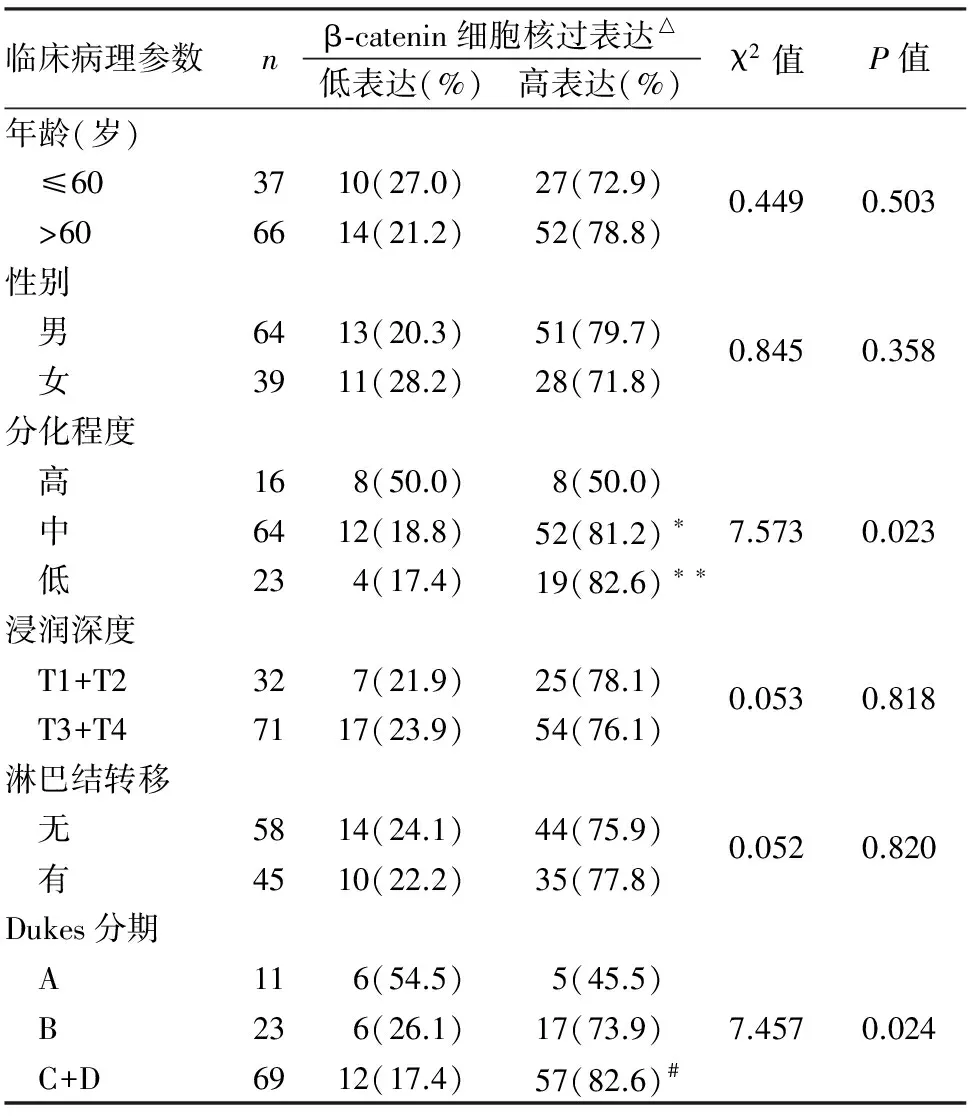
表5 结直肠癌组织中β-catenin细胞核过表达与临床病理特征的关系
与高分化组相比,*χ2=6.667,P=0.010,**χ2=4.710,P=0.030;与A期相比,#χ2=7.511,P=0.006;△≤50%细胞核表达为低表达,>50%细胞核表达为过表达
3 讨论
研究发现Wingless和Int-1基因编码同一种蛋白,故统一命名为Wnt。Wnt信号通路在胚胎细胞黏附、细胞增殖和凋亡方面发挥重要作用[3]。Wnt信号通路可通过Wnt配体或下游组件突变的传递作用而激活。Wnt有多条信号通路,研究较多的是经典Wnt信号通路,即Wnt/β-catenin信号通路。其主要成分包括Wnt家族分泌型糖蛋白(Wnt)、卷曲蛋白(frizzled, Frz)、低密度脂蛋白受体相关蛋白5/6(LRP5/6)、糖原合成酶激酶-3(GSK-3β)、轴蛋白(Axin)、松散蛋白(disheveled, Dsh)、β-连环蛋白(β-catenin)、结肠腺瘤样息肉病(APC)蛋白、酪蛋白激酶1(casein kinase, CK1)、T细胞因子/淋巴增强因子(TCF/LEF)等[4]。在Wnt/β-catenin信号通路未被激活的正常细胞中,β-catenin主要与细胞膜的E-cadherin结合,少量游离的β-catenin 存在于细胞内,其中部分可被细胞质内Axin、APC、CK1和GSK3β 形成的破坏复合体通过泛素化后被降解,不能进入核内启动下游靶基因转录及表达,当 Wnt/β-Catenin信号通路激活时,Wnt蛋白(分泌型糖蛋白)与Frz及LRP5/6结合,活化Dsh蛋白,活化的Dsh可抑制GSK-3β活性,使β-catenin不能被磷酸化和降解,β-catenin不断累积在细胞质中,然后转位进入细胞核,与TCF/LEF结合,启动下游靶基因转录及表达,如c-myc、Cyclin D1等[5],导致细胞异常增殖,促进肿瘤的发生。
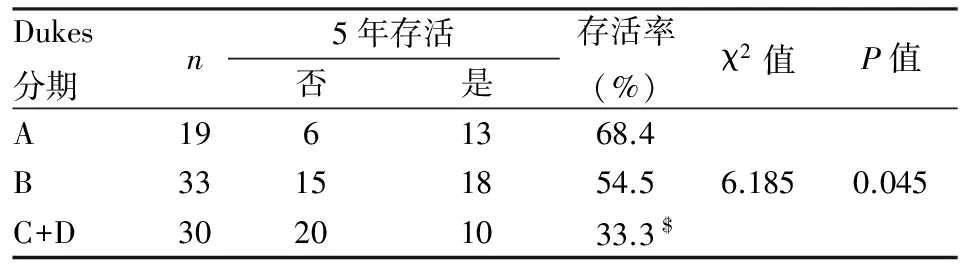
表6 结直肠癌Dukes分期与患者生存期之间的关系
与A期相比,$χ2=5.750,P=0.016
研究认为Wnt/β-catenin信号通路异常与人类多种肿瘤相关,如肝癌、胃癌等[6-7]。本组实验结果显示正常结直肠黏膜中见细胞膜完整的弱阳性表达,未见细胞质、细胞核或核/质等异常表达;结直肠癌组织中可见细胞膜不同程度的表达(细胞膜部分表达或完全丢失)及细胞质、细胞核或核/质等异位表达,提示β-catenin细胞膜表达丢失及细胞核/质等异位表达在结直肠癌的发生中起重要作用。在结直肠高分化腺癌中可见较多细胞膜表达,随着组织分化越来越差(高分化腺癌→中分化腺癌→低分化腺癌),细胞膜表达减少或细胞膜表达不完整,细胞核或细胞质/核表达增加,β-catenin细胞核表达与组织分化程度、淋巴结转移及临床Dukes分期有关,β-catenin细胞膜不完整表达与组织分化程度、浸润深度、淋巴结转移及临床Dukes分期等均有关(P<0.05);推测可能是由于随着组织分化越差,癌细胞β-catenin及E-Cadherin在细胞膜表达减少,肿瘤细胞间黏附能力下降,易发生组织浸润及脉管转移有关[8-9]。另外,本组4例为绒毛状腺瘤恶变,在腺瘤区域仅见β-catenin细胞膜表达,未见细胞核阳性,在相邻的癌变区域,可见细胞核表达,提示β-catenin可能在结直肠腺瘤癌变中起重要作用,检测腺瘤β-catenin表达有助于腺瘤恶变的诊断。有研究认为β-catenin细胞核高表达,临床分期较晚的患者预后较差[10-13]。β-catenin细胞核高表达与结直肠癌组织的分化程度、Dukes分期有关(P<0.05),与文献报道一致[14],提示β-catenin细胞表达量可作为结直肠癌患者预后判断的指标[15],可能是由于β-catenin细胞核表达,促进与细胞增殖、凋亡及侵袭转移的有关基因转录及表达有关,如c-myc、Cycling D1、MMP-7及CD44等。另外,本组实验结果显示β-catenin细胞核表达及胞膜不完整表达与组织分化程度、淋巴结转移及临床Dukes分期有关;β-catenin细胞核高表达与结直肠癌组织的分化程度、Dukes分期有关,与淋巴结转移无关,可能与本组病例选择较为严格有关。在随访的82例结直肠癌患者中β-catenin细胞核阳性组患者5年生存率明显低于阴性组,提示β-catenin细胞核表达可作为结直肠癌进展及判断预后的指标。
总之,β-catenin在结直肠癌组织中高表达,其不同表达模式与结直肠癌的发生及进展有关,并有助于预后判断,为以β-catenin为靶点的基因治疗提供理论依据。
[1] Arnold C N, Goel A, Blum H E,etal. Molecular pathogenesis of colorectal cancer: implications for molecular diagnosis[J]. Cancer, 2005,104(10):2035-2047.
[2] Giles R H, Lolkema M P, Snijckers C M,etal. Interplay between VHL/HIF1 alpha and Wnt/beta-catenin pathways during colorectal tumorigenesis[J]. Oncogene, 2006,25(21):3065-3070.
[3] Koziński K, Dobrzyń A. Wnt signaling pathway: its role in regulation of cell metabolism[J]. Postepy Hig Med Dosw, 2013,26(67):1098-1108.
[4] Saito-Diaz K, Chen T W, Wang X,etal. The way Wnt works: components and mechanism[J]. Growth Factors, 2013,31(1):1-31.
[5] de Sousa E M, Vermeulen L, Richel D,etal. Targeting Wnt signaling in colon cancer stem cells[J]. Clin Cancer Res, 2011,17(4):647-653.
[6] Wands J R, Kim M. WNT/β-catenin signaling and hepatocellular carcinoma[J]. Hepatology, 2014,60(2):452-454.
[7] Hidaka Y, Mitomi H, Saito T,etal. Alteration in the Wnt/β-catenin signaling pathway in gastric neoplasias of fundic gland(chief cell predominant) type[J]. Hum Pathol, 2013,44(11):2438-2448.
[8] Ma Y R, Ren Z,Conner M G,etal. Reduced E-cadherin and aberrant β-catenin expression are associated with advanced disease in signet-ring cell carcinomas[J]. Appl Immunohistochem Mol Morphol, 2016 Jan 22. [Epub ahead of print].DOI:10.1097/PAI.0000000000000317.
[9] Onder T T, Gupta P B, Mani S A,etal. Loss of E-cadherin promotes metastasis via multiple downstream transcriptional pathways[J]. Cancer Res, 2008,68(10):3645-3654.
[10] Wang Z, Zhang H, Hou J,etal. Clinical implications of β-catenin protein expression in breast cancer[J].Int J Clin Pathol, 2015,8(11):14989-14994.
[11] Wang Z, Sheng Y Y, Gao X M,etal. β-catenin mutation is correlated with a favorable prognosis in patients with hepatocellular carcinoma[J]. Mol Clin Oncol, 2015,3(4):936-940.
[12] Deng F, Zhou K, Cui W,etal. Clinicopathological significance of Wnt/β-catenin signaling pathway in esophageal squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2015,8(3):3045-3053.
[13] Balzi M, Ringressi M N, Faraoni P,etal. B-cell lymphoma 2 and β-catenin expression in colorectal cancer and their prognostic role following surgery[J]. Mol Med Rep, 2015,12(1):553-560.
[14] Gao Z H, Lu C, Wang M X,etal. Differential β-catenin expression levels are associated with morphological features and prognosis of colorectal cancer[J]. Oncol Lett, 2014,8(5):2069-2076.
[15] 吴 健, 范钦和. 结直肠癌中TAZ和β-catenin的表达及意义[J]. 临床与实验病理学杂志, 2014,30(12):1346-1349.
Different expression patterns of β-catenin and its correlation with clinicopathological facters in colorectal cancer
JIN Wen1,2, CHEN Shun-hua1,3, YIN Yu1,3, ZHANG Cong1,3, CAO Li-yu1,3
(1DepartmentofPathology,AnhuiMedicalUniversity,Hefei230032,China;2TonglingVocationalandTechnicalCollege,Tongling244061,China;3TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China)
Purpose To observe different expression patterns of β-catenin and its clinical significance in colorectal cancer (CRC). Methods A total of 181 cases of CRC tissues and 30 cases of norma1 colorectal tissue were investigated by immunohistochemistry for the expression of β-catenin. Results The expression rate of β-catenin was 56.9%(103/181)in CRC, and higher than that in norma1 colorectal tissue(P<0.05). The overexpression of nuclear β-catenin was significantly correlated with histological differentiation, lymph node metastasis and Dukes’ stage in CRC (P<0.05), and no relationship with other pathological parameters, such as age, gender and the depth of infiltration. The incomplete membranous expression of β-catenin was significantly correlated with histological differentiation, the depth of infiltration, lymph node metastasis and Dukes’ stage in CRC (P<0.05). The high expression of nuclear β-catenin related to histological differentiation and Dukes’ stage in CRC (P<0.05). In the follow-up data of 82 cases of CRC, the expression of nuclear β-catenin was associated with poor prognosis, and the 5-year survival rate was significantly lower than that of self-control groups (P<0.05). Conclusion β-catenin plays important roles in colorectal carcinogenesis. Abnormal expression of β-catenin was related to the aggressive progression of CRC and may be helpful for evaluating the prognosis of patients with CRC. β-catenin is expected to become a new target for diagnosis and treatment of CRC in future.
colorectal neoplasms; β-catenin; expression patterns; immunohistochemistry
国家自然科学基金(81201536)、安徽省自然科学基金(KJ2013A150)
1安徽医科大学病理学教研室,合肥 2300322铜陵职业技术学院基础教研室,铜陵 2440613安徽医科大学第一附属医院病理科,合肥 230022
金 雯,女,硕士研究生,讲师。E-mail: 117507844@qq.com 曹立宇,男,副教授,硕士生导师,通讯作者。E-mail: caoliyuhf@163.com
时间:2017-6-20 11:17 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.002.html
R 735.34
A
1001-7399(2017)06-0596-06
10.13315/j.cnki.cjcep.2017.06.002
接受日期:2017-03-29
