藜麦萌芽期营养与功能成分的动态变化
2017-07-05黄金
黄 金
秦礼康
石庆楠
文安燕
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
藜麦萌芽期营养与功能成分的动态变化
黄 金
秦礼康
石庆楠
文安燕
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
对藜麦进行萌芽处理,测定其萌芽过程中芽长、萌芽率、蛋白质、氨基酸、粗脂肪、淀粉、灰分、总黄酮、总多酚、γ-氨基丁酸(GABA)和皂甙含量的动态变化。结果表明,藜麦萌芽过程中,24 h时萌芽率即达80%;蛋白质、总灰分及总淀粉含量呈递减趋势,而粗脂肪含量则呈递增趋势,其变化幅度分别为-64%,-41%,-49%,+28%;氨基酸组成无明显变化,但总必需氨基酸占总氨基酸含量的比例从35%增加至38%;多酚和黄酮含量均呈先降后增再减少,分别在36 h和60 h达最大值(1.76 mg/g和2.8 mg/g);γ-氨基丁酸含量从萌芽初期持续增加,至72 h达最高值(185.6 mg/100 g,为未萌芽藜麦的3.4倍),其后略有下降;皂甙含量在萌芽初期(6 h内)迅速下降,6~42 h期间含量保持平稳,之后逐渐升高直至96 h时达最高值(7.80 mg/g),萌芽120 h后皂甙含量开始下降。
藜麦;萌芽;营养成分;功能成分;动态变化
藜麦(ChenopodiumquinoaWilld.),作为一种藜科植物的杂粮珍品,不仅富含优质蛋白、健康油脂及钙、铁、锌、VE等营养物质,还含有皂苷、多酚、黄酮等功能成分,具有提高人群健康,预防癌症、过敏、炎症及降低心血管疾病的功效,被国际营养学家称为“超级谷物” “粮食之母”“营养黄金”或“未来食品”[1]。继2004年“国际大米年”和2008年“国际土豆年”之后,在第67届联合国大会上将2013年设为“国际藜麦年”,联合国粮农组织(FAO)正式推荐藜麦为最适宜人类的“全营养食品”,并列入全球十大健康营养食品之一[2]。
谷物萌芽对改善种子氨基酸的组成、提高蛋白质的利用率[3]、增加B族维生素的含量[4]、降低抗营养因子的水平[5]、改善加工特性[6]及适口性具有积极的作用。Koyama M等[7]将苦荞浸泡20 h后萌芽处理6 d,可使其芦丁含量从15.8 mg/100 g提高到109.0 mg/100 g,增加6.9倍;Ren S等[8]发现苦荞种子萌芽处理期间总酚、总黄酮、芦丁含量逐渐增加,并在第9天到最大值。另有研究表明,萌芽还可富集γ-氨基丁酸(γ-aminobutyric acid,GABA)等原来含量低或不具有的功能性成分[9];萌芽在一定程度上还可调整豆类营养结构,增加豆类中维生素和矿物质的生物利用率[10]。
随着杂粮消费全球化趋势的加速发展,藜麦的国际市场也日益扩大,从美国扩展到欧洲、亚洲和非洲,但中国对藜麦的引种及研究的起步相对较晚。国内外有关藜麦的研究虽已有一些报道,但主要集中于引种栽培[11]、品种选育[12]、基本营养成分[13]、功能性成分含量(皂甙、黄酮、多酚)测定等研究之上,对藜麦进行萌芽处理后,跟踪分析其主要营养成分及重要活性物质(黄酮、多酚、GABA、皂甙)的含量,未有报道。因此,系统分析藜麦种子萌芽过程中主要营养成分及重要活性物质的动态变化,以探讨萌芽藜麦的营养价值和功能价值,并为藜麦高值化产品开发提供科学依据。
1 材料与方法
1.1 主要原料
藜麦:2015年产,甘肃省农业科学院。
1.2 主要试剂
GABA标准品(CAS56-12-2):纯度≥99%,美国Sigma公司;
芦丁标准品(CAS153-18-4)、齐墩果酸标准品(CAS480-43-3):纯度≥98%,成都曼思特生物科技有限公司;
没食子酸标准品(CAS149-01-7):纯度≥98%,上海源叶生物生物科技有限公司;
葡萄糖、次氯酸钠、苯酚、硫酸等:分析纯;
考马斯亮蓝G-250、牛血清白蛋白:生化试剂。
1.3 仪器与设备
酶标仪:Spectra Max 190型,美国分子仪器公司;
豆芽培育箱:MK-C315型,中国Meikong公司;
冷冻干燥机:FD-1A-50型,北京博医康实验仪器有限公司;
超高速粉碎机:HC-700型,永康市天祺盛世工贸有限公司;
氨基酸自动分析仪:L-8800型,日本Hitachi公司。
1.4 试验方法
1.4.1 藜麦萌芽的工艺流程 藜麦粒过筛,除杂后选取饱满完好的藜麦粒,用0.1%次氯酸钠溶液浸泡20 min后用去离子水清洗2次。然后将藜麦粒平铺于铺有4层纱布的培芽箱上,喷晒去离子水,放入恒温恒湿培养箱于(24±1) ℃下萌芽,期间每隔6 h淋水及臭氧杀菌处理。每隔12 h取样一次,分别制得萌芽0,12,24,36,48,60,72 h的萌芽藜麦。然后将萌芽藜麦粒冷冻干燥,粉碎,过100目筛,得到萌芽藜麦粉,保存于-20 ℃冰箱待用。
1.4.2 理化指标的测定
(1) 芽长:随机抽选30粒萌芽藜麦,用游标卡尺测定其芽长。
(2) 萌芽率:按GB/T 3543.1~3543.7—1995《农作物种子检验规程》执行。
(3) 可溶性蛋白质:采用考马斯亮蓝G-250染色法[14]124-125。
(4) 氨基酸含量:采用氨基酸自动分析仪测定。
(5) 粗脂肪:按GB/T 5512—2008《粮油检验粮食中粗脂肪含量测定》的索氏抽提法执行。
(6) 淀粉:采用蒽酮—硫酸比色法[14]146-147。
(7) 灰分:按GB/T 22510—2008《谷物、豆类及副产品灰分含量的测定》执行。
1.4.3 黄酮含量的测定 采用NaNO2-Al(NO2)3比色法,根据董施彬等[15]测定藜麦总黄酮的方法及条件,以吸光值(Y)与芦丁浓度(X)求得回归方程,绘出芦丁对照品标准曲线。所得回归方程:Y=0.078 5X+0.000 2,R2= 0.998 09。
1.4.4 多酚含量的测定 根据阙淼琳等[16]测定藜麦种子多酚的方法及条件,以吸光值(Y)与没食子酸浓度(X)求得回归方程,绘出没食子酸对照品标准曲线。所得回归方程:Y=0.334 6X-0.000 9,R2=0.999 12。
1.4.5γ-氨基丁酸的提取与测定 根据党娟等[17]方法测定藜麦GABA。通过GABA标准品的浓度及对应吸光值算出标准曲线方程为:Y=0.950 9X+ 0.012 7,R2=0.999 17。
1.4.6 皂甙含量的测定 按课题组前期研究确认的藜麦皂甙提取的最佳工艺条件[乙醇浓度65%,料液比1∶40(g/mL),浸提温度60 ℃]下提取藜麦皂甙,用酶标仪于560 nm波长下扫描,测定萌芽各阶段藜麦皂甙含量。以吸光度值为横坐标(X),以齐墩果酸浓度(mg/mL)为纵坐标(Y)绘制标准曲线方程为:Y=2.863 1X+0.011 2,R2=0.997 4。
2 结果与分析
2.1 萌芽期发芽率及芽长的变化
藜麦属于易萌芽种子[18],浸泡即可使藜麦萌芽[19]。图1表明,萌芽24 h其萌芽率可达80%,最终发芽率为87%;萌芽60 h前,芽长的增长速率保持平稳,60~96 h时增长速率最高。

图1 萌芽率及芽长的变化Figure 1 The change of germination rate and bud length
2.2 萌芽前后藜麦中常规营养成分的变化
表1显示,随着发芽时间延长,蛋白质、总灰分含量出现先减少后增加的趋势,萌芽24 h达最低值,较未萌芽下降了64%和41%,之后虽逐渐增加,但其含量均低于未萌芽的,其原因可能是种子浸泡中可溶性氮溶出以及萌芽过程中蛋白质在蛋白酶的作用下不断分解和重新形成所致。总淀粉呈持续下降趋势,降幅约49%,其原因可能是萌芽过程中的呼吸消耗以及淀粉酶活性增加而引起的淀粉持续降解。粗脂肪含量在藜麦萌发过程中呈上升趋势,在萌芽0~48 h时含量增加值为1.8%,其后粗脂肪含量无显著变化。
2.3 萌芽前后藜麦氨基酸含量和组成对比
由表2可知,藜麦富含17种氨基酸。其中,谷氨酸含量最高,其次为天冬氨酸、亮氨酸及赖氨酸,且人体必需的8种氨基酸齐全,组成比例接近人体的氨基酸。尤应指出的是,藜麦中赖氨酸含量约占总氨基酸含量的7%,而赖氨酸是谷物类的第一限制氨基酸,其在多数谷物中含量较少或不含;蛋氨酸是豆类食物的限制性氨基酸,在藜麦中蛋氨酸含量也占总氨基酸含量的0.9%。
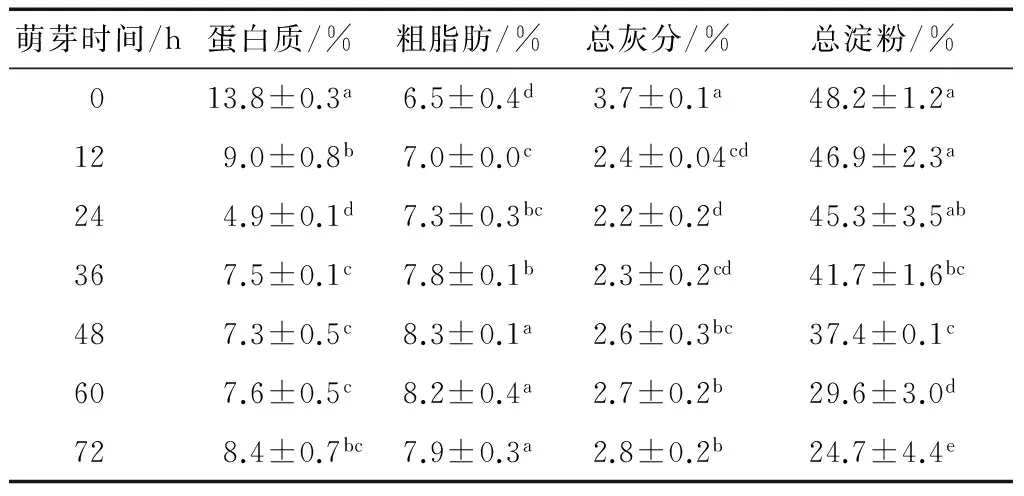
表1 藜麦萌芽前后营养物质的变化†Table 1 The change of nutrients during sprouting %(dry basis)
† 相同字母代表差异不显著;不同字母代表差异显著(P<0.05) 。
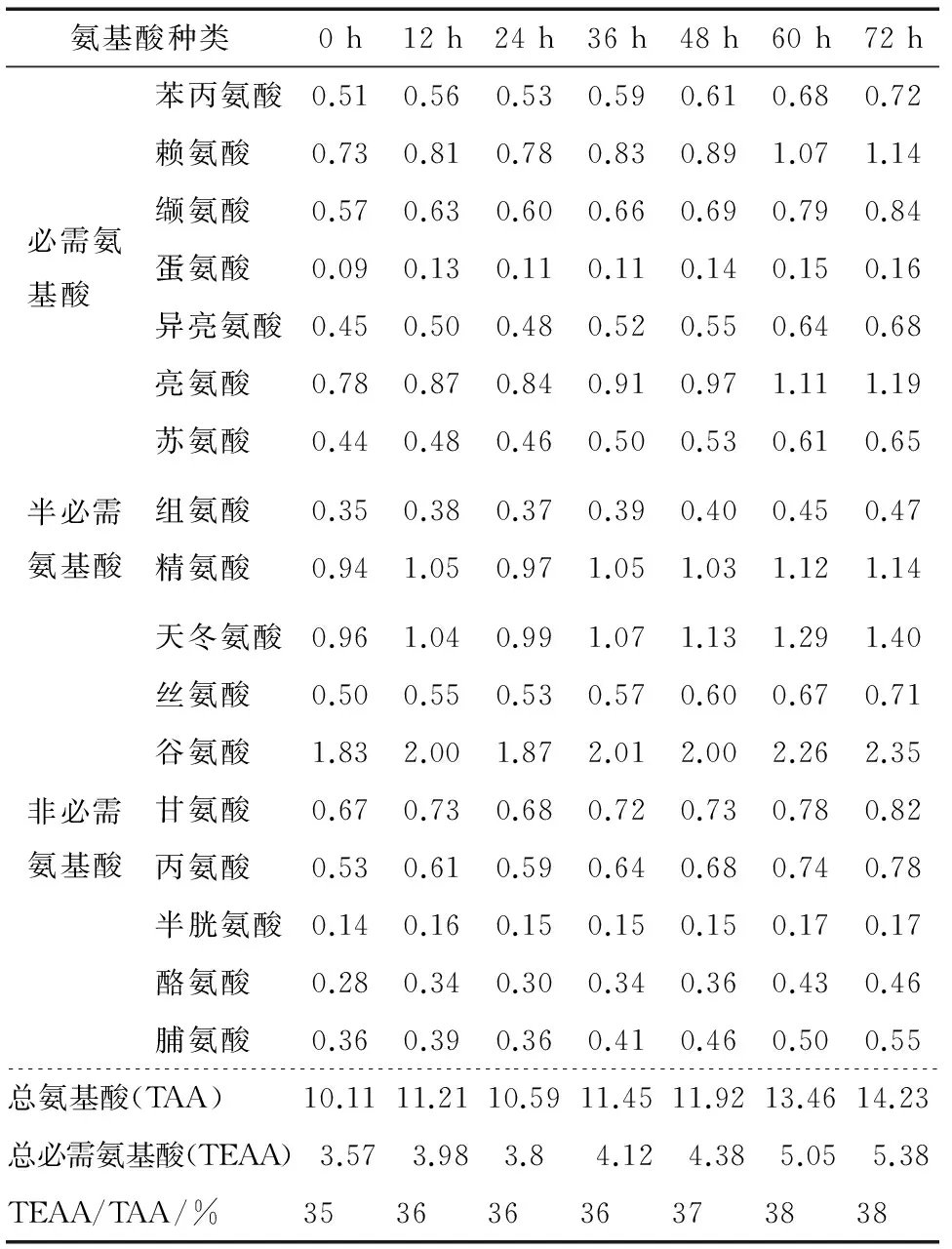
表2 不同萌芽时间氨基酸含量Table 2 The content of amino acid during sprouting g/100 g
总体上看,萌芽过后氨基酸组成无明显变化,总氨基酸含量持续增加。总必需氨基酸(TEAA)占总氨基酸(TAA)含量的比例从35%增加至38%。萌芽末期的各氨基酸含量是未萌芽状态下的1.2~1.5倍,其中蛋氨酸含量增幅最大(约1.8倍)。萌芽后游离氨基酸总量明显上升,是因为一部分蛋白质受酶催化水解为低分子肽与氨基酸,其中一部分氨基酸又继续参与分解代谢产生脱氨、转氨、脱羧等代谢物,这些代谢物又合成新的氨基酸从而使氨基酸种类和数量发生变化[20]。
2.4 萌芽对藜麦主要功能成分的影响
2.4.1 黄酮含量 黄酮类化合物是天然的植物雌激素,具有多种生物活性,包括诱导凋亡、抗诱变、抑制蛋白激酶C、超氧化物歧化酶和脂肪氧合酶活性、阻碍组胺的释放等[21]。藜麦籽实是黄酮类化合物的良好来源[22]195-196,含量范围在36.2~144.3 mg/100 g[19]。藜麦的芦丁、槲皮素、异槲皮素和山奈酚的含量比荞麦高[22]194,而其他谷物类如小米、大米、玉米、小麦、大麦和燕麦都不含黄酮类[23]。由图2可知,藜麦发芽24 h内的黄酮类物质含量有所减少,之后含量开始增加直至60 h达最高值1.76 mg/g,该含量是未萌芽条件下的1.4倍。因为藜麦在萌发过程中呼吸作用加强,酶的种类和数量显著增加,苯丙氨酸氨基裂解酶(PAL)作为黄酮生物合成的关键酶发挥作用,使黄酮的合成持续进行[24]。
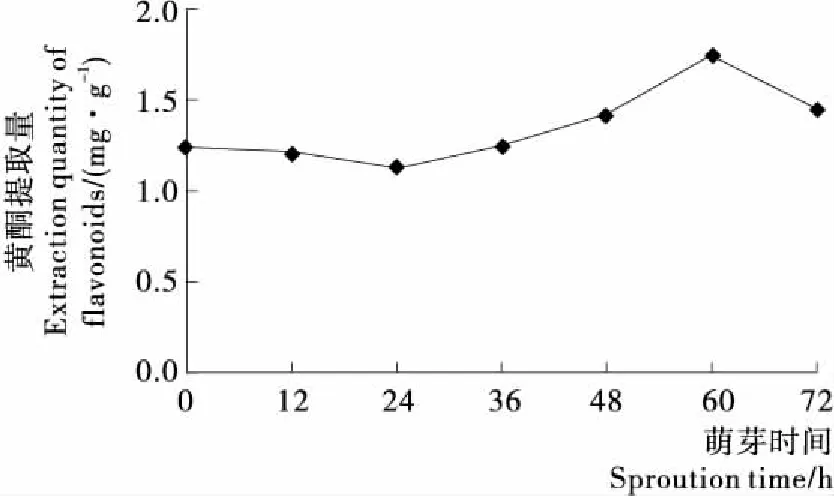
图2 萌芽过程中黄酮含量变化Figure 2 The change of flavonoids during sprouting
2.4.2 多酚含量 藜麦提取物中很多活性成分具有抗氧化作用,其中最主要的是多酚类物质[25]。Pasko[26]、Alvarez-Jubete[27]、Hirose[28]等的研究认为,藜麦种子及新芽中有较多的总多酚。由图3可知,藜麦在萌发过程中多酚随着时间变化含量出现了先降低后增高再减少的趋势。这可能是不溶性结合酚的释放导致酚酸类物质含量的变化。多酚含量在0~24 h内下降,24~36 h增高,萌发36 h时达最大值2.8 mg/g,较未萌芽状态约增加了21%。36 h后多酚含量呈下降趋势,但减势平稳。萌芽过程中藜麦多酚含量变化与黄酮含量变化趋势接近,两者都在24 h内减少,之后开始增加,分别在36 h和60 h达最高值后开始减少。此结果与赵霞[29]发现的萌芽燕麦多酚与黄酮含量的变化趋势接近的结果一致。
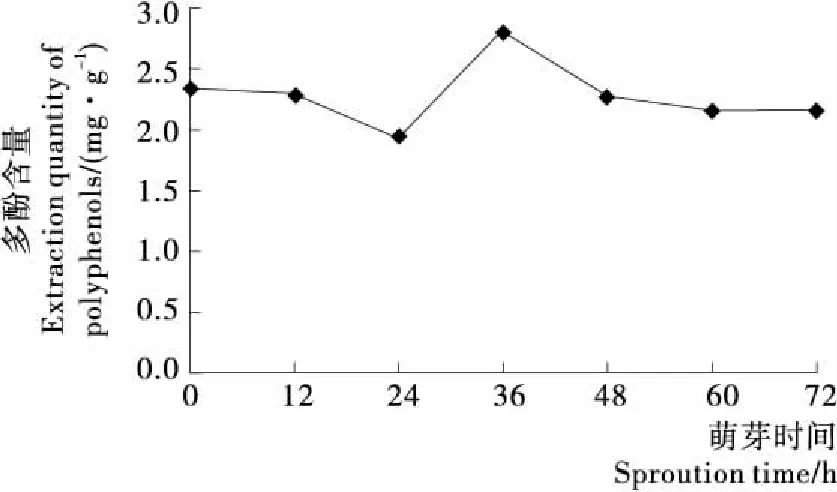
图3 萌芽过程中多酚含量变化Figure 3 The change of polyphenols during sprouting
2.4.3γ-氨基丁酸(GABA)含量 由图4可知,藜麦萌芽前期,GABA含量持续升高,72 h时达最大值185.6 mg/100 g,为未萌芽藜麦(55.4 mg/g)的3.4倍。萌芽72 h后,藜麦中的GABA含量匀速减少,但至萌芽末期(144 h)时,仍为未萌芽藜麦的2.5倍。有研究表明,GABA广泛分布于动植物中,为哺乳动物中枢神经系统重要的抑制性神经递质,具有降血压、改善脑机能、缓解疼痛和焦虑[30],以及肝、肾功能活化和促进乙醇代谢等作用[31]。萌芽后谷氨酸脱羧酶活性的增加使谷氨酸转化为GABA是导致其含量增长的主要原因[32]。
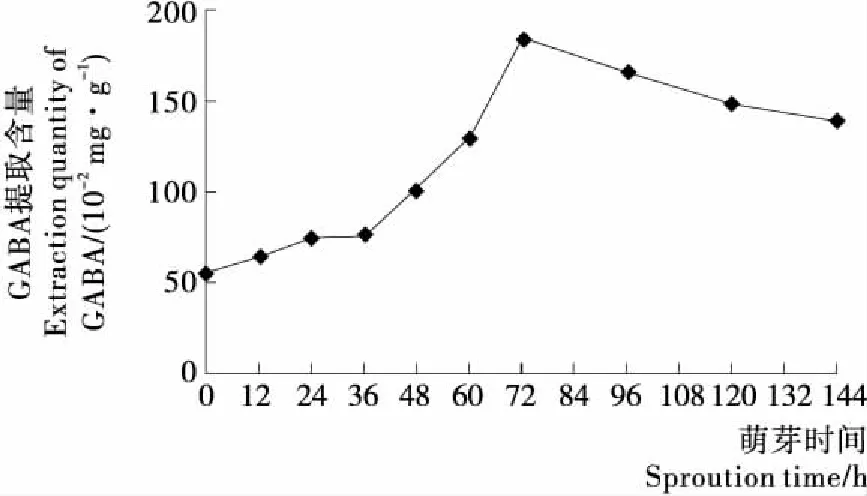
图4 萌芽过程中GABA含量变化Figure 4 The change of γ-aminobutyric acid during sprouting
2.4.4 皂甙含量 图5表明,萌芽6 h内,皂甙含量较未萌芽时约下降了40%,可能是藜麦种子浸泡中富含皂甙的种皮脱落而流失;萌芽6~42 h时,皂甙含量稳定在3.5 mg/g左右;萌芽42 h后,皂甙含量开始增加,直至96 h时达最高值(7.8 mg/g);萌芽后期(120 h后),皂甙含量缓慢减少。关于藜麦萌芽中后期皂甙含量增加的原因,有待进一步研究。
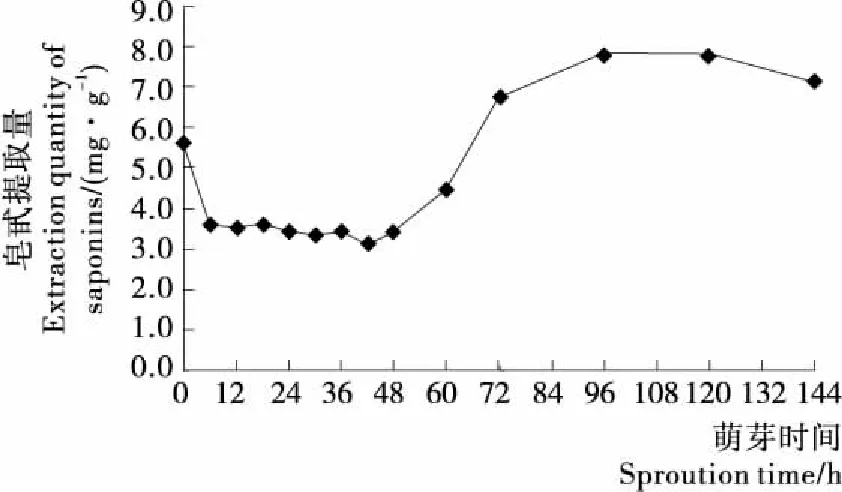
图5 萌芽过程中皂甙含量变化Figure 5 The change of saponins during sprouting
3 结论
经萌芽处理后,藜麦中的营养成分呈动态变化趋势。蛋白质、总灰分含量先减后增,萌芽24 h达最低值;淀粉因持续为萌芽活动供应能量而呈下降趋势;粗脂肪持续上升,在萌芽48 h之前增幅显著,萌芽48 h之后粗脂肪含量无显著变化。黄酮、多酚和GABA等功能成分的含量在萌芽期间先增后降,其中GABA含量增幅最大,72 h的含量为未萌芽时3.4倍;皂甙含量虽在萌芽前期有短时下降,但从总体上看呈逐渐上升趋势,在萌芽96 h后达最大值。
因此,通过简单的萌芽处理可改善藜麦的口感,提高藜麦功能性营养成分含量。在食用及加工藜麦时,人们可根据具体需要来确定所需最佳萌芽时间,使各种指标达到最优。同时,萌芽藜麦在保健食品等新型食品研究领域具有广泛的开发价值。
[1] STIKIC R, GLAMOCLIJA D, DEMIN M, et al. Agronomical and nutritional evaluation of quinoa seed (Chenopodium quinoa Wild) as an ingredient in bread formulations [J]. Journal of Cereal Science, 2012, 55(2): 132-138.
[2] Food And Agriculture Organization Of The United Nations. Home-international year of quinoa 2013:report of FAO[R]. Roman : FAO, 2014.
[3] CHAVAN J K, KADAM S S. Nutritional improvement of cereals by sprouting[J]. Critical Reviews in Food Science and Nutrition, 1989, 28(5): 401-437.
[4] ARORA S, JOOD S, KHET Arp Aul N. Effect of germination and probiotic fermentation on nutrient composition of barley based food mixtures[J]. Food Chemistry, 2010, 119(2): 779-784.
[5] SRIPRIYA G, ANTONY U T, CHANDRA S. Changes in carbohydrate, free amino acids, organic acids, phytate and HCl extractability of miner- als during germination and fermentation of finger millet (Eleusine coracana)[J]. Food Chemistry, 1997, 58(4): 345-350.
[6] ELMONEIM A, ELKHALIFA O, BERNHARDT R. Influence of grain germination on functional properties of sorghum flour[J]. Food Chemistry, 2010, 121(2): 387-392.
[7] KOYAMA M, NAKAMURA C, NAKAMURA K. Changes in phenols contents from buckwheat sprouts during growth stage[J]. Journal of Food Science and Technology, 2013, 50(1): 86-93.
[8] REN Shun-cheng, SUN Jun-tao. Changes in phenolic content, phenylalanine ammonia-lyase (PAL) activity, and antioxidant capacity of two buckwheat sprouts in relation to germination[J]. Journal of Functional Foods, 2014, 7(2): 298-304.
[9] GUO Yua-xin, CHEN Hui, SONG Yu. Effects of soaking and aeration treatment onγ-aminobutyric acid accumulation in germinated soybean(Glycine max L.)[J]. European Food Research and Technology, 2011, 232(5): 787-795.
[10] 朱新荣, 胡筱波, 潘思轶, 等. 大豆发芽期间多种营养成分变化的研究[J]. 中国酿造, 2008(12): 64-66.
[11] BOIS J F, WINKEL T, LHOMME J P, et al. Response of some Andean cultivars of quinoa (Chenopodium quinoa Willd.) to temperature: Effects on germination, phenology, growth and freezing[J]. European Journal of Agronomy, 2006(25): 299-308.
[12] 姜奇彦, 牛风娟, 胡正, 等. 金藜麦耐盐性分析及营养评价[J]. 植物遗传资源学报, 2015, 16(4): 700-707.
[13] 王黎明, 马宁, 李颂, 等. 藜麦的营养价值及其应用前景[J]. 食品工业科技, 2014, 35(1): 381-384.
[14] 王福荣. 生物工程分析与检验[M]. 北京:中国轻工业出版社, 2006.
[15] 董施彬, 宁亚萍, 杨喆, 等. 藜麦总黄酮提取及大孔树脂纯化工艺得研究[J]. 食品工业科技,2015(16): 272-278.
[16] 阙淼琳, 蒋玉蓉, 曹美丽, 等. 响应面试验优化藜麦种子多酚提取工艺及其品种差异[J]. 食品科学, 2016(4): 7-12.
[17] 党娟, 秦礼康, 杨先龙, 等. 不同薏米品种萌芽特性比较及工艺条件优化[J]. 食品与机械, 2015, 31(5): 250-255.
[19] KULJANABHAGAVAD T, THONGPHASUK P, CHAMULITRAT W, et al. Triterpenesaponins from Chenopodium quinoa Wild[J]. Phytochemistry, 2008, 69(9): 1 919-1 926.
[20] 沈同. 生物化学[M]. 北京: 高等教育出版社, 1996: 50-52.
[21] FORMICA J V, REGELSON W. Review of the biology of quercetin and related bioflavonoids[J]. Food and Chemical Toxicology, 1995, 33(12): 1 061-1 080.
[22] 博汗格瓦, 瓦斯塔瓦. 藜麦生产与应用[M]. 任贵兴, 译. 北京: 科学出版社, 2014.
[23] United States Department Of Agriculture. National nutrient data-base for standard reference[DB/OL]. USDA: Nutrient Data Laboratory, 2005. http://amh.adam.com/graphics/pdf/ en/1998.
[24] 鲍会梅. 黑豆发芽过程中成分的变化[J]. 食品工业, 2016, 37(5): 1-4.
[25] 魏爱春, 杨修仕, 么杨, 等. 藜麦营养功能成分及生物活性研究进展[J]. 食品科学, 2015, 36(15): 272-276.
[26] PASKO P, BARTON H, ZAGRODZKI P, et al. Anthocyan-ins, total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J]. Food Chemistry, 2009, 115(3): 994-998.
[27] ALVAREZ-JUBETE L, WIJNGAARD H, ARENDT E K, et al. Polyphenol composition and in vitro antioxidant activity of amaranth, quinoa, buckwheat and wheat as affected by sprouting and backing[J]. Food Chemistry, 2010, 119(2): 770-778.
[28] HIROSE Y, FUJITA T, ISHILL T, et al. Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J]. Food Chemistry, 2010, 119(4): 1 300-1 306.
[29] 赵霞. 热加工和发芽处理对燕麦多酚含量和抗氧化性的影响[D]. 无锡: 江南大学, 2016: 30-31.
[30] 顾振新, 蒋振晖. 食品原料γ-氨基丁酸(GABA)形成机理及富集技术[J]. 食品与发酵工业, 2002, 28(10): 65-69.
[31] 张晖, 姚惠源, 姜元荣. 富含γ-氨基丁酸保健食品的研究与开发[J]. 食品与发酵工业, 2002, 28(9): 69-72.
[32] OHSUBO K, SMUKI K, YASUI Y, et al. Bio-functional components in the processed pre-germinated brown rice by a twin-screw extruder[J]. Journal of Food Composition and Analysis, 2005(18): 303-316.
Dynamic Changes of nutrational and functional Ingredients During Germination of Quinoa
HUANGJin
QINLi-kang
SHIQing-nan
WENAn-yan
(SchoolofLiquorandFoodEngineering,GuizhouUniversity,Guiyang,Guizhou550025,China)
The changes of bud length, germination rate, protein, amino acid, crude fat, starch, ash content, total flavonoids, total polyphenols,γ-aminobutyric acid and saponin content were investigatedduring the period of sprouting. The rate of germination could reach 80% after 24 hours. There was a decreasing tendency on the content of protein, total ash and total starch, while the crude fat content displayed a trend of increasing, and the variation were 64%, 41%, 49% and 28% respectively. The composition of amino acids had no obvious change, but the proportion of total essential amino acids (TEAA) to total content of amino acids (TAA) increased from 35% to 38%; Polyphenols and flavonoids content were dropping after increasing firstly, then decreasing, the peak values were 1.76 mg/g and 2.8 mg/g after sprouting 36 hours and 60 hours respectively. From early stages of germination to 72 hours, the content ofγ-aminobutyric acid (GABA) was rising continuously to the highest (185.6 mg / 100 g, 3.4 times of not sprout quinoa), then followed by a slightly decline. Saponins content dropped rapidly at the beginning of the germination (6 hours), kept steady during 6~42 hours and then up to highest content (7.80 mg/g) after sprouting of 96 hours, it began to decline after 120 h.
quinoa; germination; nutrients; functional component; dynamic changes
六盘水市级科技计划项目(编号:52020-2015-02)
黄金,女,贵州大学在读硕士研究生。
秦礼康(1965—),男,贵州大学教授,博士。 E-mail:likangqin@126.com
2017—03—08
10.13652/j.issn.1003-5788.2017.05.011
