普罗布考对小鼠肾缺血再灌注损伤的保护作用与机制
2017-05-18赵春芳张亚楠任广伟
龚 淼,张 雷,赵春芳,李 莉,张亚楠,任广伟
(1.河北医科大学基础医学院组织胚胎学教研室,河北 石家庄 050017;2.河北医科大学第一医院肾内科,河北 石家庄 050031)
·论 著·
普罗布考对小鼠肾缺血再灌注损伤的保护作用与机制
龚 淼1,张 雷1,赵春芳1,李 莉1,张亚楠1,任广伟2*
(1.河北医科大学基础医学院组织胚胎学教研室,河北 石家庄 050017;2.河北医科大学第一医院肾内科,河北 石家庄 050031)
目的探讨普罗布考对小鼠肾缺血再灌注(I/R)损伤的保护作用及其机制。方法选取雄性10周龄C57BL/6j小鼠40只随机分为4组各10只,分别为正常对照组、假手术组、I/R组、I/R+普罗布考灌胃组(100 mg/kg)。石蜡切片HE染色观察小鼠肾脏形态学变化并进行肾小管病理改变评分;生化法检测小鼠血清肌酐(serum creatinine,SCr)和尿素氮(blood urea nitrogen,BUN)水平;比色法检测肾组织中丙二醛(malondialdehyde,MDA)含量和谷胱甘肽过氧化物酶(glutathione peroxidase,GPXs)活性;Western blot法检测肾组织GPX4蛋白表达。结果与正常对照组比较,IR组HE染色切片可观察到肾组织损伤,SCr和BUN水平显著升高,肾组织中MDA含量显著增高,GPXs活性和GPX4蛋白表达明显降低(P<0.01);与IR组比较,IR+普罗布考灌胃组肾组织损伤明显减轻,SCr和BUN水平显著降低,肾组织中MDA含量明显降低,GPXs活性和GPX4蛋白的表达明显升高(P<0.05)。结论普罗布考能减轻小鼠肾组织因急性缺血再灌注引起的损伤,其机制可能通过上调GPX4活性发挥肾组织保护作用。
再灌注损伤;肾;普罗布考;小鼠
急性缺血再灌注(ischemia-reperfusion,I/R)损伤是临床上导致急性肾衰竭的常见原因之一[1]。近来研究发现,谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的失活在肾I/R损伤中发挥重要作用,是引起肾小管上皮细胞死亡的主要原因[2-4]。由于肾脏是高血流灌注器官[5],对缺血非常敏感,再灌注时过多的氧自由基更加重了肾组织的损伤[6]。普罗布考是曾广泛应用于临床降低血脂的药物,同时具有很强的抗氧化和抗炎的作用。研究表明普罗布考可以显著降低组织或细胞的脂质过氧化水平,提高多种抗氧化酶活性,且不良反应较小,只要停药不良反应随即消失[7]。近年的研究已证实普罗布考预处理有效减轻心、肾等器官的I/R损伤,更加巩固了其作为抗氧化药物的临床地位[8]。目前尚未见到关于普罗布考是否可以通过提高GPX4活性减轻肾组织I/R损伤的报道。本研究通过肾动脉夹闭方法建立小鼠肾I/R损伤模型,探讨普罗布考后处理对小鼠I/R损伤的保护作用及可能机制,旨在为临床选取恰当的组织保护药物提供参考。
1 材料与方法
1.1 实验动物与试剂 10周龄的清洁级C57BL/6j雄性小鼠40只(北京华阜康生物科技股份有限公司,合格证号:SCXK 京2009-0004)。兔抗GPX4单克隆抗体(sc-166120)、兔抗β-actin单克隆抗体(sc-58673)(Santa Cruz公司),增强型ECL化学发光试剂盒(美国Abcam公司),普罗布考、脂质过氧化(malondialdehyde,MDA)试剂盒、GPXs活性检测试剂盒(Sigma公司),血肌酐(serum creatinine,SCr)检测试剂盒、尿素氮检测试剂盒(南京建成)。
1.2 实验分组与I/R动物模型的建立 40只小鼠实验分为4组:正常对照组(control)、假手术组(sham)、缺血再灌注组(I/R)、IR+普罗布考灌胃组(100 mg/kg)(I/R+probucol),每组10只。参照Soares等[9]的方法建立小鼠肾脏I/R模型。戊巴比妥溶液腹腔注射进行麻醉后,将小鼠呈仰卧位固定于37 ℃恒温实验台上以维持体温。腹部正中纵行切口暴露双侧肾脏,钝性分离双侧肾蒂后用微型无创动脉夹夹闭40 min,待肾脏由鲜红色变为暗红色后松开动脉夹,恢复血流再灌注 24 h,待肾脏由暗红变为鲜红色后,造模完成。假手术组仅钝性分离双侧肾蒂并穿线,不使用动脉夹夹闭肾蒂。I/R+普罗布考组小鼠在行造模手术后,给予100 mg/kg普罗布考灌胃2次/d,连续给药3 d。造模72 h后,经股动脉抽取动脉血,摘取双侧肾脏,一侧快速放入液氮冻存备用,一侧固定进行组织学检测。
1.3 HE染色与肾组织病理评分 一侧肾取材后立即放入4%多聚甲醛中固定24 h,常规石蜡包埋连续切片,切片脱蜡、梯度乙醇水合,苏木精染液染色1~10 min、自来水冲洗5 min,1% 盐酸酒精分化2~5 s、自来水冲洗2 min,5%氨水返蓝30 s,伊红染液染色1~3 min,梯度乙醇脱水、二甲苯透明、中性树胶封片,光学显微镜下观察并摄片。参照分级评分标准对肾脏病理变化进行评价[10],随机选取10个400倍显微镜视野,对肾小管扩张、肾小管上皮细胞脱落、肾小球结构破坏、间质充血与肾小管内蛋白管型进行半定量评价,对损伤阳性面积进行评估,分级评分标准如下:<10%为0分;10%~25%为1分;>25%~50%为2分;>50%~75%为3分;>75%~100%为4分。
1.4 SCr和BUN水平检测 再灌注24 h后,经股动脉取动脉血放入离心管静置30 min,离心后苦味酸速率法测定SCr含量,酶偶联速率法测定BUN含量,所有步骤严格按照说明书顺序,应用全自动生化分析仪。
1.5 肾组织MDA含量与GPXs活性检测 取一侧肾组织冰上剪碎,加入预冷组织裂解液,离心后取上清液,严格按照试剂盒方法进行操作,分光光度计分别检测MDA含量与GPXs活性。
1.6 Western blot检测肾组织GPX4蛋白表达 取液氮冻存的小鼠肾组织,组织裂解液冰上裂解提取组织蛋白,BCA法测定蛋白浓度,蛋白上样量均为40 μg,SDS-PAGE胶分离、转膜、5%牛血清白蛋白(bull serum albumin,BSA)室温封闭 1 h,去除封闭液后分别加入3%BSA稀释的GPX4(1∶500)和β-actin(1∶1 000)抗体,4 ℃过夜,次日室温平衡1 h后,加入辣根酶过氧化物标记的羊抗兔IgG(1∶200),室温孵育2 h,增强化学发光法显色并显影,应用Quantity One定量分析条带,以GPX4/β-actin比值表示GPX4的相对含量。
1.7 统计学方法 应用SPSS 23.0统计软件进行数据分析,计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 4组肾脏组织病理学改变和肾组织损伤评分比较 与对照组比较,I/R组HE染色切片光镜下可见肾组织损害,肾小管上皮变薄,肾小管管腔缩小,局部出现上皮细胞脱落,肾间质红细胞与白细胞增多,肾小管损伤评分明显增高(P<0.01);与I/R组比较,I/R+普罗布考组肾组织损害程度减轻,肾小管损伤评分明显降低(P<0.05)。见图1,表1。

图1 普罗布考对肾组织形态结构的影响(HE ×400)A.正常对照组;B.假手术组;C.I/R组;D.I/R+普罗布考灌胃组Figure 1 Effect of probucol on the renal tissue morphology (HE ×400)

表1 4组肾组织损伤评分比较Table 1 Comparison of renal injury score between 4 groups ,分)
*P<0.01与正常对照组比较 #P<0.05与I/R组比较(SNK-q检验)
2.2 4组SCr和BUN水平比较 与正常对照组比较,I/R组SCr和BUN含量明显升高,差异有统计学意义(P<0.01);与I/R组比较,I/R+普罗布考组SCr和BUN明显降低,差异有统计学意义(P<0.05)。见表2。

表2 4组SCr和BUN水平比较Table 2 Comparison of SCr and BUN levels between 4 groups
*P<0.01与正常对照组比较 #P<0.05与 I/R组比较(q检验)
2.3 4组肾组织MDA含量和GPXs活性比较 与正常对照组比较,I/R组肾组织MDA含量明显升高,GPXs活性明显降低,差异有统计学意义(P<0.01);与I/R组比较,I/R+普罗布考组肾组织MDA含量明显降低,GPXs活性明显升高,差异有统计学意义(P<0.05)。见表3。

表3 4组肾组织MDA含量和GPXs活性比较Table 3 Comparison of MDA content and GPXs activity in 4 groups
*P<0.01与正常对照组比较 #P<0.05与 I/R组比较(q检验)
2.4 GPX4蛋白在肾组织中的表达 与正常对照组比较,I/R组肾组织中GPX4蛋白表达水平明显降低(P<0.01);与I/R组比较,I/R+procubol组肾组织中GPX4蛋白表达水平明显升高(P<0.05)。见图2,表4。

图2 Western blot 检测GPX4蛋白在小鼠肾组织中的表达
Figure2 The expression of GPX4 in mouse renal tissue detected by western blot
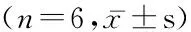
表4 普罗布考对肾组织GPX4蛋白表达的影响Table 4 Effect of probucol on the protein expression of GPX4 in renal tissue
*P<0.01与正常对照组比较 #P<0.05与I/R组比较(SNK-q检验)
3 讨 论
研究表明,肾作为高血流灌注的器官,缺血在40 min以内造成的肾组织损伤是可逆的,缺血时间超过40 min可造成肾组织不可逆损伤[11]。目前,大部分研究侧重于对肾组织可逆性I/R损伤的保护作用,而临床更期望如何避免不可逆损伤或延长肾组织对缺血的耐受时间,并且临床上I/R损伤的防治仍以药物对症治疗为主[12]。本研究采用无创动脉夹阻断肾脏血流40 min的方法建立小鼠急性I/R损伤模型,介于可逆损伤与不可逆损伤的中间状态,通过肾脏颜色由鲜红转为暗红再转为鲜红的大体结构特征把握缺血与再灌注的时间间隔。同时采用术后给药来模拟临床无法进行预处理的情况,于给药3 d后取材,正好排除手术对肾功能造成的影响,有利于模型的有效性。本研究首先从肾组织的病理形态学入手,直观观察肾组织的损伤情况,并进行分级评分。石蜡切片HE染色结果显示,I/R组小鼠肾组织的损伤主要发生在皮质与髓质交界的部位,肾小管上皮细胞可见空泡变性,肾小管组织结构因上皮细胞脱落呈现严重破坏,肾间质内可见弥漫性出血和中性粒细胞浸润;而普罗布考治疗组肾组织结构完整,肾小管上皮细胞排列较整齐,边界清晰,空泡变性少见,肾小管管腔未见明显缩窄。表明普罗布考可以减轻小鼠肾I/R损伤,对肾组织具有保护作用。
临床上,判断肾组织受损情况的常用检测方法是肾功能的检查,常用指标是SCr与BUN,SCr和BUN水平同时升高时提示出现肾组织损伤[13]。本研究结果显示,模型建立后小鼠SCr和BUN水平较正常对照组明显升高。提示模型可用于肾组织I/R损伤研究。由于单位时间内通过肾脏进行过滤的血液占心输出量的25%左右,肾组织对缺血的敏感程度很高,缺血缺氧导致过量活性氧簇(reactive oxygen species,ROS)作用于脂肪酸等生物大分子造成脂质过氧化,产生大量MDA。因此,MDA也是肾组织损伤的指标[14]。本研究结果显示,肾I/R损伤组小鼠肾组织内的MDA含量显著升高。表明I/R引起肾组织脂质过氧化。最新研究发现,I/R损伤引起肾小管上皮细胞发生脂质过氧化依赖的ferroptosis,是一种新发现的细胞死亡方式,其主要机制是使GPX4失活,引起更多的脂质过氧化物蓄积,加重组织损伤,同时敲除掉小鼠GPX4基因可以通过诱导肾小管上皮细胞死亡而导致急性肾衰竭,体内实验研究也发现应用脂质过氧化小分子抑制剂Liproxstain-1可以有效减轻肾组织损伤[3]。本研究结果显示,肾I/R损伤模型小鼠的肾组织中MDA升高的同时伴随GPXs活性的降低和GPX4表达的减少。说明GPX4在肾组织损伤中发挥作用,可以将GPX4作为药物治疗的靶点。
普罗布考最初是作为降脂药物应用于临床,其抗氧化、抗炎与抗肿瘤活性逐渐被人们所认识,曾经因为不良反应一度被新型降脂药替代,但越来越多的研究发现普罗布考具有强大的抗氧化能力[15]。虽然有不少研究表明许多天然提取物通过抗氧化发挥较好的组织保护作用,但仅限于动物体内外实验,很少能直接用于临床。普罗布考虽然具有可能导致心律失常的不良反应,不过只对有严重心脏疾病的患者有此不良反应,而且不良反应会随着停药而消失,作为数十年应用于临床一线的药物,随时可以应用于临床治疗[8]。目前,研究发现普罗布考的抗氧化作用主要是通过清除细胞内和细胞膜上的自由基抑制脂质过氧化物的产生,间接或直接激活细胞内的抗氧化酶类,其中包括GPXs[16]。本研究结果显示,普罗布考治疗后,SCr和BUN明显降低,肾组织内MDA含量降低,而GPXs活性与GPX4蛋白表达显著提高。提示普罗布考不仅可以通过直接抑制脂质过氧化促进肾组织损伤和功能的恢复,还可以通过提高GPXs活性加速清除过氧化物,特别是提高GPX4的活性,发挥组织保护作用。由于I/R是一个复杂的病理生理过程,普罗布考发挥其肾组织保护作用也不仅限于单纯的抗氧化应激,有可能是多靶点、多途径的。普罗布考保护肾脏的机制尚未完全明了,需进一步深入探讨。
综上所述,普罗布考处理对肾I/R损伤具有保护作用,可能是通过激活GPX4,直接或间接抑制脂质过氧化达到肾组织保护作用。
[1] Kers J,Leemans JC,Linkermann A. An Overview of Pathways of Regulated Necrosis in Acute Kidney Injury[J]. Semin Nephrolo,2016,36(3):139-152.
[2] Yang Y,Song M,Liu Y,et al. Renoprotective approaches and strategies in acute kidney injury[J]. Pharmacol Ther,2016,163:58-73.
[3] Friedmann Angeli JP,Schneider M,Proneth B,et al. Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice[J]. Nat Cell Biol,2014,16(12):1180-1191.
[4] Garg JP,Vucic D. Targeting Cell Death Pathways for Therapeutic Intervention in Kidney Diseases[J]. Semin Nephrol,2016,36(3):153-161.
[5] 霍宏昌,王切,王素玲,等.大鼠肾缺血再灌注损伤模型心肌内过氧化酶Ⅲ的表达变化[J].河北医科大学学报,2016,37(10):1165-1169.
[6] Doi K,Rabb H. Impact of acute kidney injury on distant organ function:recent findings and potential therapeutic targets[J]. Kidney Int,2016,89(3):555-564.
[7] Jung YS,Park JH,Kim H,et al. Probucol inhibits LPS-induced microglia activation and ameliorates brain ischemic injury in normal and hyperlipidemic mice[J]. Acta Pharmacol Sin,2016,37(8):1031-144.
[8] Yamashita S,Masuda D,Matsuzawa Y. Did we abandon probucol too soon[J]. Curr Opin Lipidol,2015,26(4):304-316.
[9] Soares RZ,Vuolo F,Dall'Igna DM,et al. Evaluation of the role of the cannabidiol system in an animal model of ischemia/reperfusion kidney injury[J]. Rev Bras Ter Intensiva,2015,27(4):383-389.
[10] Lv J,Feng M,Zhang L,et al. Protective effect ofepigallocatechin gallate,a major constituent of green tea,against renal ischemia-reperfusion injury in rats[J]. Int Urol Nephrol,2015,47(8):1429-1435.
[11] Akbas A,Silan C,Gulpinar MT,et al. Renoprotective Effect of Humic Acid on Renal Ischemia-Reperfusion Injury:an Experimental Study in Rats[J]. Inflammation,2015,38(6):2042-2048.
[12] Cusumano G,Romagnoli J,Liuzzo G,et al. N-Acetylcysteine and High-Dose Atorvastatin Reduce Oxidative Stress in an Ischemia-Reperfusion Model in the Rat Kidney[J]. Transplant Proc,2015,47(9):2757-2762.
[13] Seo K,Choi JW,Kim DW,et al. Aminophylline Effect on Renal Ischemia-Reperfusion Injury in Mice[J]. Transplant Proc,2017,49(2):358-365.
[14] Kadkhodaee M,Najafi A,Seifi B. Classical and remote post-conditioning effects on ischemia/reperfusion-induced acute oxidant kidney injury[J]. Int J Surg,2014,12(11):1162-1166.
[16] Santos DB,Peres KC,Ribeiro RP,et al. Probucol,a lipid-lowering drug,prevents cognitive and hippocampal synaptic impairments induced by amyloid β peptide in mice[J].Exp Neurol,2012,233(2):767-775.
(本文编辑:刘斯静)
Protective effect and mechanism of probucol on renal ischemia-reperfusion injury in mice
GONG Miao1, ZHANG Lei1, ZHAO Chun-fang1, LI Li1, ZHANG Ya-nan1, REN Guang-wei2*
(1.DepartmentofHistologyandEmbryology,theSchoolofBasicMedicalScience,HebeiMedicalUniversity,Shijiazhuang050017,China; 2.DepartmentofNephrology,theFirstHospitalAffiliatedtoHebeiMedicalUniversity,Shijiazhuang050017,China)
Objective To investigate the protective effect and mechanism of probucol on renal ischemia-reperfusion(I/R) injury in mice. Methods 10-week-old male C57BL/6j mice were randomly divided into four groups(n=10): control group, sham operation group, I/R group, and I/R+probucol(100 mg/kg) group. The renal tissue pathological changes were observed by HE staining and graded. Levels of SCr and BUN in serum were tested by ELISA. The content of MDA and activity of GPXs were detected by using chromometry. The protein expression of GPX4 was measured by western blot. Results Compared with control group, pathological changes of renal tissue were aggravated in IR group. SCr and BUN levels as well as MDA content of renal tissue were significantly increased. We also found that GPXs activity and GPX4 protein expression were significantly decreased(P<0.01). Compared with IR group, histopathological changes of renal tissue were alleviated in IR+probucol group. The levels of Cr and BUN were decreased significantly, with MDA content decreased and GPXs activity or GPX4 protein increased(P<0.05). Conclusion Probucol reduces the damage of renal tissue induced by acute ischemia reperfusion injury in mice, which might be involved in activating GPX4.
reperfusion injury; kidney; probucol; mice
2017-03-31;
2017-04-06
河北省医学科学研究重点课题(20170517)
龚淼(1983-),女,河北石家庄人,河北医科大学基础医学院实验师,医学硕士,从事器官组织学研究。
*通讯作者。E-mail:55390309@qq.com
R619.9
A
1007-3205(2017)05-0497-05
10.3969/j.issn.1007-3205.2017.05.001
