二苯乙烯苷对淀粉样前体蛋白/早老蛋白-1双转基因小鼠脑组织半胱氨酸天冬氨酸蛋白酶3和淀粉样前体蛋白表达的影响
2017-05-18廖艳花黄忠仕
刘 宁,廖艳花,赖 术,黄 健,黎 昀,黄忠仕
533000广西百色市,右江民族医学院
·论著·
二苯乙烯苷对淀粉样前体蛋白/早老蛋白-1双转基因小鼠脑组织半胱氨酸天冬氨酸蛋白酶3和淀粉样前体蛋白表达的影响
刘 宁,廖艳花,赖 术,黄 健,黎 昀,黄忠仕*
533000广西百色市,右江民族医学院
目的 观察二苯乙烯苷(TSG)对淀粉样前体蛋白(APP)/早老蛋白-1(PS1)双转基因小鼠脑组织半胱氨酸天冬氨酸蛋白酶3(caspase-3)、APP表达水平的影响,探讨其防治AD的可能机制。方法 2014年10月,将50只SPF级、雄性、APP/PS1双转基因小鼠按照随机数字表法分为模型组、石杉碱甲组、TSG低剂量组、TSG中剂量组、TSG高剂量组,每组10只。并选取10只SPF级、雄性、C5B7L/6J小鼠为正常对照组。石杉碱甲组小鼠灌胃给予石杉碱甲0.020 mg/kg,TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠分别灌胃给予TSG 0.033、0.100、0.300 g/kg,模型组、正常对照组小鼠灌胃给予0.9%氯化钠溶液10.000 ml/kg;1次/d,连续给药60 d。采用免疫组化法检测各组小鼠脑皮质和海马区caspase-3阳性细胞数,Western blotting法检测各组小鼠脑组织APP表达水平。结果 正常对照组、石杉碱甲组、TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑皮质、海马区caspase-3阳性细胞数少于模型组(P<0.05);TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑皮质、海马区caspase-3阳性细胞数与石杉碱甲组比较,差异无统计学意义(P>0.05)。正常对照组、石杉碱甲组、TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑组织APP表达水平均低于模型组(P<0.05);TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑组织APP表达水平与石杉碱甲组比较,差异无统计学意义(P>0.05)。结论 TSG对APP/PS1双转基因小鼠有明显的治疗作用,其防治AD的机制可能与抑制caspase-3和APP表达、减少β淀粉样蛋白产生、减缓神经元凋亡等机制有关。
阿尔茨海默病;二苯乙烯苷;半胱氨酸天冬氨酸蛋白酶3;淀粉样前体蛋白分泌酶类
阿尔茨海默病(AD)是一种以记忆障碍为主要临床表现、病程呈进行性发展的中枢神经变性病。目前中国55岁以上人群中,AD患病率已超过2.2%[1]。临床上治疗AD的药物种类较多,但均仅能改善患者的临床症状,而不能控制病情进展,因此,寻求疗效确切且能控制病情发展的药物成为当今研究的热点。二苯乙烯苷(TSG)是何首乌中主要的生物活性成分,属多羟基芪类化合物,具有保护神经、提高学习记忆力、抗衰老、防治AD、舒张血管、保护肝脏、降血脂、抗炎、抗肿瘤等多种生物活性[2-3]。石杉碱甲是从中草药石杉中提取分离到的一种高活性的倍半萜类生物碱,相对分子量小,脂溶性好,容易透过血-脑脊液屏障,口服生物利用度高,口服吸收后在脑内主要分布于海马区、额叶和颞叶等部位。多项研究表明,石杉碱甲对轻、中度AD有确切的临床疗效[4-5]。石杉碱甲治疗AD的作用机制除了与抑制胆碱酯酶活性有关外,还与其抑制神经元凋亡有关[6-7]。
本课题组前期研究也发现,TSG能提高SAMP8鼠的学习记忆能力[8],抑制AD模型鼠脑组织中淀粉样前体蛋白(APP)mRNA和早老蛋白-1(PS1)mRNA的表达[9-10]。本课题组前期研究初步表明TSG对痴呆动物模型有明显的防治疗效,但其对半胱氨酸天冬氨酸蛋白酶(caspase)-3表达水平是否有影响,尚未见相关报道。本研究拟在前期研究的基础上以APP/PS1双转基因小鼠为模型,观察TSG对其脑组织caspase-3、APP表达水平的影响,分析TSG防治AD的可能机制,为TSG的临床应用提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 50只APP/PS1双转基因小鼠和10只C5B7L/6J小鼠,均为雄性,SPF级,平均体质量(28±2)g,3月龄,均由北京华阜康生物科技股份有限公司提供〔许可证号:SCXK(京)2014-0004〕。
1.1.2 主要试剂 TSG(成都克洛玛生物科技有限公司,批号:14112),纯度≥70%;石杉碱甲(河南太龙药业股份有限公司,批号:H10940156);二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司,批号:20150223);RIPA裂解液(产品编号P0013B)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒(产品编号P0012A)、免疫染色洗涤液(产品编号P0106)、特超敏ECL化学发光试剂盒(产品编号P0018A)及显影定影试剂盒(产品编号P0020)均购自上海碧云天生物技术有限公司;PageRuler Plus Prestained Protein Ladder(Thermo Scientific公司,#26619);0.45 μm聚偏氟乙烯(PVDF)膜(Millipore公司,产品编号IPVH00010);caspase-3兔抗小鼠单克隆抗体(#9579)、APP多克隆抗体(#2452)、β-actin兔单克隆抗体(#8457)及HRP标记抗兔IgG(#7074)均购自美国Cell Signaling Technology公司。
1.1.3 主要仪器 HMIAS-2000W 高清彩色图文分析系统(LO-GENE-I型)由右江民族医学院附属医院病理科提供。BIO-RAD的电泳/转膜仪(型号:041BR60422)、Mini型垂直电泳槽(型号:552BR068856)、湿法转膜槽(型号:153BR57570)均由右江民族医学院科学实验中心提供。
1.2 实验方法
1.2.1 动物分组与给药 2014年10月,将50只APP/PS1双转基因小鼠按照随机数字表法分为模型组、石杉碱甲组、TSG低剂量组、TSG中剂量组、TSG高剂量组,每组10只。并选取10只C5B7L/6J小鼠为正常对照组。石杉碱甲组灌胃给予石杉碱甲0.020 mg/kg,TSG低剂量组、TSG中剂量组、TSG高剂量组分别灌胃给予TSG 0.033、0.100、0.300 g/kg,模型组和正常对照组灌胃给予0.9%氯化钠溶液10.000 ml/kg;1次/d,连续给药60 d。
1.2.2 标本采集 治疗2个月后,采用颈椎脱臼处死小鼠,断头,冰上迅速取出脑组织,每组随机抽取4只小鼠的脑组织放入10%甲醛溶液中固定,剩余的小鼠脑组织装入冻存管,用液氮罐转移至-80 ℃冰箱保存用于后续实验。
1.2.3 免疫组化法检测caspase-3阳性细胞 10%甲醛溶液固定1周后的脑组织进行石蜡包埋、海马区冠状切片。切片经二甲苯脱蜡,梯度乙醇水化,0.01 mol/L枸橼酸缓冲液于压力锅中加热至沸腾2 min修复抗原,磷酸盐缓冲液(PBS)冲洗3次,2 min/次;免疫染色封闭液封闭15 min(甩干);滴加caspase-3兔抗小鼠单克隆抗体(免疫染色一抗稀释液1∶250稀释),4 ℃孵育过夜,免疫染色洗涤液冲洗3次,2 min/次;HRP标记抗兔IgG孵育15 min,免疫染色洗涤液冲洗6次,2 min/次;DAB显色5~8 min、苏木素复染、从低到高浓度乙醇脱水、二甲苯透明、封固、观察。DAB显色后caspase-3阳性细胞为棕黄色,免疫染色一抗稀释液代替一抗作为阴性对照。caspase-3阳性细胞测定方法:每组随机抽取4张切片,每张切片在海马区和脑皮质各采集连续且不重叠的5个视野(×400)的图片,计算每个视野内的caspase-3阳性细胞数,取5个视野的平均值作为该组织caspase-3阳性细胞数。
1.2.4 Western blotting法检测APP表达水平 于-80 ℃冰箱中取出脑组织,冰上剪碎,加入预冷的RIPA裂解液,匀浆器匀浆至充分裂解;4 ℃14 000×g离心15 min,取上清液,测定并计算样本总蛋白;每个样本取30 μg进行SDS-PAGE,300 mA恒流湿式电印迹法转至PVDF膜,双蒸水洗膜3 min,封闭液室温封闭1 h后剪膜,分别加入APP兔多克隆抗体和β-actin兔单克隆抗体(1∶1 000稀释),4 ℃冰箱摇床孵育过夜;TBST漂洗5次,10 min/次,加入HRP标记的二抗(1∶1 000~1∶3 000稀释)孵育1~2 h;TBST洗膜3次,20 min/次,暗室曝光,压片。采用Image J软件分析,目的蛋白条带与β-actin蛋白条带灰度值的比值表示APP相对表达水平。为去除曝光时间差异对结果的影响,本实验再将同一张X片上各实验组目的条带灰度相对值与正常对照组目的条带灰度相对值相比,用其最终比值代表各目的蛋白的相对表达水平,纳入统计数据。
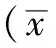
2 结果
2.1 各组小鼠脑皮质、海马区caspase-3阳性细胞数比较 免疫组化法结果显示,正常对照组小鼠脑皮质和海马区caspase-3阳性细胞数较少,细胞内反应物染色较浅;模型组小鼠脑皮质和海马区caspase-3阳性细胞数较多,细胞内反应物染色较深;石杉碱甲组与模型组相比,小鼠脑皮质和海马区caspase-3阳性细胞数明显减少,且细胞内反应物染色也较浅;TSG低剂量组、TSG中剂量组、TSG高剂量组与模型组相比,小鼠脑皮质和海马区caspase-3阳性细胞数明显减少,且以TSG高剂量组减少最明显(详见图1~2,本文图1~2彩图见本刊官网www.chinagp.net电子期刊相应文章)。
6组小鼠脑皮质、海马区caspase-3阳性细胞数比较,差异有统计学意义(P<0.05);正常对照组、石杉碱甲组、TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑皮质、海马区caspase-3阳性细胞数少于模型组,差异有统计学意义(P<0.05);TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑皮质、海马区caspase-3阳性细胞数与石杉碱甲组比较,差异无统计学意义(P>0.05,见表1)。
2.2 各组小鼠脑组织APP表达水平比较 6组小鼠脑组织APP表达水平比较,差异有统计学意义(P<0.05);正常对照组、石杉碱甲组、TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑组织APP表达水平均低于模型组,差异有统计学意义(P<0.05);TSG低剂量组、TSG中剂量组、TSG高剂量组小鼠脑组织APP表达水平与石杉碱甲组比较,差异无统计学意义(P>0.05,见表2、图3)。

注:a为正常对照组,b为模型组,c为石杉碱甲组,d为二苯乙烯苷(TSG)低剂量组,e为TSG中剂量组,f为TSG高剂量组
图1 各组小鼠脑皮质caspase-3阳性细胞表达情况(免疫组化染色,×400)
Figure 1 Expressions of caspase-3 positive cells in the cerebral cortex stained by immunohistochemistry of six groups of mice

注:a为正常对照组,b为模型组,c为石杉碱甲组,d为TSG低剂量组,e为TSG中剂量组,f为TSG高剂量组
图2 各组小鼠海马区caspase-3阳性细胞表达情况(免疫组化染色,×400)
Figure 2 Expressions of caspase-3 positive cells in the hippocampus stained by immunohistochemistry of six groups of mice

注:APP=淀粉样前体蛋白;a为正常对照组,b为模型组,c为石杉碱甲组,d为TSG低剂量组,e为TSG中剂量组,f为TSG高剂量组
图3 TSG对各组小鼠脑组织中APP表达水平的影响
Figure 3 Effect of TSG on the expression level of APP in the brain tissues of six groups of mice

Table1Numberofcaspase-3positivecellsinthecerebralcortexandhippocampusofsixgroupsofmice

组别只数脑皮质海马区正常对照组46955±1557a5185±1020a模型组411670±371710330±2462石杉碱甲组47410±1717a6495±1179aTSG低剂量组48520±1434a7400±1235aTSG中剂量组48070±1266a6930±1315aTSG高剂量组47140±1364a5820±2631aF值29924162P值00390010
注:TSG=二苯乙烯苷;与模型组比较,aP<0.05

表2 各组小鼠脑组织APP表达水平比较±s)
注:APP=淀粉样前体蛋白;与模型组比较,aP<0.05
3 讨论
本实验选用的APP/PS1双转基因小鼠,其脑内斑块形成较早,可以较好模拟AD脑组织神经病理特征[11],得到国际的认可[12-14],目前该模型已被广泛用于AD的相关研究[15-16]。
神经元纤维缠结、脑内老年斑和神经元丢失是AD的主要病理特征[17]。AD患者脑组织切片中单位面积的凋亡细胞数增加[18],提示凋亡参与了AD神经元丢失的过程。目前AD公认的发病机制为脑内积累具有神经毒性的β淀粉样蛋白(Aβ),其通过引发一系列反应,导致大量的神经元凋亡、丢失[19]。有研究表明,AD患者的神经元凋亡主要是通过caspase激活途径[20-21]。caspase-3是caspase家族中的重要成员,是细胞凋亡的主要执行者[22]。王述菊等[23]研究结果显示,艾灸治疗AD的作用机制可能与减少caspase-3的释放有关。AD主要受累部位为脑皮质和海马区[24]。本研究中免疫组化法结果显示,治疗2个月后,石杉碱甲组及TSG各剂量组小鼠脑皮质和海马区caspase-3阳性细胞数均减少,TSG各剂量组脑皮质和海马区caspase-3阳性细胞数与石杉碱甲组相比无差异,表明TSG可以有效抑制小鼠脑皮质和海马区caspase-3表达,减少小鼠脑神经元的凋亡和丢失。
APP与AD的发生密切相关,老年斑的核心成分Aβ是由APP裂解产生的。APP是一种跨膜糖蛋白,在体内各组织均有表达,而在脑中以APP695为主。大量生成的APP可激活caspase-3,加速神经元凋亡[25]。此外,病理状态下,过量表达的APP除了依次被β-分泌酶和γ-分泌酶裂解产生有神经毒性的Aβ外,其胞质部分还能直接被激活的caspase-3裂解,加大Aβ的生成量,加快老年斑的形成,加速神经元的凋亡[26-28]。因此,过量表达的APP既是caspase-3的激活剂,又是caspase-3的底物,APP和caspase-3之间相互作用,放大凋亡信号,形成毒性网络,加速神经元凋亡。本课题组前期研究发现,TSG治疗AD的机制可能和下调AD模型小鼠脑组织中APP表达水平有关[29]。本研究Western blotting法结果显示,治疗2个月后,石杉碱甲组及TSG各剂量组小鼠脑组织APP表达水平均低于模型组,且TSG各剂量组小鼠脑组织APP表达水平与石杉碱甲组相比无差异,表明TSG可以有效降低小鼠脑组织APP表达水平,减少Aβ产生,减缓AD进程。
综上所述,TSG防治AD的机制除了与抑制caspase-3表达、直接抑制神经元凋亡有关外,还可能与减少APP作为caspase-3底物的裂解途径、抑制Aβ的产生及其神经毒性有关,也可能与TSG作用于APP和caspase-3产生协同作用有关,鉴于中药作用的多靶点、多途径的特点,其具体作用机制有待进一步探究。
作者贡献:刘宁负责查阅资料,购买小鼠、实验试剂和耗材,进行实验操作、文章写作;廖艳花负责辅助实验操作;赖术、黄健、黎昀负责查阅资料及小鼠饲养及给药;黄忠仕负责课题设计、实验指导、文章审核。
本文无利益冲突。
本研究不足与展望:
(1)淀粉样前体蛋白(APP)/早老蛋白-1(PS1)双转基因小鼠的价格限制了本次实验的样本量,这在一定程度上可能影响实验结果的准确性,后续研究中若能增加样本量,将为二苯乙烯苷(TSG)的临床应用和研究提供更可靠的实验数据。(2)本课题组关于TSG的研究目前尚处于动物实验研究阶段,关于其防治阿尔茨海默病的临床疗效和具体作用机制还有待进一步验证。
[1]秦俊法.微量元素与阿尔茨海默病(9)[J].广东微量元素科学,2016,23(1):1-8. QIN J F.Trace elements and Alzheimer′s disease(9)[J].Guangdong Trace Elements Science,2016,23(1):1-8.
[2]黄世琼,张毅,杨军宣.何首乌主要成分二苯乙烯苷的研究进展[J].海峡药学,2016,28(6):37-39.DOI:10.3969/j.issn.1006-3765.2016.06.016. HUANG S Q,ZHANG Y,YANG J X.Recent advances on stilbene glucoside of the main component of polygonum multiflorum Thunb[J].Strait Pharmaceutical Journal,2016,28(6):37-39.DOI:10.3969/j.issn.1006-3765.2016.06.016.
[3]陈冰冰,姜爱玲,张岩.何首乌有效成分二苯乙烯苷的药理活性研究进展[J].中国临床药理学与治疗学,2016,21(6):710-715. CHEN B B,JIANG A L,ZHANG Y.Research progress on pharmacological activities of stilbene glucoside,active component from Polygonum multiflorum Thunb[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2016,21(6):710-715.
[4] 史宝和,李玉锋,李成洋,等.石杉碱甲治疗轻中度阿尔茨海默病的临床研究[J].实用药物与临床,2013,16(1):37-38.DOI:10.3969/j.issn.1673-0070.2013.01.015. SHI B H,LI Y F,LI C Y,et al.Clinical study of huperzine A on patients with mild and moderate Alzheimer disease[J].Practical Pharmacy and Clinical Remedies,2013,16(1):37-38.DOI:10.3969/j.issn.1673-0070.2013.01.015.
[5]唐建良.石杉碱甲与多奈哌齐对阿尔茨海默病患者认知功能损害的对照研究[C]//中国心理卫生协会.第七届全国心理卫生学术大会论文汇编.中国心理卫生协会,2014:2. TANG J L.A comparative study of huperzine A and donepezil on cognitive impairment in patients with Alzheimer′s disease[C]//Chinese Association for Mental Health.Paper compilation of the Seventh National Conference on mental Hygiene.Chinese Association for Mental Health,2014:2.
[6]XIAO X Q,ZHANG H Y,TANG X C.Huperzine A attenuates amyloid beta-peptide fragment 25-35-induced apoptosis in rat cortical neurons via inhibiting reactive oxygen species formation and caspase-3 activation[J].J Neurosci Res,2002,67(1):30-36.
[7]ZHANG H Y,TANG X C.Huperzine A attenuates the neurotoxic effect ofstaurosporine in primary rat cortical neurons[J].Neurosci Lett,2003,340(2):91-94.
[8]刘玲,赖术,黎昀,等.二苯乙烯苷对SAMP8小鼠学习记忆能力的改善作用[J].中国现代中药,2012,14(10):12-15.DOI:10.3969/j.issn.1673-4890.2012.10.003. LIU L,LAI S,LI Y,et al.TSG on learning and memory abilities in senescence accelerated SAMP8 mouse[J].Modern Chinese Medicine,2012,14(10):12-15.DOI:10.3969/j.issn.1673-4890.2012.10.003.
[9]刘玲,朱晓莹,黎昀,等.二苯乙烯苷对SAMP8小鼠APP mRNA和PS1 mRNA表达的影响[J].中国实验方剂学杂志,2013,19(1):240-243. LIU L,ZHU X Y,LI Y,et al.Effects of TSG on expression of APP mRNA and PS1 mRNA in SAMP8 mice[J].Chinese Journal of Experimental Traditional Medical Formulae,2013,19(1):240-243.
[10]杨晓颖,刘宁,黄岑汉,等.二苯乙烯苷对APP/PS1双转基因小鼠APP、PS1基因表达的影响[J].中国老年学杂志,2016,36(7):1573-1575.DOI:10.3969/j.issn.1005-9202.2016.07.016. YANG X Y,LIU N,HUANG C H,et al.Effect of TSG on gene expression of APP and PS1 in APP/PS1 double transgenic mice[J].Chinese Journal of Gerontology,2016,36(7):1573-1575.DOI:10.3969/j.issn.1005-9202.2016.07.016.
[11]LEE J E,HAN P L.An update of animal models of Alzheimer disease with areevaluation of plaque depositions[J].Exp Neurobiol,2013,22(2):84-95.
[12]YAO Z G,ZHANG L,LIANG L,et al.The effect of PN-1,a traditional chineseprescription,on the learning and memory ina transgenic mouse model of Alzheimer′s disease[J].Evid Based Complement Alternat Med,2013,2013:518421.DOI:10.1155/2013/518421.
[13]NEUMEISTER K L,RIEPE M W.Bupropion and citalopram in the APP23 mouse model of Alzheimer′s disease:a study in a dry-land maze[J].Int J Alzheimers Dis,2012,2012:673584.
[14]LUO H,WU Q,YE X,et al.Genome-wide analysis of miRNA signature in the APPswe/PS1ΔE9 mouse model of Alzheimer′s disease[J].PLoS One,2014,9(8):e101725.DOI:10.1371/journal.pone.0101725.
[15]赵晓燕,王丹丹,单烨,等.APP/PS1转基因鼠脑内小泛素化修饰物-1上调可能参与阿尔茨海默病老年斑形成和神经突起变性的调节[J].生理学报,2013,65(3):253-262. ZHAO X Y,WANG D D,SHAN Y,et al.Potential involvement of abnormal increased SUMO-1 in modulation of the formation of Alzheimer′s disease senile plaques and neuritic dystrophy in APP/PS1 transgenic mice[J].Acta Physiologica Sinica,2013,65(3):253-262.
[16]邱昕,陈国华,汪弢,等.黄连解毒汤对APP/PS1双转基因阿尔茨海默病小鼠自由基代谢及海马区病理形态学影响[J].中国中西医结合杂志,2011,31(10):1379-1382. QIU X,CHEN G H,WANG T,et al.Effects of Huanglian Jiedu Decoction on free radicals metabolism and pathomorphism of the hippocampus in APP/PS1 double transgenic mice[J].Chinese Journal of Integrated Traditional and Western Medicine,2011,31(10):1379-1382.
[17]肖稳,丁萍,杨飞.阿尔茨海默病早期生物标记物及其检测方法的研究进展[J].中国预防医学杂志,2016,17(3):225-228.DOI:10.16506/j.1009-6639.2016.03.016. XIAO W,DING P,YANG F.Research progress of biomarkers and detection methods of Alzheimer′s disease[J].Chinese Preventive Medicine,2016,17(3):225-228.DOI:10.16506/j.1009-6639.2016.03.016.
[18]孟艳,王蓉,刘梦霞,等.阿尔茨海默病患者脑神经元凋亡机制中相关因素的研究[J].中华老年医学杂志,2006,25(4):245-247. MENG Y,WANG R,LIU M X,et al.Study on the factors related with mechanism of neuron apoptosis in Alzheimer disease[J].Chinese Journal of Geriatrics,2006,25(4):245-247.
[19]余云舟,徐青.靶向β-淀粉样蛋白的阿尔茨海默病免疫治疗研究进展[J].国际药学研究杂志,2016,43(2):216-223.DOI:10.13220/j.cnki.jipr.2016.02.005. YU Y Z,XU Q.Immunotherapy targeting β-amyloid for Alzheimer′s disease:research advances[J].Journal of International Pharmaceutical Research,2016,43(2):216-223.DOI:10.13220/j.cnki.jipr.2016.02.005.[20]YAMAZAKI Y,TSURUGA M,ZHOU D,et al.Cytoskeletal disruption accelerates caspase-3 activation and alters theintracellular membrane reorganization in DNA damage-induced apoptosis[J].Exp Cell Res,2000,259(1):64-78.[21]ROHN T T,RISSMAN R A,DAVIS M C,et al.Caspase-9 activationand caspase cleavage of tau in the Alzheimer′s disease brain[J].Neurobiol Dis,2002,11(2):341-354.
[22]陈雪,孙婧霞,蒋常文.Bcl-2、Caspase-3与阿尔茨海默病关系的研究进展[J].临床医学工程,2013,20(9):1177-1179. CHEN X,SUN J X,JIANG C W.Research progress on Bcl-2,Caspase-3 and Alzheimer′s disease[J].Clinical Medical & Engineering,2013,20(9):1177-1179.
[23]王述菊,孙国杰,马骏,等.艾灸对Alzheimer病模型大鼠行为学及海马区Bcl-2、Bax、Caspase-3影响的研究[J].世界科学技术-中医药现代化,2015,17(6):1243-1248.DOI:10.11842/wst.2015.06.022. WANG S J,SUN G J,MA J,et al.Effects of moxibustion on behaviors and Bcl-2,Bax,Caspase-3 in hippocampus of Alzheimer′s disease model rats[J].World Science and Technology-Modernization of Traditional Chinese Medicine,2015,17(6):1243-1248.DOI:10.11842/wst.2015.06.022.
[24]ZHOU Z D,CHAN C H,MA Q H,et al.The roles of amyloidprecursor protein(APP) in neurogenesis:implications to pathogenesis and therapy of Alzheimer disease[J].Cell Adh Migr,2011,5(4):280-292.
[25]许志强,周华东,蒋晓江.淀粉样β蛋白沉淀及其神经毒性与阿尔茨海默病[J].中国临床康复,2006,10(14):138-140.DOI:10.3321/j.issn:1673-8225.2006.14.058. XU Z Q,ZHOU H D,JIANG X J.Amyloid beta protein deposit and its neurotoxicity associated with Alzheimer disease[J].Chinese Journal of Clinical Rehabilitation,2006,10(14):138-140.DOI:10.3321/j.issn:1673-8225.2006.14.058.
[26]GERVAIS F G,XU D,ROBERTSON G S,et al.Involvement ofcaspases in proteolytic cleavage of Alzheimer′s amyloid-beta precursor proteinand amyloidogenic A beta peptide formation[J].Cell,1999,97(3):395-406.
[27]LEBLANC A,LIU H,GOODYER C,et al.Caspase-6 role inapoptosis of human neurons,amyloidogenesis,and Alzheimer′s disease[J].J Biol Chem,1999,274(33):23426-23436.
[28]BARNES N Y,LI L,YOSHIKAWA K,et al.Increased production of amyloid precursor protein provides a substrate for caspase-3 in dying motoneurons[J].J Neurosci,1998,18(15):5869-5880.
[29]杨晓颖,刘宁,黄岑汉,等.二苯乙烯苷对APP/PS1双转基因阿尔茨海默病小鼠脑内β淀粉样前体蛋白及分拣蛋白相关受体1 mRNA表达的影响[J].中国老年学杂志,2016,36(3):536-539.DOI:10.3969/j.issn.1005-9202.2016.03.009. YANG X Y,LIU N,HUANG C H,et al.Effect of TSG on protein expression of APP in APP/PS1 double transgenic AD mice brain tissues[J].Chinese Journal of Gerontology,2016,36(3):536-539.DOI:10.3969/j.issn.1005-9202.2016.03.009.
(本文编辑:毛亚敏)
Effect of TSG on the Expressions of Caspase-3 and APP in Brain Tissues of APP/PS1 Double Transgenic Mouse Model of Alzheimer′s Disease
LIUNing,LIAOYan-hua,LAIShu,HUANGJian,LIYun,HUANGZhong-shi*
YoujiangMedicalCollegeyforNationalities,Baise533000,China
*Correspondingauthor:HUANGZhong-shi,Professor;E-mail:hzs1004@163.com
Objective To observe the effect of tetrahydroxy stilbene glucoside(TSG) on the expressions of caspase-3 and amyloid precursor protein(APP) in brain tissues of APP/presenilin-1(PS1) double transgenic mouse model of Alzheimer′s disease(AD),and to investigate the possible mechanisms of therapeutic effect about TSG on AD.Methods In October 2014,50 SPF rank male APP/PS1 double transgenic mice were randomly divided into model group,huperzine A group and low-dose TSG group,mid-dose TSG group,high-dose TSG group with 10 mice in each based on the random number table.Another 10 SPF rank male C5B7L/6J mice were assigned to the normal control group.Huperzine A group,low-,mid- and high-dose TSG groups,model group and normal control group were respectively given by gavage with huperzine A(0.020 mg/kg),TSG(0.033,0.100,0.300 g/kg),0.9% sodium chloride solution(10.000 ml/kg),0.9% sodium chloride solution(10.000 ml/kg),once a day,for 60 days.At the end of intervention,all the mice were sacrificed and the brain tissues were taken out for experiments.Immunohistochemistry was used to determine the number of caspase-3 positive cells in each group mice′s cerebral cortex and hippocampus,and Western blotting was adopted to detect the expression level of APP in each group mice′s brain tissues.Results The number of caspase-3 positive cells in the cerebral cortex and hippocampus of the mice in the normal control group,huperzine A group and low-,mid- and high-dose TSG groups were less than those in the model group(P<0.05).The number of caspase-3 positive cells in the cerebral cortex and hippocampus of mice in huperzine A group was not significantly different from that of the mice in low-,mid- and high-dose TSG groups(P>0.05).The mice in the model group had higher expression level of APP in brain tissues than those in the normal control group,huperzine A group and low-,mid- and high-dose TSG groups(P<0.05).The expression level of APP in brain tissues of mice in huperzine A group did not differ substantially from that of the mice in low-,mid- and high-dose TSG groups(P>0.05).Conclusion TSG has obvious therapeutic effect on APP/PS1 double transgenic mice,the mechanism might be related to the inhibition of the expression levels of caspase-3 and APP so as to reduce the production of amyloid-β protein,and delay the apoptosis of nerve cells.
Alzheimer disease;Tetrahydroxy stilbene glucoside;Caspase 3;Amyloid precursor protein secretases
国家自然科学基金资助项目(81260495)
R 745.7
A
10.3969/j.issn.1007-9572.2017.15.014
2017-01-02;
2017-03-01)
*通信作者:黄忠仕,教授;E-mail:hzs1004@163.com
刘宁,廖艳花,赖术,等.二苯乙烯苷对淀粉样前体蛋白/早老蛋白-1双转基因小鼠脑组织半胱氨酸天冬氨酸蛋白酶3和淀粉样前体蛋白表达的影响[J].中国全科医学,2017,20(15):1854-1859.[www.chinagp.net]
LIU N,LIAO Y H,LAI S,et al.Effect of TSG on the expressions of caspase-3 and APP in brain tissues of APP/PS1 double transgenic mouse model of Alzheimer′s disease[J].Chinese General Practice,2017,20(15):1854-1859.
