抗CD47靶向治疗研究现状及应用前景*
2017-05-08白银鹏于虎王珂高鹏
白银鹏 于虎 王珂 高鹏
·国家基金研究进展综述·
抗CD47靶向治疗研究现状及应用前景*
白银鹏①于虎①王珂①高鹏②
在肿瘤发生发展过程中,肿瘤细胞逃逸了免疫系统的监视;免疫逃逸机制对于研发新的抗肿瘤治疗方案具有重要的意义。免疫治疗旨在激活患者自身的免疫系统,是肿瘤治疗相关研究的前沿,具有广阔的应用前景。CD47是一种广泛表达的细胞表面分子,肿瘤细胞可能借此“别吃我”信号,逃避了肿瘤免疫;肿瘤干细胞中CD47的表达水平甚至比肿瘤细胞更高。通过使用抗CD47抗体阻断CD47-SIRPα通路,从而介导细胞吞噬作用,能够靶向性杀伤肿瘤细胞。现在多项关于CD47靶向治疗的临床试验正在进行中,包括两种单克隆抗体和一种融合蛋白。然而由于使用动物模型不一,可能高估了这些药物的临床疗效预测。现将CD47抗肿瘤治疗相关研究的背景及潜在问题加以综述,并对该治疗的未来应用前景予以展望。
CD47 单克隆抗体 靶向治疗 动物模型 吞噬作用
免疫系统失调可以引起各种免疫相关疾病,如风湿病[1]、糖尿病[2-3]、肿瘤[4]。免疫治疗旨在激活患者自身的免疫系统,是肿瘤治疗相关研究的前沿,具有广阔的应用前景。在肿瘤发生发展过程中,肿瘤细胞逃逸了免疫系统的监视。理解免疫逃逸机制对于研发新的抗肿瘤治疗方案具有重要的意义。
在众多的免疫治疗方案中,CD47是近年来出现的一个热门靶点[5]。抗CD47治疗的临床前研究涵盖了非霍奇金淋巴瘤[6]、乳腺癌[7]、卵巢癌[7-8]、非小细胞肺癌[9]等多种肿瘤。现有3种针对CD47的药物已经进入I期临床试验,包括两种单克隆抗体(Hu5F9-G4,CC-90002)和一种融合蛋白(TTI-621,SIRPα-Fc融合蛋白),覆盖了多种血液肿瘤和实体瘤[10]。尽管药物研发投入巨大而且进展迅速,临床前研究已经广泛呈现较好的疗效,CD47靶向治疗的机理目前尚存争议,其临床疗效真正如何尚不得而知。对现有CD47相关研究加以综述,提出动物模型的SIRPα多态性和CD47的聚集效应两个因素会高估CD47-SIRPα的相互作用,并对今后的治疗发展予以展望。
1 CD47的生理病理功能
CD47又称整联蛋白相关蛋白(integrin-associat⁃ed protein,IAP),其配体为信号调节蛋白α链(signalregulatory protein alpha,SIRPα)。CD47是一种广泛表达于细胞膜表面的免疫球蛋白样蛋白质,是由特定的整联蛋白、G蛋白及胆固醇组成的超分子复合物。CD47的配体为信号调节蛋白α链(SIRPα),是一种跨膜蛋白,其胞外区含具有3个免疫球蛋白超家族样区域,其中N末端的区域介导与CD47的结合,主要表达于巨噬细胞、树突状细胞和神经细胞表面,通过细胞表面受体与配体的接触来调节细胞的迁移和吞噬活性、免疫自稳及神经元网络。CD47通过与SIRPα结合可产生抑制性信号从而降低巨噬细胞的活性,抑制非特异性免疫系统,如红细胞表面的CD47表达下降可以增强脾的红髓区巨噬细胞对红细胞的吞噬作用,这是溶血性贫血的一个重要发病因素[11-12];血小板表面的CD47表达也会显著影响巨噬细胞吞噬破坏血小板的作用,在特发性血小板减少性紫癜患者中CD47表达缺失或低下,因此血小板更容易受到巨噬细胞吞噬[13]。CD47高表达则可以抑制巨噬细胞的吞噬,如在正常造血干细胞迁移过程之前和过程中,均有CD47的短暂上调[14]。在白血病[15]、非霍奇金淋巴瘤[6]、膀胱癌和乳腺癌[7]等恶性疾病的研究中,发现肿瘤细胞存在CD47的升高,且CD47高表达提示临床预后不良。肿瘤干细胞[16]具有基因组不稳定性高[17-19]、易耐药[20-21]等特点,是肿瘤播散转移的根源[22],一些类型癌症中的肿瘤干细胞亦存在CD47的过表达。肿瘤细胞可能借助“别吃我”信号,逃避肿瘤免疫。通过使用抗CD47抗体阻断CD47-SIRPα通路,从而介导细胞吞噬作用,能够靶向性杀伤肿瘤细胞(表1)。
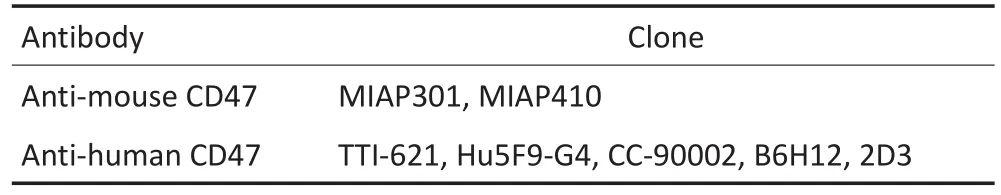
表1 常用CD47抗体种属特异性Table 1 Species specificity of the commonly used CD47 antibodies
2 CD47靶向治疗是否依赖于抗体Fc片段
现存争议的焦点在于抗CD47单克隆抗体的治疗作用是通过阻断CD47本身的功能,还是仅仅是抗体介导的非特异性的细胞毒性作用ADCC。在Fc片段依赖的作用当中,IgG的Fc片段能够激发下游巨噬细胞、NK细胞和粒细胞的反应。这个效应对于药品研发意义重大,因其不但影响着疗效,而且同时决定了对CD47阳性的正常细胞的毒性作用。如果ADCC发挥主导作用,要缓解药物不良反应则必须牺牲药物有效性;如果CD47本身内在功能起主导作用,则有可能通过优化F(ab′)2片段或者使用介导ADCC效应较弱的IgG4等途径,减少抗CD47治疗的不良反应。
目前这两个机制均有研究报道支持。抗CD47单抗Fc片段可以激活中性粒细胞和巨噬细胞的ADCC作用[23]。此外,很多研究证实存在着Fc段非依赖性作用。敲低CD47表达水平[24]或者使用抗CD47抗体的F(ab′)2片段可以激发巨噬细胞的吞噬作用。另一系列研究证实抗CD47单抗与其他单抗(如利妥昔单抗和抗CD56单克隆抗体)具有协同作用,从而说明了具有Fc段非依赖的效应。Fc受体缺陷的巨噬细胞与抗CD47单克隆抗体共孵育以后依然具有吞噬效应[6]。CD47-Hu5F9结合的结构域与CD47-SIRPα的结构域类似[9]。这是首次证实抗CD47单克隆抗体Hu5F9通过阻断了CD47-SIRPα通路而起作用。因此本文认为CD47靶向性治疗同时具有Fc片段依赖的ADCC等效应和Fc片段非依赖的CD47内源性作用,二者共同实现了抗肿瘤效应。
3 当前抗CD47抗肿瘤治疗研究中可能高估预期疗效的因素
3.1 动物模型的SIRPα多态性
理想的研究CD47靶向性抗肿瘤效应的动物模型应具有以下特点:1)能够准确模拟人CD47-人SIRPα的相互作用,具有与在患者体内相类似的亲和力。2)能够模拟红细胞、血小板等CD47表达阳性的其他细胞。能够反映该治疗对于这些作用引起的不良反应。3)具有健全的天然免疫和特异性免疫系统。
现有用于研究CD47治疗的小鼠模型均存在某方面的不足,总结如下:既往研究很多使用NOD背景小鼠作为动物模型,然而对于选择这一遗传背景小鼠的原因以及潜在的问题并没有得到重视(表2)。肿瘤相关研究广泛采用NSG小鼠进行移植瘤研究,但是这个选择是否适合抗CD47相关研究有待商榷。NSG小鼠携带SIRPαNOD位点,人CD47与SIRPαNOD之间的亲和力是与人SIRPα之间亲和力的10倍[25]。因此,NOD遗传背景(包括NSG、NOG、NRG、NOD-SCID等)会更加凸显CD47-SIRPα通路对巨噬细胞吞噬的作用,进而Fc段非依赖的相关效应会被增强。在这种情况下,相对应到临床应用领域,由于人SIRPα不具有如此强的与CD47的结合能力[25],因此抗CD47治疗在患者中所能够达到的治疗效果,不能够与从NOD遗传背景小鼠移植瘤试验中实现的效果相比较。此外,因为缺少了对Fc段起作用的健全的免疫网络,包括特异性免疫、补体系统和自然杀伤细胞。使用免疫缺陷鼠研究抗CD47效应可能低估了ADCC作用和Fc依赖的细胞毒作用。以下两个方法可解决NSG动物模型存在的问题:1)使用小鼠肿瘤细胞系在小鼠中建立移植瘤模型。该动物模型的优点在于[1]具有健全的特异性免疫和天然免疫系统[2],使之成为理想的体内实验模型,具有其他表达CD47的正常体细胞包括红细胞[3]不需要考虑跨种属的CD47-SIRPα亲和力的问题[26]。与使用NOD背景小鼠的相关研究相比,使用非NOD遗传背景小鼠模型移植小鼠肿瘤细胞系的移植瘤试验,阻断CD47-SIRPα通路显示出的疗效往往较弱。比如在C57BL6模型中多次给予抗CD47单克隆抗体MI⁃AP301,仅仅获得了轻微的一过性肿瘤抑制效果[27]。在FVB模型中给予MIAP301抗体未能呈现显著疗效[7]。抗CD47单克隆抗体MIAP410在FVB模型中抗不同种类肿瘤的效果不一,比如抗小鼠结肠癌(CT26)和黑色素瘤(B16)的效果有限[28],但是在乳腺癌中能通过IgG1介导的活跃的天然免疫和获得性免疫抑制移植瘤生长[7]。使用FVB模型成功地实现了前述3个目的。使用免疫健全小鼠进行研究,使用的抗体需要具有合适的Fc段。有研究报道使用抗CD47单抗(克隆MIAP301,大鼠IgG2a)[27],由于不具备合适的Fc段,免疫应答强度可能被低估。为了排除CD47-SIRPα亲和力差异的影响,可以考虑使用改进的免疫缺陷鼠模型,如人SIRPα转基因Rag2-/-gc-/-小鼠[29]。使用人SIRPα转基因小鼠能够模拟天然免疫中CD47-SIRPα的亲和力以获得更准确的研究结果。另一个小鼠模型也能够达到同样的效果,MIS⁃TRG小鼠携带人TPO、IL-3和GM-CSF,利于巨噬细胞人源化[30],但是仍需进一步试验证实。这类人源化动物已经应用在PD-1/PD-L1抗体开发中[31]。而且在进行该研究时应使用种属亚型匹配的IgG抗体。2)除体内实验,可选择种属匹配的体外吞噬实验。很多现有研究尝试在体外试验中使用抗CD47单抗的F(ab′)2片段。在这样的试验体系中,可以使用人源性巨噬细胞和肿瘤细胞,因此CD47-SIRPα的亲和力应该与体内临床试验相当。值得注意的是,虽然F(ab′)2的抗肿瘤效应较完整的抗体低,但是对于介导吞噬作用依然起到了显著的促进作用[6]。尽管一项研究报道中性粒细胞对于F(ab′)2没有反应[23],不能排除其他天然免疫细胞对F(ab′)2起作用的可能性。
3.2 CD47集聚影响CD47-SIRPα的相互作用
除了SIRPα亲和力的不同,CD47集聚也可以影响CD47-SIRPα的相互作用,使CD47-SIRPα的亲和力增强,从而有可能抑制了巨噬细胞的吞噬作用。例如凋亡细胞被天然免疫细胞清除,并非由于CD47的表达下降,而是通过减少CD47的集聚[32]。

表2 常用免疫缺陷小鼠名称和基因型Table 2 Names and genotypes of the commonly used immune-compromised mice
CD47单克隆抗体2D3是一种非封闭性抗体,由于2D3识别的抗原表位与封闭性抗体B6H12识别SIRPα的表位接近[33],因此被多项研究广泛使用作为对照抗体[34]。然而,2D3抗体增加了CD47的聚集效应,增强了CD47和SIRPα的亲和力[35],从而过度突出了CD47-SIRPα对巨噬细胞吞噬的抑制作用。因此,使用2D3抗体作为阴性对照可能会高估了抗CD47抗体的疗效。然而现有报道使用2D3对照抗体,未观察到对于巨噬细胞吞噬作用有额外的抑制作用[6,15,24,34]。这可能由于现有使用2D3对照抗体的研究均采用了NSG遗传背景小鼠。在该背景下,CD47-SIRPα的亲和力过高,因此2D3对于CD47聚集作用所产生的影响可能被淹没而不能反映出来。
4 CD47和钙调蛋白
抗CD47单克隆抗体显示出了显著的抗肿瘤作用,机制包括Fc介导的ADCC等作用和Fc非依赖的CD47自身的作用。然而抗SIRPα抗体的效果却存在很大的争议,一些报道显示抗SIRPα不具有抗肿瘤效果[23],另一些研究支持其抗肿瘤效果[36]。而且,在非NOD遗传背景小鼠中研究抗CD47的治疗效果往往不能得到显著而统一的抗肿瘤效应。本文认为这与大部分研究选取NOD遗传背景小鼠,高估了CD47-SIRPα作用效果有关。抗CD47的抗肿瘤效应可能依赖于CD47的同时,并不依赖于SIRPα。曾经有研究显示,钙调蛋白是调控巨噬细胞吞噬肿瘤细胞的重要调控分子[37],然而钙调蛋白和CD47在平衡巨噬细胞吞噬作用中的机制尚存在争议。有研究报道,肿瘤细胞表面的钙调蛋白对于促进巨噬细胞吞噬肿瘤细胞至关重要,使用封闭肽分子阻断肿瘤细胞表面的钙调蛋白能够使抗CD47单克隆抗体的促吞噬作用消失[37]。然而另一些研究表明巨噬细胞的钙调蛋白表达对于该过程起着调控作用[38]。在T细胞迁移的相关研究中已经证实CD47和钙调蛋白通过TSP1分子影响着T细胞的迁移运动,说明这三个分子有直接的相互作用[39]。因此,虽然对于钙调蛋白的作用机制目前没有达成共识,但是可以肯定的是钙调蛋白和CD47在平衡巨噬细胞和肿瘤细胞的吞噬过程中起着重要作用。
5 CD47靶向性治疗的临床结果及其应用前景
Hu5F9-G4和TTI-621在已公布的Ⅰ期临床结果中显示了不同的安全性。使用Hu5F9-G4的16例患者全部出现了不同程度的贫血,部分发生了高胆红素血症,然而并没有报道低血小板的发生[40];与之相反给予0.3 mg/kg TTI-621的试验组,5例患者中4例出现G3和G4级别的血小板低下症状,但是全部11例患者血红蛋白均稳定,并无报道贫血的发生[41]。这个重要区别的原因可能是积极利用了CD47的聚集效应,减少了红细胞的不良反应[42]。融合蛋白TTI-621只能够识别聚集的CD47。有报道显示血影蛋白骨架限制了人红细胞表面的CD47聚集。因此,TTI-621利用了红细胞CD47难以聚集这一特点,实现对人红细胞的容受,避免了可能导致的贫血不良反应。如前所述,抗CD47治疗的临床前模型中存在高估疗效的因素,且疗效在不同肿瘤间存在巨大差异。届时真正的临床效果可能难以媲美动物实验的结果,且需要根据CD47的表达和聚集情况,慎重选择适用患者。然而卵巢癌由于其特殊的解剖结构和病理生理特点成为了CD47抗体治疗的理想应用对象。
卵巢癌是妇科肿瘤的头号杀手,虽然不断改进治疗方法,5年生存率依然徘徊于30%左右。卵巢癌的治疗以瘤体减灭术联合铂类为主的化疗。造成治疗失败的主要原因在于卵巢癌易于腹腔内转移和化疗耐药。可以预见的是,抗CD47抗体治疗在卵巢癌的治疗中存在着极大的优势。可以通过腹腔内给药等方式,降低抗体靶向治疗可能带来的贫血和血小板减低等不良反应。提高局部抗体药物浓度,实现抗体治疗效果的最大化。CD47临床前研究在卵巢癌的治疗方面已经展现了可喜的成果。可以预见手术联合化疗辅助单克隆抗体治疗很有可能成为未来卵巢癌治疗的标准方案。
抗CD47单克隆抗体在多种肿瘤中观察到了抗肿瘤干细胞的效果。且在生理状态下,对于保护干细胞逃逸天然免疫系统不被吞噬起着重要作用。干细胞在除肿瘤之外很多疾病的发生发展中也发挥重要作用[43],如最常见的造成不孕不育的子宫内膜异位症[44-45]。有研究表明,骨髓来源干细胞可以在体内和体外分化为子宫内膜上皮细胞[46]。随着干细胞相关研究进展,以及多能诱导干细胞等相关前沿技术的不断提高,抗CD47靶向性治疗在抗肿瘤及其他干细胞相关疾病治疗方面具有巨大的应用前景[47]。
[1]Klareskog L,Rönnelid J,Lundberg K,et al.Immunity to citrullinated proteins in rheumatoid arthritis[J].Annu Rev Immunol,2008,26:651-675.
[2]Gao P,Jiao Y,Xiong Q,et al.Genetic and molecular basis of QTL of diabetes in mouse:genes and polymorphisms[J].Current genomics, 2008,9(5):324-337.
[3]Gu W,Gerling I,Jiao Y,et al.Candidate genes within known QTL of type 1 diabetes frommouse models[J].BMC Bioinformatics,2008,9(S7):P2.
[4]Chen DS,Mellman I.Oncology meets immunology:the cancer-immunity cycle[J].Immunity,2013,39(1):1-10.
[5]Huang,YT.Hao Q.CD47-A novel target in ovarian cancer treatment[J]? Journal of Jiangsu University(Medicine Edition),2011,21(3):273-276. [黄宇婷,郝 权.CD47_卵巢癌治疗的新靶点[J]?江苏大学学报(医学版),2011,21(3):273-276.]
[6]Chao MP,Alizadeh AA,Tang C,et al.Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J].Cell,2010,142(5):699-713.
[7]Willingham SB,Volkmer JP,Gentles AJ,et al.The CD47-signal regulatory protein alpha(SIRPα)interaction is a therapeutic target for human solid tumors[J].Proc Nat Acad Sci U S A,2012,109(17):6662-6667.
[8]Ju BH,Huang YT,Tian J,et al.In vitro application of anti-CD47 monoclonal antibody for targeted therapy of ovarian cancer[J].Chinese Journal of Clinical Oncology,2013,40(8):440-443.[鞠宝辉,黄宇婷,田 菁,等.抗CD47单克隆抗体对卵巢癌细胞靶向治疗的体外研究[J].中国肿瘤临床,2013,40(8):440-443.]
[9]Weiskopf K,Jahchan NS,Schnorr PJ,et al.CD47-blocking immunotherapies stimulate macrophage-mediated destruction of small-cell lung cancer[J].J Clin Invest,2016,126(7):2610-2620.
[10]Liu X,Kwon H,Li Z,et al.Is CD47 an innate immune checkpoint for tumor evasion[J].J Hematol Oncol,2017,10(1):12.
[11]Oldenborg PA,Gresham HD,Chen Y,et al.Lethal autoimmune hemolytic anemia in CD47-deficient nonobese diabetic(NOD)mice[J]. Blood,2002,99(10):3500-3504.
[12]Oldenborg PA,Zheleznyak A,Fang YF,et al.Role of CD47 as a marker of self on red blood cells[J].Science,2000,288(5473):2051-2054.
[13]Olsson M,Bruhns P,Frazier WA,et al.Platelet homeostasis is regulated by platelet expression of CD47 under normal conditions and in passive immune thrombocytopenia[J].Blood,2005,105(9):3577-3582.
[14]Jaiswal S,Jamieson CH,Pang WW,et al.CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J].Cell,2009,138(2):271-285.
[15]Majeti R,Chao MP,Alizadeh AA,et al.CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells[J].Cell,2009,138(2):286-299.
[16]Huang Y,Ju B,Tian J,et al.Ovarian cancer stem cell-specific gene expression profiling and targeted drug prescreening[J].Oncol Rep,2014, 31(3):1235-1248.
[17]Hu L,Ru K,Zhang L,et al.Fluorescence in situ hybridization(FISH):an increasingly demanded tool for biomarker research and personalized medicine[J].Biomarker Research,2014,2(3).doi:10.1186/2050-7771-2-3.
[18]Huang YT,Hu LP,Tian J,et al.c-myc amplification and Rb1 deletion in epithelial ovarian cancer[J].Chinese Journal of Clinical Oncology,2011; 39(20):1547-1551.[黄宇婷,胡林萍,田 菁,等.上皮性卵巢癌中c-myc基因扩增和Rb1基因缺失及临床意义[J].中国肿瘤临床,2011,39(20): 1547-1551.]
[19]Huang YT,Hu LP,Ju BH,et al.Establishing the quantitative multi-gene fluorescence in situ hybridization technique in ovarian cancer research[J].Progress in Obstetrics and Gynecology,2013,22(2):86-89.[黄宇婷,胡林萍,鞠宝辉,等.定量多基因荧光原位杂交技术在卵巢癌研究中的初步探索[J].现代妇产科进展,2013,22(2):86-89.]
[20]Ju BH,Tian J,Huang YT,et al.Analysis of shared characteristics of ovarian cancer stem cell by gene expression profiling[J].Shandong Medicine,2013,53(24):1-5.[鞠宝辉,田菁,黄宇婷,等.卵巢癌干细胞基因表达谱共有特征分析[J].山东医药,2013,53(24):1-5.]
[21]Huang YT,Zhao L,Fu Z,et al.Therapeutic effects of tyroservatide on metastasis of lung cancer and its mechanism affecting integrin-focal adhesion kinase signal transduction[J].Drug Des Devel Ther,2016,10: 649-663.
[22]Huang YT ZM,Xu HX,et al.RASAL2 down-regulation in ovarian cancer promotes epithelial-mesenchymal transition and metastasis[J].Oncotarget,2014,5(16):6734-6745.
[23]Zhao XW,van Beek EM,Schornagel K,et al.CD47-signal regulatory protein-alpha(SIRPαlpha)interactions form a barrier for antibodymediated tumor cell destruction[J].Proc Nat Acad Sci U S A,2011,108 (45):18342-18347.
[24]Chao MP,Tang C,Pachynski RK,et al.Extranodal dissemination of non-Hodgkin lymphoma requires CD47 and is inhibited by anti-CD47 antibody therapy[J].Blood,2011,118(18):4890-4901.
[25]Kwong LS,Brown MH,Barclay AN,et al.Signal‐regulatory protein α from the NOD mouse binds human CD47 with an exceptionally high affinity-implications for engraftment of human cells[J].Immunology, 2014,143(1):61-67.
[26]Sockolosky JT,Dougan M,IngramJR,et al.Durable antitumor responses to CD47 blockade require adaptive immune stimulation[J].Proc Nat Acad Sci U S A,2016,113(19):E2646-E2654.
[27]Liu X,Pu Y,Cron K,et al.CD47 blockade triggers T cell-mediated destruction of immunogenic tumors[J].Nat Med,2015,21(10):1209-1215.
[28]Willingham SB,Volkmer JP,Weiskopf K,et al.Reply to Soto-Pantoja et al.and Zhao et al.Targeting CD47 on human solid tumors[J].Proc Nat Acad Sci U S A,2012,109(42):E2844-E2845.
[29]Strowig T,Rongvaux A,Rathinam C,et al.Transgenic expression of human signal regulatory protein alpha in Rag2−/−γc−/−mice improves engraftment of human hematopoietic cells in humanized mice[J].Proc Nat Acad Sci U S A,2011,108(32):13218-13223.
[30]Rongvaux A,Willinger T,Martinek J,et al.Development and function of human innate immune cells in a humanized mouse model[J].Nat Biotechnol,2014,32(4):364-372.
[31]Stecklum M,Wulf-Goldenberg A,Brzezicha B,et al.Abstract B126: Correlation of tumor growth inhibition by check point inhibitors with PD-L1 expression in preclinical patient derived xenograft(PDX)models [J].Cancer Immunology Research,2016,4(11 Suppl):B126-B.
[32]Lv Z,Bian Z,Shi L,et al.Loss of Cell Surface CD47 Clustering Formation and Binding Avidity to SIRPα Facilitate Apoptotic Cell Clearance by Macrophages[J].J Immunol,2015,195(2):661-671.
[33]Subramanian S,Boder ET,Discher DE.Phylogenetic Divergence of CD47 Interactions with Human Signal Regulatory Protein α Reveals Locus of Species Specificity IMPLICATIONS FOR THE BINDING SITE[J].J Bio Chem,2007,282(3):1805-1818.
[34]Weiskopf K,Ring AM,Ho CCM,et al.Engineered SIRPα variants as immunotherapeutic adjuvants to anticancer antibodies[J].Science, 2013,341(6141):88-91.
[35]Subramanian S,Parthasarathy R,Sen S,et al.Species-and cell typespecific interactions between CD47 and human SIRPα[J].Blood,2006, 107(6):2548-2556.
[36]Weiskopf K,Ring AM,Guo N,et al.Direct SIRPα Blockade Augments Macrophage Responses to Therapeutic Anticancer Antibodies[J]. Blood,2014,124(21):2729.
[37]Chao MP,Jaiswal S,Weissman-Tsukamoto R,et al.Calreticulin is the dominant pro-phagocytic signal on multiple human cancers and is counterbalanced by CD47[J].Sci Transl Med,2010,2(63):63ra94.
[38]Feng M,Chen JY,Weissman-Tsukamoto R,et al.Macrophages eat cancer cells using their own calreticulin as a guide:roles of TLRand Btk [J].Proc Nat Acad Sci U S A,2015,112(7):2145-2150.
[39]Li SS,Forslöw A,Sundqvist KG.Autocrine regulation of T cell motility by calreticulin-thrombospondin-1 interaction[J].J Immunol,2005,174 (2):654-661.
[40]Sikic BI,Narayanan S,Colevas AD,et al.A first-in-human,first-in-class phase I trial of the anti-CD47 antibody Hu5F9-G4 in patients with advanced cancers[J].J Clin Oncol,2016,34(suppl):abstr3019..
[41]Ansell S,Chen RW,Flinn IW,et al.A Phase 1 Study of TTI-621,a Novel Immune Checkpoint Inhibitor Targeting CD47,in Patients with Relapsed or Refractory Hematologic Malignancies[J].Blood,2016,128 (22):1812.
[42]Petrova PS,Viller NN,Wong M,et al.TTI-621(SIRPαFc):A CD47-Blocking Innate Immune Checkpoint Inhibitor with Broad Anti-Tumor Activity and Minimal Erythrocyte Binding[M].Clinical Cancer Research, 2017.
[43]Huang YT,Cheng MJ,Xu CJ,Stem cell theory of endometriosis etiology, Journal of Jiangsu University(Medicine Edition),2008,18(5):451-454. [黄宇婷,程明军,徐丛剑.子宫内膜异位症病因的干细胞学说[J].江苏大学学报(医学版),2008,18(5):451-454.
[44]Huang YT,Zhang WB,Cheng MJ,et al.Stem cell and endometriosis[J]. International Journal of Gynecology&Obstetrics,2009,36(4):299-302. [黄宇婷,张雯碧,程明军,等.干细胞与子宫内膜异位症[J].国际妇产科学杂志,2009,36(4):299-302.]
[45]XuCJ,ChengMJ,HuangYT,et al.Advances inetiology of endometriosis, Chinese Journal of Practical Gynecology and Obstetrics,2009,25(9): 712-714.[徐丛剑,程明军,黄宇婷,等,子宫内膜异位症病因学研究进展[J].中国实用妇科与产科杂志,2009,25(9):712-714.]
[46]Zhang WB,Cheng MJ,Huang YT,et al.A study in vitro on differentiation of bone marrow mesenchymal stem cells into endometrial epithelial cells in mice[J].Eur J Obstel Gynecol Reprod Biol,2012,160(2):185-190.
[47]Huang YT,Ma Y,Gao P,et al.Targeting CD47:the achievements and concerns of current studies on cancer immunotherapy[J].J Thorac Dis, 2017,9(2):E168-E174.
(2017-02-01收稿)
(2017-03-30修回)
(编辑:郑莉 校对:杨红欣)
Achievements and concerns of the CD47 targeted anti-cancer therapy
Yinpeng BAI1,Hu YU1,Ke WANG1,Peng GAO2
Peng GAO;E-mail:gopher1_6@163.com
1Department of Ultrasound Diagnosis and Treatment,Tianjin Medical University Cancer Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer;Tianjin 300060,China;2University of the District of Columbia,Washington D.C.20008,USA
This work was supported by National Natural Science Foundation of China(No.81502247)
In cancer development and progression,tumor cells escape from the surveillance of our immune system.Understanding the mechanism behind this phenomenon is crucial in developing new anti-cancer therapies.Immunotherapy,which aims to trigger the immune reaction of the patient's own immune system,stands in the spotlight of cancer research and has promising applications.CD47 is ubiquitously expressed in many kinds of cells serving as a"do-not-eat-me"signal.Cancer cells may take advantage of CD47 overexpression to escape from immunosurveillance.Cancer stem cells have high expression levels of CD47.Blocking the interaction between CD47 and SIRPα can induce targeted phagocytosis of cancer cells.Several clinical trials on three different kinds of CD47-targeted drugs are ongoing,but the animal models used may have a potential issue in estimating clinical efficacy.The present study aims to review the development and current status of anti-CD47 anti-cancer therapy,raise the concerns on the animal models,and discuss some perspectives on future clinical applications.
CD47,monoclonal antibody,targeted therapy,animal model,phagocytosis

10.3969/j.issn.1000-8179.2017.07.329
①天津医科大学肿瘤医院超声诊疗科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060);②哥伦比亚特区大学
*本文课题受国家自然科学青年基金资助项目(编号:81502247)资助
高鹏 gopher1_6@163.com
白银鹏 专业方向为肿瘤的超声诊断与治疗。
E-mail:baiyinpeng1985@126.com
