miR-200a抑制YAP1基因表达对肺癌细胞增殖的影响
2017-05-08许璐方玉松王丹云王宗明许鹏
许璐 方玉松 王丹云 王宗明 许鹏
·基础研究·
miR-200a抑制YAP1基因表达对肺癌细胞增殖的影响
许璐①方玉松②王丹云②王宗明②许鹏②
目的:研究微小RNA-200a(miR-200a)对肺癌细胞增殖的影响,并探讨其分子机制。方法:采用Real-time PCR检测15例非小细胞肺癌组织和对应癌旁组织、人肺癌细胞株(A549、NCI-H520、SK-MES-1)及人正常肺支气管上皮细胞株16HBE中miR-200a的表达水平。用CCK-8法检测miR-200a对A549肺癌细胞增殖活性的影响。通过生物信息学方法预测miR-200a可能的靶基因,双荧光素酶报告基因实验结合Real-time PCR和Western blot验证miR-200a对靶基因YAP1的调控作用。CCK-8法检测下调靶基因YAP1对A549肺癌细胞株增殖活性的影响。结果:miR-200a在非小细胞肺癌组织和肺癌细胞系中表达明显降低(P<0.01)。上调miR-200a表达后明显抑制A549肺癌细胞的增殖活力(P<0.01)。双荧光素酶报告基因显示miR-200a可以直接作用于靶基因YAP1的3′-UTR区域抑制荧光素酶活性(P<0.01),Real-time PCR和Western blot检测显示上调miR-200a的表达能够明显下调A549肺癌细胞YAP1 mRNA和蛋白的表达水平(P<0.01)。CCK-8法显示下调YAP1的表达能够明显抑制A549肺癌细胞的增殖活性(P<0.01)。结论:miR-200a通过靶向作用于YAP1基因来抑制肺癌细胞的增殖,从而在肺癌中发挥抑癌基因的功能。
miR-200a 肺癌 YAP1 增殖
肺癌已成为人类病死率最高的恶性肿瘤[1-2],严重威胁着人类的生命及健康。近年来,随着生物技术的发展和研究的深入,针对驱动基因的分子靶向治疗作为新兴的肿瘤治疗方式已经成为研究热点,为肺癌的治疗提供了一个有效的手段[3]。微小RNA(microRNA,miRNAs)是一类长度在17~25个核苷酸的内源性、高度保守的单链非编码小RNA,可以通过与下游靶基因mRNA的3′-非编码区(3′-UTR)结合,降解mRNA或在转录后水平抑制其翻译,在肿瘤的发生发展中起着“癌基因”或者“抑癌基因”的作用[4]。miR-200a属于miR-200家族成员之一,其定位于人1号染色体(1p36.33)[5],目前研究发现miR-200a表达异常与恶性肿瘤的发生发展有着一定的关系,miR-200a在大部分恶性肿瘤如胰腺癌[6]、乳腺癌[7]、肾细胞癌[8]、肝癌[9]等恶性肿瘤中表达下调,起着类似“抑癌基因”的作用,但也有研究发现其在鼻咽癌[10]、卵巢癌[11]等恶性肿瘤中表达上调,起着类似“癌基因”的作用。目前有关miR-200a在肺癌中表达情况的研究较少,并且作用机制尚不明确。本研究旨在研究miR-200a在非小细胞肺癌组织及肺癌细胞系细胞中的表达情况以及对肺癌细胞增殖能力的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1 组织标本 收集2015年8月至2015年10月在山东大学附属济南市中心医院手术切除的15例非小细胞肺癌组织和对应的距离肿瘤边缘>5 cm的癌旁组织;组织离体30 min内置入液氮中,-80℃冰箱保存备用。15例肺癌患者中男性10例,女性5例,年龄(54.8±7.9)岁。术后病理切片均经证实。术后病理按WHO肺癌分类标准,其中腺癌8例,鳞癌6例,腺鳞癌1例。所有患者均签署知情同意书,该研究获得医院医学伦理委员会批准。
1.1.2 细胞与试剂 人肺腺癌细胞系A549、人肺鳞癌细胞系NCI-H520、SK-MES-1及人正常肺支气管上皮细胞株16HBE均购自美国ATCC公司。Trizol试剂和LipofectamineTM2000均购自美国Invitrogen公司。RNA逆转录试剂盒及Real-time PCR试剂盒、双荧光素酶检测试剂盒及pmirGLO载体均购自美国Promega公司。miR-200a、YAP1及内参U6、GAPDH引物由上海吉玛公司设计合成。YAP1 siRNA质粒(siRNA-YAP1)和阴性对照siRNA-NC,miR-200a mimics和阴性对照mimics-NC均购自美国Santa Cruz公司。CCK-8试剂盒购自上海东仁化学科技公司。YPA1抗体以及β-actin抗体均购自美国Abcam公司。1.2 方法
1.2.1 细胞培养及转染 人肺癌细胞株A549、NCIH520、SK-MES-1及人正常肺支气管上皮细胞株16HBE均置于含10%胎牛血清的RPMI 1640培养基中,37℃、5%CO2培养箱中培养,每2~3d按1:3传代。取对数生长期的A549肺癌细胞接种于细胞培养板中,待细胞贴壁达70%~80%时进行转染操作,转染操作严格按LipofectamineTM2000试剂盒说明书进行,分别转染miR-200a mimics、mimics-NC以及siR⁃NA-YAP1、siRNA-NC。
1.2.2 Real-time PCR检测miR-200a及YAP1 mRNA的表达 利用Trizol试剂提取组织或细胞总RNA,测RNA浓度,以1 μg总RNA按逆转录试剂盒操作说明书进行反转录得到cDNA。配置Real-PCR体系,PCR反应条件为:95℃3 min、95℃10 s、59℃30 s,共40个循环。实验重复3次,以U6/GAPDH作为内参,miR-200a和YAP1 mRNA的相对表达量以2-ΔΔCt法计算,[ΔΔCt=(待测组目的基因平均Ct值-待测组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)]。
1.2.3 Western blot检测YAP1蛋白的表达 收集转染后48h的各组细胞,PBS洗涤细胞3遍,用蛋白裂解液提取细胞总蛋白,用BCA法测定蛋白浓度。分别取40 μg蛋白上样,SDS-PAGE上电泳30min,蛋白质半干转移至PVDF膜,加入5%脱脂奶粉的封闭液,室温封闭2 h后,加入适当浓度YPA1、β-actin一抗,4℃过夜,次日洗膜后,加入二抗室温孵育2 h,洗膜后,加入ECL发光剂,凝胶成像系统显影,以YPA1蛋白条带灰度值与β-actin蛋白条带灰度值的比值表示YPA1蛋白的相对表达量。
1.2.4 CCK-8法检测细胞的增殖活力 细胞转染24 h后细胞接种于96孔板,常规培养,分别于转染后24、48、72、96 h 4个时点参照CCK-8试剂盒操作说明书操作向每孔加入10 μL CCK-8溶液,置于37℃、50 ml/L CO2的培养箱中避光孵育2 h,用酶标仪测定450 nm处的吸光度,实验重复3次。
1.2.5 miR-200a靶基因的预测及双荧光素酶报告基因验证 应用miRNA在线靶基因预测软件miRanda(http://www.microrna.org),并结合基因的功能分析,最终筛选出YAP1极有可能为miR-200a的直接靶基因。双荧光素酶报告基因验证miR-200a的靶基因。委托上海吉玛公司构建带有野生型结合位点的荧光报告载体pmirGLO-YAP1-wtUTR和带有突变型结合位点的荧光报告载体pmirGLO-YAP1-mtUTR。转染前1天,将肺癌细胞A549接种于24孔板中,转染当天,将经过测序验证正确的pmirGLO-YAP1-wtUTR或pmirGLO-YAP1-mtUTR荧光报告载体与miR-200a mimics或mimics-NC共转染入肺癌A549细胞。细胞共分为4组:miR-200a mimics+pmirGLO-YAP1-wtUTR组、miR-200a mimics+pmirGLO-YAP1-mtUTR组、mimics-NC+pmirGLO-YAP1-wtUTR组、mimics-NC+pmirGLO-YAP1-mtUTR组。转染后48h收集细胞,按照双荧光素酶活性检测试剂盒说明书操作检测萤火虫荧光素酶及海肾荧光素酶活性。
荧光酶活性比值=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.3 统计学分析
2 结果
2.1 miR-200a在非小细胞肺癌组织和细胞中的表达Real-time PCR结果显示miR-200a在非小细胞肺癌组织中的表达水平明显低于癌旁组织,差异具有统计学意义(P<0.05,图1A)。并且miR-200a在肺癌细胞株A549、NCI-H520、SK-MES-1中的表达水平明显低于正常肺支气管上皮细胞株16HBE,差异具有统计学意义(P<0.05,图1B),其中miR-200a在肺癌细胞株A549中相对表达量最低,因此选择肺癌细胞株A549作为后续研究对象。
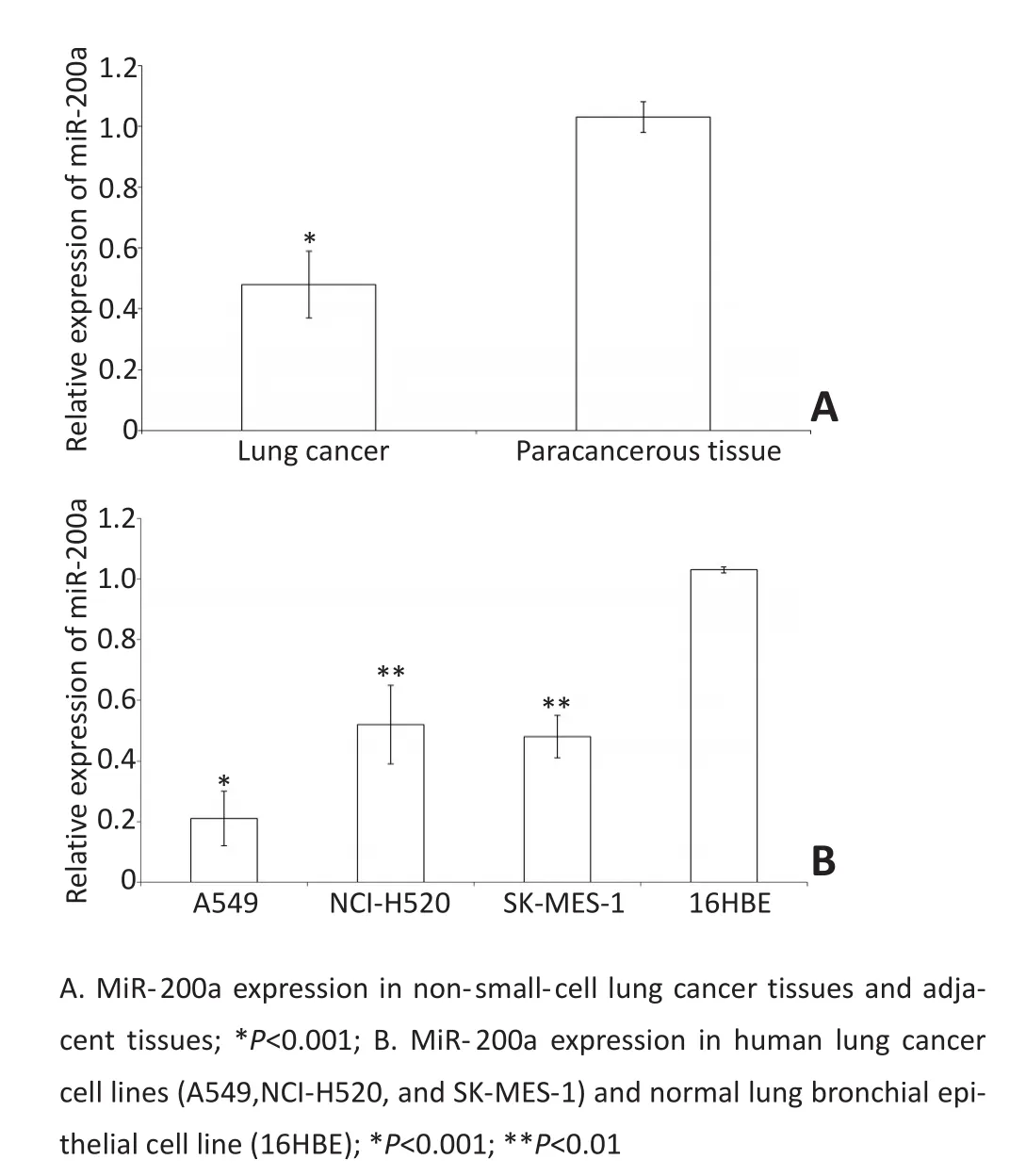
图1 miR-200a在非小细胞肺癌组织和肺癌细胞株中的表达水平明显降低Figure 1 The expression of miR-200a in non-small cell lung cancer tissues and lung cancer cell lines was significantly decreased
2.2 上调miR-200a表达抑制A549肺癌细胞的增殖活力
A549肺癌细胞转染miR-200a mimics或mimics-NC后,Real-time PCR显示转染后miR-200a mimics组细胞miR-200a表达水平明显高于mimic-NC组(P<0.01,图2A),证明转染效率较高。CCK-8法检测细胞增殖活力显示miR-200a mimics组A549肺癌细胞48、72、96 h时吸光度明显低于mimics-NC组细胞,提示上调miR-200a表达能够明显抑制A549肺癌细胞的增殖活力(P<0.01,图2B)。
2.3 YAP1是miR-200a的直接调控靶基因
应用靶基因预测数据库miRanda,并结合基因的功能分析,预测miR-200a的可能靶基因为YAP1,发现YAP1的3′UTR区存在与miR-200a的种子序列理论上互补的结合位点(图3A)。为进一步验证YAP1是否为miR-200a的直接调控靶基因,在A549肺癌细胞共转染miR-200a mimics、mimics-NC和野生型pmirGLO-YAP1-wtUTR或突变型pmirGLO-YAP1-mtUTR后,双荧光素酶报告基因显示miR-200a mim⁃ics+pmirGLO-YAP1-wtUTR组细胞荧光素酶活性比mimics-NC+pmirGLO-YAP1-wtUTR组细胞荧光素酶活性明显减低(P<0.01);而miR-200a mimics+pmir⁃GLO-YAP1-mtUTR组细胞荧光素酶活性与mimics-NC+pmirGLO-YAP1-mtUTR组细胞荧光素酶活性相近,差异均无统计学意义(P>0.05,图3B)。证实miR-200a能够特异性结合YAP1的3′UTR区,使荧光蛋白表达水平明显降低,而YAP1的3′UTR区突变后则无此作用,说明YAP1是miR-200a的直接调控靶基因。
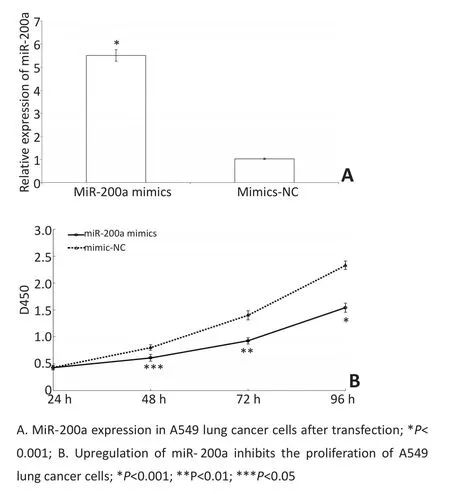
图2 转染后A549细胞miR-200a表达水平增高,增殖活力下降Figure 2 The expression level of miR-200a increased and the proliferation activity decreased after transfection in A549 cells
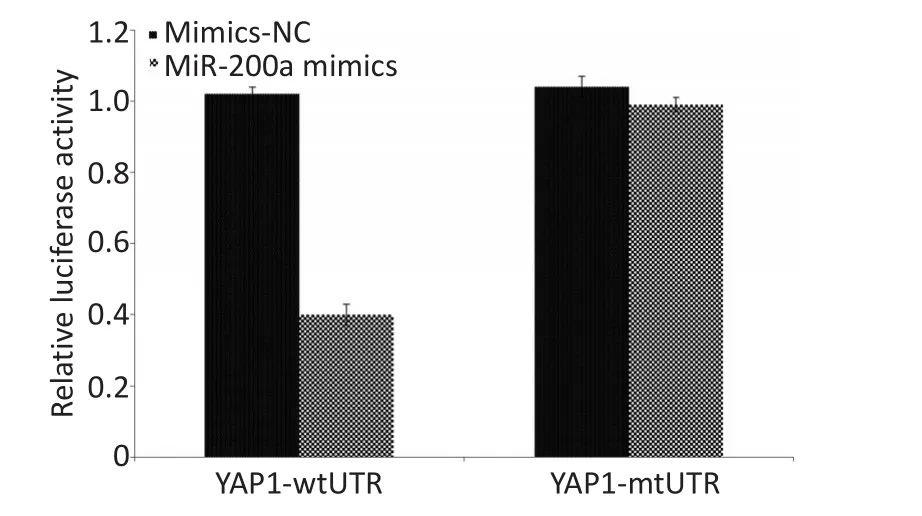
图3 双荧光素酶报告基因Figure 3 Dual luciferase reporter gene assay
2.4 上调miR-200a抑制YAP1 mRNA和蛋白的表达
Real-time PCR和Western blot结果显示miR-200a mimics组A549肺癌细胞中YAP1 mRNA和蛋白的表达水平明显低于mimic-NC(P<0.01,图4A、B),提示miR-200a能够负调控YAP1的表达。
2.5 下调YAP1能够抑制A549肺癌细胞的增殖活力
A549肺癌细胞转染siRNA-YAP1或siRNA-NC后,Real-time PCR和Western blot显示转染后siRNA-YAP1组A549细胞中YAP1 mRNA和蛋白表达水平明显低于siRNA-NC组(P<0.01,图5A、B),证明转染效率较高,成功下调A549肺癌细胞YAP1的表达。同时CCK-8法检测细胞增殖活力显示siRNA-YAP1组A549肺癌细胞48、72、96 h时吸光度明显低于siRNA-NC组细胞,提示下调YAP1表达能够明显抑制A549肺癌细胞的增殖活力(P<0.01,图5C)。
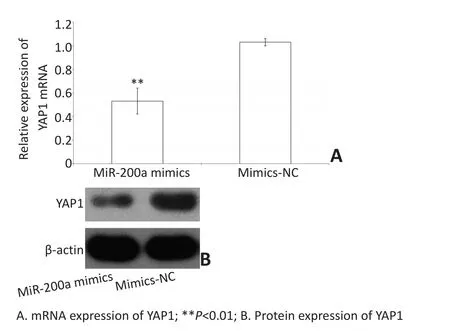
图4 miR-200a mimics组A549细胞YAP1 mRNA和蛋白的表达水平降低Figure 4 mRNA and protein expression of YAP1 in the miR-200a mimic group was lower than that in the mimic-NC group
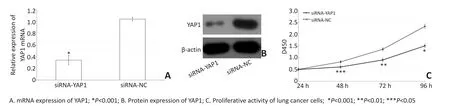
图5 下调YAP1能够抑制A549肺癌细胞的增殖活力Figure 5 Downregulation of YAP1 could inhibit the proliferation of A549 lung cancer cells
3 讨论
肺癌是一种高发性恶性肿瘤,肺癌的发生发展是多种基因改变、多步骤的复杂过程,其发生发展的具体分子机制尚不明确。近年来随着表观遗传学的发展,miRNA在疾病中作用越来越受到重视。研究显示在多数恶性肿瘤中存在miRNA的异常表达,miRNA在恶性肿瘤的发生发展过程中发挥着重要的作用[12-13]。
miR-200a属于miR-200家族成员之一,目前研究发现miR-200a表达异常与恶性肿瘤的发生发展关系密切,Gao等[14]研究发现,miR-200a在神经母细胞瘤中表达较癌旁组织明显降低,上调miR-200a的表达可以通过靶向AP-2γ基因抑制肿瘤细胞的增殖和成瘤作用。Yao等[15]报道miR-200a在乳腺癌中表达减低,上调miR-200a的表达可以通过靶向TFAM基因抑制肿瘤细胞的增殖。但目前有关miR-200a与肺癌发生发展关系方面的研究较少。Zhen等[16]和Chen等[17]均在研究中证实miR-200a在非小细胞肺癌细胞系中表达降低。本研究中通过Real-time PCR检测了15例非小细胞肺癌组织及对应癌旁组织、人肺癌细胞株(A549、NCI-H520、SKMES-1)及人正常肺支气管上皮细胞株16HBE中miR-200a的表达水平,发现miR-200a在非小细胞肺癌组织和肺癌细胞系中表达均明显降低,与其他研究结果一致。但miR-200a对肺癌细胞增殖影响及机制方面的研究国内外尚缺乏研究报道。为了研究miR-200a对肺癌细胞增殖的影响,通过脂质体介导法将miR-200a mimics成功转染入A549肺癌细胞,成功在A549细胞过表达miR-200a。CCK-8法显示过表达miR-200a能够明显抑制A549肺癌细胞的增殖活力,说明miR-200a能够抑制肺癌细胞的增殖,属于肺癌“抑癌基因”。
一个miRNA可以参与调控多个靶基因,并且每个靶基因又可以受到多个miRNA的同时调节。miRNA在肿瘤中的作用主要取决于其调控的下游靶基因的生物学效应。Zhen等[16]发现miR-200a可以通过靶向EGFR和c-Met抑制肺癌细胞的侵袭及转移。Chen等[17]报道miR-200a可以通过靶向TSPAN1抑制肺癌细胞的侵袭。为了研究miR-200a对肺癌细胞增殖影响可能的机制,应用靶基因预测数据库miRanda,并结合基因的功能分析,预测miR-200a的可能靶基因YAP1、YAP1的3′UTR区存在与miR-200a的种子序列理论上互补的结合位点,通过双荧光素酶报告基因证实miR-200a能够特异性结合YAP1的3′UTR区,使荧光蛋白表达水平明显降低,为了进一步验证YAP1是否为miR-200a的靶基因,本研究应用Real-time PCR和Western blot检测发现上调miR-200a能够明显下调YAP1 mRNA和蛋白表达的水平,说明miR-200a对YAP1基因存在负调控关系,从基因和蛋白两个水平验证两者之间的靶向调控关系,结合双荧光素酶报告基因证实YAP1是miR-200a的直接调控靶基因。
Yes相关蛋白1(yes-associated protein 1,YAP1)是Hippo信号通路(hippo pathway)的下游信号分子,在细胞生长发育、DNA修复、内源性稳态方面发挥着重要的作用。研究发现正常活化状态的YAP1可以促进生物体的创伤修复,但是超激活状态下的YAP1将过度促进细胞的增殖能力,从而促进了肿瘤的形成[18]。目前研究已经证实YAP1在肺癌中表达上调,许多上游基因可以调控YAP1参与肺癌细胞的增殖、侵袭及迁移等生物学行为[19-21]。本研究通过干扰实验,下调肺癌A549细胞中YAP1的表达,CCK-8法显示下调YAP1表达能够明显抑制A549肺癌细胞的增殖活力,与上调miR-200a表达对A549肺癌细胞恶性表型的影响一致,进一步证实miR-200a通过对YAP1基因的调控影响肺癌细胞的增殖。
综上所述,本研究证实miR-200a在肺癌组织和细胞中呈表达降低,YAP1是miR-200a的直接调控靶基因,miR-200a通过负性调节YAP1的表达从而抑制肺癌细胞的增殖,为肺癌的治疗提供了新的研究思路,并且有可能成为未来肺癌基因治疗的潜在靶点。
[1]Eckel SP,Cockburn M,Shu YH,et al.Air pollution affects lung cancer survival[J].Thorax,2016,71(10):891-898.
[2]Ridge CA,Mcerlean AM,Ginsberg MS.Epidemiology of lung cancer[J]. Semin Intervent Radiol,2013,30(2):93-98.
[3]Sheng M,Zhao Y,Wang F,et al.Targeted drugs for unselected patients with advanced non-small-cell lung cancer:a network meta-analysis[J]. J Thorac Dis,2016,8(1):98-115.
[4]Farazi TA,Spitzer JI,Morozov P,et al.miRNAs in human cancer[J].J Pathol,2011,223(2):102-115.
[5]Cochrane DR,Spoelstra NS,Howe EN,et al.microRNA-200c mitigates invasiveness and restores sensitivity to microtubule-targeting chemotherapeutic agents[J].Mol Cancer Ther,2009,8(5):1055-1066.
[6]Wu X,Wu G,Wu Z,et al.miR-200a suppresses the proliferation and metastasis in pancreatic ductal adenocarcinoma through downregulation of DEK Gene[J].Oncogene,2015,34(33):4333-4346.
[7]Tsouko E,Wang J,Frigo DE,et al.miR-200a inhibits migration of triplenegative breast cancer cells through direct repression of the EPHA2 oncogene[J].Carcinogenesis,2015,36(9):1051-1060.
[8]Lu R,Ji Z,Li X,et al.Tumor suppressive microRNA-200a inhibits renal cell carcinoma development by directly targeting TGFB2[J].Tumour Biol,2015,36(9):6691-6700.
[9]Yang X,Wang J,Qu S,et al.microRNA-200a suppresses metastatic potential of side population cells in human hepatocellular carcinoma by decreasing ZEB2[J].Oncotarget,2015,6(10):7918-7929.
[10]Shi Z,Hu Z,Chen D,et al.microRNA-200a mediates nasopharyngeal carcinoma cell proliferation through the activation of nuclear factorκB[J].Mol Med Rep,2012,6(3):501-506.
[11]Liu N,Zhong L,Zeng J,et al.Upregulation of microRNA-200a associates with tumor proliferation,CSCs phenotype and chemosensitivity in ovarian cancer[J].Neoplasma,2015,62(4):550-559.
[12]Salido-Guardarrama I,Romero-Cordoba S,Peralta-Zaragoza O,et al. MicroRNAs transported by exosomes in body fluids as mediators of intercelluar communication in cancer[J].Onco Targets Ther,2014,7: 1327-1338.
[13]Wang Z,Yao H,Lin S,et al.Transcriptional and epigenetic regulation of human microRNAs[J].Cancer Lett,2013,331(1):1-10.
[14]Gao SL,Wang LZ,Liu HY,et al.miR-200a inhibits tumor proliferation by targeting AP-2γ in neuroblastoma cells[J].Asian Pac J Cancer Prev, 2014,15(11):4671-4676.
[15]Yao J,Zhou E,Wang Y,et al.microRNA-200a inhibits cell proliferation by targeting mitochondrial transcription factor A in breast cancer[J]. DNA Cell Bio,2014,33(5):291-300.
[16]Zhen Q,Liu J,Gao L,et al.microRNA-200a Targets EGFR and c-Met to Inhibit Migration,Invasion,and Gefitinib Resistance in Non-Small Cell Lung Cancer[J].Cytogenet Genome Res,2015,146(1):1-8.
[17]Chen Y,Peng W,Lu Y,et al.miR-200a enhances the migrations of A549 and SK-MES-1 cells by regulating the expression of TSPAN1[J].PLoS One,2008,3(7):e2557.
[18]HarveyKF,ZhangX,Thomas DM.TheHippopathwayandhumancancer [J].Nat Rev Cancer,2013,13(4):246-257.
[19]Xiao L,Zhou H,Li XP,et al.microRNA-138 acts as a tumor suppressor in non small cell lung cancer via targeting YAP1[J].Oncotarget,2016, 7(26):40038-40046.
[20]Dubois F,Keller M,Calvayrac O,et al.RASSF1A suppresses the invasion and metastatic potential of human non-small cell lung cancer cells by inhibiting YAP activation through the GEF-H1/RhoB Pathway[J].Cancer Res,2016,76(6):1627-1640.
[21]Huang C,Ma R,Yue J,et al.MiR-497 Suppresses YAP1 and inhibits tumor growth in non-small cell lung cancer[J].Cell Physiol Biochem, 2015,37(1):342-352.
(2016-12-14收稿)
(2017-03-09修回)
(编辑:杨红欣 校对:武斌)
Effects of miR-200a on the proliferation of lung cancer cells by inhibiting YAP1
Lu XU1,Yusong FANG2,Danyun WANG2,Zongming WANG2,Peng XU2
Peng XU;E-mail:lwys002@163.com
1Department of Oncology,The Central Hospital of Xinwen Mining Group,Tai'an 271233,China;2Department of Thoracic Surgery,Ji'nan Central Hospital Affiliated to Shandong University,Ji'nan 250013,China
Objective:To investigate the effects of miR-200a on the proliferation of lung cancer cells and to identify its direct target genes.Methods:Real-time PCR was performed to analyze the miR-200a expression in 15 paired clinical specimens of non-small cell lung cancer and adjacent noncancerous tissues,human lung cancer cell lines(A549,NCI-H520,and SK-MES-1),and one human normal lung bronchial epithelial cell line(16HBE).The effects of miR-200a on the proliferation of A549 lung cancer cells were detected through CCK-8 method.The candidate target genes of miR-200a were identified by bioinformatics screening and then verified by dual luciferase reporter gene assay,real-time PCR,and Western blot.The effects of YAP1 downregulation on the proliferation of A549 lung cancer cell line were also observed through CCK-8 method.Results:The miR-200a expression in non-small cell lung cancer tissues and lung cancer cell lines was significantly decreased(P<0.01).The upregulation of miR-200a expression could significantly inhibit the proliferation of A549 lung cancer cells(P<0.01).Dual luciferase reporter gene indicated that miR-200a could directly affect the 3′‐untranslated region of the YAP1 gene to inhibit luciferase activity(P<0.01).Real-time PCR and Western blot revealed that the upregulation of miR-200a expression could significantly reduce the mRNA and protein expression levels of YAP1 in A549 lung cancer cells(P<0.01). CCK-8 method indicated that the downregulation of YAP1 could significantly prevent the proliferation of A549 lung cancer cells(P<0.01).Conclusion:MiR-200a inhibits the proliferation of lung cancer cells by targeting YAP1.Thus,miR-200a elicits tumor suppression effects.
miR-200a,lung cancer,YAP1,proliferation

10.3969/j.issn.1000-8179.07.424
①新汶矿业集团中心医院肿瘤科(山东省泰安市271233);②山东大学附属济南市中心医院胸外科
许鹏 lwys002@163.com
许璐 专业方向为恶性肿瘤内科治疗。
E-mail:xuluzlk@yeah.net
