慢性淋巴细胞白血病合并急性髓系白血病多学科协作诊疗1例*
2017-05-08宁乔杨杨洪亮夏冰白丽萍曹增王慧君张翼鷟尤明健
宁乔杨 杨洪亮 夏冰 白丽萍 曹增 王慧君 张翼鷟 尤明健
·MDT论坛·
慢性淋巴细胞白血病合并急性髓系白血病多学科协作诊疗1例*
宁乔杨①杨洪亮①夏冰①白丽萍②曹增①王慧君③张翼鷟①尤明健④
天津医科大学肿瘤医院血液科2014年6月收治慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)患者1例,该患者第1个周期化疗1个月后,在原有CLL细胞亚群的基础上发现另一群急性髓系白血病(acute myeloid leukemia,AML)细胞亚群。此后,虽然未经针对性治疗,但肿瘤在较长时间内(约11个月余)均呈现稳定状态。通过回顾患者前期的相关检查,明确此病例为极其罕见的CLL/AML。汇集综合血液科、分子诊断科、病理科等多学科的诊疗意见和延伸讨论,本研究通过此病例对CLL/AML、肿瘤二次打击学说与肿瘤树状演化模型有了比较全面和直观的认识。
慢性淋巴细胞白血病 急性髓系白血病 多学科协作
1 病历简介
患者男性,54岁,主因“发热、咳嗽伴少量白痰”于2014年6月就诊于天津市红桥医院,血常规示:WBC 19.1×109/L,Lym 15.99×109/L,无贫血、血小板减少等,抗感染治疗后症状好转。复查血常规示:WBC 26.22×109/L,Lym 23.76×109/L。遂考虑血液系统疾病,就诊于天津医科大学肿瘤医院,骨髓形态及活检提示:粒、红、巨三系减低,淋巴细胞明显增多(成熟淋巴细胞为79%+幼稚淋巴细胞为5.5%),异型淋巴细胞增多;免疫组织化学示:CD20+,PAX5+,CD3-,CD43+,CD10-,Cyclin D1-;骨髓流式结果示:异常细胞占57.07%,表达CD19、CD20、CD22、sIgM、CD25、CD79b、Kappa、CD81、CD200,弱表达CD5、CD11c,不表达CD43、Lambada、CD10、CD23、FMC7、sIgD,符合CD5+CD10-B淋巴细胞淋巴瘤。染色体检查示克隆性异常+8。FISH检测提示IgH基因重排阳性,伴5′IgH基因信号缺失。基因检测示:IgH,IgK重排阳性。PET-CT检查提示:1)双侧肱骨及股骨髓腔密度升高,可见不同程度放射性浓聚,代谢增高,考虑恶性淋巴瘤侵犯;2)双颈深、颌下、颏下、下颈、纵隔内、腔静脉后主肺窗等淋巴结可见放射性浓聚。结合以上检查,明确诊断为:CD5+CD10-B淋巴细胞淋巴瘤,不典型慢性淋巴细胞白血病(chronic lymphocytic leuke⁃mia,CLL),RaiⅡ期,Binet B期。患者因经济原因未使用利妥昔单抗,于2014年7月予以FC方案(氟达拉滨+环磷酰胺)化疗,过程顺利,后中断治疗。2014年10月,因贫血再次入院,复查血常规示:WBC 1.34× 109/L,Hb 49 g/L,Lym 0.38×109/L。叶酸、B12浓度未见明显异常,酸溶血试验、Coombs试验,尿含铁血黄素试验等均阴性。复查骨髓形态示:骨髓增生较活跃,原始细胞比例明显增高,少量小淋巴细胞散在分布,不除外髓系白血病。2014年10月29日骨髓流式检测示:异常细胞占20.2%,表达CD34、CD33、CD13、CD36,部分表达CD7、CD123,弱表达CD117、CD64、CD56,不表达HLA-DR、CD38、CD5、CD11b、CD14、MPO、CD79a、cCD3、TdT,符合急性髓系白血病(acute myeloid leukemia,AML)表型AML-M5。因该结果与首次骨穿结果差异较大,再次行骨穿,2014年11月12日骨髓形态学检测结果回报:异常细胞比例偏高,分类不明细胞占29%,骨髓增生大致正常(50%),粒系各阶段可见原始、早幼细胞增多,未见异型淋巴细胞。骨髓活检免疫组织化学示CD3+散在,CD5+散在,CD20+散在,PAX5+少量,CD23-,粒细胞MPO+,CD34+较多。流式检测结果示:同时存在两群异常有核细胞,一群为(11%)CD34+、CD117dim,HLA-DR dim、CD38-、CD13+、CD33+、CD56dim、CD7部分阳性的异常髓系原始细胞;另一群为(1.11%)CD19+、CD20+、CD38+、CD10-、CD5-、Kappa+Lambda-的异常B淋巴细胞(图1)。复查染色体核型示:47,XY,+8[5]/47,XY,del(7)(q22),+8[10]。此时考虑修正诊断为CLL治疗后继发AML或CLL伴发AML-M5两种可能。仔细复习第一次骨髓流式检测结果,发现当时即有一小群异常的髓系原始细胞,但因其占比较小当时未予重视(详见流式部分)。遂考虑该患者为CLL同时伴发AML。二代测序(next-generation sequencing,NGS)结果示:ATM(G2023R,52.1%),MYH11(R1535Q,50.7%),U2AF1(S34Y,44.8%),ASXL1(H630fs,19.8%),WHSC1(E1099K,5.7%)。诊断明确后,患者因经济原因拒绝行进一步化疗,以输血、抗感染等对症支持治疗为主。血红蛋白波动于46~68 g/L左右,白细胞波动于(0.77~2.86)×109/L左右。2015年1月复查骨髓象示:异常髓系原始细胞为28.35%,异常B淋巴细胞为0.56%。2015年7月患者于院外死于肺部感染。
2 讨论要点
1)明确本例患者的诊断;2)CLL合并髓系第二肿瘤(second neoplasms,sN)的临床特点及发生机制;3)CLL合并髓系sN的治疗策略;4)惰性性质白血病患者的诊断及治疗策略;5)本例CLL合并AML患者的肿瘤演化模式及其对临床的启示。
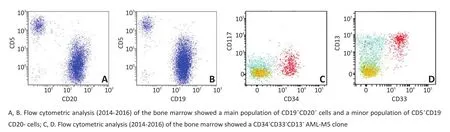
图1 患者流式细胞检测信息Figure 1 Patient flow cytometry information
3 临床讨论
张翼鷟主任医师(血液科):患者为中年男性,起病较为隐匿,不典型CLL诊断后予以FC方案化疗,化疗后持续重度贫血难以恢复。复查骨髓提示,在被显著抑制的CLL异常克隆外发现异常髓系原始细胞群,再回顾首次骨髓流式检测结果,发现亦有少量异常的髓系细胞群,明确为AML异常克隆,是CLL未治疗时并发的另一异常克隆群体。综合染色体常规、NGS等其他检查结果,最后诊断为:CD5+CD10-B淋巴细胞淋巴瘤,CLL RAIⅡ期,Binet B期;AML的FAB分型M5。患者因自身原因,除首次FC方案化疗外拒绝行任何针对AML的化疗,以输血等支持治疗为主,此后复查发现异常髓/淋系细胞在骨髓内的比例一直较为稳定,在近9个月的时间,未呈现爆发式增长,亦无自发缓解,此状态持续至2015年7月,患者于院外因肺部感染死亡。本研究认为未经过烷化剂、放射等治疗的CLL发生sN特别是血液系统肿瘤比较罕见,且通常认为AML是一种具有较高侵袭性的疾病,如无针对性治疗,自然生存期很短,而本例患者却能在较长时间内维持疾病的稳定状态,这是非常罕见的病例。
本次讨论的要点是提请血液、病理、检验、分子诊断等方面的专家,分别从文献回顾、临床特点及对本研究今后工作的启示等方面,共同研究本病例的整体诊疗策略。
宁乔杨医师(血液科):CLL是一种低度恶性小淋巴细胞疾病。其特征是CD5+的成熟B淋巴细胞在外周血、骨髓、淋巴结以及脾脏中的克隆性增殖和积聚。CLL是北美和欧洲地区最常见的白血病亚型,约占该地区全部白血病患者的16%~30%[1],多为50岁以上的中老年患者,诊断时中位年龄在67~72岁之间,男性多于女性[2]。CLL在我国较少见,不足全部白血病患者的3%,但随着我国人口老龄化进程的不断推进,CLL在我国的发病率近年也呈逐渐上升的趋势。
CLL患者合并sN并非罕见,较为多见的是发生于肺、皮肤、胃肠道、乳腺等的实体瘤[3],有研究发现CLL患者在确诊5年内sN的发生率在6.9%~9.7%[4]。此外,CLL合并多发性骨髓瘤(multiple my⁃eloma,MM)、骨髓异常增生综合征(myelodysplasia syndrome,MDS)、AML等血液系统异常的案例也曾有报道[5]。刘凯奇等[6]及Zhang等[7]分别于2006年和2011年总结了部分见于文献报道的初治或未治疗CLL合并AML病例(表1)。
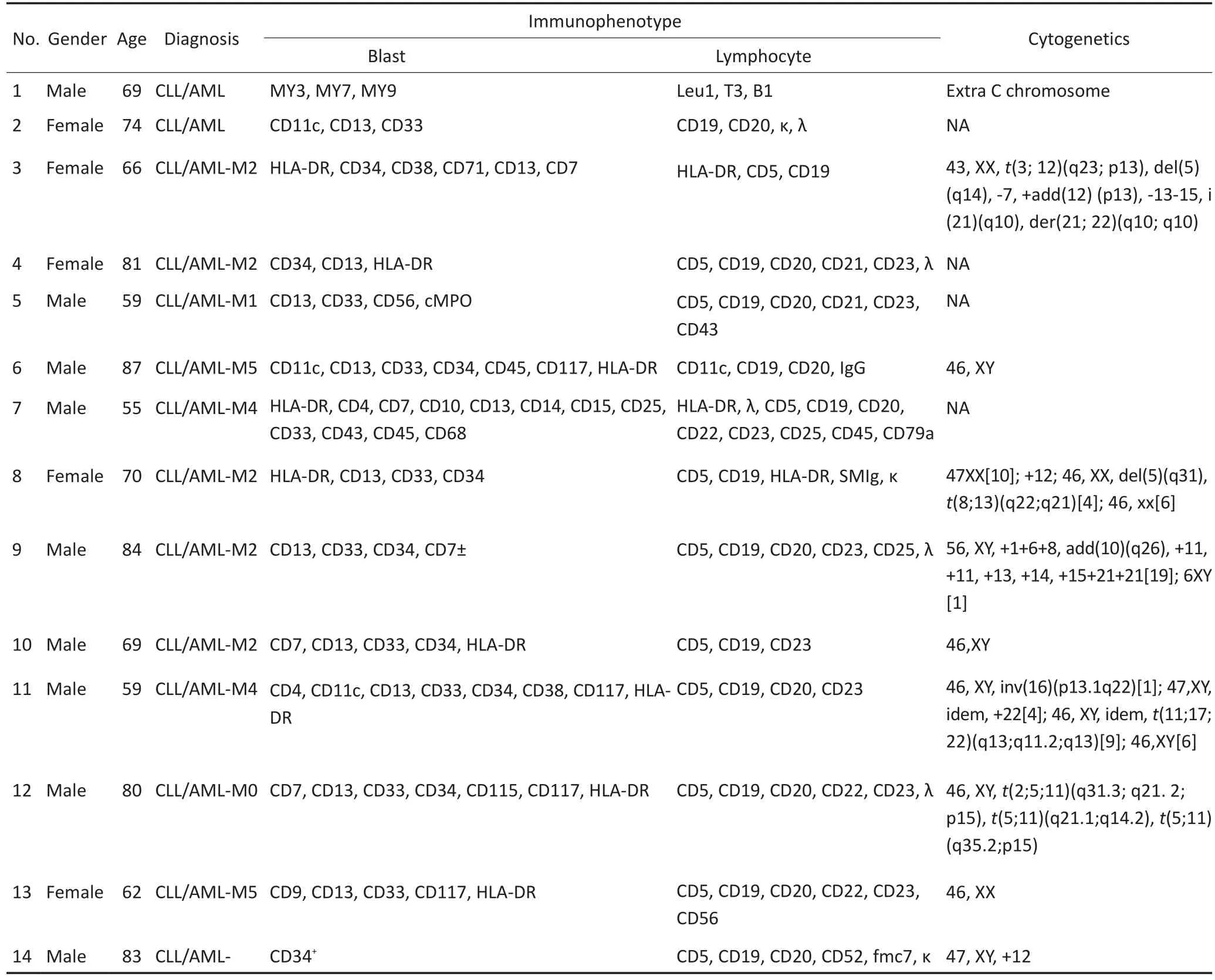
表1 14例CLL/AML患者临床资料Table 1 Clinical characteristics of 14 cases of concurrent AML and CLL
回顾病例及其诊疗过程,可以发现CLL/AML患者的一些特征:1)男性多于女性;2)多发生于老年,年龄为55~87岁,中位年龄69岁;3)复杂核型发生比例高;4)合并AML种类多样,但似乎M2更为多见;5)生存期短于一般老年AML。
由于CLL拥有相对惰性的病理过程,病程较长。因此,一般认为CLL/AML患者的CLL克隆群率先出现,而AML多在CLL的漫长病程中出现新的异常克隆亚群。目前,导致此过程发生的机理可能为:1)CLL/AML患者的异常细胞起源于有同样缺陷的造血干细胞,此后缺陷的干细胞分别向两个不同的方向分化为两种不同的异常克隆群体[8];2)患者因具有某些致白血病因素或某些肿瘤易感因素(理化影响、年龄等),影响了两个或以上的造血祖细胞,使得CLL和AML起源于不同的受影响的造血祖细胞[9]。本例患者因为初诊时的骨髓液或外周血样本已无法获得。因此,无法确凿地考证患者的CLL与AML克隆是否源于同一克隆起源,但考虑患者初始(CLL克隆为主时)染色体只检测到+8异常,而出现AML时出现合并的del(7)异常,只能推测AML及CLL克隆可能均源于某一个有+8异常的缺陷造血干细胞,并分别分化为含有+8异常的CLL及AML细胞群,并在AML细胞群得到del(7)异常后侵袭性增加,出现相应的临床表现。
回顾以往个案报道的治疗方案,由于CLL本身的预后较好,5年生存期远高于AML。因此,CLL/AML的患者治疗上多以针对AML的中、大剂量阿糖胞苷治疗为主,以期达到短期的AML缓解;事实证明,大部分CLL/AML患者的预后取决于AML的治疗缓解程度。但遗憾的是由于CLL/AML患者多伴有高龄、复杂核型等不良预后因素,治疗效果有限,患者死亡原因多为AML而非CLL。
本例特殊之处在于患者只进行了针对CLL细胞的FC方案治疗,并未对AML进行含有中、大剂量阿糖胞苷的化疗,但患者的AML异常细胞仍在较长时间内处于稳定状态,并在无任何针对性治疗的情况下获得≥10个月的生存期。通过回顾文献分析其可能原因有以下几种:1)针对CLL的FC化疗方案对AML起到一定程度的抑制作用;2)类似于Mohammad等[10]曾报道的病例,AML的相对稳定可能与前期CLL本身分泌的各种细胞因子水平异常,导致AML抑制有关;3)AML细胞群体本身的特性,根据Boudard等[11]的总结,有一种特殊类型的“郁积型白血病(smoldering AML)”,常发生于老年AML-M2患者中,AML的性质相对惰性,且生存期在只有支持治疗的情况下长于一般的老年白血病,但由于对此种病例研究较少,且随着安全有效的治疗老年AML治疗手段层出不穷,目前对于“郁积型白血病”的研究不多,机制尚不明确;此外,尚有极少数个案报道部分急性白血病本身即有“惰性性质”[12]。本例患者情况特殊,考虑由于CLL分泌的细胞因子导致AML长期处于抑制阶段的可能性较大。以上为本研究从既往文献角度分析的本例特殊CLL/AML患者的临床及病理机制。
白丽萍副主任技师(检验科):患者第一次骨髓形态学检查示淋巴细胞明显增多(成熟淋巴细胞79%),H&E及PAS染色提示异型淋巴细胞增多,CLL诊断明确。行针对性化疗后血象持续不恢复,复查骨髓则示骨髓增生较活跃(70%~80%),原始细胞比例明显增高,是较为明确的AML征象。这种诊断上的前后矛盾是令人困惑的。尽管骨髓形态学检验是诊断各类血液系统疾病的最基础和直接的方法,但目前国际上多采用MICM诊疗体系,即通过细胞形态学、免疫学、细胞遗传学和分子生物学分型的方法,在血液病患者初诊阶段即对其进行精准的分析和评估,并在疾病的诊疗过程中不断跟踪疾病的变化情况。在本病例中,骨髓形态学能提供的信息有限,特别是在评估CLL在化疗后的微小残留情况,以及CLL和AML的异常克隆起源方面。需要免疫学(流式)、细胞遗传学(染色体)以及分子生物学(基因突变)等其他检查结果来共同评估病情。
曹增副主任技师(血液科):该患者首次骨髓检测提示异常细胞占57.07%,表达CD19、CD20、CD22、sIgM、CD25、CD79b、Kappa、CD81、CD200,弱表达CD5、CD11c,不表达CD43、Lambada、CD10、CD23、FMC7、sIgD;根据Marti等[13]在2005年提出的诊断标准,该例患者并非经典CD5+CD23+型CLL,属于CD5+CD20+CD79b+CD23-的不典型CLL。患者1个周期化疗后,出现持续性贫血,复查骨髓流式,发现骨髓中出现20.2%的异常细胞,表达CD34、CD33、CD13、CD36,部分表达CD7、CD123,弱表达CD117、CD64、CD56,不表达HLA-DR、CD38、CD5、CD11b、CD14、MPO、CD79a、cCD3、TdT,符合AML-M5。面对这种情况首先会考虑治疗相关AML,但既往文献报道提示[6],CLL治疗相关的二次肿瘤的发生往往与烷化剂、放射治疗或氟达拉滨有关,且二次肿瘤发生多出现于化疗1~3年后,本病例发现AML细胞群出现的时间那与初次治疗时间过于接近(<3个月),不符合t-AML。为明确诊断本研究复习了首次骨髓流式检测结果,发现当时已经有一小群异常的髓系原始细胞,但因其所占比例较小,被主克隆群异常B淋巴细胞掩盖,当时未予重视。因此,考虑该修正诊断为CLL/AML。
染色体+8异常通常见于AML和MDS患者中,于髓系异常细胞中多见。近年来,也有CLL伴有+8染色体异常的报道,CLL中+8染色体异常的出现多伴有其他染色体异常,少数病例为CLL中独立出现克隆性+8异常。+8异常在CLL中的临床意义尚有争议,有些报道认为+8异常的出现提示在CLL的基础上存在髓系病变的可能性,但对此结果仍存较大争议[14]。染色体del(7q)通常与MDS和AML的不良预后相关,既往鲜有del(7q)发现于CLL的报道,但近年来的研究显示7号染色体长臂的部分缺失可能在CLL中并非罕见[15],而del(7q)在CLL中的出现也可能预示着预后不良[16]。尽管相关证据仍有限,但这种del(7q)异常在CLL中的出现仍值得本研究在今后的工作中引起足够的重视。
值得关注的是,该例患者在2014年6月第一次染色体检测中仅发现染色体克隆性+8异常,而在经过1个周期FC化疗3个月后的2014年11月染色提检测,即发现在单纯染色体+8异常的基础上出现del(7)(q22)合并+8异常(图2),这提示患者的肿瘤细胞在数月间已经出现变化。由于在2014年11月第二次染色体检查时,患者异常髓系原始细胞已经在骨髓中占据的比例为20%左右。本研究高度怀疑初次染色体检查时的单纯+8染色体异常属于CLL细胞群,而第二次出现的+8合并del(7)异常细胞则很可能代表着另一群AML细胞。有理由认为侵袭性较高的AML异常细胞的出现很可能与del(7)的出现相关,而此组细胞的异常在第一次染色体检查中可能因比例过低而被忽视。但因为首诊时未存留相应的标本,故无法通过FISH等方法对初诊时+8甚至del(7)异常核型的出现比例进行判定,以并证实此前的推测是非常遗憾的。
尤明建教授(美国M.D.安德森肿瘤中心血液病理中心):NGS因其高通量(全面)、高灵敏度(精确)等特性,近年来被广泛用于各种疾病特别是异质性较高、发病机制复杂的血液系统疾病的研究中。2012年在NEJM发表了398例AML的基因突变图谱及其对预后影响的文章[17],引发了学界对血液系统恶性疾病中基因点突变作用的重视,开创了血液病精准医疗的新篇章。有研究报道114例难治/复发CLL患者的基因突变图谱并对其做了预后分析,进一步完善了NGS技术在恶性血液病领域的应用[18]。
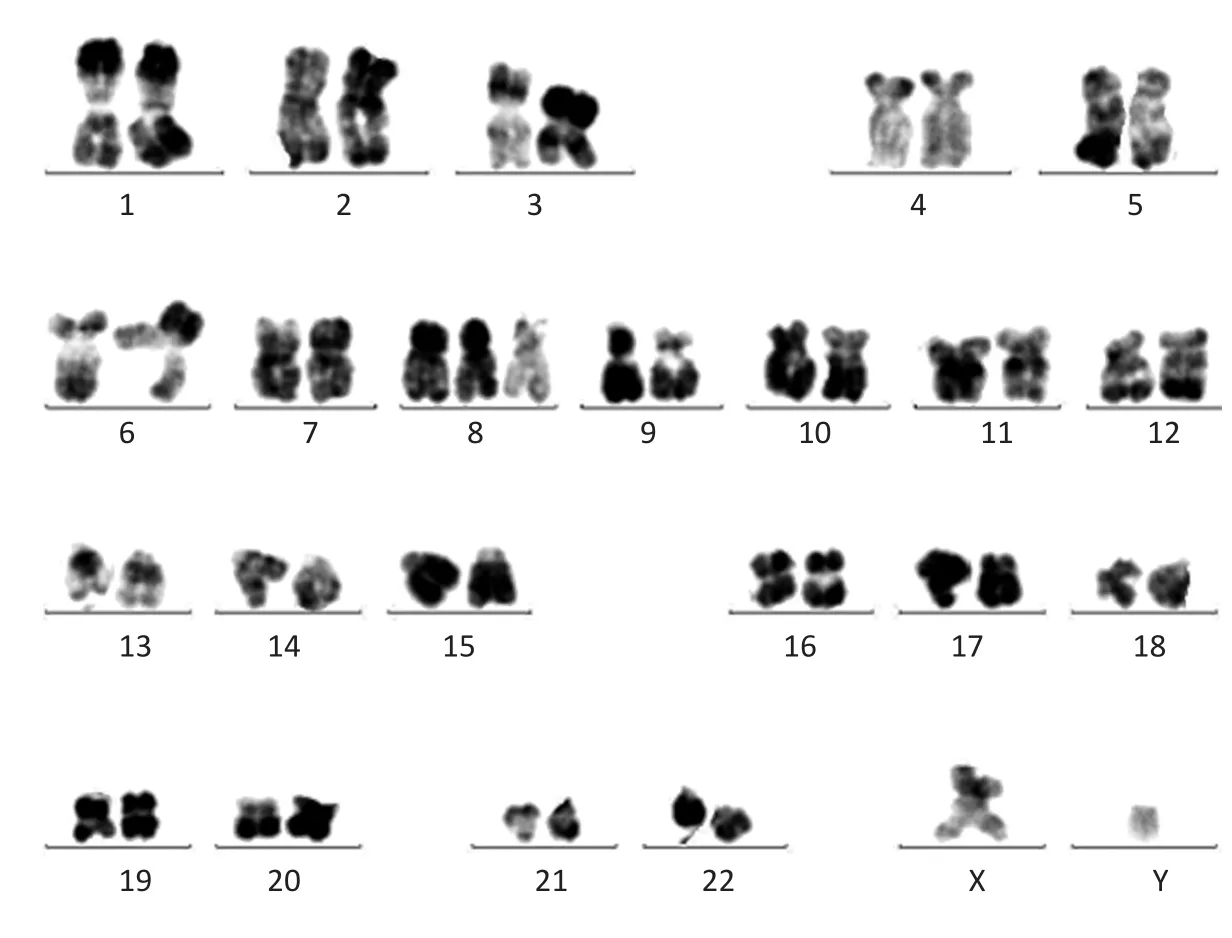
▶图2 患者染色体核型分析(14-11-12):47,XY,+8[5]/ 47,XY,del(7)(q22),+8[10]Figure 2 Cytogenetics of bone marrow(14-11-12):47,XY,+8 [5]/47,XY,del(7)(q22),+8[10]
通常在CLL患者中较为常见的会影响预后的突变有NOTCH1、Exportin 1(XPO1)、MYD88、Kelch-like(KLH6)、SF3B1、TP53等。本例患者标本在送检时仅发现5种基因突变:分别为ATM(G2023R,52.1%),MYH11(R1535Q,50.7%),U2AF1(S34Y,44.8%),ASXL1(H630fs,19.8%),WHSC1(E1099K,5.7%)。其中ATM突变为CLL中较为常见的突变,在CLL中发生率约为9.4%,该突变可能与不良预后相关;MYH11的点突变在血液系统疾病中较为罕见;U2AF1突变是MDS中的一种热点突变,其发生意味着MDS患者易进展为继发AML,往往提示存在不良预后。目前,尚未发现U2AF1突变发生于淋系的报道,最初见到此突变时怀疑本例患者可能有MDS病史,但回顾病史本研究发现患者并无明确的血细胞减低病史,且回顾骨髓涂片和活检结果并未发现病态造血证据,故除外MDS诊断;ASXL1基因突变多见于MDS、CM⁃ML、AML等髓系肿瘤患者中,目前多认为其本身为一种有表观遗传调节作用的抑癌基因,其突变多与不良预后相关,ASXL1突变在淋系肿瘤中罕有报道,结合其突变发生频率,怀疑此突变可能仅出现于此患者的异常髓系细胞群中[19];WHSC1本身是一种表观遗传学酶类,E1009突变可见于少量的淋系恶性疾病(淋巴瘤/骨髓瘤)可通过影响基因组的甲基化增加疾病的侵袭性。
结合骨髓免疫分型检查,骨髓中异常髓系细胞占有核细胞的28.35%,异常淋系细胞占0.56%。而在这4种突变中ATM、MYH11、U2AF1的细胞突变频率比较相似,占40%以上,而ASXL1和WHSC1的突变频率较低,提示这几种突变可能分别发生于不同的细胞群体内。恶性血液病是发生于造血干/组细胞的恶性克隆性疾病,根据肿瘤的二次打击学说,经过“第一打击”如染色体异位、重排或“初始突变”后,正常细胞可获得的某些引起基因组不稳定性增加或驱使细胞进行异常扩增的特性;而在异常扩增的细胞中某些亚克隆可获得“二次打击”,增强抗凋亡等恶性生物学特性,而肿瘤微环境、免疫抑制、其他理化因素等,则会对不同的亚克隆进行筛选,从而形成某些优势亚克隆,最终形成恶性血液病的某一个或某几个亚克隆[20]。本例患者同时包含异常髓系以及异常淋系两个肿瘤细胞群体,但是否拥有相同的、存在于造血干细胞的初始事件并发生过肿瘤克隆演进的标本,尚不明确。可以推测,本病例的肿瘤初次打击可能存在于造血干细胞阶段,并导致基因的不稳定性增加、二次突变的可能性增大,异常干细胞在向髓系/淋系分化的过程中,又出现了不同的优势克隆,并进一步形成异常的髓系/淋系肿瘤细胞克隆群,导致本病的发生。根据Ding等[21]的理论,本研究认为很有可能ATM、MYH11、U2AF1这几个突变发生于分化较早阶段,代表主要克隆群体;而ASXL1和WHSC1则可能发生于异常AML出现的较晚阶段,可能代表了最后出现的不同的克隆亚群。遗憾的是,本研究并没有存留患者初次发病时的骨髓液标本,从而不能对初诊时(CLL表型为主)的骨髓进行全基因组外显子组测序(whole exome sequencing,WES)或单细胞层面[22]的全基因组测序(whole-genome sequencing,WGS),以明确异常突变在同一细胞或细胞群体内的组合及变化方式,明确异常突变究竟出现于哪一系细胞群中,无法进一步确定肿瘤的突变演进方向,对明确其肿瘤演化方式留下了比较大的遗憾。
4 小结
该患者诊断为CD5+CD10-B淋巴细胞淋巴瘤,CLL RAIⅡ期,Binet B期;AML的FAB分型M5较为明确,但其临床过程比较特殊,AML在病程中呈现出一定的惰性。回顾文献,上述情况在CLL/AML或CLL/ sN的病例中并非罕见,本研究团队一般认为CLL患者的免疫系统处于抑制状态并导致感染和二次肿瘤发生率高于一般人群,但结合本病例发现此类患者可能因细胞因子分泌异常,对某些肿瘤呈现一定的抑制作用,这表现了CLL对免疫的影响可能具有一定的双面性。此外,患者在两次送检细胞遗传学检查的过程中,异常细胞比例及染色体异常种类出现了变化,而第二次+8/del(7)异常,很可能是发生在+8异常的基础之上,提示最初的+8异常很有可能出现在造血干细胞阶段,并在疾病过程中形成了两种不同的克隆亚群。该病例的探讨,不仅让专业人员对CLL/AML这一特殊类型白血病的诊疗有了较为深入的理解,也对肿瘤二次打击学说与肿瘤克隆树状演化模型学说有了比较直观的认识,并且提供了宝贵的经验。因此,该患者CLL/AML极为罕见,对其治疗的探索还有待于今后进一步深入研究。
[1]Morton LM,Wang SS,Devesa SS,et al.Lymphoma incidence patterns by WHO subtype in the United States,1992-2001[J].Blood, 2006,107:265-276.
[2]Klein U,Dalla-Favera R.New insights into the pathogenesis of chronic lymphocytic leukemia[J].Cancer Biol,2010,20(6):377-383.
[3]Hoffman R,Benz E,Shattil S,et al.Hematology:basic principles and practice(ed 5)[M].Philadelphia,PA,churchill livingstone elsevier press,2009,15:110-121.
[4]Molica S,Alberti A.Second neoplasms in chronic lymphocytic leukemia:analysis of incidence as a function of the length of follow-up [J].Haematologica,1989,74(5):481-485.
[5]Srinivasan S,Schiffer CA.Concurrent B-cell chronic lymphocytic leukemia and multiple myeloma treated successfully with lenalidomide[J].Leuk Res,33(4):561-564.
[6]Liu KQ,Mi YC,Li DP,et al.Patient with concurrent AML and CLL:a case report and literature review[J].Leukemia·Lymphoma,2006, 15(5):344-346.[刘凯奇,秘营昌,李大鹏,等.急性髓系白血病合并慢性淋巴细胞白血病一例报道及文献复习[J].白血病·淋巴瘤, 2006,15(5):344-346.]
[7]Zhang R,Kim YM,Lu X.Characterization of a novel t(2;5;11)in a patient with concurrent AML and CLL:a case report and literature review[J].Cancer Genet,2011,204(6):328-333.
[8]Miller MK,Strauchen JA,Nichols KT,et al.Concurrent chronic lymphocytic leukemia cutis and acute myelogenous leukemia cutis in a patient with untreated CLL[J].Am J Dermato,2001,23(4):334-340.
[9]Gottardi M,Gattei V,Degan M,et al.Concomitant chronic lymphocytic leukemia and acute myeloid leukemia:evidence of simultaneous expansion of two independent clones[J].Leuk Lymphoma, 2006,47(5):885-889.
[10]Mohammad A,Auerbach M,Bahrain H,et al.A case of CLL that was successfully treated resulted in the immediate development of AML from a coexistent myeloid line that had been suppressed[J]. Clin Case Rep,2015,3(3):165-169.
[11]Boudard M,Legrand O,Marie JP,et al.Smoldering acute myelogenous leukemia in the elderly[J].Leukemia and lymphoma,1999,34 (5):561-567.
[12]Campos L,Nadal N,Flandrin-Gresta P,et al.Congenital acute leuke-mia with initial indolent presentation—a case report[J].Cytometry B Clin Cytom,2011,80(2):130-133.
[13]Marti GE,Rawstron AC,Ghia P,et al.Diagnostic criteria for monoclonal B-cell lymphocytosis[J].Br J Haematol,2005,130(3):325-332. [14]Xu W,Cao X,Liu Q.Trisomy 8 in two newly diagnosed Chinese patients with chronic lymphocytic leukemia[J].Cancer Genet Cytogenet,2009,192(2):79-81.
[15]Lu G,Zhang J,Pauper K.The frequency of chromosome 7q interstitial deletions associated with B-cell lymphoproliferative disorders is substantially high among hematological malignancies[J].Acta Scientiarum Naturalium Univ Peki,2006,38(1):57-61.
[16]Houldsworth J,Guttapalli A,Thodima V.Genomic imbalance defines three prognostic groups for risk stratification of patients with chronic lymphocytic leukemia[J].Leuk Lymphoma,2014,55(4):920-928.
[17]Patel JP,Gönen M,Figueroa ME,et al.Prognostic relevance of integrated genetic profiling in acute myeloid leukemia[J].N Engl J Med, 2012,366(12):1079-1089.
[18]Guièze R,Robbe P,Clifford R,et al.Presence of multiple recurrent mutations revealed by targeted NGS confers poor trial outcome of relapsed/refractory CLL[J].Blood,2015,126(18):2110-2117.
[19]Fisher CL,Pineault N,Brookes C,et al.Loss-of-function additional sex combs like 1 mutations disrupt hematopoiesis but do not cause severe myelodysplasia or leukemia[J].Blood,2010,115(1):38-46.
[20]Sugimoto Y,Muramatsu H,Makishima H,et al.Spectrum of molecular defects in juvenile myelomonocytic leukemia includes ASXL1 mutations[J].Br J Haematol,2010,150(1):83-87.
[21]Ding L,Ley TJ,Larson DE.Clonal evolution in relapsed acute myeloid leukemia revealed by whole genome sequencing[J].Nature, 2012,481(7382):506-510.
[22]Shirai M,Taniguchi T,Kambara H.Emerging applications of singlecell diagnostics.Springer Berlin Heidelberg[J].2012,336:99-116.
(2016-12-25收稿)
(2017-02-21修回)
(编辑:孙喜佳 校对:郑莉)
Multidisciplinary team confirmed the simultaneous diagnosis of CLL and AML-M5
Qiaoyang NING1,Hongliang YANG1,Bing XIA1,Liping BAI2,Zeng CAO1,Huijun WANG3,Yizhuo ZHANG1,Mingjian YOU4
Yizhuo ZHANG;E-mail:yizhuozhang111@163.com
1Department of Hematology,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer;Tianjin 300060,China;2Department of Clinical Laboratory;3Department of Pathology,State Key Laboratory of Experimental Hematology,Institute of Hematology& Blood Diseases Hospital,CAMS&PUMC,Tianjin,300020,China;4Department of Hematopathology,The University of Texas M.D.Anderson Cancer Center,Houston 77054,USA
This work was supported by grants from the National Natural Science Foundation of China(No.81270603)and Sister Institution Network Fund(SINF)University of Texas MD Anderson Cancer Center
A 54-year-old man diagnosed with chronic lymphocytic leukemia(CLL)was admitted in our department in June 2014.After one cycle of FC chemotherapy,a bone marrow examination revealed normalized lymphocyte count and another acute myeloid leukemia(AML)-M5 clone.The patient refused sequential treatment and only received follow-up examination.He had continuous hematologically stable disease and died of pulmonary infection on July 2015.After a multidisciplinary team discussion,we confirmed the simultaneous diagnosis of CLL and AML-M5.Through this discussion,"tumor second hit model,""tumor evolution model,"and"tumor heterogeneity"were further defined.
chronic lymphocytic leukemia,acute myeloid leukemia,multidisciplinary team

10.3969/j.issn.1000-8179.2017.07.464
①天津医科大学肿瘤医院血液科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060);②检验科;③中国医学科学院,北京协和医学院血液学研究所,血液病医院病理科,实验血液学国家重点实验室;④美国德克萨斯大学M. D.安德森肿瘤医院血液病理科
*本文课题受国家自然科学基金项目(编号:81270603)和美国M.D.安德森肿瘤中心姊妹医院合作项目资助
张翼鷟 yizhuozhang111@163.com
宁乔杨 专业方向为血液系统肿瘤的内科治疗。
E-mail:18612944513@163.com
