误诊为脑内炎性肉芽肿的多形性黄色星形细胞瘤1例报道及文献复习
2017-03-31李文森李剑剑洪新雨
李文森,李剑剑,洪新雨,关 毅
(吉林大学第一医院 神经肿瘤外科,吉林 长春130021)
*通讯作者
误诊为脑内炎性肉芽肿的多形性黄色星形细胞瘤1例报道及文献复习
李文森,李剑剑,洪新雨,关 毅*
(吉林大学第一医院 神经肿瘤外科,吉林 长春130021)
多形性黄色星形细胞瘤(pleomorphic xanthoastrocytoma,PXA)是一种非常少见的颅内原发肿瘤,发生率占星形细胞瘤1%左右,以往观点认为PXA是趋于良性的肿瘤,手术全切预后较好[1,2]。近年来研究发现,部分PXA术后具有复发、转移、间变等恶性组织学特点,因此2007年WHO将PXA定为Ⅱ级,将伴有间变特征的PXA定为Ⅲ级[3]。由于PXA发生率较低,对于其临床特点和影像学了解不多,临床上常将其误诊为血管网状细胞瘤、脑膜瘤等其它肿瘤[4],因此尽快提高对PXA认识,早期诊断治疗,对患者预后起着至关重要的作用。日前我们收治1例青年男性病人,长期被诊断为“脑内炎性肉芽肿”,术后病理证实为PXA(Ⅱ级),现结合国内外文献对PXA的临床特点和容易误诊的原因进行分析。
1 临床资料
患者22岁,男性。2008年因癫痫大发作,行头部MRI检查见右顶叶稍长T1长T2信号影,FLAIR呈稍高信号影,边界清楚,病灶呈不均匀强化,直径约0.5 cm,周围水肿不明显,中线结构无移位。发病后在北京和长春多家三甲医院均诊断为“脑内炎性肉芽肿”,建议抗炎和抗癫痫治疗(具体不详)。近7年未规律服用抗癫痫和抗炎药物。每年癫痫大发作3至4次,于2015年4月来我院就诊,考虑脑内炎性肉芽肿可能性大,建议头孢吡肟1.0 g/次,每日2次静点,规范抗炎治疗2个月后复查头MRI,病灶未缩小(图1),决定行手术治疗。病程中无明显感染病史。查体和化验检查无阳性表现。入院后行24小时视频脑电图监测提示脑内考虑多发癫痫灶,给予德巴金1 000 mg/日口服。
入院后在神经导航下行手术治疗,术中见肿瘤呈灰白色、实性、质软,边界清楚。术中行皮层脑电监测,确认病变周边存在癫痫波,显微镜下将病变全部切除。再次行术中皮层脑电监测,约10分钟后癫痫波逐渐消退。术后给予抗炎、抗癫痫等对症治疗。
术后病理回报:右侧顶叶多形性黄色星形细胞瘤(PXA),WHO分级:II级。免疫组化结果:GFAP(+),S-100(+),CD34(部分+),Ki-67(+2%)。
术后14个月复查头部MRI,未见肿瘤复发;24小时视频脑电监测示仍有癫痫波存在,德巴金用量同术前,术后病人未有癫痫发作,癫痫得到有效控制。
2 讨论
PXA由Kepes等人发现并认为肿瘤是起源于脑表软膜下星形细胞的一种特殊类型的星形细胞瘤,于1979年正式命名为多形性黄色星形细胞瘤[1]。PXA最初被认为是趋于良性肿瘤,手术全切效果好,长期生存率较高,九十年代初WHO曾将其定为Ⅰ级。近十余年,研究发现部分肿瘤术后可复发,具有侵袭、转移等特点,甚至可转化为胶质母细胞瘤,放化疗效果不佳,最终2007年WHO将它定为Ⅱ级(PXA)和Ⅲ级(间变性PXA)。这改变了我们对PXA的认识,并逐渐引起人们的重视。而其影像学特点,在临床上常常容易被误诊为其它颅内肿瘤。
发病年龄和部位 据报道,PXA主要好发于儿童和青少年,发病平均年龄26岁左右,男女无明显性别差异[5]。PXA大多为单发,可能由于肿瘤起源于软膜下星形细胞,因此大多数肿瘤部位表浅,其中近半数发生在颞叶[2],其次发生在顶叶、枕叶等部位,发生于小脑半球、松体果区、脊髓等处少见[6]。
临床特征和MRI影像学表现 大部分病人发病缓慢,病程较长,提示该病趋于良性。可能与PXA发生于脑表软膜下和颞叶有关,绝大数病人主要症状表现为反复发作性癫痫,部分病人即使手术切除肿瘤,癫痫也很难有效控制。随着肿瘤大小、部位不同,还可表现为高颅压和其他局灶性神经症状。
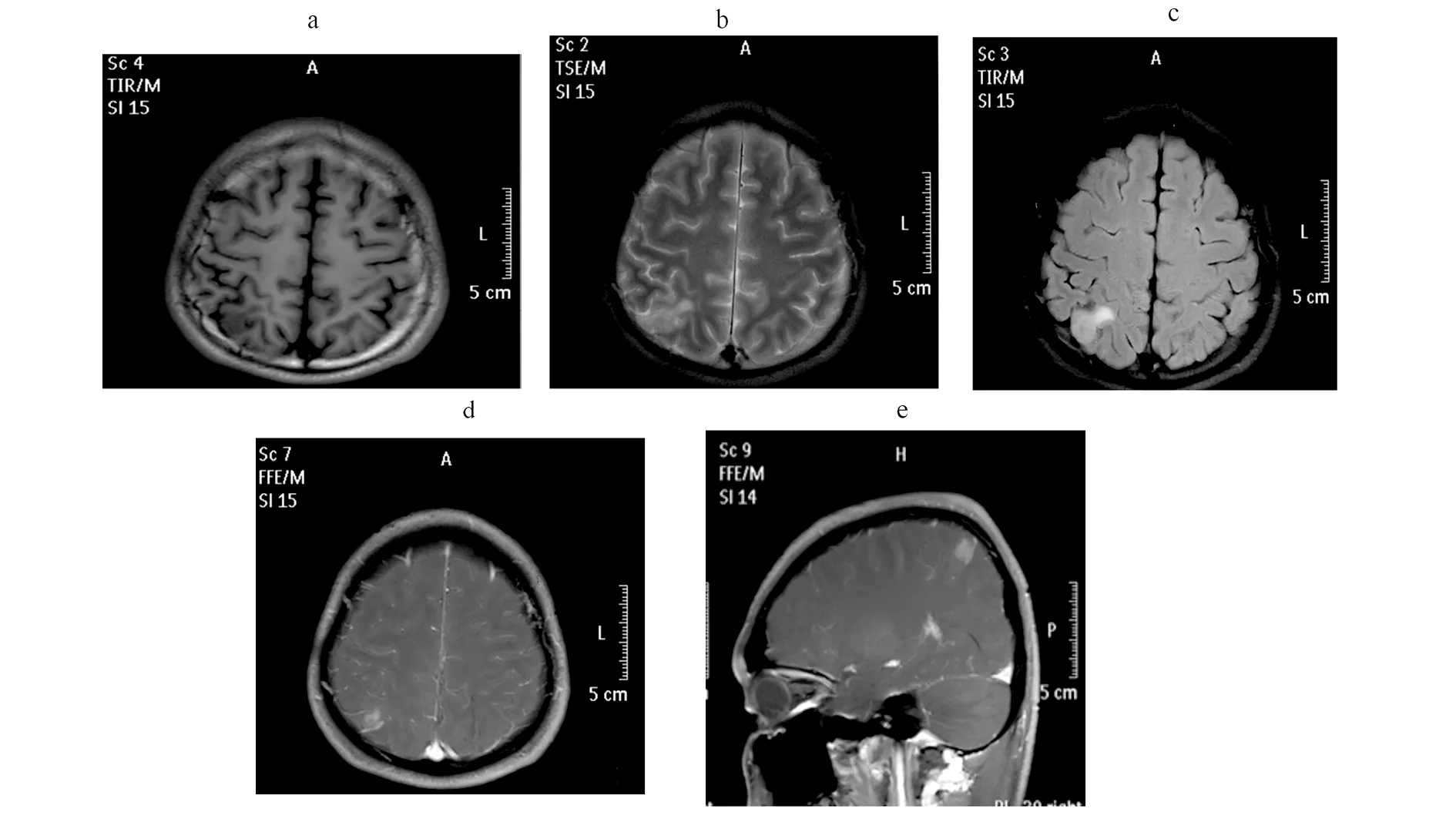
右顶叶脑表见稍长T1长T2信号影(a,b),FLAIR呈稍高信号影(c),边界清,病灶明显强化,直径约0.5 cm,周围水肿不明显(d,e)。
2011年Yu等人将PXA分为三型,即实性型、大囊伴壁结节型和囊实混合型[7]。实性型指病变表现为实性结节,伴或不伴囊腔,实性部分占病变总体积50%以上。MRI平扫病变边界较清,肿瘤实性部分和壁结节T1W1呈等信号或稍低信号影,T2W1呈等信号或稍高信号影;囊壁T1W1和T2W1均为等信号;囊性部分T1W1为低信号,T2W1为高信号。实性部分和壁结节呈不均匀强化,囊壁强化不明显或不强化,病变周边多为轻度水肿[8]。有的肿瘤伴有脑膜强化,易于脑膜瘤相混淆[3]。国内学者也有利用磁共振波谱成像(MRS),对PXA病变进行检查的报道,Cho/NAA比值<2,提示肿瘤趋于良性病变,目前国内外资料较少,还有待进一步研究,未来MRS对鉴别PXA良恶性程度应有较大帮助[9]。
病理学和免疫组化表现 病理组织镜下见多核巨细胞、梭形细胞、肥胖细胞和泡沫样细胞混合组成。伴有星形细胞增生和血管周围淋巴细胞浸润,细胞间充满丰富的网状纤维,核分裂像无或少,定义为WHO Ⅱ级。当肿瘤细胞核分裂像≥5个/10HP或/和伴有细胞坏死、明显的细胞间变时,定义为间变性PXA(Ⅲ级)[10]。
几乎全部PXA免疫组化染色神经胶质纤维酸性蛋白(GFAP)呈阳性,证明其来源于星形细胞,这也是最具特征性组织学表现。GFAP阳性是重要诊断依据之一,并有助于与其他肿瘤相鉴别。其次CD34表达与PXA恶性程度有关,在良性PXA标本中CD34阳性率高达84%,而在间变性PXA中CD34阳性率仅为44%,因此CD34可初步鉴别良性和间变性PXA,S-100被证明也与本病高度相关[11]。
治疗 治疗以手术为主,肿瘤全切预后较好。研究发现,肿瘤全切的患者中有85%生存期超过15年,大部分切除者则只有50%生存期超过15年[6]。另外Giannini等人对71例PXA病例研究证实,肿瘤全切的病人长期生存率较高,5年生存率为81%,10年生存率为70%;5年无复发生存率为72%,10年无复发生存率可达61%,且肿瘤切除范围与无复发生存率有直接关系[2]。
研究表明,有15% -20%PXA可复发或间变,具有高度侵袭性,甚至可转变为胶质母细胞瘤[10,12]。最新研究发现,在组织学、免疫组化、分子和临床特征方面,上皮样胶质母细胞瘤和PXA密切相关或他们实为同一类型肿瘤,这也许可以解释部分PXA具有复发、转移等生物学行为[13]。复发不伴有转移者,仍建议积极手术治疗;复发伴有转移者,特别是伴有广泛转移灶者,则治疗非常棘手,手术很难将这些病灶完全切除。PXA术后是否需要放化疗、目前还存在争议。Koga等对一例播散性PXA病人采取立体定向放射治疗,患者生存期延长至66个月[10]。Lubansu等对一例复发伴有转移的患者,采用硫替派、卡铂和替莫唑胺联合化疗,26个月后复查病灶无明显进展[14]。截止目前,虽然个别病例取得了较好的治疗效果,整体来说复发特别是伴有转移病灶的病人,放化疗效果并不确切,多数预后不良。
由于PXA较特殊的临床和影像学表现,同时发病率低,很容易被误诊为其他肿瘤。PXA术前多被诊断为胚胎发育不良性肿瘤、血管网状细胞瘤等肿瘤,甚至个别PXA位置表浅,伴有脑膜尾征而被诊断为脑膜瘤[3]。
本病例术前长达数年,被多家大医院均诊断为“脑内炎性肉芽肿”。脑内炎性肉芽肿,多为隐匿性感染局限后,局部炎性组织包裹,胶质纤维增生而形成境界明显的结节状病灶。临床上直径2 cm以下微型肉芽肿主要为细菌性,个别为寄生虫性或结核性。癫痫为主要症状,MRI扫描呈长T1、长T2信号,病灶边界清楚,强化明显,形状多为类圆形。治疗以抗炎、抗癫痫治疗为主,治疗后病变不消退、癫痫难以控制者,考虑手术治疗。
我们反思本病例误诊原因,总结出以下几条经验:①脑内炎性肉芽肿即使抗炎治疗无效,也不要轻易考虑病变为结核性或寄生虫性肉芽肿,应高度怀疑可能为肿瘤,特别是PXA的可能;②特别是病变位于脑表软膜下的考虑为脑内炎性肉芽肿的病人,规律抗炎治疗后病变无明显消退者,应尽快手术治疗,尽早明确病理,以免延误治疗时机。目前实性PXA术前误诊为脑内炎性肉芽肿的病例国内外还未见报道。虽然研究表明实性PXA较其他两型PXA具有恶性程度低、预后好等特点,但不积极手术治疗,实性PXA有进一步发展为恶性、间变PXA的可能[5]。因此充分了解、认识和重视本病,在临床工作中具有重要意义。
综上所述,PXA总体来说是趋于良性肿瘤,手术全切预后好,但近年来随着病例报道逐渐增多,发现有15% -20% PXA可复发或间变,治疗效果不佳,预后差。实际临床工作中,PXA常常被误诊为其它肿瘤或病变,需引起高度重视。结合临床和影像学特点,对高度怀疑PXA的病人,尽早手术治疗,明确病理,以免延误最佳治疗时机。
[1]Kepes JJ,Rubinstein LJ,Eng LF.Pleomorphic xanthoastrocytoma:A distinctive meningocerebral glioma of young subjects with relatively favorable prognosis.A study of 12 cases[J].Cancer,1979,44(5):1839.
[2]Giannini C,Scheithauer BW,Butget PC,et al.Pleomorphic xanthoastrocytoma:What do we really know about it?[J].Cancer,1999,85(9):2033.
[3]Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO Classificationof Tumours of the Central Nervous System[J].Acta Neuropathol,2007,114 (2):97.
[4]徐 露,成官迅,李学农.颅内多形性黄色星形细胞瘤的MRI表现及误诊分析[J].中国医学影像技术,2015,31(2):201.
[5]韦程纲,谭洁莹,刘国顺,等.非典型多形性黄色星形细胞瘤的MRI及病理表现[J].放射学实践,2015,30(1):21.
[6]沈 军,程宏伟.多形性黄色星形细胞瘤的临床研究进展[J].国际神经病学神经外科学杂志,2011,38(3):245.
[7]Yu S,He L,Zhuang X,et al.Pleomorphic xanthoastrocytoma:MR imaging findings in 19 patients[J].Acta Radiol,2011,52(2):223.
[8]韦程纲,龚艳媚,刘国顺,等.23例脑部多形性黄色星形细胞瘤的MRI分型对比研究[J].临床放射学杂志,2015,34(2):173.
[9]张 蕊,彭晓刚,崔丽华,等.磁共振在多形性黄色星形细胞瘤诊断中的价值[J].肿瘤学杂志,2015,21 (2):157.
[10]Koga T,Morita A,Maruyama K,et a1.Long-tetm control of disseminated pleomorphic xanthoastrocytoma with anaplastic features by means of stereotactic irradiation[J].Neuro Oncol,2009,11(4):446.
[11]Matsumoto K,Suzuki SO,Fukui M,et a1.Accumulation of MDM2 in pleomorphic xanthoastrocytomas[J].Pathol Int,2004,54(6):387.
[12]Perry A,Giannini C,Scheithauer BW,et al.Composite pleomorphic xanthoastrocytoma and ganglioglioma:report of four cases and review of the literature[J].Am J Surg Pathol,1997,21(7):763.
[13]Alexandrescu S,Korshunov A,Lai SH,et al.Epithelioid glioblastomas and anaplastic epithelioid pleomorphic xanthoastrocytomas-same entity or first cousins?[J].Brain Pathol,2016,26(2):215.
[14]Lubansu A,Rorive S,David P,et al.Cerebral anaplastic pleomorphic xanthoastrocytoma with meningeal dissemination at first presentation[J].Childs Nerv Syst,2004,20(2):119.
1007-4287(2017)03-0529-03
2016-09-17)
