舌癌CAL-27细胞GnRHR的检测及曲普瑞林对细胞增殖抑制作用研究
2017-03-31魏洪涛张国利岳玉环吴广谋邱丽娜马洪圆王冬冬吉元刚
李 健,魏洪涛*,张国利,岳玉环,吴广谋,田 园,邱丽娜,马洪圆,王冬冬,吉元刚
(1.吉林大学中日联谊医院 口腔科,吉林 长春130033;2.中国人民解放军军事医学科学院军事兽医研究所;3.吉林农业大学生命科学学院)
舌癌CAL-27细胞GnRHR的检测及曲普瑞林对细胞增殖抑制作用研究
李 健1,魏洪涛1*,张国利2,岳玉环2,吴广谋2,田 园2,邱丽娜1,马洪圆3,王冬冬2,吉元刚3
(1.吉林大学中日联谊医院 口腔科,吉林 长春130033;2.中国人民解放军军事医学科学院军事兽医研究所;3.吉林农业大学生命科学学院)
目的 研究I型促性腺激素释放激素(GnRH-I)类似物(GnRHa)曲普瑞林(Triptorelin)对人舌鳞状细胞癌CAL-27细胞株的体外增殖抑制作用。方法 利用RT-PCR方法检测CAL-27细胞株GnRHR mRNA。Western Blot法检测CAL-27细胞表面GnRHR蛋白表达。通过CCK-8法检测曲普瑞林对CAL-27细胞的生长抑制作用。结果 经RT-PCR法检测显示CAL-27细胞存在GnRHR mRNA。Western Blot结果显示, CAL-27细胞蛋白在60 kDa处存在GnRHR特异性反应条带。CCK-8检测结果显示,曲普瑞林对CAL-27细胞抑制率呈现浓度依赖性,且差异显著(P<0.01)。结论 舌鳞状细胞癌CAL-27细胞株中GnRHR基因及蛋白呈阳性,曲普瑞林对CAL-27细胞增殖具有抑制作用。
曲普瑞林;促性腺激素释放激素受体;舌癌
(ChinJLabDiagn,2017,21:0475)
40%的头颈部恶性肿瘤发生于口腔[1],目前手术治疗仍是主要的治疗方式[2]。尽管联用包括放化疗在内的多种治疗方法,但预后仍然较差,5年生存率不到50%[3]。有学者研究发现口腔癌根治性治疗对患者生活质量有显著的影响[4]。促性腺激素释放激素(GnRH)是一种由下丘脑分泌的十肽激素,其调控垂体分泌促性腺激素的作用众所周知。然而在过去的三十年中,逐渐发现GnRH及其受体除在垂体以及生殖系统存在,还存在于多种肿瘤组织中[5]。GnRH及合成的GnRH类似物已被证实对多种恶性肿瘤有抑制增殖的作用,包括卵巢癌、乳腺癌,子宫内膜癌、前列腺癌、胃癌、鼻咽癌等[6-11]。近年来,Cheung LW的研究显示肿瘤细胞表面GnRHR与肿瘤的转移及血管生成有关[12]。Lu等发现,胃癌组织中GnRHR的表达量与预后显著相关[13]。 这些均提示我们GnRH及GnRHR在肿瘤组织中的表达具有重要意义。迄今,尚未发现国内外关于人口腔癌细胞或组织表达GnRHR的报道,本课题组检测了人舌鳞状细胞癌CAL-27细胞株GnRHR的基因及蛋白表达情况,并利用曲普瑞林针对GnRHR进行了细胞增殖抑制试验,以期为提高口腔癌预后提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞株 人舌鳞状细胞癌CAL-27细胞株购自上海拜力生物科技有限公司。
1.1.2 主要试剂、材料及仪器 曲普瑞林(Triptorelin,pGlu-His-Trp-Ser-Tyr-Trp-Leu-Arg-Pro-Gly-NH2)委托苏州强耀生物科技有限公司合成。DMEM培养基以及新生牛血清购自GIBCO公司。总RNA提取试剂盒购自Promega公司。反转录试剂盒、PCR相关试剂均购自TaKaRa公司。GnRHR引物(F:5’-GCTCTCTGCGACCTTTA-3’;R:5’-TGTT CCACATCCCATCC-3’)及内参基因β2-M引物(F:5’-GGGTTTCATCCATCCG ACATT-3’;R:5’-CACGGCAGGCATACTCATCTT-3’)委托长春库美生物科技有限公司合成。CCK-8试剂盒购自DOJINDO公司。RIPA裂解液(强)、快速琼脂糖凝胶DNA回收试剂盒、BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司。鼠抗人单克隆抗体(ab22168)购自abcam公司,辣根酶标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司。
CO2培养箱购自德国Heraeus公司。PCR仪购自Bioer公司。核酸定量分析仪购自Thermo Fisher公司。凝胶图像分析仪购自上海天能公司。多功能酶标仪购自瑞士Tecan公司。高速低温离心机购自 Hettich公司。电泳槽、电泳仪电源、半干转印仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 人舌鳞状细胞癌CAL-27细胞株使用含10%胎牛血清、1%双抗的DMEM培养基,培养于37℃、饱和湿度、含5% CO2的培养箱中。
1.2.2 RT-PCR方法检测CAL-27细胞株中GnRHR的mRNA 根据NCBI数据库GnRHR及β2-M基因序列使用Primer5.0软件设计引物。取生长至80%汇合时的对数生长期细胞,收集细胞提取细胞总RNA,核酸定量分析仪分析并定量显示A260/A280值为1.9,浓度为253 ng/μl。使用TaKaRa PrimeScript RT reagent Kit进行反转录合成cDNA。先去除基因组DNA,反应体系为5×g DNA Eraser Buffer 2 μl、gDNA Eraser 1 μl、RNA 4 μl 、RNase Free dH2O 3 μl,共10μl 体系42℃加热2分钟后,与PrimeScript RT Enzyme Mix I 1 μl、RT Primer Mix 1 μl、5×PrimeScript Buffer 2 4 μl、RNase Free dH2O 4 μl,组成20 μl 体系。37℃ 15 min、85℃5 s,4℃保存。取5 μl cDNA模板与1×Ex Taq buffer(含Mg2+)2 μl、Ex Taq 0.2 μl、上下游引物(10 μM)各0.5 μl、dNTP 1 μl、H2O 10.8 μl构成20 μl扩增体系。反应条件为94℃预变性5 min,94℃ 30 s、60℃ 30 s、72℃ 40 s,40个循环,72℃5 min。扩增产物进行1.6%琼脂糖凝胶电泳。切胶回收后委托长春库美生物科技有限公司进行PCR产物测序。
1.2.3 Western Blot检测CAL-27细胞GnRHR蛋白表达 取生长至80%汇合时的对数生长期细胞,吸去细胞瓶内旧培养基后使用无菌冰PBS清洗两次。细胞刮刀收集细胞至2 ml EP管内2000 rpm离心5分钟,弃上清。再用冷PBS清洗细胞2次,每次洗后离心。300 μl RIPA裂解液与3 μl PMSF(100 mM)混匀后加入至EP管,冰上裂解30分钟后12 000 rpm离心10 分钟,收集上清至新的预冷离心管。取适量蛋白溶液利用BCA法进行浓度测定。
取40 μg蛋白进行12% SDS-PAGE电泳,然后将蛋白半干转移至NC膜上。含5%脱脂奶粉的TBST溶液37℃温箱中封闭150分钟。TBST洗膜3次每次5分钟后,加入TBST稀释(1∶1000)的鼠抗GnRHR单克隆抗体4℃孵育过夜。洗膜后,HRP标记山羊抗鼠IgG(1∶2000稀释)室温孵育2小时。洗膜后进行DAB显色。
1.2.4 利用CCK-8进行细胞增殖分析 取生长至80%汇合时的对数生长期细胞,无菌PBS清洗两遍,加入0.1%胰蛋白酶1.5 ml,37℃孵育4分钟后去除胰蛋白酶。加入DMEM培养基吹打制成单细胞悬液,细胞计数板计数后调整细胞浓度至1×105个/ml,将细胞种植在96孔板中,每孔100 μl即10 000 个细胞。96孔板贴壁培养6小时后去除原培养基并加入用DMEM完全培养基稀释的不同浓度的Triptorelin(10、20、40、80μg/ml)以及不含药物的溶剂对照组培养48小时,每个浓度5个复孔。48小时后去除旧培养基,统一更换新培养基,并设置不含细胞的培养基空白对照组,每孔加入10 μl CCK-8溶液37℃培养90分钟后,利用酶标仪检测OD450,记录检测结果。实验重复三次。
1.2.5 数据处理 每个浓度5个复孔的OD450数值去掉一个最大值、一个最小值后取平均值,根据公式:细胞存活率=[(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)]×100%计算细胞存活率,应用SPSS 22.0统计软件对实验数据进行单因素方差分析,数据以x—±s表示。
2 结果
2.1 RT-PCR检测结果
以CAL-27细胞cDNA为模板,扩增GnRHR基因序列,对CAL-27细胞的GnRHR基因表达进行初步检测。琼脂糖凝胶电泳图显示GnRHR (167 bp)和内参β2-M(160 bp)基因PCR扩增结果无杂带,经胶回收后进行测序,测序结果序列正确,证实CAL-27细胞存在GnRHR mRNA表达。见图1。
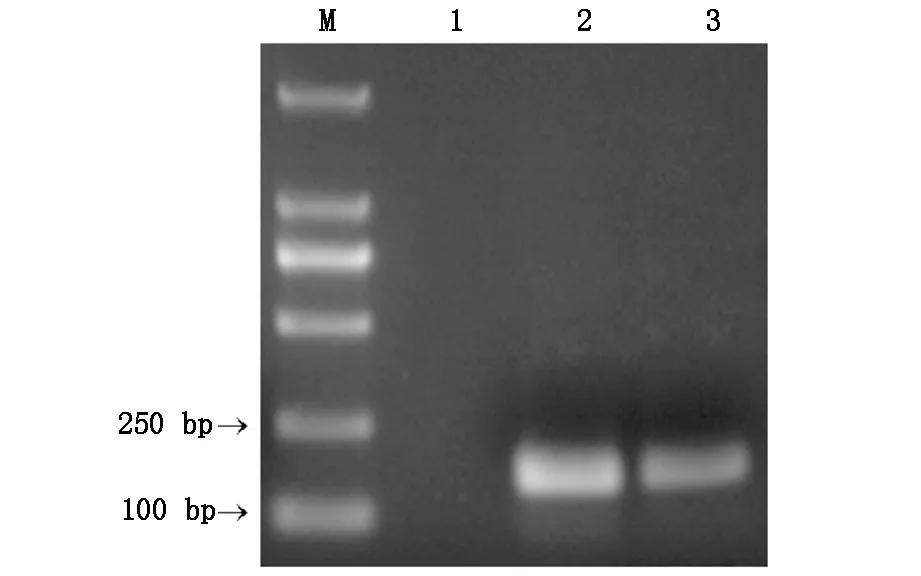
M;TaKaRa DL2000 Marker;1:阴性对照 2:β2-M(160 bp);3:GnRHR(167 bp).
图1 CAL-27细胞GnRHR与内参基因PCR电泳图
2.2 Western Blot检测结果
结果显示在60kDa处出现特异性反应条带,与其他文献所报道的GnRHR蛋白大小一致,表明舌癌CAL-27细胞株存在GnRHR。见图2。
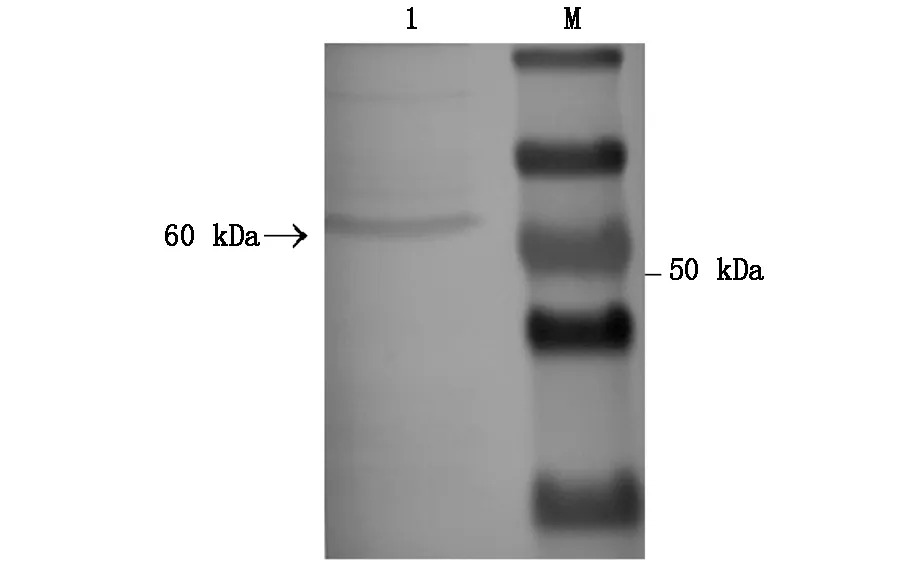
M:Protein Marker;1:CAL-27细胞蛋白
2.3 细胞增殖-毒性检测结果
实验中使用不同浓度的曲普瑞林(10、20、40、80μg/ml)处理CAL-27细胞48小时后使用CCK-8试剂盒检测细胞存活率来观察曲普瑞林对CAL-27细胞的增殖抑制作用,结果显示随曲普瑞林浓度增加,细胞存活率显著降低 (F=11.535,P<0.001),分别为(96.92±2.15)%、(93.03±2.35)%、(91.77±2.76)%、(88.62±2.39)%。10 μg/ml组与对照组相比较存活率差异无显著性(P=0.128),20、40、80 μg/ml组与对照组比较差异均具有极显著性(P<0.01)。见图3。
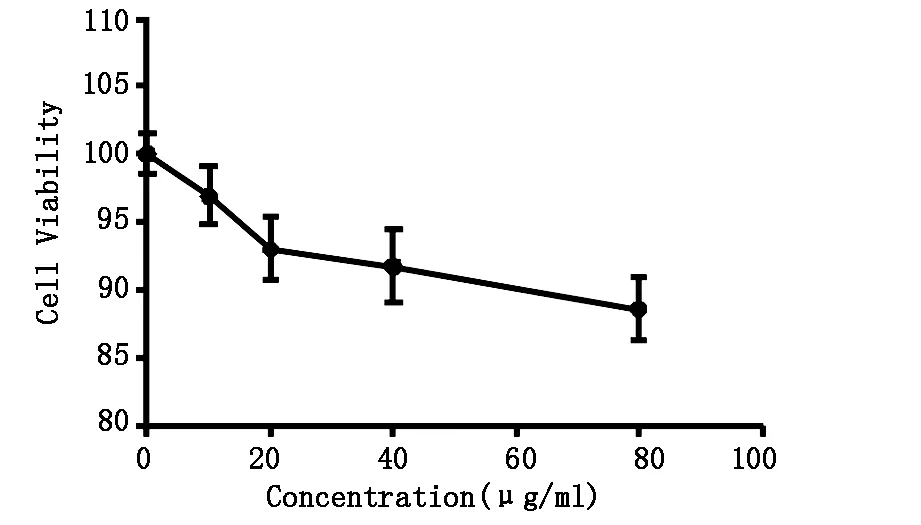
图3 曲普瑞林处理CAL-27细胞48小时后的存活率
3 讨论
近二三十年,得益于癌症基因组学的发展,使癌症靶向性治疗成为可能。例如伊马替尼可以特异性作用于BCR-ABL酪氨酸激酶,使其对慢性粒细胞白血病有较好的疗效[14]。再如曲妥珠单抗特异性作用于HER2高表达的乳腺癌细胞,阻断HER2相关信号通路,使其成为目前HER2阳性乳腺癌患者主要靶向治疗药物[15]。GnRH激动剂亦是一种靶向性药物,目前已有曲普瑞林、戈舍瑞林、亮丙瑞林应用于临床治疗前列腺癌、乳腺癌、子宫肌瘤、子宫内膜异位以及多种性激素相关疾病。曲普瑞林的氨基酸序列与I型促性腺激素释放激素相比较,其第六位由色氨酸代替了天然序列中的甘氨酸。在人体内,由于血清蛋白酶的裂解作用,GnRH-I的半衰期只有2-5分钟,而包括曲普瑞林在内的一系列的GnRH激动剂都延长了半衰期并提高了与受体的结合力[16]。在对于前列腺癌的治疗中,曲普瑞林是一线激素治疗药物,在临床应用中,对于晚期前列腺癌患者具有较好的疗效和安全性[17]。本研究结果显示人舌鳞状细胞癌CAL-27细胞表面存在GnRHR,在人口腔癌细胞或组织中发现GnRHR的存在在国内外尚属首次。研究显示,GnRHR在肿瘤组织中表达量很少[18],本研究发现曲普瑞林对CAL-27细胞的抑制作用呈剂量依赖性关系,这可能与GnRH与其受体的高亲和力有关。在垂体外肿瘤组织中,GnRH及其受体构成了自分泌、负调控系统,使得其具有抗癌活性[19]。这一发现使得学者们对GnRH所介导的细胞内信号转导通路产生浓厚兴趣。Patrizia Limonta等人的研究发现,与垂体内GnRH的信号通路不同,GnRH-I激动剂不会影响PLC介导的磷脂酰肌醇代谢或细胞内Ca2+水平。GnRH及其类似物与受体结合后,激活酪氨酸磷酸酶使癌细胞表皮生长因子受体去磷酸化[20]。目前我们尚不清楚GnRH及其类似物对口腔癌的抑制作用是否与此相关,未来我们将对此问题进行深入探讨。本研究对解释体内激素水平影响肿瘤组织的生长状态有重要意义,这将有助于提升口腔癌的预后维护以及临床新药开发。
[1]Nemoto RP,Victorino AA,Pessoa GB,et al.Oral cancer preventive campaigns:are we reaching the real target? [J].Braz J Otorhinolaryngol,2015,81(1):44.
[2]Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137.
[3]Leemans CR,Braakhuis BJ,Brakenhoff RH.The molecular biology of head and neck cancer[J].Nature Reviews Cancer,2011,11(1):9.
[4]肖 燕,张沛沛,李文鹿,等.口腔癌患者健康相关生活质量及其影响因素调查[J].口腔医学研究,2016,32 (5):478.
[5]Bliss SP,Navratil AM,Xie JJ,et al.GnRH signaling,the gonadotrope and endocrine control of fertility[J].Front Neuroendocrinol,2010,31(3):322.
[6]Cheng JC,Klausen C,Leung PC.Overexpression of wild-type but not C134W mutant FOXL2 enhances GnRH-induced cell apoptosis by increasing GnRH receptor expression in human granulosa cell tumors[J].PLoS One,2013;8(1):e55099.
[7]Feng Z,Wen H,Bi R,et al.A clinically applicable molecular classification for high-grade serous ovarian cancer based on hormone receptor expression[J].Scientific Reports,2016,6:25408.
[8]Pazaitou-Panayiotou K,Chemonidou C,Poupi A,et al.Gonadotropin-releasing hormone neuropeptides and receptor in human breast cancer:correlation to poor prognosis parameters[J].Peptides,2013,42:15.
[9]Jeon YT,Kim YB,Park SY,et al.Gonadotropin-releasing hormone receptor expression in endometrial cancer[J].International Journal of Gynecological Pathology,2009,28(1):19.
[10]Limonta P,Manea M.Gonadotropin-releasing hormone receptors as molecular therapeutic targets in prostate cancer:Current options and emerging strategies[J].Cancer Treatment Reviews,2013,39(6):647.
[11]Teng LH,Ahmad M.Gonadotropin-releasing hormone inhibits the proliferation and motility of nasopharyngeal carcinoma cells[J].Molecular Medicine Reports,2015,12(4):4909.
[12]Cheung LW,Wong AS.Gonadotropin-releasing hormone:GnRH receptor signaling in extrapituitary tissues[J].The FEBS Journal,2008,275(22):5479.
[13]Mingzhu Lu,Jing Zhu,Yang Ling,et al.The lower expression of gonadotropin-releasing hormone receptor associated with poor prognosis in gastric cancer[J].Int J Clin Exp Med,2015,8(8):13365.
[14]Afghahi A,Sledge GW Jr.Targeted Therapy for Cancer in the Genomic Era[J].Cancer J,2015,21(4):294.
[15]李 伟,潘 燕,李学军.HER 2 阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J].中国临床药理学杂志,2014,(171):48.
[16]Weckermann D,Harzmann R.Hormone Therapy in Prostate Cancer:LHRH Antagonists versus LHRH Analogues[J].European Urology,2004(46):279.
[17]Merseburger AS,Hupe MC.Update on Triptorelin:Current Thinking on Androgen Deprivation Therapy for Prostate Cancer[J].Adv Ther,2016,(33):1072.
[18]Aguilar-Rojas A,Huerta-Reyes M.Human gonadotropin-releasing hormone receptor-activated cellular functions and signaling pathways in extra-pituitary tissues and cancer cells[J].Oncol Rep,2009,(22):981.
[19]Saleh-Abady MM,Naderi-Manesh H,Alizadeh A,et al.Anticancer activity of a new gonadotropin releasing hormone analogue[J].Biopolymers,2010,94(3):292.
[20]Limonta P,Moretti RM,Montagnani Marelli M,et al.The biology of gonadotropin hormone-releasing hormone:role in the control of tumor growth and progression in humans[J].Front Neuroendocrinol,2003,24(4):279.
The expression of GnRHR on CAL-27 cells and the inhibitory effect of Triptorelin on the proliferation of CAL-27 cells in vitro
LIJian,WEIHong-tao,ZHANGGuo-li,etal.
(China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
Objective To investigate the antiproliferation effect of GnRH-I analogue Triptorelin on human tongue squamous cell carcinoma cell line CAL-27 in vitro.Methods RT-PCR method was used for detection of gonadotropin releasing hormone receptor (GnRHR) mRNA in CAL-27 cell line.Western blot was employed to detect the expression of GnRH receptor on CAL-27 cells.CAL-27 cells were treated with different concentrations of Triptorelin for 48 hours and then OD450 was detected using CCK-8 assay to calculate the cell viability.Results The result of RT-PCR showed that CAL-27 cells have GnRHR mRNA.Western Blotting has showed that the protein samples of CAL-27 cells have specific reaction at approximately 60 kDa.CCK-8 detection showed a significant decrease in cell viability rate with the increase of concentration of Triptorelin (P<0.01).Conclusion CAL-27 cell line has the gene and protein expression of GnRH receptor .Our results demonstrate that Triptorelin has inhibitory effect on CAL-27 cells.
Triptorelin;Gonadotropin-releasing hormone receptor;Tongue cancer
吉林省自然科学基金(20160101095JC)
1007-4287(2017)03-0475-04
R739.86
A
2016-07-06)
*通讯作者
