某规模化育肥猪场呼吸道疾病的诊断与防控
2017-03-13山东农业大学动物科技学院陈同煜王玉超古金元胡东方刘思当秦四海
■文/山东农业大学动物科技学院 陈同煜 彭 涛 王玉超 古金元 胡东方 刘思当 秦四海
某规模化育肥猪场呼吸道疾病的诊断与防控
■文/山东农业大学动物科技学院 陈同煜 彭 涛 王玉超 古金元 胡东方 刘思当 秦四海
冬季作为猪呼吸道疾病的高发季节,大小猪场尤其是猪舍条件简陋或经长途运输的猪群患呼吸道疾病的风险显著增加。山东某规模化育肥猪场通过长途运输购进某种猪公司60日龄左右的仔猪1,000多头,进场1周猪群即出现咳嗽、气喘、发热并伴有腹泻症状,发病率20%,病死率10%,是一起传播迅速的急性呼吸道疾病。通过病死猪剖检诊断、细菌分离鉴定、组织病理学检查、ELISA试验和分子生物学检测,确诊为一场由应激继发的呼吸道细菌感染,并导致猪群对重要病毒病抵抗力下降,通过药敏试验选择敏感药物,对猪群实施了科学的药物防治并对相关病毒性疾病进行了免疫,使该猪场疫情得以迅速控制,挽回了巨大的经济损失。
猪;呼吸道疾病;诊断;防控
猪呼吸道疾病是危害猪场稳定生产的首要疾病,因其致病因素复杂,涉及细菌、病毒、支原体、寄生虫、不良的环境及饲养管理等,往往难究其根源,因此称其为呼吸道疾病综合征(PRDC)。随着疫苗制品的质量提高和养殖户免疫意识的增强,猪场病毒性疾病的防控显著改善,但却轻视了细菌性疾病对猪呼吸道的危害。近年来猪场PRDC频发,尤其是许多中小规模猪场或散养户由于引种或外购仔猪育肥使该病的发生风险显著增加,多数猪场在购猪1月内即出现不同程度的疫情。通过多起病例检测发现,在危害猪呼吸道的细菌性疾病中,支原体、副猪嗜血杆菌、传染性胸膜肺炎放线杆菌以及巴氏杆菌占据了主导位置,该类病菌通常条件下不会出现大规模暴发,以隐性感染居多,在冷热交替、气候突变、长途运输或饲料改变等应激诱发状态下易引起PRDC流行,常混发或并发病毒性疾病,使病情复杂化。下面介绍一起规模化专业育肥猪场呼吸道疫情的诊断与防治,为猪场呼吸道疾病的诊断防控提供参考借鉴。
1 背景
山东省某规模化专业育肥猪场于2016年12月1日远距离引进某种猪公司1,600头20~30kg保育猪育肥,进场1周后猪群即出现部分仔猪发烧(39.5~40.5℃)、咳嗽、气喘,并有腹泻病症,有的病猪表现耳朵发绀、被毛粗乱、消瘦症状,以呼吸道病症最为明显,短时间内发病率高达20%,死亡率10%,仔猪前期免疫程序不明,发病后经紧急投服氟苯尼考、阿莫西林及中药,效果不佳,遂前来就诊。
2 综合诊断
2.1 病猪临床检查
送检病猪主要表现咳嗽、气喘,呈明显腹式呼吸,体表被毛粗乱、精神沉郁、瘦弱、耳朵发绀等症状。
2.2 病猪剖检病变
下颌及肺门淋巴结肿大出血,腹股沟及肠系膜淋巴结显著肿大(图1-A);肺脏硬实暗红色肿胀,小叶间质水肿增宽,有的被膜附有纤维蛋白渗出物(图1-B);有的发生纤维素性心包炎,心脏呈“绒毛心”样变(图1-C);胸腔、腹腔积液(图1-D、E);肝脏淤血并附有纤维素;有的病猪结肠黏膜出血、溃疡(图1-F)。
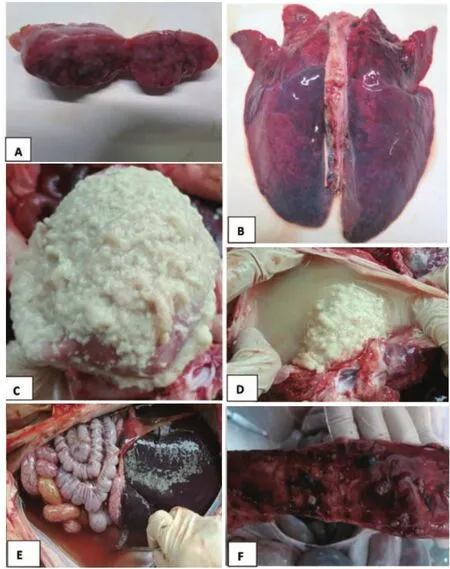
图1 病猪剖检病变
2.3 组织病理学病变
对剖检猪的淋巴结、脾脏、肾脏、心脏、肺脏、脑组织采样,10%中性福尔马林溶液固定,常规方法制作石蜡切片,H.E染色,镜检。可见淋巴结毛细血管充血、浆液渗出,呈浆液性淋巴结炎病变(图2-A);脾脏充血、出血,呈败血脾病变(图2-B);肺间质充血,肺泡内大量浆液、纤维素渗出,呈大叶性肺炎病变(图2-C);肾间质淤血、肾小管上皮细胞变性坏死(图2-D);心肌纤维呈现空泡变性(图2-E);脑血管充血,神经元空泡变性、坏死(图2-F)。
2.4 病原学和血清学检查
因该场猪群发病率和死亡率均较高,首先怀疑是否有蓝耳病野毒感染,除对病死猪剖检,采集脑、脾脏、肝脏、肾脏、淋巴结及扁桃体组织液氮保存,同时随机采集发病猪群血清18份,离心,-20℃备存。将冻存于液氮中的组织病料解冻后取适量组织加入灭菌PBS液并研磨成匀浆,9,000rpm离心4min,取上清液,同时分成18份血清,每份吸出20μL折合1份样品,使用北京全式金EasyPure Viral DNA/RNA kit(批号为K10314)提取病毒核酸。根据GenBank中公布的序列设计猪蓝耳病病毒片段为372bp的特异性引物,用PCR/RT-PCR方法扩增,将扩增产物在1.5%的琼脂糖凝胶中电泳,紫外凝胶成像仪下据条带位置判定病猪的病原感染状况。
使用韩国金诺试剂盒对备存血清进行猪瘟、蓝耳病、伪狂犬病毒gE、2型圆环病毒抗体水平检测,4种病毒检测均按照说明书步骤严格规范操作。判定标准及检测结果如下:
猪瘟病毒(CSFV):阻断率≥40%为阳性;阻断率<40%为阴性。
猪蓝耳病病毒(PRRSV):S/P值≥0.40为阳性;S/P<值0.40为阴性。
猪伪狂犬病病毒gE(PRV gE):S/ N≤0.6为阳性;S/N>0.6为阴性。
猪2型圆环病毒(PCV 2):S/ P≥0.4为阳性;S/P<0.3为阴性,之间为可疑。
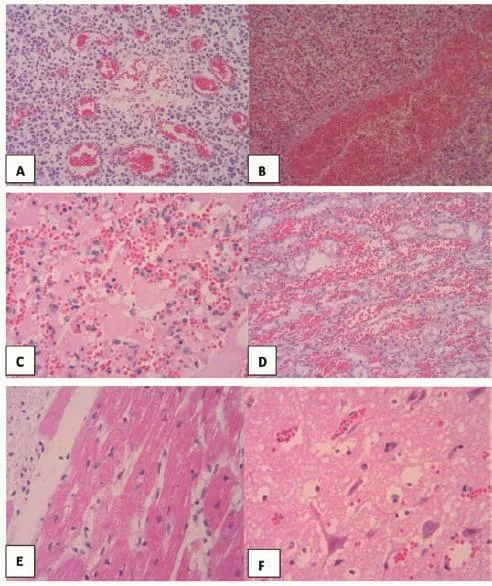
图2 病猪组织病理学变化
图3 1.5%琼脂糖凝胶电泳
由表1可知:部分猪只猪瘟抗体检测阴性,且均匀度较差,猪瘟免疫状态较差,发病风险较大。蓝耳抗体全部阳性,离散度较大,猪群蓝耳病病毒活跃,存在发病风险。伪狂犬gE抗体阳性率较高,虽病猪未表现神经症状,但严重的呼吸道病症与之不无关系。2型圆环病毒抗体几乎全部阳性,由于该猪群免疫过一次圆环病毒疫苗,鉴于发病猪腹股沟及肠系膜淋巴结显著肿大,不能排除猪群存在圆环病毒感染,导致猪只体质下降,从而促进呼吸道疾病的发生。
2.5 细菌分离鉴定及药物敏感试验
采集不同病猪肺组织分别划线接种于含新生牛血清(终浓度10%)和NAD(终浓度20g/mL)的TSA培养基及鲜血琼脂平板上,37℃培养24~48h后TSA培养基可见针尖大小,无色透明,光滑湿润的菌落形态,鲜血琼脂平板可见淡灰色、圆形、湿润、露珠样小菌落。革兰氏染色镜检,观察到TSA培养基菌体呈革兰氏阴性细小杆菌,有多种不同形态,从单个球杆菌到细丝杆菌不等(图4);鲜血琼脂平板菌体为革兰氏阴性短杆菌或球杆菌,散在或成双(图5)。初步诊断疑似副猪嗜血杆菌(HPS)与巴氏杆菌(PM)混合感染。同时,挑取细小单菌落接种于含新生牛血清(终浓度10%)和NAD(终浓度20g/mL)的TSB液体培养基中进行增菌,37℃,12h后挑取菌液进行副猪嗜血杆菌(HPS)和巴氏杆菌(PM)特异性PCR鉴定。
分别挑取两种细菌及培养基其他形态菌落均匀涂布于新鲜血琼脂平板上,选取头孢噻呋钠、强力霉素、氟苯尼考、嗯喏沙星、阿莫西林、庆大霉素、丁胺卡那霉素、磺胺间甲氧嘧啶8类药敏片,每片药物含量10μg。无菌镊子将药敏片按一定间隔分别平贴于培养基表面,于37℃CO2培养箱中培养24h。根据抑菌圈直径(Ø)判定细菌对药物的敏感程度,判定标准为:Ø≥25mm为极度敏感;15mm≤Ø<25mm为高度敏感;10mm≤Ø<15mm为中度敏感;Ø<10mm为低度敏感;无抑菌圈则为耐药。结果显示:头孢噻呋钠、丁胺卡那霉素极度敏感,恩诺沙星、磺胺间甲氧嘧啶高度敏感,阿莫西林、庆大霉素、强力霉素、氟苯尼考低度敏感。
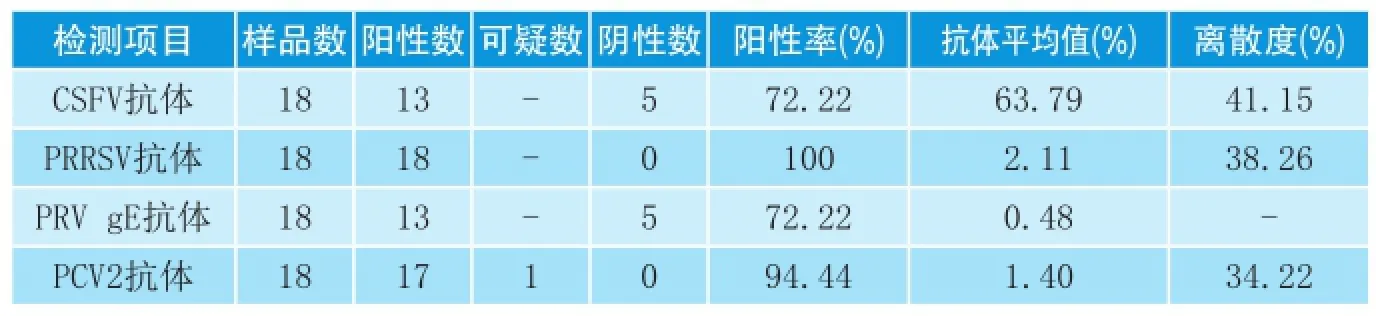
表1 4种病毒血清抗体检测结果
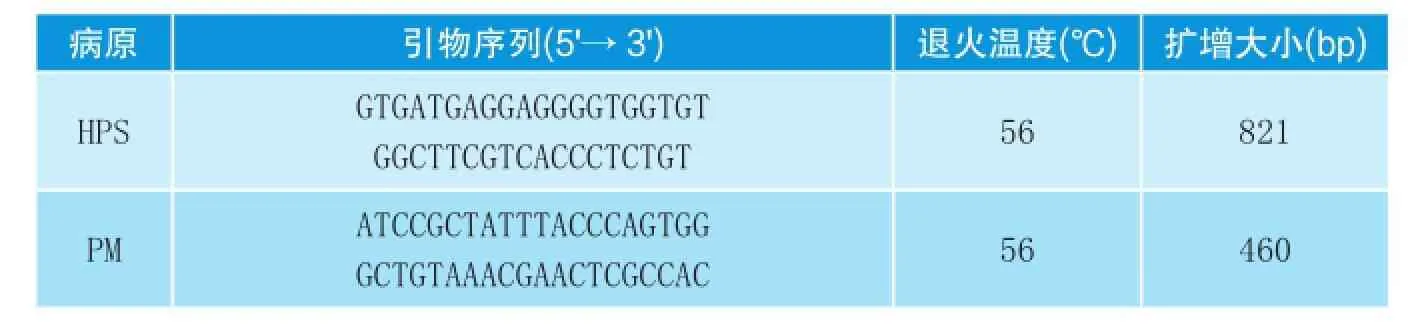
表2 PCR/RT-PCR引物序列

图4 分离菌株革兰氏染色 200X
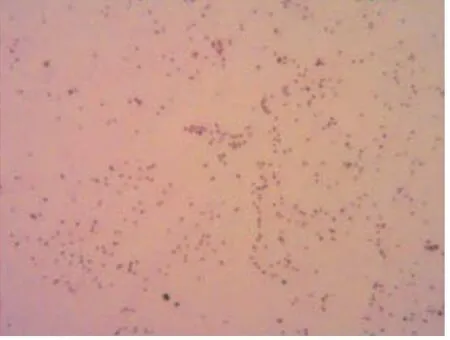
图5 分离菌株革兰氏染色 200X
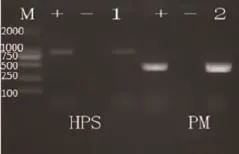
图6 1.5%琼脂糖凝胶电泳
3 疾病诊断
综合分析实验室检测结果,导致本次疫情的主要原因是长途运输应激所诱发的以副猪嗜血杆菌和巴氏杆菌为主的细菌急性感染所导致的以大叶性肺炎为主要病变特征的重症PRDC,且不排除支原体、传染性胸膜肺炎放线杆菌及魏氏梭菌的参与。另外,冬季寒冷、猪舍饲养密度大、通风不良也是引发本次疫情的重要原因。因猪群运输应激并造成了呼吸道细菌病的暴发,进而造成对蓝耳病、猪瘟、伪狂犬病免疫抵抗力下降,猪群存在暴发上述疫病的巨大风险。
4 防控
结合该猪场流行病学、病原学、血清学及药敏试验结果,制定以下治疗方案:
4.1 隔离病猪
及时挑离发病猪只,单独隔离饲养,切断传染源;严控不同圈舍饲养人员和外来人员交互串访,切断传播媒介。
4.2 卫生消毒
选用刺激性较小的过氧化剂类消毒液全群紧急消毒,包括猪舍所有空间,疫情期间育肥舍和病猪隔离舍每日消毒一次。
4.3 改善饲养环境
降低圈舍饲养密度,加强猪舍御寒保暖,及时清理粪污和经常通风,保持圈舍清洁干燥及空气新鲜。
4.4 药物防治与疫苗加强免疫
4.4.1 对发病猪只应用头孢噻呋钠针剂,5mg/kg体重,肌肉注射,1次/d,连用5d。
4.4.2 全群用包被恩诺沙星和硫酸新霉素20g/100kg饲料,拌料,发病猪用量加倍,连用5d。
4.4.3 全群电解质、维生素C或黄芪多糖饮水,增强猪只抵抗力,减少应激反应。
4.4.4 待疫情稳定后,全群普免1次高效猪瘟细胞疫苗,间隔1周普免伪狂犬弱毒疫苗,以平衡猪群抗体均匀度,减少隐性感染猪只的排毒和临床症状。
经过实施以上防治措施,该猪场疫情得到有效控制,短时间内恢复稳定生产。■
