垂体促性腺激素瘤导致的卵巢过度刺激综合征
2017-02-06王姝,邓姗
·临床病例讨论·
垂体促性腺激素瘤导致的卵巢过度刺激综合征
排卵功能障碍是常见的异常子宫出血原因,涉及下丘脑-垂体-卵巢轴的调控。性激素六项和盆腔超声是必要的检查项目,由此可以识别卵巢过度刺激综合征。而非孕期的卵巢过度刺激综合征应想到无功能垂体腺瘤的可能,切除垂体腺瘤方能根本解决性腺轴异常问题,而单纯卵巢手术和药物治疗都难以达到满意疗效。
卵巢过度刺激综合征; 垂体促性腺激素瘤
病例梁*,女,37岁。以“月经紊乱3年余,发现鞍区占位1月”为主诉住院。
2012年8月无明显诱因出现月经紊乱。同年12月行诊刮术后一度月经恢复正常。2014年2月患者再次出现月经紊乱,超声提示右卵巢多囊样改变。2015年1月因经期可延长至30 d于当地医院复查超声提示右附件区5.8 cm×6.2 cm×3.1 cm囊性占位,2月后复查超声提示盆腔囊性占位大小约10.9 cm×9.0 cm×7.0 cm,形态欠规则,内为无回声伴数条带状分隔(图1),同期血清肿瘤标志物CEA、CA125、CA199均在正常范围内,盆腔MRI证示右侧盆腔囊实性占位。2015年3月26日行腹腔镜双侧卵巢囊肿剔除术,术后病理提示“右卵巢滤泡囊肿伴黄素化,左卵巢滤泡囊肿”。术后1月余无月经来潮,B超提示子宫右后方11.6 cm×10.9 cm×8.3 cm无回声。予地屈孕酮10 mg bid×7 d撤退性出血并接续妈富隆周期性用药调控月经,用药期间无异常出血。
2015年8月停药后再发经期延长、经量增多伴下腹胀痛,10月查黄体生成素(LH)2.58 U/L、卵泡刺激素(FSH)6.56 U/L、雌二醇(E2)1 892.77 pg/ml(6 946.47 pmol/L)、孕酮(P)1.04 ng/ml(3.31 nmol/L)、睾酮(T)0.29 ng/ml(1.00 nmol/L)、泌乳素(PRL)71.66 ng/ml(3.26 nmol/L);β-HCG正常。甲状腺功能检测:促甲状腺激素(TSH)4.577 mIU/L,游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)均正常。2015年10月28日垂体MRI:垂体2.3 cm×1.4 cm占位,左侧海绵窦区局部包绕,Knosp 3级,考虑“垂体无功能腺瘤”(图2)。予达菲林肌注1次,当晚月经来潮,至11月7日止。
2015年11月本次月经周期第9、13、20天外院查:LH 3.50、4.13、4.12 U/L;FSH 9.20、9.36、9.45 U/L;E217 520.98、>5 099.83、>5 099.83 pmol/L;P 9.98、16.06、22.07 nmol/L;T(-);PRL 3.24、4.14、3.89 nmol/L;血IGF(8am)及GH正常。2015年11月25日超声提示子宫右后方15.3 cm×10.3 cm×9.6 cm无回声,内见多条条带样分隔。
2015年11月27日转来我院复查:LH 3.09 U/L、FSH 14.03 U/L、E28 7419.40 pmol/L、P 16.85 nmol/L、T 1.08 nmol/L、PRL 4.41 nmol/L。生长抑素受体显像(-)。后入院系统检查治疗。
患者2015年12月11日于神经外科行经鼻蝶入路垂体腺瘤切除术。术后病理:(鞍区肿瘤)垂体腺瘤;(瘤周垂体)垂体前叶组织;免疫组化结果显示: ACTH(-), FSH(+), GH(+), Ki-67(index 1%), LH(+), P53(-), PRL(-), TSH(-)。
患者术后第1天月经来潮。复查性激素水平变化:(1)术后24 h:LH<0.2 U/L、FSH 0.68 U/L、E22 690.11 pmol/L、P 2.07 nmol/L、T 0.65 nmol/L;PRL 0.30 nmol/L。(2)术后10 d:LH 0.73 U/L、FSH 3.50 U/L、E240.37 pmol/L、P 2.54 nmol/L、T 0.56 nmol/L;PRL 0.59 nmol/L。(3)2016年3月复查:LH 4.54 U/L、FSH 6.81 U/L、E2250.22 pmol/L、P 1.24 nmol/L、T 0.76 nmol/L;PRL 0.25 nmol/L(激素水平变化见图3);超声盆腔未见明显包块。患者月经正常来潮。
病例警示
一、病例概要分析
本例患者因“腹痛、月经紊乱”发现双侧卵巢显著增大伴多房囊肿和显著的高雌激素血症,类似辅助生育技术中超促排卵引起的卵巢过度刺激征(OHSS)。以“卵巢多房囊实性包块”行腹腔镜检查,术后病理为“卵巢滤泡囊肿伴黄素化”,而术后双侧卵巢囊肿复发并持续增大(图1)。激素测定中FSH和LH水平并无明显升高,E2水平显著升高;泌乳素水平轻度升高。为寻找卵巢过度刺激的来源,行头颅MRI发现垂体大腺瘤(图2),手术切除后OHSS相关症状消退,E2和PRL均降至正常(激素变化曲线见图3),患者月经亦恢复正常,病理亦证实为垂体促性腺激素(Gn)瘤。
由垂体促性腺激素瘤引起的OHSS相对少见,值得了解和思考。
二、垂体促性腺激素瘤的临床特点和诊治要点
垂体促性腺激素瘤约占垂体瘤15%~40%,占临床无功能垂体腺瘤的80%以上,约占大腺瘤的一半。大多数垂体促性腺激素瘤患者没有自觉症状,直至大腺瘤增大到一定程度产生颅内压迫症状,如视力受损、头痛等。实验室检查中,大多数患者血清FSH值在正常范围或仅轻微高于育龄女性正常值上限,即如本例所示。约35%促性腺激素瘤分泌LH/FSH而使血清中促性腺激素水平升高,但这些患者也少有出现相关的临床症状。绝经后女性常见,而由于此时绝大多数卵泡已闭锁,因而对FSH刺激不敏感[1-2]。因此,对于围绝经期或绝经后女性,垂体促性腺激素瘤的诊断是相对困难的[3]。青春期女孩则可能出现乳房发育、阴道出血、腹胀等症状。
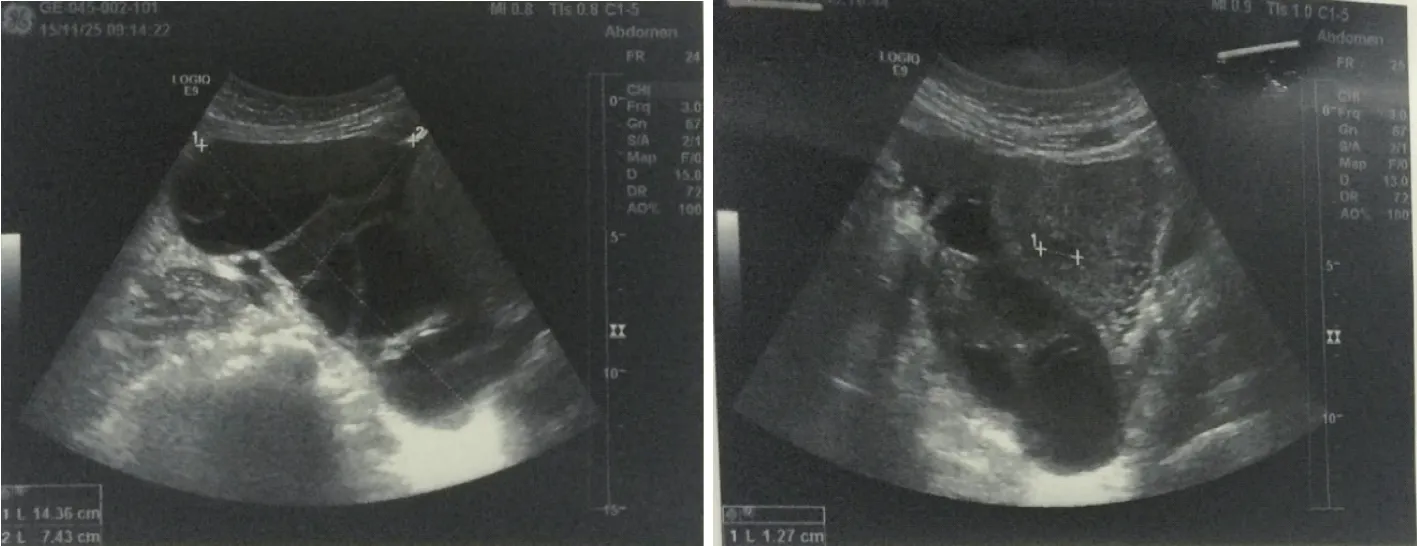
超声提示盆腔囊性占位大小约10.9 cm×9.0 cm×7.0 cm,形态欠规则,内为无回声伴数条带状分隔图1 盆腔超声所见

箭头示垂体2.3 cm×1.4 cm占位,左侧海绵窦区局部包绕,Knosp 3级图2 垂体MRI
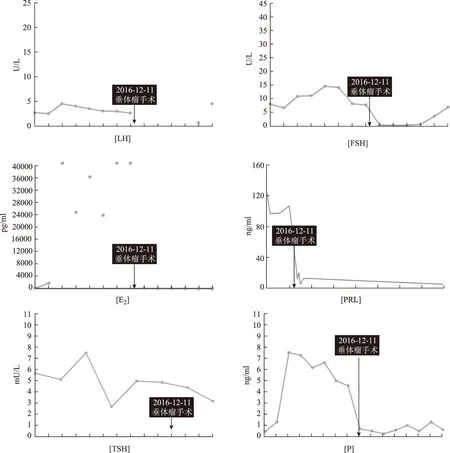
图中E2、P、PRL单位均为旧制图3 患者诊疗过程中FSH、LH、E2、P、PRL和TSH水平变化
FSH、LH及其亚单位检测有助于诊断,如LH和FSH亚单位位于正常上限,或FSH和LH比例失常,提示可能有垂体促性腺激素瘤。使用TRH(促甲状腺激素释放激素)刺激实验诱导生成这两种激素的a亚单位,可协助诊断。在正常人,注射TRH不会引起Gn或Gn亚单位分泌。但垂体促性腺激素瘤患者则可能被诱导升高70%[4]。70%~100%无功能腺瘤分泌游离亚单位,但通常不表现生物学活性[5]。本例患者因我院尚未开展FSH和LH亚单位检测项目,无相关直接证据。Kanaya等[3]报道的两例患者FSH值在正常范围或仅轻度升高,但LH水平异常降低至不可测。一例患者E2水平以6周为一周期波动显著,而第二例患者E2相对平稳,但FSH以6周为一周期发生波动。第一例患者自然受孕后发生严重的OHSS,孕9周时因为发生深静脉血栓而人工流产中止妊娠。人流后1月发现双侧卵巢明显增大,因可疑恶性肿瘤行腹腔镜检查+卵巢活检,病理显示卵巢组织水肿伴卵泡囊肿。术后监测发现E2以6周为周期波动。
最确切的治疗是手术切除垂体促性腺激素瘤。术后促性腺激素和E2水平可迅速降至正常,卵巢囊肿缩小直至消失,月经恢复规律,如本例所见,也与文献相符[5]。对于复发的垂体腺瘤,也可使用放疗。术后建议患者4~6个月复查,包括MRI和激素水平,同时评估是否发生垂体功能降低。如果垂体轴上任一激素水平缺乏,应开始激素替代治疗。
药物治疗一般是无效的。理论上讲,GnRH类似物(GnRHa)有可能降低FSH水平从而缓解OHSS,但事实上报道显示该治疗会引起FSH反跳[2, 6-11],有一例报道甚至在开始GnRHa治疗后,诱发患者出现OHSS[12]。有作者报道了3例药物治疗垂体促性腺激素瘤相关的OHSS,患者都表现为月经稀发、腹胀、增大多囊的卵巢。E2水平最高达6,755 pmol/L,PRL和FSH水平升高,LH降低。这3例患者均使用了多巴胺激动剂,其中2例还联合用了甲羟孕酮。卵巢大小和激素水平降至正常。但腺瘤继续增大最终接受手术切除,免疫组化染色2例LH阳性,1例FSH阳性[13-15]。
三、其它原因导致的OHSS
OHSS主要发生于辅助生育过程中,受外源性促性腺激素的影响,多个部分激活的窦卵泡产生了过度反应,多见于PCOS患者。也有报道OHSS与原发甲状腺功能低下有关,可能由TSH介导的FSH受体激活或TRH产物增加刺激促性腺激素释放有关。此外,双侧卵巢颗粒细胞瘤的患者[12]、46,XX部分型17羟化酶缺乏患者和细胞色素p450氧化还原酶缺乏[16-17]也可能发生OHSS。
(病例整理:北京协和医院妇产科 王姝 邓姗)
[1] Roberts JE, Spandorfer S, Fasouliotis SJ, et al.Spontaneous ovarian hyperstimulation caused by a follicle-stimulating hormone-secreting pituitary adenoma[J]. Fertil Steril,2005,83: 208-210.
[3] Kanaya M, Baba T, Kitajima Y, et al. Continuous follicle-stimulating hormone exposure from pituitary adenoma causes periodic follicle recruitment and atresia, which mimics ovarian hyperstimulation syndrome[J].Int J Womens Health,2012,4:427-431.
[4] Melmed S. The Pituitary[M]. 2nded. Malden: Blackwell science Inc, 2002:405-418.
[5] Chaidarun SS, Klibanski A.Gonadotropinomas[J]. Semin Reprod Med,2002, 20: 339-348.
[6] Murata Y, Ando H, Nagasaka T, et al. Successful pregnancy after bromocriptine therapy in an anovulatory woman complicated by follicle-stimulating hormone-producing plurihormonal pituitary microadenoma. J Clin Endocrinol Metab, 2003,88: 1988-1993.
[7] Christin-Maitre S, Rongières-Bertrand C, Kottler ML, et al. A spontaneous and severe hyperstimulation of the ovaries revealing a gonadotroph adenoma[J]. J Clin Endocrinol Metab, 1998, 83: 3450-3453.
[8] Maruyama T, Masuda H, Uchida H, et al. Follicle stimulating hormone-secreting pituitary microadenoma with fluctuating levels of ovarian hyperstimulation[J]. Obstet Gynecol, 2005, 105: 1215-1218.
[9] Kihara M, Sugita T, Nagai Y, et al. Ovarian hyperstimulation caused by gonadotroph cell adenoma: a case report and review of the literature[J]. Gynecol Endocrinol, 2006, 22: 110-113.
[10] Berezin M, Olchovsky D, Pines A, et al. Reduction of follicle-stimulating hormone (FSH) secretion in FSH-producing pituitary adenoma by bromocriptine[J]. J Clin Endocrinol Metab, 1984, 59: 1220-1223.
[11] Yamakita N, Komaki T, Murai T, et al. Reduction of plasma gonadotropin levels and pituitary tumor size by treatment with bromocriptine in a patient with gonadotropinoma[J]. Intern Med, 1999, 38: 266-271.
[12] Segal R, DePetrillo AD, Thomas G, et al. Clinical review of adult granulosa cell tumors of the ovary[J]. Gynecol Oncol, 1995, 56: 338-344.
[13] Castelbaum AJ, Bigdeli H, Post KD, et al. Exacerbation of ovarian hyperstimulation by leuprolide reveals a gonadotroph adenoma[J]. Fertil Steril, 2002, 78: 1311-1313.
[14] Knoepfelmacher M, Danilovic DL, Rosa Nasser RH, et al. Effectiveness of treating ovarian hyperstimulation syndrome with cabergoline in two patients with gonadotropin-producing pituitary adenomas[J]. Fertil Steril,2006, 86: e15-e18.
[15] Baba T, Endo T, Kitajima Y, et al. Spontaneous ovarian hyperstimulation syndrome and pituitary adenoma: incidental pregnancy triggers a catastrophic event[J]. Fertil Steril,2009,92:390.e1-3.
[16] Tian Q,Zhang Y,Lu Z. Partial 17alpha-hydroxylase/17,20-lyase deficiency-clinical report of five Chinese 46,XX cases[J].Gynecol Endocrinol, 2008, 24:362-367.
[17] 王春庆,杨佳欣,田秦杰.细胞色素p450氧化还原酶缺乏伴卵巢黄素化囊肿1例[J].生殖医学杂志,2014,23:325-327.
[编辑:罗宏志]
10.3969/j.issn.1004-3845.2017.01.013
