不同融合参数对小鼠圆形精子细胞与卵母细胞融合胚胎发育的影响
2017-02-06杨爱军于春娜牛焕付王雪楠刘树真魏泽锋郝翠芳
杨爱军,于春娜,牛焕付,王雪楠,刘树真,魏泽锋,郝翠芳
(1.青岛大学,青岛 266071; 2.济宁医学院附属医院生殖医学科,济宁 272029;3.山东师范大学生命科学学院,济南 250014)
·实验研究·
不同融合参数对小鼠圆形精子细胞与卵母细胞融合胚胎发育的影响
杨爱军1#,于春娜2#,牛焕付2,王雪楠2,刘树真3,魏泽锋2,郝翠芳1*
(1.青岛大学,青岛 266071; 2.济宁医学院附属医院生殖医学科,济宁 272029;3.山东师范大学生命科学学院,济南 250014)
目的 利用手工克隆 (handmade cloning, HMC) 技术对小鼠圆形精子细胞与去透明带卵母细胞进行电融合,以研究电融合参数对融合胚胎发育潜能的影响。 方法 选取549枚卵母细胞与圆形精子细胞融合,根据电融合参数分为三组:A组(n=186)采用电场强度60 V/mm、脉宽30 μs、脉冲次数为 2次的直流电脉冲;B组(n=188)采用电场强度80 V/mm、脉宽20 μs、脉冲次数为2次的直流电脉冲;C组(n=175)采用电场强度100 V/mm、脉宽10 μs、脉冲次数为2次的直流电脉冲。观察记录不同电融合参数下圆形精子细胞与无透明带卵母细胞的融合率、融合胚胎卵裂率以及囊胚形成率。 结果 (1)A组圆形精子细胞与去透明带卵母细胞的平均融合率为(84.87±3.84)%,与其他两组[(74.93±5.46)%、(73.60±5.48)%]相比平均融合率显著升高(P<0.05);(2)A组融合胚胎的平均卵裂率为(77.37±3.97)%,与B组、C组融合胚胎的卵裂率[(67.74±7.32)%、(66.17±9.87)%]相比显著升高(P<0.05);(3)A组的平均囊胚形成率为(41.28±6.50)%,显著高于C组[(31.03±6.09)%](P<0.05)。 结论 A组采用电场强度60 V/mm、脉宽30 μs、脉冲次数为2的直流电脉冲是圆形精子细胞与去透明带卵母细胞融合的最佳方案,有利于提高胚胎的发育潜能。
电融合参数; 圆形精子细胞; 去透明带卵母细胞
(JReprodMed2017,26(1):53-58)
手工克隆(HMC)技术是一种新的核移植技术,与SCNT技术相比,无需借助价格昂贵的显微操作仪器,简化了核移植程序,降低了医疗费用。Selokar等[4]利用HMC技术获得牛-水牛、水牛-水牛、山羊-水牛、大鼠-水牛胚胎,并且利用HMC技术已成功获得了牛[5]、马[6]以及猪[7]等几种家畜的克隆后代。由于去除了卵母细胞最外层的透明带,因此卵母细胞与圆形精子细胞的融合无需再借助于显微操作仪器, HMC技术方法简单,且能降低患者的治疗费用。在HMC技术中最关键的环节是圆形精子细胞与去透明带卵母细胞有效的电融合,可以通过选择电场强度和脉冲宽度两个重要的电融合参数来提高融合率[8]。本研究旨在寻求小鼠圆形精子细胞与去透明带卵母细胞融合的最适电压强度和脉冲宽度,以获得较高的融合率和囊胚形成率,提高融合胚胎的发育潜能,同时为男性原发性无精子症或非梗阻性无精子症患者的治疗提供参考方法。
材料与方法
一、材料
1. 实验动物:昆明白雌性及雄性小鼠(清洁级)均购买于山东大学新药评价中心(SCXK(鲁)20130009),雌性小鼠4~6周龄,雄性小鼠10周龄。饲养条件:温度为20~22℃,湿度为40%~60%,光照周期(白天光照12 h,夜间黑暗12 h)。自由饮水取食,饲料为小鼠生长饲料,购自北京华阜康生物科技股份有限公司。
2. 仪器和试剂:电融合仪CF-150B(BLS,匈牙利);体视显微镜K-400及倒置显微镜AE31(Motic,美国);培养箱MCO-15AC(SANYO,日本);胚胎聚集针DN-10(BLS,匈牙利);自制口吸管;孕马血清促性腺激素(PMSG)和HCG(宁波三生药业);KSOM培养液(Millipore,美国);牛血清白蛋白(BSA)(Roche,美国);其他试剂均购自美国Sigma公司。
3. 溶液配制:(1)CZB培养液:称取NaCl 477.0 mg,KCl 36.0 mg,KH2PO416.0 mg,MgSO4·7H2O 29.0 mg,NaHCO3211.0 mg,CaCl2·2H2O 25.0 mg,60%乳酸钠584.0 mg,丙酮酸钠3.0 mg,EDTA·Na24.1 mg,L-谷氨酰胺14.6 mg,青霉素6.0 mg,链霉素5.0 mg,葡萄糖110.0 mg,BSA 500 mg溶于100 ml三蒸水中,过滤除菌分装,-20℃冰箱内保存;(2)H-CZB:称取238.31 mg Hepes溶于100 mL CZB中;(3)酸性CZB溶液(pH 2.5):将10 μl的10 mol/L HCl加入1 ml CZB中;(4)SrCl2(100 mmol/L):2.666 g SrCl2·6H2O溶于98 ml三蒸水中。激活处理前用含L-谷氨酰胺CB的无钙CZB稀释得到浓度为10 mmol/L的工作液;(5)电融合液:甘露醇2 732.7 mg,MgSO4·7H2O 1.232 mg,CaCI2·2H2O 0.368 mg,BSA 50 mg,溶于50 ml三蒸水中过滤除菌分装,保存于4℃冰箱内;(6)植物凝集素(PHA)溶液(200 μg/ml):将1 mg PHA粉末溶于5 ml H-CZB,每个EP管分装200 μl,-20℃保存。
二、研究方法
1. WOW培养皿的制作:用无菌的胚胎聚集针在60 mm培养皿上压制小凹,每排5个小凹相邻,用预平衡的KSOM培养液覆盖小凹,覆盖石蜡油,放入37℃、5% CO2培养箱内过夜平衡。
2.圆形精子细胞准备:圆形精子细胞的准备参照Ogura等[9]的方法:采用颈椎脱臼法处死昆明白雄鼠,取出一侧睾丸将被膜剥离,用两个1 ml无菌注射器将曲细精管划碎,置Hepes-CZB中离心2次 (1 000 r/min, 5 min/次), 最后用生理盐水重悬沉淀物。在显微镜下可看到圆形精子细胞中央有明显的球形区(染色质团构成的轮廓),体积比其它生精细胞小(直径约为10 μm),因此在显微镜下可根据其大小与其他生精细胞区分开来。
每一个心理学派的心理隐喻都存在着巨大的差异,这些差异使得心理治疗模式得到不断的改善。从第一个心理学治疗模式——经典精神分析模式开始,就开启了人们对于心理治疗的探究里程,直至目前的后现代心理治疗,中间经历了不断的变革、更改,这些心理治疗模式的差异也暗示了人类社会地位、生活环境在不断改变。为了帮助人们对心理治疗理论及方法具有更深层次的理解,提高对心理治疗的关注程度,笔者对心理隐喻的变迁进行调查分析,总结了心理学发展研究的特点,并对其精华进行分析总结,以便运用至我国心理治疗中。
3.卵母细胞激活:选择发情间期的昆明白雌鼠每只腹腔注射10 U的PMSG,48 h后每只注射10 U的HCG,于13~14 h后用颈椎脱臼法处死小鼠,在无菌条件下取出输卵管壶腹部,放入H-CZB中,用无菌注射针刺破输卵管壶腹部,将取出的卵丘卵母细胞复合体放入0.1%透明质酸酶中消化1 min,以便脱去颗粒细胞,共取得549枚卵母细胞,然后将卵母细胞在H-CZB溶液中清洗5次,移入融合液中放置1~2 min。每5个卵母细胞一组,施以120 V/mm,10 μs×1的直流电脉冲激活卵母细胞,将激活后的卵母细胞在H-CZB溶液中清洗5次后,移入CZB培养液中培养1 h。
4.卵母细胞透明带去除:激活的卵母细胞在CZB培养液中培养1 h后,移入酸性H-CZB中,观察到卵母细胞透明带去除时,将卵母细胞移到H-CZB溶液中清洗5次。
5.电融合及分组:将去透明带卵母细胞和圆形精子细胞加入到PHA中,用玻璃针将卵母细胞推到圆形精子细胞上,粘附形成卵母细胞-圆形精子细胞对,将卵母细胞-圆形精子细胞对在融合液中清洗3次,然后在融合液中平衡1~2 min,把圆形精子细胞-卵母细胞对放入充满融合液的融合槽中,使两者的切面与电流方向垂直,根据融合参数不同,分为A、B、C三组:施加电场强度分别为60 V/mm、80 V/mm、100 V/mm,脉冲宽度分别为30 μs、20 μs、10 μs,脉冲次数为2的直流电脉冲。每组试验重复7次,计算7次实验的平均值。
每次试验颈椎脱臼法处死2~3只昆明白小鼠,每次获卵数是20枚或者30枚左右,A、B、C三组总获卵数分别为186枚、188枚和175枚。融合后的卵放入KSOM中洗3遍,然后移入覆盖KSOM培养液的培养皿中,置于37℃、5% CO2培养箱内,15~20 min后观察融合情况,统计融合率。
6.融合胚胎的激活:将融合后的胚胎移入10 mmol/L SrCl2内激活3 h,将激活后的融合胚胎移入覆盖石蜡油的KSOM小凹培养皿(图1)中,置于37℃、5% CO2培养箱内培养。
7.观察指标:每24 h观察胚胎的发育情况,详细记录卵裂胚胎的数目和形成囊胚的数目,统计卵裂率和囊胚形成率。

图1 WOW培养皿培养的融合胚胎(100×)
三、统计分析

结 果
一、不同融合参数下各组的融合胚胎融合率、卵裂率及囊胚形成率比较
A、B、C三组试验共获取549枚卵母细胞。其中,A组(n=186)在电场强度为60 V/mm、脉冲宽度为30 μs、脉冲次数为2的电融合参数下,有158枚卵母细胞与圆形精子细胞发生融合、122枚融合胚胎发生卵裂、65枚胚胎发育至囊胚;B组(n=188)在电场强度为80 V/mm、脉冲宽度为20 μs、脉冲次数为2的电融合参数下,有142枚卵母细胞与圆形精子细胞发生融合、98枚融合胚胎发生卵裂、60枚胚胎发育至囊胚;C组(n=175)在电场强度为100 V/mm、脉冲宽度为10 μs、脉冲次数为2的电融合参数下,有130枚卵母细胞与圆形精子细胞发生融合、87枚融合胚胎发生卵裂、42枚胚胎发育至囊胚;A组的平均胚胎融合率、卵裂率均高于B、C组,差异有统计学意义(P<0.05);A组的囊胚形成率显著高于C组,差异有统计学意义(P<0.05)(表1)。
表1 不同参数下各组融合胚胎融合率、卵裂率及囊胚形成率比较(%)

组别作用卵数融合率卵裂率囊胚形成率A组1868487±3847737±3974128±650B组1887493±546∗6774±732∗3475±524C组1757360±548∗6617±987∗3103±609∗
注:数值是实验重复7次的均数结果;与A组相比,*P<0.05
二、圆形精子细胞与卵母细胞融合中的胚胎发育形态
圆形精子细胞(图2A)与激活的无透明带卵母细胞(图2C)融合后,卵子恢复减数分裂,释放第二极体,随后圆形精子细胞染色质去浓缩,形成雄原核,卵子的染色体转变成为雌原核,一般授精后16~18 h评估原核,最晚不超过20 h,雌雄原核相互靠近(图2D),核膜破裂,双方的遗传物质混合,启动有丝分裂。在受精24 h后进行第一次卵裂,形成2-细胞,之后每间隔约12 h进行一次卵裂,分别形成4-细胞、8-细胞(图2E)。在卵裂至16细胞期时,发生致密化(compaction),致密化发生后胚胎细胞开始具有极性,内部细胞和外部细胞之间发生了很大的变化,胚胎发育到桑椹胚时,大约具32个细胞。以后胚胎的外部细胞开始分泌液体,逐渐出现胚泡腔,标志着囊胚(图2F)的形成(图2)。
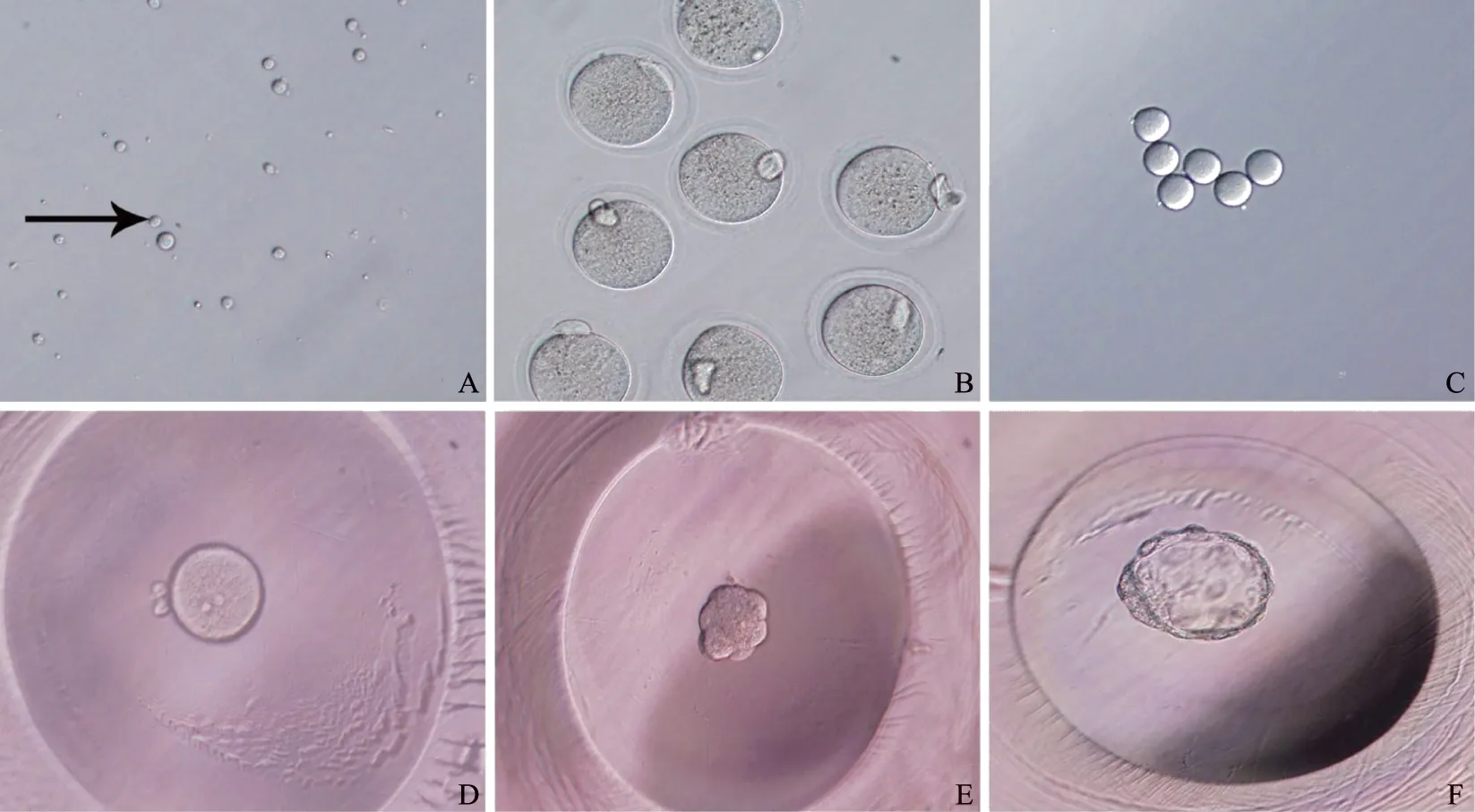
A:圆形精子细胞(箭头所示)(40×);B:激活的MII期卵母细胞(20×);C:激活的无透明带卵母细胞(10×);D:融合胚胎出现雌雄原核(20×);E:融合胚胎发育至8-细胞(10×);F:融合胚胎发育至囊胚(20×)图2 小鼠圆形精子细胞与去透明带卵母细胞融合胚胎的发育
讨 论
在临床实践中,利用卵胞浆内单精子注射 (ICSI) 技术将精子注射入发育成熟度欠佳的卵母细胞后,受精卵易发生退化,患者获得可利用的胚胎很少,甚至有的患者无可利用胚胎。由于显微操作仪器价格昂贵,对操作人员的技术要求非常高,因此患者需要缴纳昂贵的手术费用。而HMC技术与ICSI 技术相比,不仅操作简单,而且节约成本,因此可以作为男性原发性无精子症、非梗阻性无精子症或女性卵母细胞发育成熟度欠佳患者治疗的一种参考方法。
在HMC过程中,卵母细胞的预激活不仅能够增加卵细胞膜内离子的交换,而且能提高细胞膜的融合[10]。因此,本实验在圆形精子细胞与无透明带卵母细胞电融合之前预先采120 V/mm、10 μs×1次电脉冲激活卵母细胞。在三组电融合参数作用下使圆形精子细胞-卵母细胞对融合。研究表明利用电融合技术联合化学激活方法更有利于无透明带卵母细胞重构胚胎的发育[11-12]。因此本实验在圆形精子细胞与卵母细胞融合后,将融合胚胎移入10 mmol/L SrCl2内激活3 h。实验结果显示:在A组电场强度为60 V/mm、脉冲宽度为30 μs、脉冲次数为2的电融合参数下,圆形精子细胞-卵母细胞对的平均融合率及平均卵裂率均显著高于B组、C组两组电融合参数作用下圆形精子细胞与无透明带卵母细胞的融合率、卵裂率;A组的囊胚形成率显著高于C组的囊胚形成率。研究发现将圆形精子细胞注射入激活的卵母细胞后融合胚胎的卵裂率为54%~64%,而其中只有2%~7%的胚胎发育至囊胚[13-14]。李子义等[15]研究表明,将圆形精子细胞注入经电激活处理的卵母细胞的透明带下, 注射卵的融合率为34.6%,卵裂率为28.3%。通过比较可以得出,本实验融合胚胎的囊胚形成率比圆形精子细胞注射入激活的卵母细胞的融合胚胎的囊胚形成率高。其原因可能是小鼠卵母细胞透明带薄而且脆性较大,卵胞浆内注射圆形精子细胞后卵容易发生退化,而本研究采用HMC技术降低了对卵母细胞的损伤,大大提高了融合胚胎的卵裂率及囊胚形成率。Suo等[16]研究表明,小鼠2-细胞胚胎在0.8 kv/cm电场作用下胚胎的融合率及囊胚形成率较高;周川等[17]研究表明在电场强度为80 V/mm、脉冲宽度为80 μs、脉冲次数为2的电融合参数下,2-细胞胚胎的融合率(92.5%)及融合胚胎的卵裂率(97.3%)较高。而本实验结果显示A组(60 V/mm、30 μs×2)电融合参数下,圆形精子细胞与卵母细胞的融合率、融合胚胎的卵裂率以及囊胚形成率较高,这可能是由于不同的细胞间融合所需要的融合参数不同。另外本实验采用WOW培养系统[10, 18],可以为胚胎发育提供稳定的微环境,从而得到较高的囊胚形成率。
因此,本实验结果得出:采用WOW培养系统,在电场强度60 V/mm、脉冲宽度30 μs、脉冲次数为2的直流电融合参数下,更适合小鼠圆形精子细胞与卵母细胞融合胚胎的发育,有助于提高胚胎的发育潜能。本研究也为男性原发性无精子症、非梗阻性无精子症患者获得自身后代提供了参考方法。
[1] Kimura Y, Yanagimachi R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring[J]. Development, 1995, 121:2397-2405.
[2] Haigo K, Yamauchi Y, Yazama F, et al. Full-term development of hamster embryos produced by injection of round spermatids into oocytes[J]. Biol Reprod, 2004, 71:194-198.
[3] Tesarik J, Mendoza C, Testart J. Viable embryos from injection of round spermatids into oocytes[J]. N EnglJ Med, 1995, 333:525-525.
[4] Selokar N, George A, Saha A. Production of interspecies handmade cloned embryos by nuclear transfer of cattle, goat and rat fibroblasts to buffalo (Bubalus bubalis) oocytes[J]. Anim Reprod Sci, 2011, 123:279-282.
[5] Tecirlioglu RT, French AJ, Lewis IM, et al. Birth of a cloned calf derived from a vitrified hand-made cloned embryo[J]. Reprod Fertil Dev, 2003, 15:361-366.
[6] Lagutina I, Lazzari G, Duchi R, et al. Somatic cell nuclear transfer in horses: effect of oocyte morphology, embryo reconstruction method and donor cell type[J]. Reproduction, 2005, 130:559-567.
[7] Du Y, Kragh PM, Zhang Y, et al. Piglets born from handmade cloning, an innovative cloning method without micromanipulation[J].Theriegenol, 2007, 68:1104-1110.
[8] Zhu J, Telfer EE, Fletcher J, et al. Improvement of an electrical activation protocol for porcine oocytes[J]. Biol Reprod, 2002, 66:635-641.
[9] Ogura A, Yanagimachi R. Round spermatid nuclei injected into hamster oocytes form pronuclei and participate in syngamy[J]. Biol Reprod, 1993, 48: 219-225.
[10] Booth PJ, Tan S, Reipurth R, et al. Simplification of bovine somatic cell nuclear transfer by application of a zona-free manipulation technique[J]. Cloning Stem Cells, 2001, 3:139-150.
[11] George A, Shah R, Sharma R, et al. Activation of zona-free Buffalo (Bubalus bubalis) oocytes by chemical or electrical stimulation, and subsequent parthenogenetic embryo development[J]. Reprod Domest Anim, 2011, 46:444-447.
[12] Hajian M, Kiani M, Hosseini MS, et al. Specific activation requirements of zona-free sheep oocytes before and after somatic cell nuclear transfer[J]. Cell Reprogram, 2013, 15:247-257.
[13] Ock SA, Kwack DO, Lee SL, et al. In vitro development of bovine oocytes reconstructed with round spermatids[J].Theriegenol, 2006, 65:1242-1253.
[14] Goto K, Kinoshita A, Nakanishi Y, et al. Blastocyst formation following intracytoplasmic injection of in-vitro derived spermatids into bovine oocytes[J]. Hum Reprod, 1996, 11:824-829.
[15] 李子义, 谭景和. 小鼠精子和球形精子细胞显微注射受精研究[J]. 解剖学报, 1999, 30:147-151.
[16] Suo L, Wang F, Zhou GB, et al. Optimal concentration of calcium and electric field levels improve tetraploid embryo production by electrofusion in mice[J]. J Reprod Dev, 2009, 55:383-385.
[17] 周川,赵云程. 不同电融合参数及融合液对昆明小鼠2-细胞胚胎融合及囊胚率的影响[J]. 动物医学进展, 2012, 33:56-59.
[18] Vajta G, Peura T, Holm P, et al. New method for culture of zona-included or zona-free embryos: The Well of the Well (WOW) system[J]. Mol Reprod Dev, 2000, 55:256-264.
[编辑:辛玲]
Effects of different electrocution parameters on development of embryos fused by round spermatids and oocytes
YANG Ai-jun1#,YU Chun-na2#,NIU Huan-fu2, WANG Xue-nan2, LIU Shu-zhen3, WEI Ze-feng2,HAO Cui-fang1*
1.QingdaoUniversity,Qingdao266071 2.CenterofReproductiveMedicine,TheAffiliatedHospitalofJiningMedicalUniversity,Jining272029 3.CollegeofLifeScience,ShandongNormalUniversity,Jinan250014
Objective: To explore the effects of different electrofusion parameters on the developmental potential of embryos which were fused by round spermatids and zona-free oocytes with handmade cloning (HMC).Methods: A total of 549 oocytes and round spermatids were fused by handmade cloning. The electric fusion parameters were divided into three groups according to the different electrofusion parameters. The electric field intensity was 60, 80 and 100V/mm in group A (n=186), group B (n=188)and group C(n=175)respectively. The pulse width was 30, 20, 10 μs of pulse width in group A, B, C respectively, and all number of direct current (DC) was 2. The electric fusion rates, cleavage rate and blastocyst formation rate of embryos fused by round spermatids and zona-free oocytes of mouse under the different electrofusion parameters were measured and recorded.Results: The results showed that the fusion rate of group A [(84.87±3.84)%]was significantly higher than that of the other two groups [(74.93±5.46)%, (73.60±5.48)%, respectively] (P<0.05). The cleavage rate of group A [(77.37±3.97%] was significantly higher than that of group B or group C [(67.74±7.32)%, (66.17±9.87)%, respectively] (P<0.05). The blastocyst rate of group A [(41.28±6.50)%] was significantly higher than that of group C [(31.03±6.09) %] (P<0.05).Conclusions: The best electrofusion parameters are 60 v/mm and 30 μs×2. It is beneficial to improve the developmental potential of embryo.
Electrofusion parameter; Round spermatids; Zona-free oocytes
10.3969/j.issn.1004-3845.2017.01.010
2016-07-01;
2016-09-13
济宁医学院附属医院苗圃计划项目(JYFY-MP-2013-MS-013);济宁医学院科研计划项目(JY2013KJ016);济宁医学院附属医院苗圃计划项目(MP-2014-003);济宁市科技局(2013jnwk132)
杨爱军,女,山东济宁人,博士研究生,主任医师,生殖医学专业;于春娜,女,山东烟台人,硕士,初级技师,生殖医学专业.(#并列第一作者;*
