基于孕期高雄激素大鼠焦虑行为探讨多囊卵巢综合征与情志的关系*
2017-01-06杨新鸣吴效科
杨新鸣 胡 敏 彭 艳 丛 晶 吴效科
(黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
基于孕期高雄激素大鼠焦虑行为探讨多囊卵巢综合征与情志的关系*
杨新鸣 胡 敏 彭 艳 丛 晶 吴效科△
(黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
目的使孕中期雌鼠暴露于高雄激素状态,观察宫内高雄激素环境是否影响子代的行为,并探讨产生焦虑行为的可能机制及多囊卵巢综合征与情志的关系。方法 Wistar雌性大鼠,分别在孕中期颈背部皮下注射T、T+Flu、T+Tam,连续3 d,所生子代雌鼠及雄鼠长至成年作为实验对象,观察基本生长情况、行为表现,检测中枢神经系统下丘脑、海马和杏仁核中关键基因的表达情况。结果 1)T组杏仁核ARmRNA的表达低于对照组。2)与对照组相比,T组子代的海马组织中ERα mRNA的表达下降。3)在T+Flu组中,下丘脑和海马中GPER mRNA的表达比T组下降。与T组相比,GPER mRNA在T+Flu和T+Tam组杏仁核中的表达显著增加。结论 通过试验发现PNA大鼠焦虑行为表现更为明显,其异常的表现是通过雄激素途径发挥作用。说明子代鼠在宫内对母鼠孕期持续的高雄激素刺激产生应激,雄激素途径对子代鼠中枢神经系统产生作用,从而影响其出生后的焦虑行为。
高雄激素 多囊卵巢综合征 焦虑 中枢神经系统
多囊卵巢综合征(PCOS)是育龄期女性最常见的内分泌疾病,临床表现为月经稀发、闭经、不孕、多毛和痤疮、胰岛素抵抗和高胰岛素血症、肥胖以及高血压。归属于中医的闭经、癥瘕、崩漏、月经后期、不孕等范畴。大量研究报道PCOS女性有发生抑郁和焦虑症的危险性,影响健康和生活质量。60%以上的PCOS女性至少会出现一种精神疾病,特别是抑郁和焦虑症。高雄激素血症是PCOS一个主要临床特征。临床和生化高雄影响生殖功能、大脑的发育以及行为表现。PCOS女性孕期表现循环中雄激素水平升高。古代医家多认为情志可以影响女性经、带、胎、产等生理功能,其中以肝、脾、肾最为突出。本研究从雄激素影响情绪的机制入手,使孕中期雌鼠暴露于高雄激素状态,观察宫内高雄激素环境是否影响子代的行为,并探讨产生焦虑行为的可能机制,探讨PCOS与情志的关系。现报告如下。
1 材料与方法
1.1 实验动物 清洁级雌性孕期Wistar大鼠购自查尔斯河实验室。孕期Wistar大鼠(孕8 d),室温21~22℃,湿度55%~65%,12 h光照12 h黑暗,独笼饲养(no.2016;Harlan Winkelmann)。
1.2 试剂与仪器 芝麻油,丙酸睾丸酮,苯甲酸苄酯,氟他胺,它莫西芬,均购自美国Sigma公司。高架十字迷宫,瑞典kungsbacka Mätoch Reglerteknik;旷场实验设备,瑞典kungsbacka Mätoch Reglerteknik;分光光度计Nanodrop 1000,美国NanoDrop;实时PCR仪系统,美国应用生物系统公司。
1.3 造模与分组 在孕15~19 d,将孕鼠随机分为4组(每组5只),每天颈部皮下注射并记录注射药物期间的体质量和食物摄取量。对照组:芝麻油和苯甲基苄酯按体积比2∶1混合注射480 μL;睾酮组(T):丙酸睾丸酮[0.5 mg/(kg·d)]溶于480 μL的2∶1混合的芝麻油和苯甲基苄酯的溶剂中。睾酮+氟他胺组(T+Flu):丙酸睾丸酮[0.5 mg/(kg·d)]和氟他胺[7.5 mg/(kg·d)]溶于480 μL的2∶1混合的芝麻油和苯甲基苄酯的溶剂中;睾酮+他莫昔芬组(T+Tam):丙酸睾丸酮[0.5 mg/(kg·d)]和他莫昔芬]10 μg/(kg·d)]溶于480 μL的2∶1混合的芝麻油和苯甲基苄酯的溶剂中。雌性和雄性子代均暴露于母体雄激素过多条件下,在孕15~19 d分别阻断雄激素和雌激素的产生,直至子代发育为成年大鼠。
1.4 观察项目 1)子代发育情况。所有的子代在出生后4~21 d每周2次测量体质量、肛门与外生殖器的间距以及食物摄取量。离乳后,持续测量雌鼠体质量和食物摄取量至65 d龄。2)行为测试。包括高架十字迷宫和旷场实验。雌性子代在动情间期测试。所有大鼠每天进行行为测试前适应实验室环境至少1 h以上。高架十字迷宫和旷场实验在同一天进行测试并在光照期白光下进行研究。行为结果通过特殊的计算机系统记录。(1)高架十字迷宫实验(EPM)。高架十字迷宫实验方法主要是利用雌雄子代面对新环境时的探究特性以及其对高悬敞开臂的恐惧情绪,模拟形成矛盾冲突的行为用来观察大鼠的焦虑情况及状态[1]。高架十字迷宫与计算机软件相连,自动计算大鼠进入开放臂和闭合臂的次数以及时间。大鼠直接放在中央区,启动该系统观察5 min。大鼠回到笼内,用水清洗迷宫设施。进入闭合臂的停留时间作为评估大鼠焦虑状态的标志。(2)旷场实验[2]。利用系统软件记录30 min内大鼠在盒中的自发活动、水平活动、直立活动、中央活动和沿边活动的时间。当1次实验结束后,大鼠回到笼中,盒子用水清洗,以免上次动物余留的信息影响下次测试结果。大鼠若停留在沿边区域或缺乏运动表明紧张度高。
1.5 标本采集 雌性子代在出生后70~81 d动情间期进行实验,雄性子代在出生后84~91 d进行试验。试验后大鼠被处死,解剖后收集脑组织中的下丘脑、海马和杏仁核,立即放入液氮中-80℃保存,用于蛋白和mRNA检测。
1.6 qRT-PCR检测 利用研磨仪Qiazol裂解液抽提下丘脑、海马和杏仁核组织中的RNA。总RNA利用RNeasy Lipid Tissue Mini Kit抽提,分光光度法和微流体芯片技术评估RNA质量。利用iScript cDNA合成试剂盒反转录500fg总RNA,cDNA产物进行实时定量PCR检测。热循环条件为50℃2 min,95℃10 min,然后95℃15 s,60℃1 min进行40个循环。所有反应重复进行,如果两次反应的CT值差异大于5%则重新实验。GAPDH和β-Actin作为内源对照管家基因,靶基因的相对表达量通过比较关键阈值(Ct)方法进行测算,通过2-ΔCt公式计算出结果。将靶基因分别与β-Actin和GAPDH对比得出数据。
1.7 统计学处理 应用SPSS21.0软件和GraphPad Prism 6.0软件。数据以表示。采取单因素方差分析方法。P<0.05为差异有统计学意义。
2 结 果
2.1 体质量变化 见表1,表2。与对照组相比,孕期暴露于睾酮下子代的出生体质量或体质量后续并没有发生改变。T+Flut组的雌性子代出生后4 d体质量低于T组,越接近成年体质量反而逐渐增加超过T组。与之相反,T+Tam组的子代出生后4~22 d体质量一直明显低于T组,直到成年后才接近T组体质量。然而,T+Tam组的雄性子代出生4~65 d体质量一直低于T组。
表1 雌性子代出生4~65 d体质量增长情况(g,)
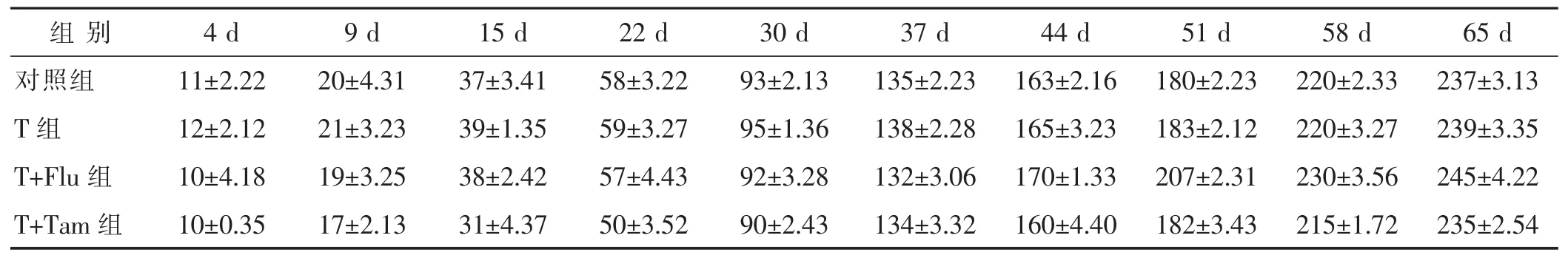
表1 雌性子代出生4~65 d体质量增长情况(g,)
?
表2 雄性子代出生4~65 d体质量增长情况(g,)
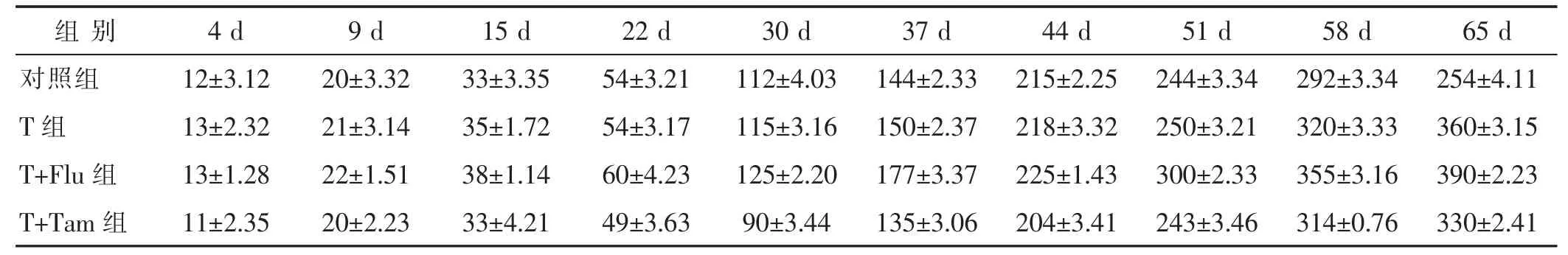
表2 雄性子代出生4~65 d体质量增长情况(g,)
?
2.2 食物摄取量 与对照组相比,出生后33~65 d PNA雌雄子代的食物摄取量没有发生明显变化。T+ Flu组和T+Tam组较T组也没有发生明显变化。
2.3 肛门与外生殖器的间距 与对照组相比,PNA雌雄子代肛门与外生殖器的距离没有差异。出生后4 d,T+Flu组雌性子代肛门与外生殖器的距离小于T组,雄性更为明显。出生后22 d,各组间雌性子代肛门与外生殖器的距离均无显著差异,而T+Flu和T+Tam组雄性子代与T组比较差异十分显著,肛门与外生殖器的距离明显小于T组。
2.4 行为反应与焦虑的关系 1)在EPM实验中,PNA雌性大鼠与对照组相比,在闭合臂中活动的时间较长(P<0.05),在开放臂中活动的时间较少(P<0.05)(表3)。2)在旷场实验中,睾酮组雌性子代的直立活动少于对照组 (P<0.05),沿边活动则呈增加趋势(0.076)。在EPM实验中,T+Flu组的雌性子代逆转这个结果。与T组相比,前者在闭合臂中活动时间较短(P<0.05),在开放臂中活动时间较长(P<0.05)。但是他莫昔芬并不能逆转这种行为的改变。在旷场实验中,PNA雌鼠的直立活动频率减少,氟他胺和他莫昔芬均能逆转这种行为,但不能影响它们在中央或沿边区域的活动时间(表4)。在任何实验组中,活动速度和水平活动均未存在差异。雄性子代的行为方式与雌性子代相似,但并不显著。
表3 4组EPM实验(%,)
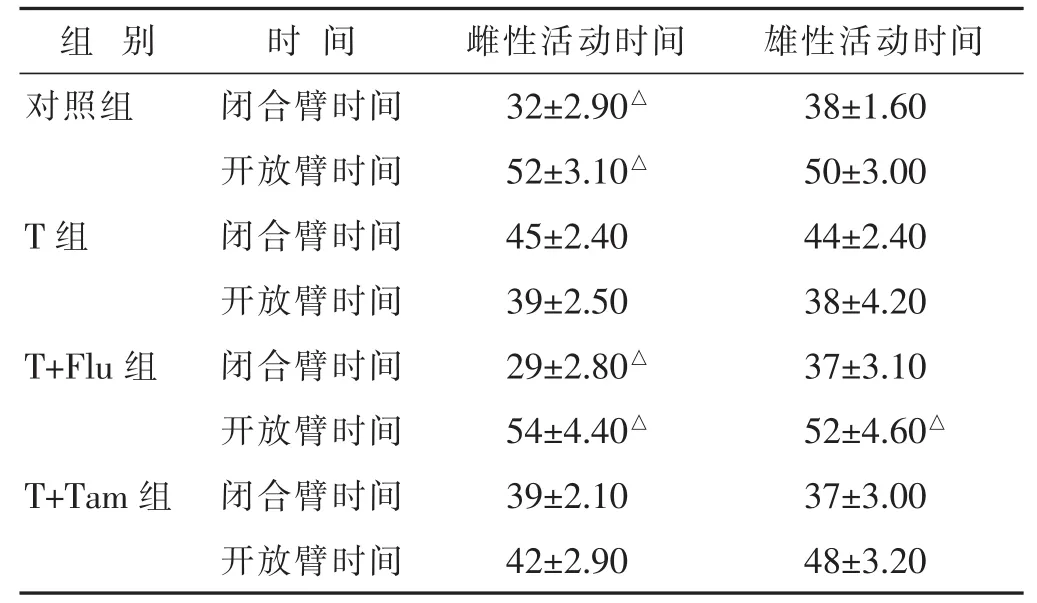
表3 4组EPM实验(%,)
与T组比较,△P<0.05。下同。
?
表4 雌雄子代的旷场实验()
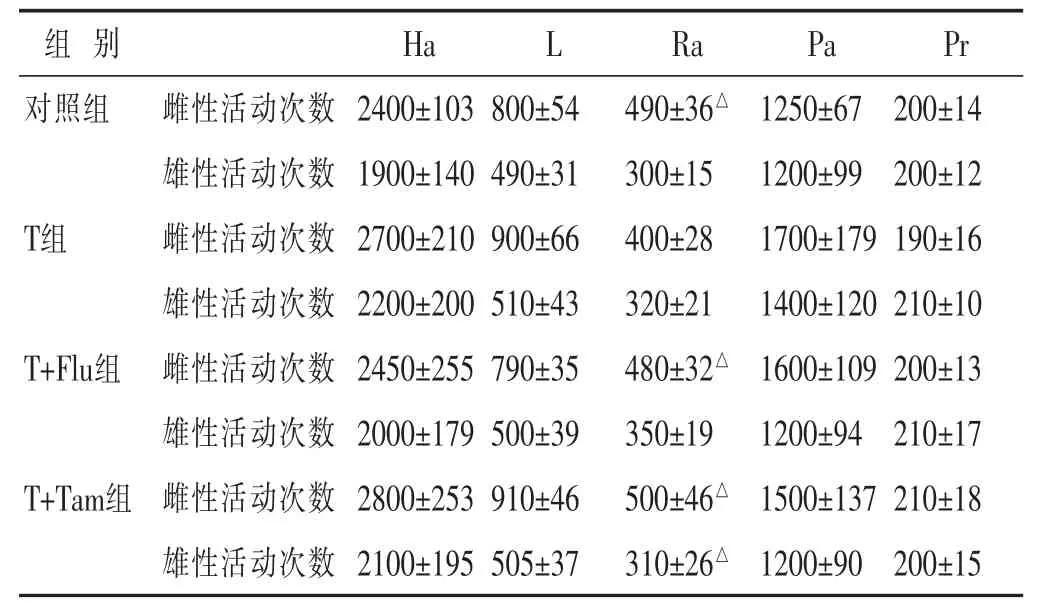
表4 雌雄子代的旷场实验()
Ha:水平活动;L:自发活动;Ra:直立活动;Pa:外围活动;Pr:外围直立活动。
?
2.5 基因表达分析 本研究发现,T组杏仁核雄激素受体(AR)mRNA的表达显著低于对照组1.9倍(P= 0.01),而下丘脑和海马的AR mRNA表达没有差异。T+Flut和T+Tam组AR mRNA与T组相比没有改变。与对照组相比,T组海马组织中雌激素受体α(ERα)mRNA的表达下降1.88倍。T+Flut组的雌性子代下丘脑和海马中的ERα mRNA表达与T组相比有下降趋势,但差异不显著。T组和对照组相比,下丘脑ERβ mRNA的表达有下降趋势,但差异不显著。GPER mRNA在对照组和T组的下丘脑、海马和杏仁核中的表达都没有差异。在T+Flut组中,下丘脑和海马中GPER mRNA的表达比T组下降。然而,在杏仁核中GPER mRNA在T+Flut和T+Tam组的表达显著高于T组。
表5 雌性子代杏仁核中AR、ERα、ERβ和GPER mRNA的表达
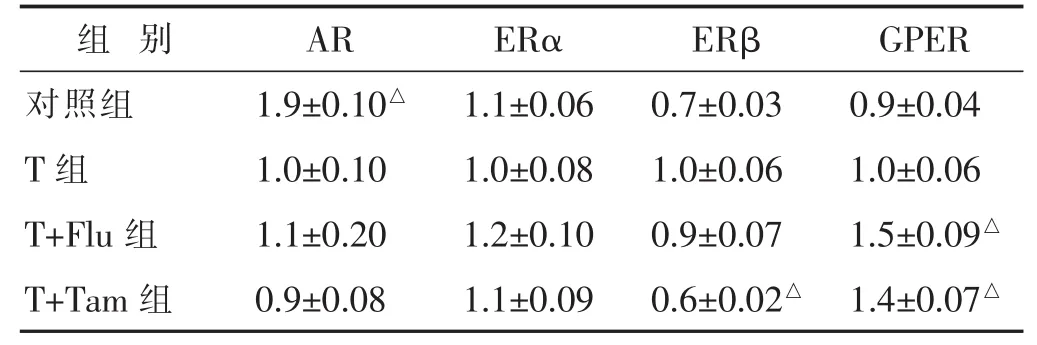
表5 雌性子代杏仁核中AR、ERα、ERβ和GPER mRNA的表达
?
3 讨 论
有关于情志致病的记载最早可以追溯到《内经》时期,“七情”即喜、怒、忧、思、悲、恐、惊,《素问·举痛论》记载“百病生于气也,怒则气上,喜则气缓,悲则气消,恐则气下,寒则气收,炅则气泄,惊则气乱,劳则气耗,思则气结”。古代医家多认为情志可以影响女性经、带、胎、产等生理功能。且情志与脏腑功能失常、气血失调是有一定关系的,其中以肝、脾、肾最为突出。肝为气机升降之枢纽,肝主疏泄,肝气舒畅能够调节全身气机疏通畅达,不郁不滞。脾在志为思,思则气结。思虑过度导致心脾受损,使得心脾气机结滞,运化失常。肾居下焦而藏精,由肾精所化生的肾气要依赖中上二焦才能布散到全身,恐使精气却而下行,导致肾气无法正常地布散全身。因此惊恐过度会损伤全身脏腑的精气,导致脏腑气机逆乱。肝、脾、肾脏功能是否正常会直接影响女性月经的变化。若情志失调,必伤及脏腑而累及气血。情志不遂,肝失条达、疏泄功能失常,每易发生妇科疾病。
西医学中也认为长期处于情绪应激状态下会对女性机体的中枢神经系统及生殖轴产生影响,甚至导致不孕。人类生活中的许多应激都会引起临床上疾病的发生,其中大部分都能引发生殖内分泌疾病。如:女性的月经失调(月经先期或迟后、无排卵月经)、高雄激素血症(多毛、多囊卵巢)、闭经、不孕、性功能障碍等。
前期研究表明PNA大鼠表现为生殖障碍和代谢异常[3],可作为PCOS模型,在本研究的EPM实验中,PNA雌性大鼠在闭合臂中活动的时间明显增加,在开放臂中活动的时间较少。同样,在旷场实验中,T组雌性子代的直立活动少于对照组,而沿边活动则呈增加趋势,这表明PNA雌性大鼠更为焦虑,证明PCOS发病与情志有关。
女性身体及器官对情绪的变化感应极其敏感,所以情绪对女性身体健康更容易产生影响,因此情绪波动在女性中较易导致疾病发生。《万氏女科》曰“忧愁思虑,恼怒怨恨、气郁血滞而经不行”,指出月经与情绪有关。《医宗金鉴·妇科心法要诀》曰“妇人从人不专主,病多忧忿郁伤情,血之行止与顺逆,皆由一气率而行”。由此可见,情志因素与妇科疾病关系密切。正如《济生方》所云“子应养血抑气,以减喜怒,阴阳平和,则妇人乐而有子”。李光荣[4]在对PCOS发病诱因的认识上,强调了情志不遂、肝气不舒的致病作用,认为“肾虚是多囊卵巢综合征的情志不遂致病基础,情志不遂是其重要的发病诱因之一”。
PCOS的家族聚集性说明该疾病具有遗传倾向[5],说明PCOS的生殖和代谢异常是遗传的,并且与性别无关。孕期PCOS女性睾酮水平升高[6],会增加妊娠并发症的危险性,导致出生前雄激素化。非灵长类、羊和大鼠的PNA模型的雌性子代表现出与PCOS女性相似的生殖和代谢异常。雄性子代在胎儿期也表现出生殖功能的改变,胰岛素抵抗、血糖增加等代谢异常表现。PCOS交感神经兴奋性提高与睾酮水平升高有关[7]。除了遗传因素会改变卵巢类固醇激素合成之外,交感神经兴奋性升高也可能是主要因素。研究发现,PNA雌性和雄性子代发生高血压说明了交感神经兴奋性对PCOS的病理生理的作用[8]。我们的前期研究证实孕期高雄(妊娠16~19 d 0.5 mg睾酮处理)的雌性子代甘油三酯和非酒精性脂肪肝升高,体质和胰岛素敏感性没有改变[9]。但之前的研究并没有确定胎儿期睾酮的这种剂量是否影响交感神经和行为的改变,以及这种改变是否是通过雄激素途径还是通过雌激素途径来调控。
在本研究的EPM实验中,PNA雌性大鼠在闭合臂中活动的时间明显增加,在开放臂中活动的时间较少。同样,在旷场实验中,T组雌性子代的直立活动少于对照组,而沿边活动则呈增加趋势,这表明PNA雌性大鼠更为焦虑。T+Flu组的雌性子代的行为表现有所改善。与T组相比,前者在闭合臂中活动时间较短,在开放臂中活动时间较长。但是它莫西芬并不能逆转这种行为的改变。在旷场实验中,PNA雌鼠的直立活动频率减少,氟他胺和它莫西芬均能逆转这种行为,但不能影响它们在中央或沿边区域的活动时间。它莫西芬为雌激素拮抗剂,氟他胺为抗雄激素药物。这些结果表明PNA大鼠行为的改变受雄激素途径调控,但与雌激素途径无关。
Marsh等[10]发现PCOS患者对于消极图片的反应是前额皮质和腹侧前扣带回的兴奋性异常提高,可以逆转杏仁核低兴奋性反应。我们的前期研究表明雄激素能直接调节下丘脑中雄激素受体的表达,诱发雌鼠发生焦虑相关的行为表现[11]。暴露于DHT 1周的大鼠其自发活动以及在EPM开放臂活动的时间减少,表明存在焦虑样的行为表现,这与我们的实验研究结果一致。同时,下丘脑中AR的表达下降,这提示DHT诱导的PCOS大鼠发生雄激素诱导的焦虑相关行为。然而,雄激素和焦虑症之间的关系在PCOS患者和动物模型中仍然存在争议。
出生前雄激素水平升高会影响脑形态和功能[12],影响神经发育导致后期行为异常[13]。出生后大脑继续发育,可能通过环境而改变出生前雄激素暴露过多的子代行为表现。但目前,孕期雄激素过多导致子代成年后行为异常的机制仍未明确。
根据行为实验,我们发现宫内环境激素水平异常使雌性子代反应更敏感。因此,我们继续研究雌性子代的基因表达情况。中枢神经系统的生理和病理功能与孕期高雄的子代的行为异常有关[14]。本研究结果显示,T组杏仁AR mRNA的表达显著低于对照组,而下丘脑和海马的AR mRNA表达没有差异。T+Flu和T+ Tam组AR mRNA与T组相比没有改变。与对照组相比,T组海马组织中ERα mRNA的表达下降。T+Flu组的雌性子代下丘脑和海马中的ERα mRNA表达与T组相比有下降趋势,但差异不显著。T组和对照组相比,下丘脑ERβ mRNA的表达有下降趋势,但差异不显著。实验结果表明,PNA大鼠的焦虑状态与杏仁核的AR有关,GPER对于调节焦虑有重要的作用。杏仁核可能是导致焦虑的主要因素。
情志因素是应激源的一种,患者对情绪变化产生应激反应,激活下丘脑-垂体-肾上腺轴,刺激机体肾上腺源性雄激素水平升高对下丘脑-垂体-性腺轴产生作用,导致疾病PCOS。Livada[15]在一项130人的调查中发现焦虑程度与胰岛素抵抗程度呈正相关,并且排除了这种相关性与受调查者的体质量指数的联系,充分表明了情志因素与激素代谢的关系。而胰岛素水平异常升高时刺激卵巢分泌雄激素过多,导致了高雄激素血症,该情况可抑制卵泡刺激素-颗粒细胞轴的功能,从而阻碍卵泡生长和成熟,最终形成多囊卵巢综合征[16]。肖雯晖等[17]对首次确诊PCOS的患者 (在告知诊断前)和正常女性进行“七情背景和七情生活事件量表”的测评。通过整理量表及统计研究证实PCOS的发病与不良情志活动可能有关系。
[1] 宗绍波,魏盛,苏云祥,等.焦虑大鼠模型高架十字迷宫实验的复测信度检验及参数相关性分析[J].中国医药导报,2011,8(30):5-7.
[2] 林晓春,李云鹏,卞艳芳,等.大鼠旷场实验指标检测及参考值的探讨[J].毒理学杂志,2010,24(3):224-225.
[3] Yang X,Zhang Y,Wu X,et al.Cryptotanshinone reverses reproductive and metabolic disturbances in prenatally androgenized rats via reguLation of ovarian signaling mechanisms and androgen synthesis[J].Am J Physiol:ReguLatory,Integrative and Comparative Physiology,2011,300(4):R869-875.
[4] 王燕,刘莹.情志不遂是多囊卵巢综合征发病的重要诱因之一—李光荣教授诊治多囊卵巢综合征临床经验[J].中华中医药杂志,2010,25(11):1812-1813.
[5] Urbanek M.The genetics of the polycystic ovary syndrome[J]. Nat Clin Pract Endocrinol Metab,2007,3(2):103-111.
[6] Sir-Petermann T,Maliqueo M,Angel B,et al.Maternal serum androgens in pregnant women with polycystic ovarian syndrome:possible implications in prenatal androgenization[J]. Hum Reprod,2002,17(10):2573-2579.
[7] Sverrisdottir YB,Mogren T,Kataoka J,et al.Is polycystic ovary syndrome associated with high sympathetic nerve activity and size at birth[J].American journal of physiology Endocrinology and metabolism,2008,294(3):E576-581.
[8] Chinnathambi V,Balakrishnan M,Ramadoss J,et al.Testosterone alters maternal vascuLar adaptations:role of the endothelialNO system[J].Hypertension,2013,61(3):647-654.
[9] Sun M,Maliqueo M,Benrick A,et al.Maternal androgen excess reduces placental and fetal weights,increases placental steroidogenesis,and leads to long-term health effects in their female offspring[J].American journal of physiology Endocrinology and metabolism,2012,303(11):E1373-1385.
[10]Marsh CA,Berent-Spillson A,Love T,et al.Functional neuroimaging of emotional processing in women with polycystic ovary syndrome:a case-control pilot study[J].Fertility and sterility,2013,100(1):200-207.
[11]Feng Y,Shao R,Weijdegard B,et al.Effects of androgen and leptin on behavioral and celluLar responses in female rats[J]. Hormones and behavior,2011,60(4):427-438.
[12]Auyeung B,Lombardo MV,Baron-Cohen S.Prenatal and postnatal hormone effects on the human brain and cognition. Pflugers Archiv[J].European journal of physiology,2013,465(5):557-571.
[13]Lombardo MV,Ashwin E,Auyeung B,et al.Fetal programming effects of testosterone on the reward system and behavioral approach tendencies in humans[J].Biological psychiatry,2012,72(10):839-847.
[14]Fauser BC,Tarlatzis BC,Rebar RW,et al.Consensus on women′s health aspects of polycystic ovary syndrome(PCOS):the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group[J].Fertility and sterility,2012,97(1):28-38.
[15]Sarantislivadas,Sofia Chaskou,Anna A,et al.Anxiety is associated with hormonal and etabolic profilein women with polycystic ovarian syndrome[J].Clinical En-docrinology,2011(75):698-703.
[16]夏翠翠,侯丽辉.多囊卵巢综合征的重要致病因素—情志不遂[J].亚太传统医药,2015,11(4):51-52.
[17]肖雯晖,裘秀月,张婷,等.多囊卵巢综合征患者情志状况及其影响因素观察[J].浙江中医杂志,2011,46(11):795-796.
Investigation of the Relationship between Polycystic Ovary Syndrome and Emotion Based on the Anxiety Behavior in Prenatally Androgenized Rats
YANG Xinming,HU Min,PENG Yan,et al.
The First Affiliated Hospital of Heilongjiang University of Chinese Medicine,Heilongjiang,Harbin 150040,China.
Objective:To observe whether the androgen excess in utero environment affected the behavior of the offspring,and to explore the possible mechanism of anxiety and the relationship between polycystic ovary syndrome and emotion after the female mice were exposed to the androgen excess in the second trimester of pregnancy.Methods:T,T+Flu and T+Tam were used in the second trimester of pregnancy on Wistar rats for three days. The basic conditions,behaviours and the expression of key genes in the hypothalamus,hippocampus and amygdala of the central nervous system of the mice offspring were observed.Results:1)The expression of ARmRNA in T group was lower than that in the control group.2)Compared with the control group,the expression of ERαmRNA in the mice offspring in T group decreased.3)In T+Flu group,the expression of GPER mRNA in hypothalamus and hippocampus decreased compared with that in T group.Compared with T group,the expression of GPER mRNA in T+Flu and T+Tam groups increased significantly.Conclusion:The anxiety behavior of PNA rats is more obvious,and the abnormal expression of the rats is achieved by the androgen pathway.It shows that the mice offspring is involved in stress responses to excessive androgen environment during the pregnancy of the female rats. It affects the central nervous system of the mice offspring by the androgen pathway thus producing the anxiety behaviours.
Androgen excess;Polycystic ovary syndrome;Anxiety;Central nervous system
国家自然科学基金面上项目(81373674);黑龙江省高校新世纪优秀人才支持计划(1254-NCET-021);教育部春晖计划(Z20100035);黑龙江中医药大学“优秀创新人才支持计划”
△(电子邮箱:xiaokewu2002@vip.sina.com)
R285.5
A
1004-745X(2016)11-2021-05
10.3969/j.issn.1004-745X.2016.11.001
(2016-05-05)
