血浆D-乳酸对非甾体抗炎药相关肠黏膜损害的早期诊断探讨
2017-01-04唐凯周新妹吴长明陈群陈涛王彩平
唐凯 周新妹 吴长明 陈群 陈涛 王彩平
血浆D-乳酸对非甾体抗炎药相关肠黏膜损害的早期诊断探讨
唐凯 周新妹 吴长明 陈群 陈涛 王彩平
目的探讨NSAIDs引起小肠黏膜损伤的机制,D-乳酸作为血浆标志物应用于NSAIDs肠黏膜损害的早期诊断价值。方法 雄性大鼠40只,对照组20只,对照组灌胃2 ml蒸馏水,2次/d;模型组阿司匹林片50mg/kg,2次/d,分T1(2d给药)和T2(7d给药)亚组,各10只。实验后进行小肠黏膜病理损伤评分;分析紧密连接Occludin蛋白的表达;同步测定血浆D-乳酸值。结果(1)模型组呈小肠黏膜损伤病理改变,T2亚组病理评分明显高于T1亚组(P<0.01)。(2)Occludin/ GAPDH相对密度值模型组均较对照组明显降低(P<0.01),T2亚组Occludin/GAPDH相对密度值显著低于T1亚组(t=7.646,P<0.01)。(3)同步测定模型组血浆D-乳酸与对照组比较均明显升高(P<0.01),T2亚组血浆D-乳酸较T1亚组明显升高(t=67.773,P<0.01)。结论阿司匹林可导致大鼠小肠黏膜屏障破坏;测定血浆D-乳酸可以较早的反映NSAIDs引起的小肠黏膜损害。
血浆D-乳酸 非甾体抗炎药 Occludin蛋白 小肠损伤
非甾体类抗炎药(NSAIDs)具有良好的抗炎、解热和镇痛作用,广泛用于关节炎及缓解疼痛症状,在心脑血管病预防也是基础用药之一。临床重视NSAIDs引起的胃黏膜损害,而导致小肠溃疡、出血、穿孔、肠通透性升高的副作用的发生率高、风险大,近年逐渐受到临床关注[1]。2014年2月至2015年10月作者通过实验研究,探讨NSAIDs引起小肠黏膜损伤的机制,了解其病理生理变化,设立早期筛查指标,在发生肠并发症之前,能够为NSAIDs服用者提供一个便捷、可靠的非侵入性检查方法,达到防止严重并发症发生的目的。
1 材料和方法
1.1 实验材料 雄性SD大鼠40只,180~220g。由嘉兴医学院动物实验中心提供;阿司匹林肠溶片为德国拜耳制药公司产品,试剂盒购自南京建成生物工程研究所。
1.2 动物分组 采用随机抽签法,将40只大鼠随机分为2组,空白对照组20只,模型组20只,每组再进一步随机分为2d给药和7d给药亚组,各10只,模型组分别标注为T1亚组、T2亚组。
1.3 给药方法 对照组以2ml蒸馏水灌胃,2次/d;模型组以阿司匹林片50mg/kg灌胃,2次/d。2d给药对照组和T1亚组大鼠在灌胃2d后处死,7d给药对照组和T2亚组大鼠在灌胃7d后处死。
1.4 标本制作 大鼠禁食、不禁水12h,实验时采用10%水合氯醛3ml/kg剂量腹腔注射麻醉后处死;肉眼观测小肠黏膜标本损伤状况。取颈静脉血10ml,离心后取血浆分装,-80℃保存,用于D-乳酸的测定;在距回盲部25cm取小肠1cm,置10%甲醛液中固定,常规石蜡包埋切片,HE染色。
1.5 小肠黏膜上皮损伤程度组织病理评分 采用Chiu氏评分法分级[2],O级:正常肠黏膜绒毛。Ⅰ级:肠黏膜绒毛顶端上皮下间隙增宽。Ⅱ级:中度固有层水肿,中央乳糜管扩张。Ⅲ级:肠黏膜上皮层细胞坏死,少数绒毛顶端脱落。Ⅳ级:部分绒毛脱落,固有层裸露,毛细血管充血。Ⅴ级:固有层崩解,出血或溃疡形成。
1.6 Occludin蛋白检测 过氧化物酶标记的链霉卵白素(SP)法检测Occludin蛋白,按照说明书进行SP三步法进行免疫组化染色,Occludin阳性呈棕黄色颗粒状,主要定位于小肠上皮细胞胞膜及胞质。WesternBlot检测Occludin蛋白表达:取各组大鼠小肠组织,加入组织裂解液,匀浆后离心,取上清液,测定蛋白含量;经过凝胶蛋白电泳,光化学法显色,拍片,以三磷酸甘油醛脱氢酶(GAPDH)作为内参照,利用QuantiScan凝胶图像扫描分析软件测定电泳条带的光密度值,计算Occludin与GAPDH光密度的比值。
1.7 血浆D-乳酸浓度测定(分光光度法) 按照试剂盒说明书操作,计算大鼠血浆D-乳酸浓度。
1.8 统计学方法 采用SPSS 13.0统计学软件,计量资料以(x±s)表示,配对t检验,以P<O.05为差异有统计学意义。
2 结果
2.1 小肠大体标本变化 对照组肠道黏膜光滑,肠管弹性好。T1亚组大鼠小肠黏膜可见散在浅表糜烂、溃疡;T2亚组大鼠肠黏膜见多发溃疡灶,部分有出血。
2.2 光镜下观察结果 对照组小肠黏膜无明显改变,绒毛完整无脱落。T1亚组肠绒毛肿胀、增粗、缩短,部分顶端破损;T2亚组小肠黏膜明显萎缩,固有层炎症细胞浸润,出现上皮细胞变性坏死、脱落,部分绒毛断裂、脱落,固有层裸露。模型组病理评分均高于对照组(P<O.01),T2亚组病理评分明显高于T1亚组(P<0.01),见图1、表1。

图1 各组大鼠小肠黏膜组织学表现(HE,×100)
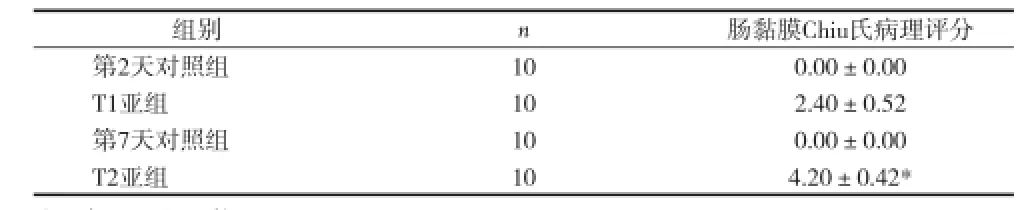
表1 对照组和模型组大鼠小肠黏膜病理评分(x±s)
2.3 各组Occludin蛋白表达 经过免疫组化染色的病理切片显示,对照组小肠黏膜胞膜及胞质内见明显Occludin蛋白表达,表现为较多棕黄色细颗粒聚集;T1亚组及T2亚组较对照组均有减少,T2亚组减少更明显。肠黏膜紧密连接Occludin蛋白的表达:Occludin/ GAPDH相对密度值T1亚组(0.507±0.051)和T2亚组(0.644±0.026)均较对照组(1.264±0.016)明显降低(P<0.01),T2亚组Occludin/GAPDH对密度值显著低于T1组(t=7.646,P<0.01),见图2~4。

图2 各组大鼠小肠黏膜上皮细胞Occludin蛋白表达

图3 各组大鼠肠黏膜Occludin蛋白电泳结果(Western blot法)
2.4 血浆D乳酸检测结果T1、T2亚组血浆D乳酸与对照组比较均明显升高(P<0.01),T2亚组血浆D乳酸较T1亚组明显升高(t=67.773,P<0.01),差异均有统计学意义。见表2。
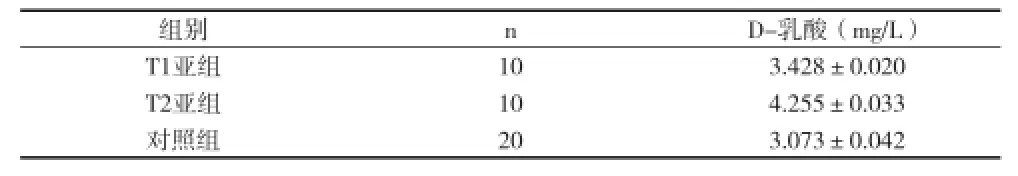
表2 分组大鼠D-乳酸值比较(x±s)

图4 各组大鼠肠上皮紧密连接occludin蛋白表达的不同
3 讨论
NSAIDs是具镇痛及抗炎作用的药物,广泛应用于各种急慢性疼痛及风湿性心血管类疾病,每年大约有20万使用NSAIDs患者出现并发症,病死率>10%[3]。既往对NSAIDs的消化道损伤重点多关注在胃黏膜,但NSAIDs引起的肠道副作用的发生率高、风险大,近年逐渐受到临床关注;NSAIDs所致的小肠黏膜早期病变多数为表浅性小溃疡,溃疡面与周围黏膜界限清晰[4],还可出现小肠出血、蛋白质丢失性肠病、肠通透性升高及穿孔等,统称为NSAIDs相关性肠病。本资料中参照成人用阿司匹林剂量作用大鼠肠道,结果大鼠小肠黏膜有不同程度的糜烂、溃疡等病变发生,光镜下也有相应的病理改变。
目前NSAIDs导致肠道损害的可能机制中,炎性反应起关键作用,通过抑制环氧合酶活性过程中增加白三烯的生成,促进组胺、自由基释放,造成肠道黏膜损伤[5];肠道屏障破坏,通透性增加使小肠细胞暴露在胆汁、消化酶及细菌机会明显增加,导致肠黏膜损伤[6]。肠黏膜机械屏障由肠道黏液层、上皮细胞、细胞间紧密连接等构成,是阻止致病物质入侵及细菌移位的屏障系统[7],其功能的发挥需要完整的上皮细胞屏障,Occludin作为一种整体膜蛋白,是细胞间紧密连接的重要组成部分,对维持肠道上皮屏障的完整至关重要[8]。本资料中对照组大鼠小肠上皮Occludin蛋白密集表达,T1亚组及T2亚组较对照组分布均有减少,T2亚组减少更明显;Occludin/ GAPDH相对密度值模型组均较对照组明显降低(P<0.01),T2亚组Occludin /GAPDH相对密度值显著低于T1组(P<0.01)。提示模型组大鼠肠道黏膜机械屏障遭到破坏,随病程延长破坏加重。
在此实验,肠黏膜屏障状况采用了新的血浆标志物D-乳酸定量测评。一般认为,D-乳酸是细菌代谢产物,肠道中多种细菌均可产生;当肠黏膜屏障受损,肠道细菌产生的D-乳酸通过受损黏膜入血循环,哺乳动物缺乏D-乳酸脱氢酶,当肠黏膜受损早期、肠黏膜通透性增加时,血中可检测到D-乳酸水平升高[9]。本资料中,T2亚组光镜下肠黏膜受损更明显,同步检测D-乳酸水平较T1亚组明显升高,表明D-乳酸测定较好的反映大鼠肠黏膜的受损状况,T1亚组较对照组D-乳酸显著升高,可早期提示大鼠肠黏膜的损害,表明血浆D-乳酸水平变化与NSAIDs引起的小肠黏膜进行性受损相关。因此,通过静脉血检测D-乳酸水平可反映NSAIDs所致肠黏膜损害的程度。
总之,NSAIDs可导致肠黏膜破坏,体循环D-乳酸水平相应升高,其含量与小肠黏膜损害相关。因此,D-乳酸可作为血浆标志物应用于NSAIDs肠黏膜损害的早期诊断。对于长期服用NSAIDs的患者,可进行血检测D-乳酸筛查,发现数值升高者,再考虑安排侵入性的内镜检查。NSAID的小肠损害机制尚不明确,本资料中大鼠肠黏膜occludin蛋白表达减少,反映肠道屏障的破坏是机制之一,其他途径尚需进一步研究。
[1]Vakhrushev IaM, Zagrebina EA. Clinical and functional changes in small intestine in the treatment of osteoarthritis with nonsteroidal antiinflammatory drugs. Eksp Klin Gastroenterol,2010,(3):18-22.
[2]Chiu CJ, McArdle AH, Brown R, et al.Intestinal mucosal lesion in Low-flow states.I.A morphological,hemodynamic,and metabolic reappraisal. Arch Surg, 1970, 101:478-483.
[3]Bindu S,Mazumder S,Dey S,et al.Non-steroida1 anti-inflammatory drug induces proinflammatory damage in gastric mucosa through NF-KB activation and neutrophi1 infiltration:Anti-inflammatory role of heme oxygenase-1 against non-steroidal anti-infIammatory drug. Free Radic Bio1 Med,2013,65:456-457.
[4]Raghav K,Overman MJ.Small bowel adenocarcinomas existing evidence and evolving paradigms. Nat Rev C1in Oncol,2013, 10(9): 534-544.
[5]Matsui H, Shimokawa O,Kaneko T, et al. The pathophysiology of non-steroidal anti-inflammatory drug(NSAID)-induced mucosal injuries in stomach and small intestine.J Clin Biochem Nutr, 2011, 48(2): 107-111.
[6]Satoh H,Takeuchi K.Management of NSAID/aspirininduced small intestinal damage by GI-sparing NSAIDs,anti-ulcer drugs and food constituents.Curr Med Chem,2012,19(1):82-89.
[7]黄蓉,欧希龙,肠道黏膜屏障功能损伤机制及其防治的研究进展,现代医学,2015,0(5):659-662.
[8]Fava F, Danese S. Intestinal microbiota in inflammatory bowel disease: friend of foe? World J Gastroenterol,2011,17:557-566.
[9]陈韵名,邓烈华,姚华国.D-乳酸的临床研究进展.医学研究杂志,2012,41(5),188-190.
ObjectiveTo study the mechanism of NSAIDs induced intestinal mucosal injury,and the early diagnosis of D-lactate as a marker of NSAIDs in the early diagnosis of intestinal mucosal damage.Methods40 male rats,the control group of 20,the control to fi ll the stomach 2 ml distilled water twice a day;Model group aspirin 50 mg/Kg twice a day,points T1(2 day delivery)and T2 for 7 days(medicine)subgroups,10 each. After the experiment of small intestinal mucosa pathological damage score;analyze the changes of Occludin protein localizing at tight junction of intestinal epithelial cells;Simultaneous determination of D-lactate in plasma.ResultsIn the model group,the pathological changes of intestinal mucosa injury,the pathological score of T2 subgroup was signifi cantly higher than that in T1(P<0.01);(2)The relative density of Occludin/ GAPDH was signifi cantly lower than that in control group(P<0.01),and the relative density of Occludin/GAPDH in T2 subgroup was signifi cantly lower than that in T1(t=7.646,P<0.01);(3)In the model group,the plasma D-lactate was signifi cantly higher than that in the control group(P<0.01),and the D-lactate in the T2 subgroup was signifi cantly higher than that in the T1(t=67.773,P<0.01).ConclusionAspirin can cause intestinal mucosal barrier damage in rats;the plasma D-lactate can refl ect the NSAIDs induced intestinal mucosal lesion in the early.
The Plasma D-lactate NSAIDs Occludin Protein Intestinal Damage
浙江省嘉兴市科技计划项目(2014AY21035-3)
314000 浙江省荣军医院(唐凯 吴长明 陈群 陈涛王彩平)
314000 浙江省嘉兴学院医学院(周新妹)
