植物甾醇在大豆油储藏过程中抗氧化作用的研究
2016-12-29高瑀珑唐瑞丽袁先雯冯燕玲韩洪玲袁建汪海峰鞠兴荣
高瑀珑 唐瑞丽 袁先雯 冯燕玲 韩洪玲 袁建 汪海峰 鞠兴荣
(南京财经大学食品科学与工学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
植物甾醇在大豆油储藏过程中抗氧化作用的研究
高瑀珑 唐瑞丽 袁先雯 冯燕玲 韩洪玲 袁建 汪海峰 鞠兴荣
(南京财经大学食品科学与工学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)

化作用量效关系的研究鲜见报道,本研究以大豆油为底物,对植物甾醇的抗氧化活性进行了研究。
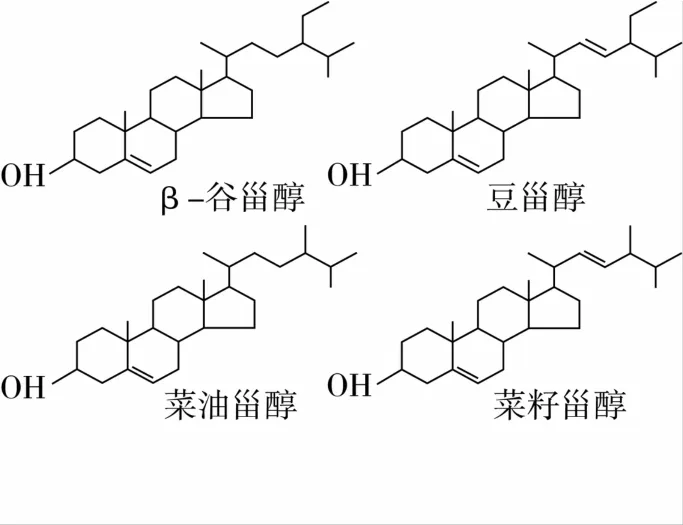
图1 4种植物甾醇的结构

图2 植物甾醇的基本结构
1 材料与方法
1.1 材料与试剂
一级大豆油(未加任何添加剂):中储粮镇江粮油有限公司提供;植物甾醇[质量分数为95% (其中β-谷甾醇45%,豆甾醇20%,菜甾醇30%)]:西安开来生物工程有限公司。
乙醇、乙醚、冰乙酸、三氯甲烷、异辛烷、碘化钾、p-茴香胺、硫代硫酸钠标准溶液、氢氧化钾标准溶液、淀粉指示剂、酚酞指示剂:南京丁贝生物技术有限公司;以上试剂均为分析纯。
1.2 仪器与设备
OSI-24型氧化稳定性测定仪:美国Ominion公司;BIC-250型人工气候箱:上海博讯实业有限公司医疗设备厂;101-3AS型电热鼓风干燥箱:上海苏进仪器设备厂;SB25-12D型超声波清洗器:宁波新芝生物科技股份有限公司;电子万用炉:北京永光明医疗仪器有限公司。
1.3 试验方法
1.3.1 高温避光试验
取250 mL具塞棕色瓶,分别装入160 g一级大豆油,在油样中分别加入植物甾醇0,0.08,0.12,0.16,0.24,0.32 g,振摇油样,混合至均匀状态,其中甾醇的含量分别为0%,0.05%,0.075%,0.10%,0.15%,0.20%,每1个样品做3个平行。将具塞棕色瓶塞紧,并外用铝箔袋包裹具塞棕色瓶,置于45℃人工气候箱内,每间隔48 h将油样振摇1次,并且交换其在人工气候箱内的位置。每隔10 d测定油样的酸价(AV),过氧化值(POV),油脂氧化稳定性指数(OSI)与p-茴香胺值(p-AV)。
1.3.2 低温避光试验
取250 mL具塞棕色瓶,分别装入160 g一级大豆油,在油样中分别加入植物甾醇0,0.08、0.12、0.16、0.24、0.32 g,振摇油样,混合至均匀状态,其中甾醇的含量分别为0%、0.05%、0.075%、0.10%、0.15%、0.20%,每1个样品做3个平行。将具塞棕色瓶塞紧,并外用铝箔袋包裹具塞棕色瓶,置于25℃人工气候箱内,每间隔48 h将油样摇动1次,并且交换其在人工气候箱内的位置。每隔10 d测量油样的酸价(AV),过氧化值(POV),油脂氧化稳定性指数(OSI),p-茴香胺值(p-AV)。
1.3.3 指标测定方法
AV 的测定:参照GB/T 5530—2005/ISO 660:1996的方法。
POV的测定:参照GB/T 5538—2008的方法。
OSI的测定:参照GB/T 21121—2007/ISO 6886:2006的方法。
称取(5±0.2)g油样于玻璃导管中,压缩空气压力30 psi,OSI内部调节器提供空气压力5.5 psi,测定温度110℃,测试水量50 mL,平行测定3次,取平均值。
p-AV 的测定:参照GB/T 24304—2009/ISO 6885:2006的方法来测定样品的p-AV值。
1.3.4 数据处理
所有试验数据均重复测定3次,利用JMP 10.0软件对试验数据进行统计,采用Tukey HSD检验进行差异显著性分析。
2 结果与分析
2.1 避光45℃条件下,不同添加量的植物甾醇对大豆油酸价的影响
避光45℃条件下,不同添加量的植物甾醇对大豆油酸价的影响结果分别见表1。油脂酸价是反映油脂水解酸败的重要指标。从表1可以看出在相同的储藏时期,添加不同浓度植物甾醇大豆油的酸价均比空白对照组显著降低(P<0.05),表明植物甾醇具有一定的抑制大豆油水解酸败的作用。从添加植物甾醇的浓度来看,甾醇添加量为0.1%时的大豆油酸价最低,即:当添加量不超过0.1%时,随着甾醇添加量的增大,大豆油酸价表现出减小趋势,表明大豆油水解程度减小。当甾醇的添加量大于0.1%,随着甾醇添加量的增大,大豆油酸价表现出增大趋势,当添加量为0.2%,大豆油的酸价与空白组的酸价无显著性差异(P>0.05)。植物甾醇是脂溶性物质;但又因为它的C-3位有羟基基团,因而又有一定的亲水性,甾醇的亲水性可能使其减缓了油脂的水解。水解反应是吸热过程,高温加速油脂水解生成游离脂肪酸,当甾醇添加量>0.1%时,可能由于甾醇浓度的增加,使得甾醇与部分游离的脂肪酸结合生成甾醇脂肪酸脂,促进了油脂的水解,引起游离脂肪酸总含量增加;与添加量<0.1%的大豆油相比,酸价变大。黄滢璋等[19]研究表明,花生油中甾醇添加量为0.01%、0.02%、0.03% 时,它们的酸价均比对照组小,并且添加量越大,花生油水解程度越小。
2.2 避光45℃条件下,不同添加量的植物甾醇对大豆油POV值的影响
避光45℃条件下,不同添加量的植物甾醇对大豆油过氧化值的影响结果见表2。过氧化值是衡量油脂氧化初期的氧化程度的重要指标[20]。从表2可以看出,在相同的储藏时期,添加不同浓度植物甾醇的大豆油的过氧化值均比空白组小,表明植物甾醇具有一定的抗氧化作用。从添加植物甾醇的量来看,添加0.1%甾醇的大豆油过氧化值最低,与空白组的过氧化值相比差异显著(P<0.05),表明甾醇具有较好的抗氧化作用,添加量为0.1%时抗氧化效果最好。以储藏时间50 d为例,添加量≤0.1%的大豆油,其过氧化值与空白组相比差异显著(P<0.05),且随浓度增大,过氧化值变小。随着甾醇添加量的增大(>0.1%),添加量为0.2%时,储藏时间超过30 d,大豆油的过氧化值与空白组无显著差异(P>0.05),说明甾醇的添加量超过一定的浓度时,抗氧化作用减弱。油脂被氧化后生成大量的自由基,形成自由基链式反应,加速油脂氧化酸败。植物甾醇能够清除羟自由基和超氧阴离子[21],它能与反应产生的氢过氧化物和自由基相结合,产生稳定化合物,减缓或终止链式反应。在高温储藏条件下,随着甾醇添加量的增大,由于受到空气和热等作用的影响,甾醇可能自身发生氧化,有助于自由基的生成,促进了油脂的氧化作用。张敬尧等[4]在研究天然抗氧化剂对大豆油的抗氧化活性中也发现,番茄红素在起始阶段,抗氧化效果较好,随着其添加量增大,可能由于受到空气、高温等的作用,自身发生氧化,有助于大量自由基的生成,反而促进了油脂的氧化作用。一些抗氧化剂生育酚等在浓度较低时具有较高的抗氧化效力,当浓度较高时,它们起到助氧化的作用[22]。

表1 不同添加量的植物甾醇对大豆油酸价的影响/mgKOH/g

表2 不同添加量的植物甾醇对大豆油POV值的影响/mmol/kg
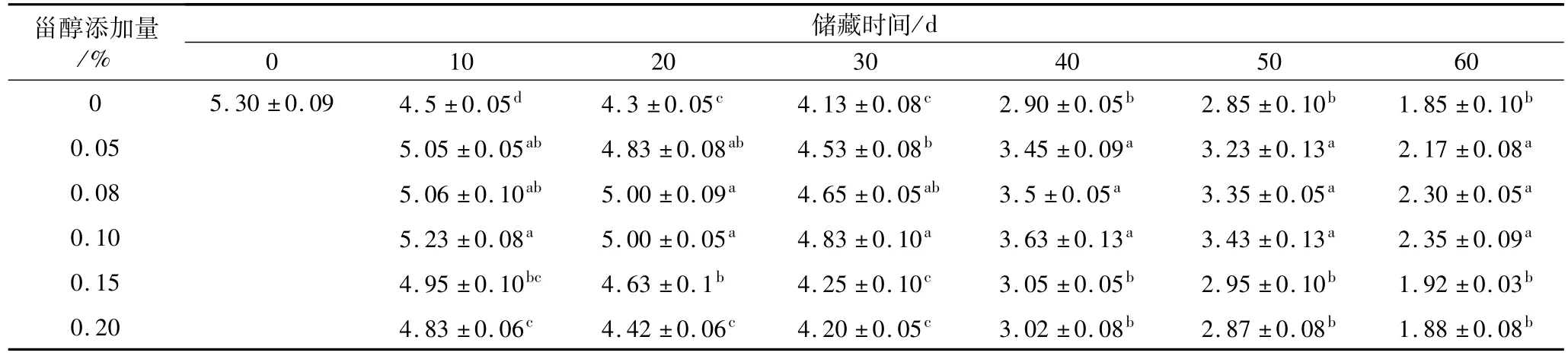
表3 不同添加量的植物甾醇对大豆油氧化稳定性指数的影响/h
2.3 避光45℃条件下,不同添加量的植物甾醇对大豆油氧化稳定性指数的影响
避光45℃条件下,不同添加量的植物甾醇对大豆油氧化稳定性指数的影响结果分别见表3。OSI值是反映油脂氧化稳定性的指标,通常OSI值越大,油脂的氧化稳定性就越高,储藏期就越长,反之就越短。从表3可以看出,在相同的储藏时期,添加不同浓度植物甾醇大豆油的OSI值均比空白组大,表明植物甾醇能提高大豆油储藏稳定性,延长货架期,表现出一定的抗氧化效果。以储藏时间30 d为例:当甾醇的添加量≤0.1%,提高添加量,大豆油氧化稳定时间延长,与空白组比较,差异显著(P<0.05),在此范围内添加植物甾醇,可明显延长大豆油氧化稳定时间。当甾醇添加量>0.1%时,储藏30~60 d,添加量为0.15%和0.2%的大豆油OSI值与空白组相比无显著差异(P>0.05)。因此,甾醇在大豆油中的抗氧化作用的量效关系有一定的阈值。
2.4 避光45℃条件下,不同添加量的植物甾醇对大豆油p-茴香胺值的影响
避光45℃条件下,不同添加量的植物甾醇对大豆油p-茴香胺值的影响结果见表4。p-茴香胺值反映油脂的次级氧化程度。从表4可以看出,储藏时间一定时,空白组的p-茴香胺值最大,甾醇添加量0.1%的大豆油p-茴香胺值最小。添加甾醇的大豆油p-茴香胺值与空白组相比均具有显著的差异(P<0.05),表明植物甾醇具有抑制大豆油次级氧化产物形成的作用,从而表现出较好的抗氧化效果。以储藏时间40 d为例:添加量0.15%和0.20%大豆油的p-茴香胺值与添加量0.05%的大豆油无显著性差异(P>0.05),说明45℃避光条件下,甾醇添加量超过一定浓度后,抗氧化能力减弱。吴时敏等[29]研究植物甾醇在菜籽高级烹调油中的抗氧化作用中同样也发现,植物甾醇添加量超过一定程度后其抗氧化能力也会减弱。在高温储藏条件下,随着甾醇添加量增大,可能由于受到空气和高温等作用的影响,甾醇自身发生氧化,加速了自由基的生成,促进了氧化产物的形成,从而增加了次级氧化产物的含量,反而不能起到抗氧化的效果[4-23]。
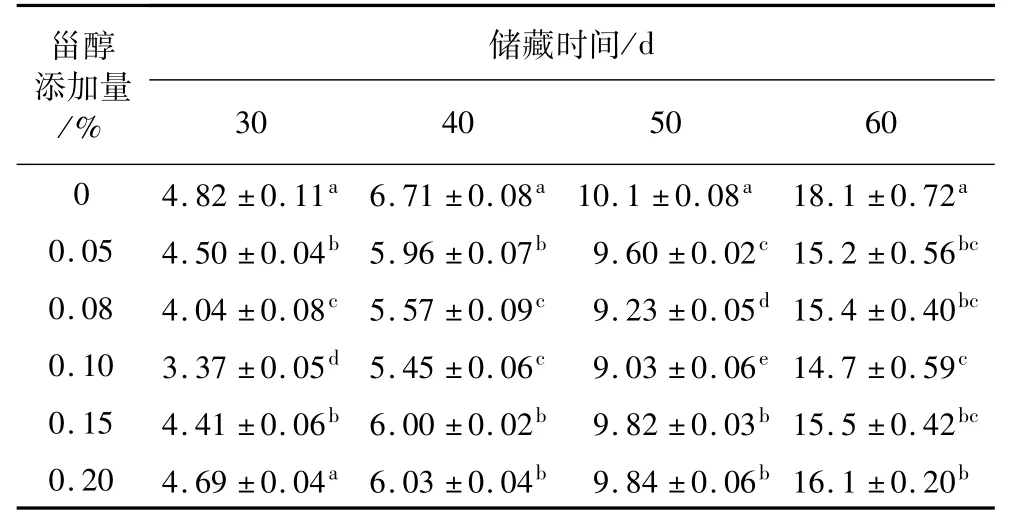
表4 不同添加量的植物甾醇对大豆油p-茴香胺值的影响
2.5 避光25℃条件下,不同添加量的植物甾醇对大豆油酸价的影响
避光25℃条件下,不同添加量的植物甾醇对大豆油酸价的影响结果分别见表5。从表5可以看出,在相同的储藏时期,添加不同浓度植物甾醇大豆油的酸价均比空白组小(P<0.05),而且随着甾醇浓度增大,大豆油酸价表现出降低的趋势。这表明在25℃避光条件下,植物甾醇具有一定的抑制大豆油水解酸败的作用。且甾醇浓度越大,大豆油水解程度越小。以储藏时间50 d和60 d为例,添加植物甾醇的各组大豆油酸价与空白对照组均具有显著的差异(P <0.05);添加量0.2%的大豆油酸价最低,油脂水解程度最小,但与添加量0.15%的大豆油酸价无显著性差异(P>0.05),这表明甾醇添加量不是越多越好,而是要控制在合理范围内发挥最大的作用。
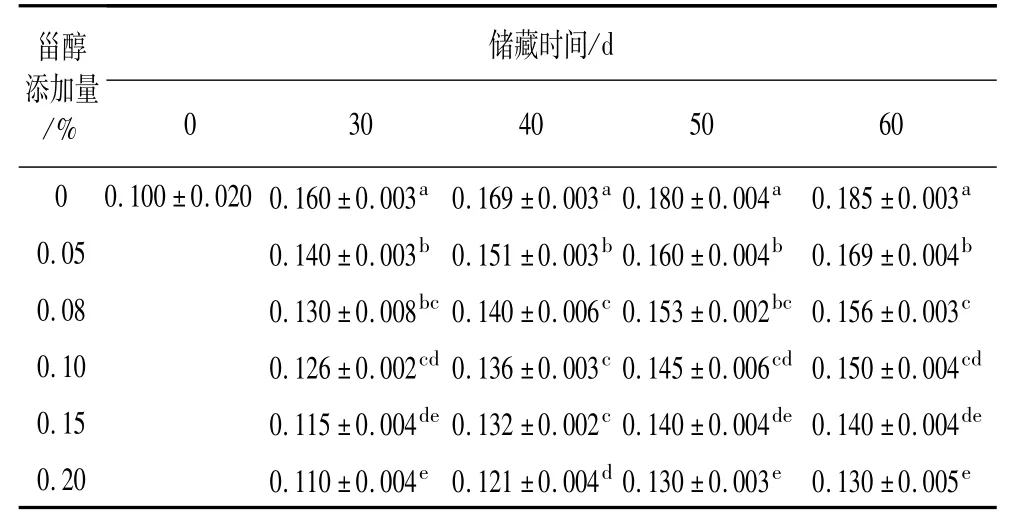
表5 不同添加量的植物甾醇对大豆油酸价的影响/mgKOH/g
2.6 避光25℃条件下,不同添加量的植物甾醇对大豆油过氧化值的影响
避光25℃条件下,不同添加量的植物甾醇对大豆油过氧化值的影响结果见表6。从表6可以看出,在同一储藏时期,添加不同浓度植物甾醇大豆油的过氧化值均比空白组小(P<0.05),而且甾醇添加量越大,大豆油过氧化值越小。这表明在25℃避光条件下,甾醇具有一定的抗氧化作用,且随着浓度的增加,抗氧化作用有增大的效果。以储藏时间60 d为例,添加植物甾醇的各组大豆油过氧化值显著小于空白组(P <0.05);添加量为0.2%和0.15%的大豆油与添加量为0.1%的大豆油过氧化值无显著性差异(P >0.05)。

表6 不同添加量的植物甾醇对大豆油过氧化值的影响/mmol/kg
2.7 避光25℃条件下,不同添加量的植物甾醇对大豆油氧化稳定性指数的影响
避光25℃条件下,不同添加量的植物甾醇对大豆油氧化稳定性指数的影响结果见表7。从表7可以看出,在同一储藏时期,空白组的氧化稳定性指数最低,表明25℃避光条件下空白组大豆油的储藏期最短,抗氧化效果最差。添加甾醇的大豆油随着添加量的增加OSI值在延长。以储藏时间50 d和60 d为例,空白组的大豆油的OSI值与添加甾醇的各组大豆油的OSI值差异显著(P<0.05),空白组OSI值最短,表明25℃避光条件下储存大豆油,添加植物甾醇可以增强其抗氧化作用,延长货架期。从甾醇的添加量来看,甾醇浓度越大,OSI值越大,储藏期越长。从多重分析比较来看,50 d时,添加量0.2%与添加量0.15% (60 d时,添加量为0.2% 与量0.15%、0.1%)的大豆油的OSI值无显著性差异(P>0.05)。这表明随着甾醇的添加量达到一定程度时,抗氧化作用不再明显增大。
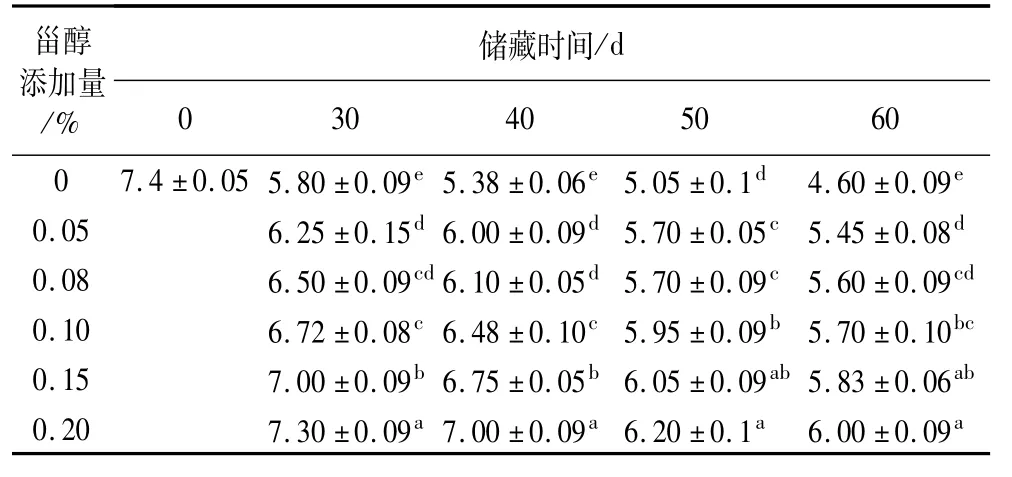
表7 不同添加量的植物甾醇对大豆油氧化稳定性指数的影响/h
2.8 避光25℃条件下,不同添加量的植物甾醇对大豆油p-茴香胺值的影响
避光25℃条件下,不同添加量的植物甾醇对大豆油p-茴香胺值的影响结果见表8。从表8可以看出,在同一储藏时期,空白组的p-茴香胺值明显比其他组大,这表明在大豆油氧化的过程中,空白组产生的次级过氧化物的量明显多,可见25℃避光条件下,植物甾醇具有抑制大豆油次级过氧化物产生的作用,从而表现出一定的抗氧化作用。从甾醇的添加量来看,甾醇浓度越大,p-茴香胺值越小。多重分析比较显示,在储藏的第40 d和第50 d,甾醇添加量最大的一组0.2%与添加量0.15%的大豆油p-茴香胺值无显著差异(P>0.05)。甾醇的添加量达到一定程度后,抗氧化作用不再随甾醇浓度增加而变大。

表8 不同添加量的植物甾醇对大豆油p-茴香胺值的影响
3 结论
避光45℃条件下,植物甾醇在大豆油储藏过程中起到抗氧化作用,其量效关系有一定的阈值。甾醇的添加量不超过0.1%,随着甾醇浓度的增加,大豆油抗氧化作用增大。甾醇的添加量大于0.1%时,随着甾醇浓度的增加,大豆油抗氧化作用减弱。
避光25℃条件下,大豆油4个指标的试验结果综合显示:添加植物甾醇具有增强大豆油抗氧化的作用。并且随着甾醇浓度的增加,抗氧化作用有增大的效果;甾醇的添加量达到一定程度时,抗氧化作用不再随甾醇浓度增加而变大。
添加植物甾醇的大豆油适宜在避光25℃条件下,再加铝箔贮藏。甾醇添加量不是越多越好,合理控制甾醇的添加量即可发挥植物甾醇最大的抗氧化作用。
[1]Esterbauer H,Schaur R J,Zollner H.Chemistry and biochemistry of 4-hydroxynonenal,malonaldehyde and related aldehydes[J].Free Radical Biology and Medicine,1991,11(1):81-128
[2]Lercker G,Rodriguez M T.Cholesterol oxidation mechanism[M].In Guardiola F,Dutta PC,Codony R,et al(Eds.),Cholesterol and phytosterol oxidation products:analysis,occurrence and biological effects.AOCS Press,Champaign,2002:1-26
[3]Farhoosh R,Einafshar S,Sharayei P.The effect of commercial refining steps on the rancidity measures of soybean and canola oils [J].Food Chemistry,2009,115(3):933-938
[4]张敬尧,张东杰.天然抗氧化剂在大豆油脂中抗氧化活性的研究[J].中国酿造,2009(3):24-26
Zhang Jingrao,Zhang Dongjie.Antioxidative activity of three natural antioxidants used in soybean oil[J].China Brewing,2009(3):24-26
[5]田堃,卢江,郭京晓.油脂氧化酸败对人体的危害及预防措施[J].中国初级卫生保健,2000,14(2):58
Tian Kun,Lu Jiang,Guo Jingxiao.The oxidation rancidity of lipid on the hazards and preventive measures of the human body.Chinese Primary Health Care,2000,14(2):58
[6]Shahidi F,Zhong Y.Antioxidants:regulatory status[M].In F.Shahidi(Ed.),Bailey’s industrial oil and fat product.New York:John Wiley& Son Inc,2005:491-512
[7]Johnsson L,Dutta P C.Determination of phytosterol oxides in some food products by using an optimized transesterification method [J].Food Chemistry,2006,97(4):606-613
[8]Normen L,Johnsson M,Andersson H,et al.Plant sterols in vegetables and fruits commonly consumed in Sweden [J].European Journal of Nutrition,1999,38(2):84-89
[9]郑集.普通生物化学(第二版)[M].北京:高等教育出版社,1986:80-87
Zheng Ji.General Biochemistry (Second Edition)[M].Beijing:Higher Education Press,1986:80-87
[10]Fu Y Q,Zhang Y,Hu H,et al.Design and straightforward synthesis of novel galloyl phytosterols with excellent antioxidant activity [J].Food Chemistry,2014,163:171-177
[11]王稳航.植物甾醇及其在食品中的应用[J].西部粮油科技,2002(6):41-44
Wang Wenhang.Phytosterol and its application in food[J].China Western Cereals and Oils Technology,2002(6):41-44
[12]Igoumenidis PE,Konstanta M A,Salta F N,et al.Phytosterols in frying oils:evaluation of their absorption in prefried potatoes and determination of their destruction kinetics after repeated deep and pan frying [J].Procedia Food Science,2011(1):608-615
[13]Verleyen T,Sosinska U,Ioannidou S,et al.Influence of the vegetable oil refining process on Free and Esterified Sterols [J].Journal of the American Oil Chemists’Society,2002,79(10):947-953
[14]Moreau R A,Whitaker B D,Hicks K B.Phytosterols,phytostanols,and their conjugates in foods:structural diversity,quantitative analysis,and health-promoting uses[J].Progress in Lipid Research,2002,41(6):457-500
[15]许新德,邵斌.植物甾醇酯——一种新型的降胆固醇健康食品[J].中国油脂,2004,25(4):25-28
Xu Xinde,Shao Bin.Phytosterol ester:a novel functional food with cholesterol-lowering [J].China Oil,2004,25(4):25-28
[16]Demonty I,Ras R T,van der Knaap H C,et al.Continuous dose-response relationship of the LDL-cholesterollowering effect of phytosterol intake[J].The Journal of Nutrition,2009,139(2):205-207
[17]Choudhary SP,Tran L S.Phytosterols:perspectives in human nutrition and clinical therapy [J].Current Medicinal Chemistry,2011,18(29):4557-4567
[18]Lampi A M,Dimberg L H,Kamal-Eldin A.A study on the influence of fucosterol on thermal polymerisation of purified high oleic sunflower triacylglycerols[J].Journal of the Science of Food and Agriculture,1999,79(4):573-579
[19]黄滢璋,赵雁武,周振中.植物甾醇对油脂的抗氧化作用研究[J].粮食科技与经济,2012,37(3):38-39
Huang Yingzhang,Zhao Yanwu,Zhou Zhenzhong.Antioxidant effect of phytosterol in edible oil[J].Grain Science and Technology and Economy,2012,37(3):38-39
[20]阚建全.食品化学[M].第二版.北京:中国农业大学出版社,2002,112-134
Kan Jianquan.Food Chemistry[M].Second Edition.Beijing:China Agricultural University Press,2002,112-134
[21]高政.菜籽植物甾醇的提取、纯化及抗氧化活性研究[D].武汉:华中农业大学,2009
Gao Zheng.Study on extraction,purification and anti-oxidation activity of rapeseed phytosterol.[D].Wuhan:Huazhong Agricultural University,2009
[22]Fennema O R.Food chemistry [M].3rd Edition.New York:Marcel Dekker Inc,2003:283-284
[23]吴时敏,吴谋成,马莉.植物甾醇在菜籽高级烹调油中的抗氧化作用(Ⅰ)-常温下抗氧化作用的研究[J].中国油脂,2003,28(4):52-54
Wu Shimin,Wu Moucheng,Ma Li.Antioxidant effect of phytosterols in high grade rapeseed cooking oil--antioxidant effect at normal temperature [J].China Oils and Fats,2003,28(4):52-54.
Antioxidant Effect of Phytosterol on Soybean Oil During the Storage
Gao Yulong Tang Ruili Yuan Xianwen Feng Yanling Han Hongling Yuan Jian Wang Haifeng Ju Xingrong
(Key Laboratory of Grains and Oils Quality Control and Processing,Collaborative Innovation Center for Modern Grain Circulation and Safety,College of Food Science and Engineering,Nanjing University of Finance and Economics,Nanjing 210023)
The influence of different phytosterol contents on the storage stability of soybean oil was investigated.Different concentrations of sterol(0%,0.05%,0.075%,0.1%,0.15,0.2%)were added to soybean oil and stored at 45℃ and 25℃ in the dark,and the changes of soybean oil quality indices were detected during the storage.Results showed when the addition of sterol was less than 0.1%,the antioxidant activities of soybean oil increased with the increasing of sterol concentration at 45℃ in the dark.When the addition of sterol was more than 0.1%,its antioxidant activities decreased.The sterol could enhance the antioxidant effect of soybean oil significantly(P <0.05)at 25 ℃ in the dark.With the increase of sterol concentration,the antioxidant activities of soybean oil increase (P <0.05).When the addition of sterol reached to a certain degree,antioxidant activities no longer increased with the increase of its concentration.Sterol had significant antioxidant effect and a significant relationship of dose-response effect during the storage of soybean oil.
phytosterol,soybean oil,storage,antioxidant effect
