水剂法提取澳洲坚果油的化学成分及其抗氧化活性研究
2016-12-05杜丽清帅希祥涂行浩
杜丽清 帅希祥 涂行浩 张 明
(中国热带农业科学院南亚热带作物研究所,广东 湛江 524091)
水剂法提取澳洲坚果油的化学成分及其抗氧化活性研究
杜丽清 帅希祥 涂行浩 张 明
(中国热带农业科学院南亚热带作物研究所,广东 湛江 524091)
采用水剂法从烘干的澳洲坚果仁中提取仁油,先对其基本理化性质进行分析,再通过红外、气相和液相色谱法对坚果油的红外特性、脂肪酸组成、生育酚、磷脂、甾醇进行分析,并通过测定其氧化诱导时间和清除DPPH自由基的能力来综合评价澳洲坚果油的抗氧化能力。结果表明:水剂法提取的澳洲坚果油的过氧化值、酸价、碘值、皂化值、折光率、水分及挥发物含量分别为0.59 mmoL/kg、0.28 mg KOH/g、74.21 g/100 g、198.78 mg KOH/g、1.466 8、0.36%;红外谱图显示澳洲坚果油具有坚果油的特征吸收;脂肪酸分析发现其不饱和脂肪酸含量为83.45%,其中棕榈油酸和油酸含量分别为17.25%和61.44%;甾醇含量为55.51 mg/100 g;总酚酸含量为31.87 mg/100 g;磷脂和生育酚均未检出;澳洲坚果油的氧化诱导时间为11.44 h,其清除DPPH自由基的能力达89.84%,具有良好的抗氧化能力。
澳洲坚果油;水剂法;化学组成;抗氧化
澳洲坚果(MacadamiaternifoliaF.Muell.)别名澳洲核桃、夏威夷果等,属山龙眼科澳洲坚果属多年生常绿乔木[1-3]。20世纪60~70年代开始引入中国[3],目前在中国广东、广西、云南及贵州等地均有种植[4]。澳洲坚果具有含油量高(脂肪含量高达78%以上)、营养丰富、香脆可口等特点[5-6],而且其不含胆固醇,饱和脂肪酸含量低,单不饱和脂肪酸超过70%,可降低患心脏病的风险[7]。
目前,植物提油方法主要有高温压榨法、低温冷榨法、有机溶剂萃取法、超临界流体萃取法、超声波辅助提取法和水剂法等[8]。其中,水剂法是利用种仁中的非油成分对油与水亲和力的差异,同时利用油水比重不同而将油脂与蛋白质等分离出来的方法[9],该法操作条件比较温和,提取率高,蛋白变性程度较低,具有简单、安全可靠和经济的特点[10]。范晓波[11]对水剂法提取澳洲坚果油的工艺进行了研究,发现该方法的提油率达79.3%;黄宗兰等[10]也研究了水剂法对澳洲坚果油的提取工艺,发现该方法的提油率达67.5%,同时对澳洲坚果油的过氧化值和酸价进行了测定;然而对于水剂法提取的澳洲坚果油的化学组成与抗氧化活性,国内外还未见报道。
本试验拟以烘干澳洲坚果仁为原料,采用水剂法提取澳洲坚果油,对其主要的理化性质进行分析,并研究其脂肪酸组成、生育酚、磷脂、甾醇等化学组成,以及澳洲坚果油的抗氧化活性,旨在为水剂法提取的澳洲坚果油的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
澳洲坚果:鲜果,中国热带农业科学院南亚热带作物研究所科研基地;
没食子酸(99%)、抗坏血酸(99.99%)、生育酚混标(α、β、γ、δ)(98%)、37种脂肪酸甲酯混标、溴化钾(99.99%)、DPPH(≥97%)、胆甾烷醇(>99%)、磷脂酰胆碱(>99%)、磷脂酰乙醇胺(>99%)、磷脂酰肌醇(>99%):标准品,阿拉丁化学试剂有限公司;
福林酚、碳酸钠、甲醇、无水乙醇、正己烷、异丙醇、氢氧化钾、碘化钾等:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
分析天平:AR224CN型,奥康斯仪器有限公司;
高速离心机:LXJ-IIB型,上海安亭科学仪器厂;
冰箱:BCD-539WT型,青岛海尔股份有限公司;
恒温水浴锅:HH-4型,江苏省金坛市荣华仪器制造有限公司;
手动可调量程单道移液器:10~1 000 μL,德国Eppendorf公司;
高速冷冻离心机:ST40型,赛默飞世尔科技(中国)有限公司;
紫外—可见分光光度计:UV2700型,岛津企业管理(中国)有限公司;
气相色谱:7890A型,安捷伦科技(上海)有限公司;
液相色谱:1260型,安捷伦科技(上海)有限公司;
油脂氧化稳定性分析仪:892型,瑞士万通中国有限公司。
1.3 方法
1.3.1 澳洲坚果油的提取 称取100 g干燥的澳洲坚果仁(采用梯度升温鼓风干燥法:澳洲坚果仁先在50 ℃鼓风干燥8 h,再在65 ℃下鼓风干燥48 h,每隔8 h对果仁翻动一次,即得到干燥的澳洲坚果仁),粉碎,置于1 000 mL的烧杯中,加入400 mL的蒸馏水,在室温下磁力搅拌1 h,4 800 r/min离心20 min,用胶头滴管吸取上层油,乳化层转入离心管中,于-20 ℃冰箱中冷冻12 h,取出后于40 ℃水浴中加热2 h,4 800 r/min离心20 min,取油相[10-11],备用。
1.3.2 甾醇含量测定 参考文献[12]。
1.3.3 磷脂含量测定 按NY/T 1798—2009《植物油脂中磷脂组分含量的测定》的高效液相色谱法执行。
1.3.4 VE含量测定 参照文献[13]。
1.3.5 理化指标的测定 参照文献[14]测定澳洲坚果油的酸值、过氧化值、皂化值、碘值、折光率、水分及挥发物含量。
1.3.6 脂肪酸组成分析 参照ISO 12966-2-2011修改如下:采用2 moL/L的氢氧化钾甲醇溶液衍生成脂肪酸甲酯,通过气相色谱来测定。Agilent 7890A气相色谱采用氢火焰检测器和BPX毛细管柱(30 m×0.22 mm×0.25 μm),载气:N2,流速:1.0 mL/min,升温程序:初始温度60 ℃,保持1 min,后以10 ℃/min 的速度升至170 ℃,继续以3 ℃/min 的速度升至230 ℃,在此温度下保持15 min。进样口温度:225 ℃,检测器温度:250 ℃。每个脂肪酸是通过与脂肪酸甲酯标品的保留时间比对来鉴定,且各自的含量是以占总脂肪酸的百分比表示。
1.3.7 傅里叶红外光谱分析 在红外灯的照射下,将干燥的KBr粉末置于玛瑙研钵中研磨,再挤压成平整透明的小圆块。在小圆块中心滴加10 μL澳洲坚果油,采用Nicolet 5700傅里叶红外光谱仪, 在4 cm-1的分辨率下重复扫描128次,光谱扫描范围为4 000~400 cm-1,用Ominic 7.2软件采集红外光谱数据,并用Origin 8.0软件绘制红外光谱曲线[15]。
1.3.8 总酚酸含量的测定
(1) 没食子酸标准曲线的绘制:精密称取0.100 0 g没食子酸,用10.00 mL无水乙醇溶解,用去离子水定容至100 mL,备用。分别移取上述溶液1.00,0.50,0.20,0.10,0.05 mL到10 mL容量瓶中,用去离子水定容。从上述不同浓度的标准溶液中分别移取0.20 mL至10.00 mL比色管中,再分别加入1.00 mL福林酚试剂(0.1 moL/L)和0.80 mL去离子水,混匀,室温下静置5 min,然后加入1.00 mL碳酸钠溶液(7.5%),混匀。将上述溶液室温下避光反应1 h后,以去离子水为空白参比,在760 nm波长处测定吸光度。以没食子酸质量浓度为横坐标、吸光度为纵坐标绘制标准曲线。
(2) 澳洲坚果油样品测定:准确称取5.000 g澳洲坚果油于25 mL容量瓶中,用三氯甲烷溶解并定容至刻度。准确吸取0.20 mL上述溶液于10 mL比色管中,按1.3.8(1)的方法测定,在760 nm处测定吸光值,并根据标准曲线计算澳洲坚果油中总酚酸的含量(以没食子酸计)。
1.3.9 澳洲坚果油氧化稳定性分析 采用892型Rancimat油脂氧化酸败仪测定澳洲坚果油的氧化稳定性。测定条件:油样用量3.0 g,温度 120 ℃,空气流速10 L/h[16]。
1.3.10 抗氧化活性的测定 以澳洲坚果油清除DPPH自由基的能力表示。采用无水乙醇将DPPH配制成2.0×10-4mol/L的溶液备用。测定时,在试管中依次加入2.0 mL DPPH和2.0 mL无水乙醇,混匀3 min后,用1 cm比色皿在517 nm波长处测吸光度,记为A0;加入2.0 mL DPPH 溶液和2.0 mL提取液混匀后测定吸光度,记为A1;以无水乙醇调零。油脂样品质量浓度设置5个梯度:100.0%,50.0%,25.0%,12.5%,5.0%,2.5%。每一吸光度平行测定3次,取其平均值。按式(1)计算清除率[17-18]。

(1)
式中:
c——DPPH清除率,%;
A0——空白样品的吸光值;
A1——样品的吸光值。
样液的制备:① 原样:称取5.000 g澳洲坚果油于25 mL容量瓶中,用三氯甲烷定容至刻度线,备用;② 极性组分:称取5.000 g澳洲坚果油于15 mL离心管中,用甲醇提取3次,收集甲醇层定容至25 mL容量瓶,备用;③ 非极性组分:提取极性组分后剩余的油脂用三氯甲烷定容至25 mL容量瓶,备用。
1.4 统计分析
所有试验重复进行3次,试验数据采用SPSS 17.0软件进行分析,结果表示为均值±标准偏差,作图采用origin 8.0软件。
2 结果与分析
2.1 水剂法提取澳洲坚果油的主要理化性质分析
由表1可知,水剂法提取的澳洲坚果油的酸价、过氧化值、皂化值、碘值、折光率、水分及挥发物含量分别为(0.280 0±0.005 4) mg KOH/g、(0.59±0.08) mmol/kg、(198.78±2.01) mg KOH/g、(74.21±1.36) g/100 g、1.466 8和0.36%。过氧化值和酸价均符合国家食用油标准(GB 2716—2005)规定的酸价(≤3 mg KOH/g)和过氧化值(≤9.85 mmoL/kg)的范围,表明水剂法提取的澳洲坚果油具有较好的品质;碘值较低说明澳洲坚果油是一种良好的不干性油,皂化值较高说明澳洲坚果油脂肪酸分子量较小,亲水性更强,更适合用做化妆品原料;水分及挥发物含量偏高,可能是水剂法提取过程中残留了一部分水分。同时这些值与黄宗兰等[10](过氧化值未检出、酸价0.23 mg KOH/g、碘值73.8 g/100 g、皂化值200.2 mg KOH/g)和范晓波[11](折光率1.477 0、碘值73 g/100 g、皂化值202.5 mg KOH/g)研究水剂法提取澳洲坚果油和许良[19]24研究亚临界丁烷萃取(过氧化值0.47 mmol/kg、酸价0.14 mg KOH/g、碘值68.3 g/100 g、皂化值191.8 mg KOH/g)澳洲坚果的理化性质是非常相似的。

表1 水剂法提取澳洲坚果油的主要理化性质
从表1中还可以看出,水剂法提取的澳洲坚果油的氧化诱导时间为(11.44±0.27) h。有研究[19]25表明,亚临界萃取、正己烷萃取、冷榨和热榨澳洲坚果油的氧化诱导时间(120 ℃)分别为8.74,8.83,6.04,11.22 h。与其它提取工艺相比,水剂法提取的澳洲坚果油氧化诱导时间更长,说明水剂法提取澳洲坚果油的氧化稳定性更好,可能是水剂法提取过程中更多的脂溶性抗氧化物质被保留在澳洲坚果油中。
2.2 水剂法提取澳洲坚果油的活性成分分析
澳洲坚果油中活性成分包括甾醇、磷脂、VE、酚酸类物质、亚麻酸、亚油酸、二十二碳六烯酸(DHA)等,本试验采用气相和液相色谱法对油脂中常见的活性物质—甾醇、磷脂和VE进行分析,结果见表2。由表2可知,甾醇含量为(55.51±0.21) mg/100 g,然而磷脂(检出限0.75 mg/g)和VE(检出限2 mg/kg)均未检出,这与前人研究的结果是非常相似的:Fourie等[20]研究澳洲坚果中的生育酚,发现与美国山胡桃和杏仁相比,其α-生育酚和δ-生育酚的含量较低(1.8 mg/kg);Kaijser等[21]研究发现了澳洲坚果油中几乎不含生育酚;Wall[22]对7个不同品种的澳洲坚果油的生物活性成分进行研究,发现大多数品种的澳洲坚果油中几乎不含生育酚,但却含有大量的生育三烯酚和角鲨烯;生育三烯酚比生育酚含有更多的双键,更易淬灭自由基反应,可能增加澳洲坚果油的氧化稳定性,这与前面研究发现澳洲坚果油的氧化诱导时间较长是相对应的,推测水剂法提取的澳洲坚果油中可能也含有大量的生育三烯酚。并且Kaijser等[21]也对新西兰地区的澳洲坚果油中甾醇含量进行分析,共鉴定出4种甾醇类,分别为谷甾醇、5-燕麦甾醇、菜油甾醇和豆甾醇,其总含量为105~179 mg/100 g,较本试验分析结果高,这可能与澳洲坚果的产地和品种有较大的关系。
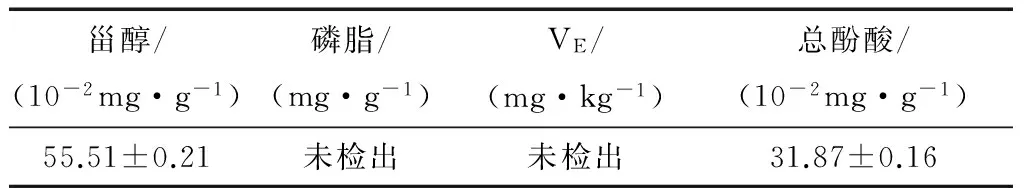
表2 水剂法提取澳洲坚果油的化学成分†
† 磷脂检出限为0.75 mg/g,VE检出限为2 mg/kg。
同时,从表2也可以看出,水剂法提取得澳洲坚果油中总酚酸含量为(31.87±0.16) mg/100 g,这与Quinn等[23]研究发现澳洲坚果仁及壳中的总酚酸类物质含量是相似的,且分离出4种酚类物质,同时发现带壳压榨的澳洲坚果油的氧化稳定性较纯仁压榨的更好,未精炼比精炼的更好,这些可能与油中酚类物质含量有关。
2.3 水剂法提取澳洲坚果油的脂肪酸组成
水剂法提取的澳洲坚果油的脂肪酸组成分析气相色谱图见图1,其脂肪酸种类、保留时间及各自所占的比例见表3。
由表3可知,澳洲坚果油中共检测出19种脂肪酸,以不饱和脂肪酸为主,含量达到83.45%,且主要为棕榈油酸和油酸,其含量分别为17.25%和61.44%。油酸由于可降低血液总胆固醇和有害胆固醇,却不降低有益胆固醇[4];同时油酸的充分摄取可促进人体钙、磷、锌等矿物质的吸收,因此澳洲坚果油是一种品质较好的植物油。其中单不饱和脂肪酸含量为81.36%,多不饱和脂肪酸含量为2.09%,饱和脂肪酸含量为16.55%。许良[19]26研究亚临界丁烷萃取的澳洲坚果油脂肪酸组成,共检测出11种脂肪酸,其中饱和脂肪酸占18.50%,不饱和脂肪酸占81.50%;魏长宾等[24]研究溶剂提取的澳洲坚果油脂肪酸组成,共检测出10种脂肪酸,且饱和脂肪酸占22.39%,不饱和脂肪酸占77.23%。说明不同提取方法得到的澳洲坚果油的脂肪酸组成存在一定的差异,但水剂法提取的澳洲坚果油中不饱和脂肪酸含量较高,饱和脂肪酸含量较低。此外,Kaijser等[21]研究新西兰产不同品种的澳洲坚果油脂肪酸发现单不饱和脂肪酸平均含量为80%,饱和脂肪酸含量为13.2%~17.8%,并且发现其存在4%左右的异油酸,而本试验中并未发现异油酸,可能与澳洲坚果的品种和产地等不同有较大的关系。
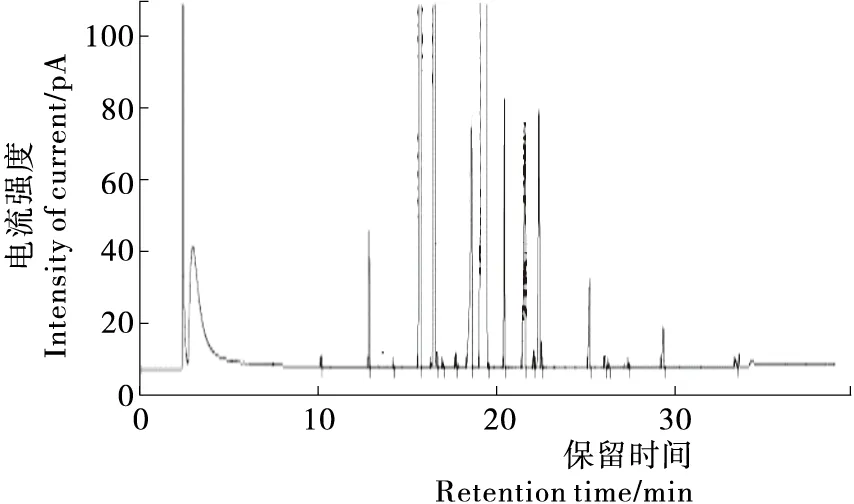
图1 气相色谱分析水剂法提取澳洲坚果油的脂肪酸组成谱图

保留时间/min化合物名称质量分数/%10.138月桂酸(C12:0)0.05712.825豆蔻酸(C14:0)0.62014.195十五烷酸(C15:0)0.00915.693棕榈酸(C16:0)8.25616.521棕榈油酸(C16:1)17.25216.953十七烷酸(C17:0)0.03117.679十七碳一烯酸(C17:1)0.07618.574硬脂酸(C18:0)3.49819.377油酸(C18:1n9c)61.44320.403亚油酸(C18:2n6c)1.64721.564花生酸(C20:0)2.82022.057亚麻酸(C18:3n3)0.11222.358二十碳烯酸(C20:1)2.56325.185山嵛酸(C22:0)0.84626.056二十碳三烯酸(C20:3n3)0.23526.263芥酸(C22:1n9)0.02527.390二十三烷酸(C23:0)0.03429.318木焦油酸(C24:0)0.37933.376二十二碳六烯酸(DHA)0.097
2.4 水剂法提取澳洲坚果油的红外光谱分析
采用傅里叶红外光谱对水剂法提取的澳洲坚果油结构进行分析,见图2。图2中,3 000~2 750 cm-1处吸收带代表的是—CH3、—CH2、—CH的特征吸收峰,1 750 cm-1处吸收带代表的是长链脂肪酸中羰基、甲酯基、酮类和醛类的特征吸收蜂,1 200 cm-1处吸收带代表的是不饱和酯的特征吸收峰,1 290~1 040 cm-1处吸收带代表的是醇类、酯类、醚类、羧酸类和脂肪酸的特征吸收峰,750 cm-1处吸收带可能与脂肪酸中脂肪族链的链接顺序有关,这与Albuquerque等[25]研究的布荔蒂油和巴巴苏仁油的红外光谱图和Santos等[26]研究的巴西坚果油的红外光谱是非常相似的。同时,从图2中可以发现,红外光谱图在2 900,1 600,750 cm-1处具有较强吸收,这与Silverstain等[27]和Reda等[28]报道不饱和脂肪酸中双健的功能基团(C—H和C═O)在2 900,1 600,750 cm-1处具有较强的特征吸收是相吻合的,说明水剂法提取的澳洲坚果油含有大量的不饱和双健,这也验证了脂肪酸组分分析的结果。
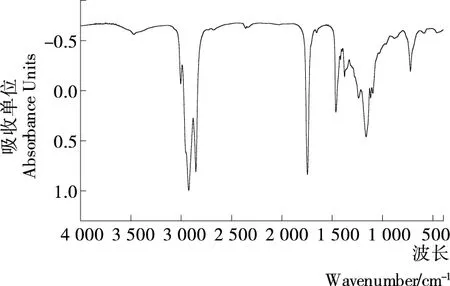
图2 水剂法提取澳洲坚果油的红外图谱
2.5 水剂法提取澳洲坚果油的抗氧化活性分析
DPPH自由基的清除能力可以用来综合评价澳洲坚果油的抗氧化活性。图3显示了澳洲坚果原油、极性组分和非极性组分对DPPH自由基的清除能力。由图3可知,澳洲坚果油对DPPH自由基都有一定的清除能力,且澳洲坚果原油对DPPH自由基的清除能力较极性组分和非极性组分强,同时,随着澳洲坚果油组分浓度的增加,其清除能力也增强,100%澳洲坚果油的清除能力达到89.84%,极性组分和非极性组分的清除能力分别为65.08%和45.45%,说明水剂法提取的澳洲坚果油具有较强的抗氧化活性。这与Miraliakbari等[29]研究发现树坚果油的氯仿/甲醇提取物比正己烷提取物的清除DPPH能力更强是极其相似的;同时,Prado等[30]研究花生油的抗氧化活性,发现花生油较强的抗氧化活性与其中含有较高的酚类物质有关。因此,澳洲坚果有具有较强的抗氧化活性可能也与其总酚酸、不饱和脂肪酸含量等较高有关。

图3 水剂法提取澳洲坚果油的抗氧化活性
3 结论
研究水剂法提取的澳洲坚果油,发现其过氧化值、酸价、碘值、皂化值、折光率、水分及挥发物含量分别为0.59 mmol/kg、0.28 mg KOH/g、74.21 g/100 g、198.78 mg KOH/g、1.466 8、0.36%;傅里叶红外光谱分析显示水剂法提取的澳洲坚果油具有坚果油的特征吸收;组分分析发现其不饱和脂肪酸含量为83.45%,其中棕榈油酸和油酸含量分别为17.25%和61.44%;甾醇含量为55.51 mg/100 g;总酚酸含量为31.87 mg/100 g;抗氧化活性分析发现其氧化诱导时间为11.44 h,清除DPPH自由基的能力达89.84%,这说明水剂法提取的澳洲坚果油具有良好的抗氧化能力。与黄宗兰[10]、范晓波[11]、许良[15]等对澳洲坚果油的研究相比,本研究更全面系统地对水剂法提取的澳洲坚果油的理化指标、化学组成及抗氧化活性进行了研究,这为澳洲坚果产业的健康发展提供了一条有效的途径,同时也为水剂法提取的澳洲坚果油的开发及应用提供科学的理论依据。
[1] 范方宇, 阚欢, 刘建琴, 等. 澳洲坚果蛋白酶解工艺及抗氧化性研究[J]. 食品科技, 2011, 36(12): 230-233.
[2] DUXBURY D. Lipid scientists shake healthy macadamia nut tree [J]. Food Processing, 1995, 54(6): 83.
[3] 刁卓超, 杨薇, 李建欢, 等. 澳洲坚果热风干燥特性研究[J]. 食品与机械, 2010, 26(6): 44-46.
[4] 刘建福, 黄莉. 澳洲坚果的营养价值及其开发利用[J]. 中国食物与营养, 2005(2): 25-26.
[5] VENKATACHALAM M, SATHE S K. Chemical composition of selected edible nut seeds [J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 4 705-4 714.
[6] 赵静, 唐君海, 王文林, 等. 澳洲坚果营养成分分析[J]. 农业研究与应用, 2013(3): 24-25.
[7] 倪秀梅. 坚果的营养及其对心血管疾病危险性的保护作用 [J]. 山东食品科技, 2003(7): 14-16.
[8] 陆雅丽, 王明力, 闫岩, 等. 微波辅助提取薏苡仁油的工艺优化[J]. 食品与机械, 2014, 30(3): 198-200.
[9] 倪培德. 植物油制取与加工工艺学[M]. 无锡: 无锡轻工业学院, 1993: 88-90.
[10] 黄宗兰, 钟俊桢, 熊洋, 等. 水剂法提取澳洲坚果油及其理化特性的研究[J]. 中国粮油学报, 2015, 30(11): 86-90.
[11] 范晓波. 澳洲坚果油水剂法提取工艺的研究[J]. 中国油脂, 2016, 41(6): 15-18.
[12] International Olive Council. Determination of the composition and content of sterols by capillary-column gas chromatography[S]. IL: English, 2013.
[13] American Oil Chemists’ Society. Official methods and recommended practices of the AOCS[M]. IL: Champaign, 2009: 8-89.
[14] American Oil Chemists’ Society. Official Methods and Recommended Practices of the AOCS[M]. IL: Champaign, 1998: 15.
[15] CHEN Jun, LIANG Rui-hong, LIU Wei, et al. Degradation of high-methoxyl pectin by dynamic high pressure microfluidization and its mechanism[J]. Food Hydrocolloids, 2012, 28(1): 121-129.
[16] 许良, 叶丽君, 黄雪松, 等. 亚临界丁烷萃取澳洲坚果油工艺及品质研究[J]. 中国粮油学报, 2015, 30(6): 79-83.
[17] LEE Jae-min, LEE Jae-hwan, CHANG Pahn-shick, et al. Development of a method predicting the oxidative stability of edible oils using 2,2-diphenyl-1-picrylhydrazyl (DPPH)[J]. Food Chemistry, 2007, 103(2): 662-669.
[18] LIU Wei, FU Yu-jie, ZU Yuan-gang, et al. Supercritical carbondioxide extraction of seed oil from Opuntia dillenii Haw. and its antioxidant activity[J]. Food Chemistry, 2009, 114(1): 334-339.
[19] 许良. 亚临界丁烷萃取澳洲坚果油及脱脂粉多糖的纯化研究[D]. 广州: 暨南大学, 2015.
[20] FOURIE P C, BASSON D S. Changes in tocopherol content of almond, pecan and macadamia kernels during storage[J]. Journal American Oil Chemists Society, 1989, 66: 1 113-1 115.
[21] KAIJSERA A, DUTTA P, SAVAGE G. Oxidative stability and lipid composition of macadamia nuts grown in New Zealand[J]. Food Chemistry, 2000, 71(1): 67-70.
[22] WALL M M. Functional lipid characteristics, oxidative stability, and antioxidant activity of macadamia nut (Macadamia integrifolia) cultivars[J]. Food Chemistry, 2010, 121(4): 1 103-1 108.
[23] QUINN L A, TANG H H. Antioxidant properties of phenolic compounds in macadamia nuts[J]. JAOCS, 1996, 73(11): 1 585-1 588.
[24] 魏长宾, 刘胜辉, 臧小平, 等. 澳洲坚果油脂肪酸组成分析[J]. 中国油脂, 2008, 33(9): 75-76.
[25] ALBUQUERQUEA M L S, GUEDES I, ALCANTARA P, et al. Infrared absorption spectra of Buriti (Mauritiaexuosa L.) oil[J]. Vibrational Spectroscopy, 2003, 33: 127-131.
[26] SANTOS O V, CORRA N C F, CARVALHO Jr R N, et al. Yield, nutritional quality, and thermal-oxidative stability of Brazil nut oil (Bertolletia excelsa H.B.K) obtained by supercritical extraction[J]. Journal of Food Engineering, 2013(117): 499-504.
[27] SILVERSTAIN R M, WEBSTER F X. Identicação espectrométrica de compostos orgnicos[J]. Rio de Janeiro, LTC, 2007, 12: 490.
[28] REDA S Y, CARNEIRO P B.leos e gorduras: aplicações e implicações[J]. Revista Analytica, 2007, 27: 60-67.
[29] MIRALLAKBARI H, SHAHIDI F. Oxidative stability of tree nut oils[J]. J. Agric. Food Chem., 2008, 56: 4 751-4 759.
[30] PRADOA A C P D, MANIONB B A, SEETHARAMAN K, et al. Relationship between antioxidant properties and chemical composition of the oil and the shell of pecan nuts [Caryaillinoinensis (Wangenh) C.Koch][J]. Industrial Crops and Products, 2013(45): 64-73.
Studied on antioxidant activities and compositions of macadamia nuts oil by aqueous extraction
DULi-qingSHUAIXi-xiangTUXing-haoZHANGMing
(SouthSubtropicalCropsResearchInstitute,ChineseAcademyofTropicalAgriculturalSciences,Zhanjiang,Guangdong524091,China)
Extracted kernel oil from dried Macadamia by aqueous method. Firstly, the basic physicochemical properties were analyzed, and then, the infrared characteristics, fatty acid, tocopherol, phospholipids, sterols of macadamia oil were analyzed by the method of IR, GC and HPLC, to determine the oxidation induction time and free radical scavenging capacity to evaluate the antioxidant capacity of macadamia nut oil. The results showed that the peroxide value, acid value, iodine value, saponification value, refractive index,moisture and volatile matter by aqueous extraction of macadamia nut oil were 0.59 mmoL/kg, 0.28 mg KOH/g, 74.21 g/100 g, 198.78 mg KOH/g, 1.466 8, 0.36%, respectively; the infrared spectrum shows that the macadamia nut oil has the characteristic absorption of the nut oil; fatty acid analysis revealed that the content of unsaturated fatty acid was 83.45%, of which the content of oleic acid and oleic acid were 17.25% and 61.44%, respectively; the content of the total phenolic and sterol were 31.87 and 55.51 mg/100 g, respectively, while phospholipids and tocopherol were not detected; the oxidation induction time of macadamia nut oil was 11.44 h, and the ability of free radical scavenging was 89.84%, which had good oxidation resistance.
macadamia nut oil, aqueous extraction, chemical composition, antioxidant
中央级公益性科研院所基本科研业务费专项资金项目(编号:1630062016006)
杜丽清(1976—),男,中国热带农业科学院南亚热带作物研究所副研究员,硕士。
E-mail:shuaixixiang1989@163.com
2016—08—26
10.13652/j.issn.1003-5788.2016.10.033
