红花籽油对D-半乳糖致衰老小鼠模型的抗衰老作用
2016-12-05韩小苗吴苏喜吴美芳
韩小苗 吴苏喜,2 吴美芳 马 斌,2
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410114;2. 长沙昊瑞生物科技有限公司,湖南 长沙 410114)
红花籽油对D-半乳糖致衰老小鼠模型的抗衰老作用
韩小苗1吴苏喜1,2吴美芳1马 斌1,2
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410114;2. 长沙昊瑞生物科技有限公司,湖南 长沙 410114)
为了研究红花籽油的抗衰老作用,采用红花籽油灌胃D-半乳糖致衰老小鼠模型,利用试剂盒测定这些小鼠脑肝组织的丙二醛(MDA)含量,单胺氧化酶(MAO)、谷胱甘肽过氧化酶(GSH-Px)及超氧化物歧化酶(SOD)活性。统计分析各组之间与衰老和抗衰老有关成分含量的差异显著性。结果表明:红花籽油组小鼠脑肝组织MDA含量和MAO活性显著(P<0.05)或极显著(P<0.01)低于衰老模型组;GSH-Px、总超氧化物歧化酶(T-SOD)、铜锌超氧化物歧化酶 (CuZn-SOD)和锰超氧化物歧化酶(Mn-SOD)活性极显著高于衰老模型组。红花籽油的抗衰老机制可能是:通过清除自由基,抑制自由基诱导的脂质过氧化反应,减少脂质过氧化物产生;通过改善机体新陈代谢,促进D-半乳糖分解和代谢,改善物质能量代谢,调节与衰老有关的基因表达,抑制MAO基因表达,降低脑肝组织的MAO含量;促进GSH-Px、CuZn-SOD和Mn-SOD基因表达,提高脑肝组织GSH-Px、CuZn-SOD和Mn-SOD含量。红花籽油能显著降低衰老模型小鼠脑肝组织MDA含量和MAO活性,显著提高GSH-Px、SOD-1和SOD-2活性,具有显著的抗老作用。
红花籽油;抗衰老;D-半乳糖;超氧化物歧化酶
红花籽为传统中药红花的种子,《本草纲目》中记载“红花出自西域,味甘无毒,其籽功能与花同”[1]。红花籽油是从红花籽中提取的一种草本植物油,含有丰富的不饱和脂肪酸,其中亚油酸含量高达73%~85%[2-4]。此外红花籽油还含有维生素、甾醇等活性物质[5-6]。研究[7]表明,红花籽油具有降血脂、软化血管及促进微循环等功效。蔺新英等[8]发现,红花籽油可有效调节家兔血脂及阻止家兔体内脂质过氧化物产生。韩荣等[9]发现红花籽油可有效提高细胞对氧化应激损伤的耐受性,减少细胞氧化损伤。但目前对红花籽油体内抗氧化、抗衰老作用尚未进行系统而深入研究,缺少动物试验数据。
由D-半乳糖诱导的衰老动物模型是根据衰老过程中代谢紊乱原理设计的综合动物模型。其每一个器官都表现不同程度的衰老症状,体内与衰老有关的生化成分也发生相应的变化。这种衰老动物模型是研究抗衰老效应的理想工具,已被广泛用于药物和功能食品的抗衰老作用研究[10-13]。例如王丽梅等[14]利用衰老动物模型研究了紫苏油对衰老大鼠的体能、学习记忆能力、SOD活力、MDA含量的影响。 刘丛彬等[15]利用衰老动物模型研究了牡丹籽油体内外抗氧化作用。衰老期间,机体的丙二醛(MDA )含量和单胺氧化酶(MAO)活性增加,而超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性减少。通过检测MDA的含量及MAO、SOD和GSH-Px的活性,可以评判机体衰老和健康的程度[16-18]。本试验利用D-半乳糖建立衰老小鼠模型,用现代药理学方法探讨了红花籽油的体内抗氧化、抗衰老作用,旨在为红花籽油的开发利用提供科学依据。
1 材料与方法
1.1 试剂与仪器
红花籽油:压榨一级油,新疆察布查尔西伯自治县沁源油脂有限责任公司;
丙二醛(MDA)、单胺氧化酶(MAO)、超氧化物歧化酶(SOD)分型、谷胱甘肽过氧化物酶(GSH-Px)、总蛋白(TP)测定试剂盒:南京建成生物工程研究所;
D-半乳糖、无水乙醇、冰醋酸均为分析纯;
紫外可见分光光度计:UV752N型,上海仪电分析仪器有限公司;
气相色谱仪:GC-14C PF型,Shimadzu Suzhou Instruments Mfg.Co.Ltd,145 Huashan Road。
1.2 试验方法
1.2.1 红花籽油的脂肪酸组成及含量测定 采用气相色谱法。检测条件:色谱柱为 DB-WAX(30 m×0.25 mm×0.25 μm)毛细管柱,柱温190 ℃,恒温20 min;进样口温度250 ℃,不分流进样;载气(氮气99.995%)流速1 mL/min,柱压2.291×10-3Pa;检测器:FID氢离子火焰检测器,温度240 ℃进样量1 μL。
1.2.2 试验动物及分组
(1) KM(昆明)小鼠:SPF(清洁健康)级,雄性,月龄4月,体重(30±5) g,长沙天勤生物技术有限公司。
(2) 受试动物分组:KM小鼠40只,适应性喂养7 d后,随机分为4组,每组10只,即正常对照组、衰老模型组、红花籽油低剂量组、红花籽油高剂量组。
1.2.3 红花籽油用量的确定 参照中国营养学会膳食平衡宝塔内推荐的食用油的食用量为每人每天25 g,根据余德林等[19]的研究结果,每公斤体重给予3 mL红花籽油可有效降低高脂血症小鼠的胆固醇(TC)、甘油三酯(TG)含量(P<0.01)以及显著降低低密度脂蛋白胆固醇(LDL-C)含量(P<0.05)。故本研究采用3 mL/(kg·d)剂量为红花籽油的低剂量;高剂量为低剂量的2倍,即6 mL/(kg·d)。
1.2.4 衰老动物模型的建立和抗衰老饲养试验 衰老模型组、红花籽油低剂量组、红花籽油高剂量组的小鼠每日颈背部皮下注射5%D-半乳糖125 mg/(kg·d)(0.2 mL),建立衰老动物模型。正常对照组每日颈背部皮下注射0.2 mL生理盐水。注射D-半乳糖后,给红花籽油低剂量组小鼠灌胃红花籽油3 mL/(kg·d),高剂量组小鼠灌胃红花籽油6 mL/(kg·d)。给衰老模型组和正常对照组小鼠灌胃6 mL/(kg·d)的蒸馏水。以上每只老鼠的灌胃剂量始终相同。每日同一时间段进行注射和灌胃处理,连续进行42 d。饲养期间,让受试小鼠自由摄取饲料和饮用水。
1.2.5 观察与记录 试验期间观察和记录试验小鼠皮毛状态、行为表现、粪尿情况、摄食量(次/每天)、体重(次/每周)等。
1.2.6 脑组织和肝脏组织匀浆制备及生化指标测定 饲养试验末(第42天),受试小鼠禁食12 h。摘除眼球取血用于生化分析。处死小鼠,迅速取脑组织和肝脏,用4 ℃生理盐水冲洗干净,用滤纸擦干,称重,剪碎,放入匀浆器内,按1∶9(g/mL)比例加入生理盐水,冰浴条件下匀浆10 min,分别制备10%的脑组织和肝脏组织匀浆,离心10 min(2 500 r/min),取上清液,置-60 ℃下保存备用。然后,按照试剂盒说明书,采用紫外可见分光光度计分别测定脑肝组织的总蛋白(TP)、丙二醛(MDA)的含量及单胺氧化酶(MAO)、谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)、铜锌超氧化物歧化酶[CuZn-SOD(SOD-1)]活性,用T-SOD含量减去CuZn-SOD含量得到锰超氧化物歧化酶 [Mn-SOD(SOD-2)]含量。
2 结果与分析
2.1 红花籽油脂肪酸组成及含量的气相色谱测定
红花籽油的脂肪酸组成和含量见表1。
2.2 试验小鼠的外观、体重和摄食量的变化
试验期间,受试小鼠无一死亡。试验结束时,衰老模型组小鼠行动迟缓、毛发稀疏、发黄而无光泽、性情暴躁、大便较稀(轻度腹泻),表现明显衰老症状;正常对照组小鼠状态良好、反应灵敏、毛色光泽、耳色红润、大便正常;红花籽油低、高剂量组小鼠的皮毛略有发黄,大便湿润但无腹泻,与对照组小鼠无明显差异。各组小鼠体重与摄食量的变化见表2、3。

表1 红花籽油的脂肪酸组成和含量
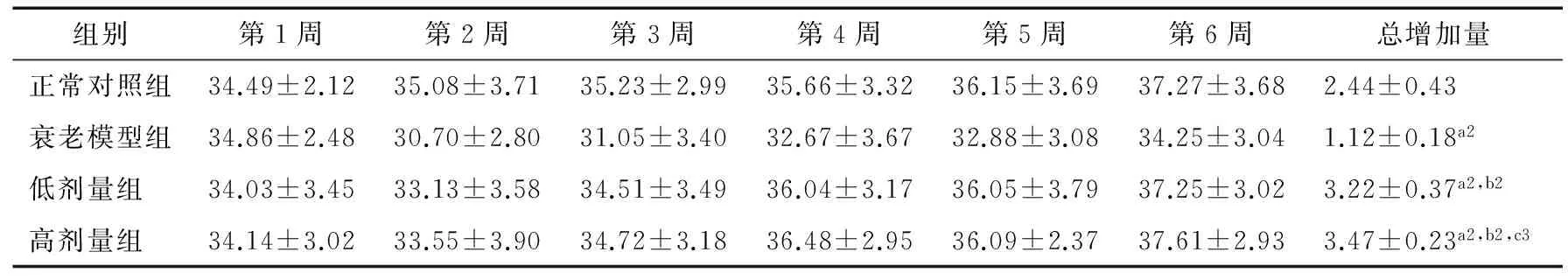
表2 各组小鼠体重的变化†
† a表示与正常对照组相比,a1为P<0.05,a2为P<0.01;b表示与衰老模型组相比,b1为P<0.05,b2为P<0.01;c表示高剂量组与低剂量组相比,c3为P>0.05。
† a表示与正常对照组相比,a1为P<0.05,a3为P>0.05;b表示与衰老模型组相比,b3为P>0.05;c表示高剂量组与低剂量组相比,c3为P>0.05。
由表2可知,试验结束时衰老模型组小鼠体重总增加量显著性低于正常对照组(P<0.05)。低、高剂量组小鼠体重总增加量都极显著性高于正常对照组及衰老模型组(P>0.01),但低、高剂量组两组间小鼠体重总增加量无显著性差异。
由表3可知,衰老模型组、红花籽油高剂量组小鼠总摄食量显著低于正常对照组(P<0.05)。但低剂量组与对照组无显著差异(P>0.05)。低、高剂量组小鼠摄食量与衰老模型组无显著差异;低、高剂量组之间小鼠摄食量也无显著差异(P>0.05)。由此可知,红花籽油的剂量高低对小鼠的摄食量不会产出明显影响。可能是红花籽油的添加并不会影响小鼠的食欲,所以摄食量没有明显变化。
2.3 红花籽油对小鼠脑及肝脏组织中MDA含量的影响
利用MDA试剂盒测定各组小鼠脑及肝脏组织中MDA含量,结果见表4。
本试验选用小鼠脑、肝组织的MDA含量作为检测抗衰老的指标,主要依据是Harman D 于1956年提出的氧化自由基学说[20]。该学说认为,人体细胞代谢过程中不断产生氧化能力极强的自由基,过量的自由基易与细胞膜中的不饱和脂肪酸发生脂质过氧化反应形成LPO(脂质过氧化物),LPO的降解产物MDA能使膜蛋白、酶等发生交联反应,使膜通透性降低,影响细胞物质交换,继而使之破裂、死亡;自由基还可氧化核酸、蛋白、糖等生命物质,使其形态、结构、功能发生改变进而导致机体衰老[21]。由表4可知,衰老模型组小鼠脑、肝组织的MDA含量显著(P<0.05)或极显著高于正常对照组(P<0.01)。红花籽油低、高剂量组小鼠脑肝组织的MDA含量略高于正常对照组,但差异不显著。红花籽油低、高剂量组小鼠肝组织MDA含量都显著低于衰老模型组(P<0.05),但脑组织MDA含量略低于衰老模型组,但差异不显著。低、高剂量组两组间小鼠脑、肝组织的MDA含量无显著性差异。因此添加红花籽油可以减少小鼠脑、肝组织的MDA的含量,具有抗衰老作用。这可能与红花籽油富含VE有关。VE是一种天然抗氧化剂, 对小鼠的细胞分裂、延缓衰老有着重要作用。

表4 各组小鼠脑及肝组织的MDA含量比较†
† a表示与正常对照组相比,a2为P<0.01,a3为P>0.05;b表示与衰老模型组相比,b1为P<0.05;c表示高剂量组与低剂量组相比,c3为P>0.05。
2.4 红花籽油对小鼠脑、肝组织MAO、GSH-PX活性的影响
利用 MAO和GSH-Px试剂盒测定各组小鼠脑、肝组织MAO和GSH-Px的活性,结果见表5。
脑、肝组织是体内氧负荷最大的器官之一。MAO的活性与机体的衰老有密切关系,MAO的升高与体内“生化损伤”呈正相关,是机体损伤的重要标记酶之一[22]。GSH-Px即谷胱甘肽过氧化物酶,可以清除活性氧和OH-诱发的脂质过氧化物,保护细胞膜结构和功能的完整性。故MAO和GSH-Px活性是研究衰老模型的重要指标。由表5可知,衰老模型组小鼠脑、肝组织MAO活性极显著高于正常对照组(P<0.01);而GSH-Px活性极显著低于正常对照组(P<0.01)。除脑组织的GSH-Ps活性显著低于正常对照组(P<0.05)以外,红花籽油低、高剂量组小鼠脑、肝组织MAO和GSH-Ps活性与正常对照组没有显著差异。红花籽油低、高剂量组小鼠脑、肝组织MAO活性极显著低于衰老模型组(P<0.01),而GSH-Px活性显著或极显著高于衰老模型组(P<0.05或P<0.01)。低、高剂量组两组间小鼠脑肝组织的MAO和GSH-Px活性无显著性差异。由此可知,红花籽油具有抗衰老作用。这可能是红花籽油抑制衰老小鼠MAO基因表达,促进GSH-Px基因表达的结果。
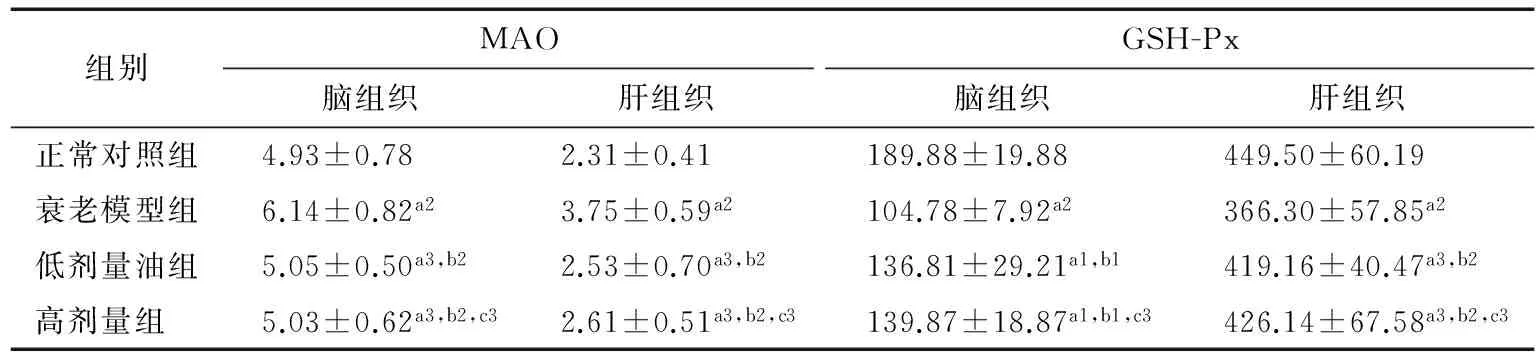
表5 各组小鼠脑、肝组织的MAO及GSH-Px活性比较†
† a表示与正常对照组相比,a1为P<0.05,a2为P<0.01,a3为P>0.05;b表示与衰老模型组相比,b1为P<0.05,b2为P<0.01;c表示高剂量组与低剂量组相比,c3为P>0.05。
2.5 红花籽油对小鼠脑、肝组织T-SOD、CuZn-SOD、Mn-SOD活性的影响
采用SOD分型试剂盒测定各组小鼠脑、肝组织T-SOD和CuZn-SOD的活性,利用T-SOD含量减去CuZn-SOD含量得到Mn-SOD含量,结果见表6、7。
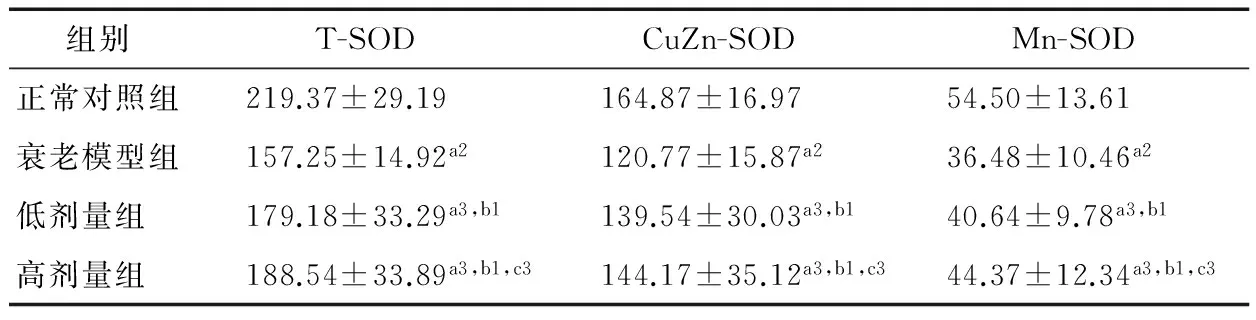
表6 各组小鼠脑组织的T-SOD、CuZn-SOD和Mn-SOD活性比较†
† a表示与正常对照组相比,a2为P<0.01,a3为P>0.05;b表示与衰老模型组相比,b1为P<0.05;c表示高剂量组与低剂量组相比,c3为P>0.05。
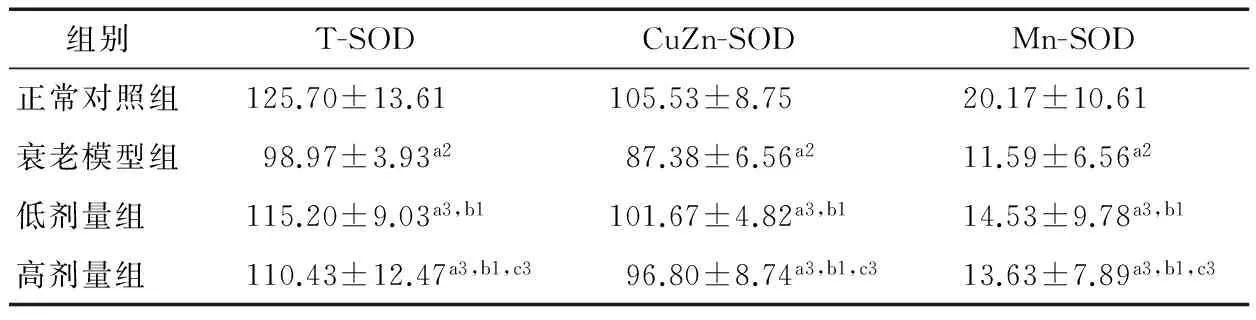
表7 各组小鼠肝组织的T-SOD、CuZn-SOD和Mn-SOD活性与比较†
† a表示与正常对照组相比,a1为P<0.05,a2为P<0.01,a3为P>0.05;b表示与衰老模型组相比,b1为P<0.05;c表示高剂量组与低剂量组相比,c3为P>0.05。
SOD作为体内重要的抗氧化酶,它能使超氧化阴离子自由基变为过氧化氢和氧离子,从而减少脂质过氧化反应,使机体组织和细胞免受损害。测定抗氧化酶SOD的活性可了解机体衰老的程度。因此,本试验选取T-SOD、CuZn-SOD及Mn-SOD作为研究对象。由表6和表7可知,衰老模型组小鼠脑、肝组织的T-SOD、CuZn-SOD及Mn-SOD活性显著低于正常对照组(P<0.01)。红花籽油低、高剂量组小鼠脑、肝组织的T-SOD、CuZn-SOD及Mn-SOD活性与正常对照组没有显著差异,但显著高于衰老模型组(P<0.05)。低剂量组小鼠脑、肝组织的T-SOD、CuZn-SOD及Mn-SOD活性与高剂量组小鼠无显著性差异。衰老机体内存在大量的自由基。SOD作为抗氧化酶之一,能够清除氧自由基从而保护细胞不受损伤。SOD因清除自由基而过度消耗,导致SOD含量相应减少,但是添加红花籽油后可以显著增加小鼠脑肝组织的T-SOD、CuZn-SOD及Mn-SOD含量,增加机体的抗氧化能力,从而达到抗衰老的目的。
3 讨论与结论
本试验给小鼠颈部皮下连续注射D-半乳糖42 d后,衰老模型组小鼠体内MDA含量和MAO活性比对照组小鼠显著升高,GSH-Px和SOD-1和SOD-2活性显著降低。因此,本试验所造衰老小鼠模型是成功的,并证明D-半乳糖能够诱导小鼠快速衰老。红花籽油能显著降低小鼠机体的MDA含量与MAO活性、显著提高小鼠机体GSH-Px、T-SOD、CuZn-SOD及Mn-SOD活性,具有显著的抗衰老作用。
红花籽油的抗衰老作用机制可能是:红花籽油含有丰富的亚油酸。亚油酸是人体必需脂肪酸,其化学结构中含有多个不饱和化学键,在体外能够捕捉自由基,或与过氧化物结合,消除过氧化物的有害作用。它还能促进胆固醇代谢,清除血管壁上的沉积物,具有抑制脂代谢紊乱的效果[23-25]。红花籽油含有丰富的VE、植物甾醇、黄酮等活性物质。它们通过清除自由基,抑制自由基诱导的脂质过氧化反应,从而降低脑、肝组织的MDA含量[26-28];红花籽油具有很强的活血通经作用[29],通过扩张血管、改善微循环,促进机体新陈代谢,加速D-半乳糖分解和代谢,防止D-半乳糖转化为半乳糖醇。调节与衰老有关的基因表达:一方面抑制能引起机体衰老的MAO基因表达,从而降低脑、肝组织的MAO活性,防止单胺类物质(神经递质)被过度分解,以保持机体健康,延缓衰老;另一方面促进抗氧化酶(抗衰老酶)GSH-Px、SOD-1和SOD-2基因表达[30-32],从而提高组织细胞的GSH-Px、SOD-1和SOD-2活性以及SOD总活性,增强机体清除自由基和过氧化物的能力,降低脑、肝组织的MDA含量,提高机体的抗衰老作用。
若要清楚地了解红花籽油的抗衰老机制还需从分子水平对其进行更深入的研究,比如研究红花籽油对衰老相关基因的表达谱等。随着人们对红花籽油功能的不断探索与研究,红花籽油新功能及其作用机制将逐步被阐明。
结论:红花籽油能显著降低小鼠机体的MDA含量与MAO活性、显著提高小鼠机体GSH-Px、T-SOD、CuZn-SOD及Mn-SOD活性,具有显著的抗衰老作用。
[1] 李时珍. 本草纲目: 上册[M]. 北京: 人民卫生出版社, 1977: 1 029-1 030.
[2] 周震, 李娟. 红花油脂肪酸的质谱分析[J]. 中成药, 1995, 17(6): 35-36.
[3] BRATCHER Sharon S, KEMMERER A R, RUBIS D D. Oxidative stability of safflower oil[J]. Journal of the American Oil Chemists Society, 1969, 46(3): 173-175.
[4] HAN Xiao-jin, CHENG Le-ming, ZHANG Rong, et al. Extraction of safflower seed oil by supercritical CO2[J]. Journal of Food Engineering, 2009, 92(4): 370-376.
[5] 王兆木, 阿尔斯坦格罗夫·山布·山明. 红花籽油的营养价值与保健作用[J]. 新疆农业科学, 2006, 43(1): 57-60.
[6] 陶海荣, 高修库, 肖吾开提, 等. 红花籽油中不皂化物成分的分析[J]. 中国油料作物学报, 2000, 22(4): 40-42.
[7] GUO Jian-xia, WANG Chang-lu, WU Zhi-jian. Study on hypolipidemic activities of safflower seed oil[J]. Applied Mechanics and Materials, 2013, 275-277: 1 640-1 645.
[8] 蔺新英, 徐贵发, 王淑娥, 等. 红花籽油对动脉粥样硬化家兔血脂及脂质过氧化作用的影响[J]. 山东医科大学学报, 2001, 39(3): 212-214.
[9] 韩荣, 吴桂荣, 张彤, 等. 配伍红花籽油对大鼠嗜铬细胞瘤细胞抗氧化损伤的保护作用[J]. 西北药学杂志, 2009, 24(4): 276-278.
[10] LU Jun, ZHENG Yuan -lin, WU Dong-mei, et al. Ursolic acid ameliorates cognition deficits and attenuates oxidative damage in the brain of aging mice induced byD-galactose[J]. Biochem Pharmacol, 2007, 74: 1 078-1 090.
[11] 王燕, 陶钧. 复合维生素对D-半乳糖小鼠衰老模型的抗衰老作用[J]. 食品与机械, 2012, 26(2): 64-66.
[12] SONG Xu, BAO Ming-min, LI Dian-dong, et al. Advanced glycation inD-galactose induced mouse aging model[J]. Mechan Age Devel, 1999, 108: 239-251.
[13] ZHANG Xiu-li, JIANG Bo, LI Zhi-bo, et al. Catalpol ameliorates cognition deficits and attenuates oxidative damage in the brain of aging mice induced byD-galactose[J]. Pharmacol, Biochem Behav, 2007, 88: 64-72.
[14] 王丽梅, 叶诚, 吴晨, 等. 紫苏油对衰老模型大鼠的抗衰老作用研究[J]. 食品科技, 2013, 38(1): 280-284.
[15] 刘丛彬, 宣子华, 董振兴, 等. 牡丹籽油体外及对脂代谢紊乱大鼠体内抗氧化作用的研究[J]. 中国粮油学报, 2014, 29(6): 53-55.
[16] NIEMEN D C. Exercise, upper respiratory tract infectionand the immene system[J]. Med. Sci. Sports Exerci., 1994, 26(2): 128-139.
[17] OH Chang-Young, LEE Kyung-Joon, LEE Jae-Cheon, et al. Differences of physiological injury and antioxidative reaction among three half-sib families of betula schmidtii to Cd treatment[J]. Journal of Korean Forestry Society, 2004, 93(7): 428-435.[18] ALVAREZ Garcia O, VEGA-NAREDO I, SIERRA V, et al.Elevated Oxidative Stress in the Brain of Senescence-accelerated Mice at 5 Months of age[J]. Biogerontology,2006,7: 43-52.
[19] 余德林, 马超英, 宋磊, 等. 紫苏籽油与红花籽油联合使用降血脂研究[J]. 中国油脂, 2014(12): 35-38.
[20] HARMAN D. Aging:a theory based on free radical and radiation chemistry[J]. J. Gerontol, 1956, 11(3): 298-300.
[21] 郭晓峰, 冯玉华, 赵延龙, 等. 大黄(庶虫)虫丸、当归补血汤对D-半乳糖致衰老小鼠血清中SOD和MDA影响的实验研究[J]. 山西中医学院学报, 2012(5): 17-19.
[22] 邓红, 李洁莹, 甘雨, 等. 蛋白质粉对老龄大鼠抗衰老作用的研究[J]. 营养学报, 2013(4): 361-364.
[23] 韩立强, 刘喜阳, 庞坤. 共轭亚油酸生理机制的研究进展[J]. 信阳农业高等专科学校校报, 2013, 23(3): 103-106.
[24] 刘小娟, 庞广昌, 李杨.ω-6亚油酸对小鼠免疫系统的调节作用[J]. 食品科学, 2010, 31(23): 375-379.
[25] LAPARRA J M, SANZ Y. Interactions of gut microbiota with functional food components and nutraceuticals[J]. Pharmacological Research, 2009, 11: 1-5.
[26] 王艺蓉, 白成勇. 红花的作用及机制研究进展[J]. 滨州医学院学报, 2009, 32(6): 451-453.[27] 金鸣, 李金荣, 吴伟. 红花黄色素抗氧化作用的研究[J]. 中国中药杂志, 2004, 29(5): 447-449.
[28] 刘志峰, 李萍, 李桂生, 等. 红花提取物抗血小板聚集及抗血栓作用的观察[J]. 中药药理与临床, 2000, 16(6): 20-21.
[29] 万秋, 刘秀明, 杨文婷, 等. 红花色素研究概述[J]. 生命的化学, 2013, 33(2): 54-58.
[30] GIZELLA Csire, JZSEF Demjén, SAROLTA Timári, et al. Electrochemical and SOD activity studies of copper(II) complexes of bis(imidazol-2-yl) derivatives[J]. Polyhedron, 2013, 61: 202-212.
[31] LIU Hui-hui, HE Jian-yu, CHI Chang-feng, et al. Identification and analysis of icCu/Zn-SOD, Mn-SOD and ecCu/Zn-SOD in superoxide dismutase multigene family of Pseudosciaena crocea[J]. Fish & Shellfish Immunology, 2015, 43: 491-501
[32] EDWARD S M Bahnsona, NATHANIEl Kooa, NADIEZHDA Cantu-Medellin, et al. Nitric oxide inhibits neointimal hyperplasia following vascular injury via differential,cell-specific modulation of SOD-1 in the arterial wall[J]. Nitric Oxide, 2015, 44C: 8-17.
Study on anti-aging effect of safflower oil on the mouse model aged byD-galactose
HANXiao-miao1WUSu-xi1,2WUMei-fang1MABin1 2
(1.CollegeofChemicalandBiologicalEngineering,ChangshaUniversityofScienceandTechnology,ChangshaHunan410114,China; 2.ChangshaHaoruiBio-technologyLtd.Co.,Changsha,Hunan410114,China)
To study the anti-aging functions of safflower oil, mice model aged byD-galactose were administered safflower oil by oral gavage. The content of malondialdehyde (MDA) and the activity levels of monoamine oxidase (MAO), glutathione peroxidase (GSH-Px), and superoxide dismutase (SOD) in the brain and liver of these mice were determined with biochemical kits, respectively. The significance of the differences in the content of the components associated with aging and anti-aging among each group was analyzed statistically. The main results were as follows. The MDA content and the activity level of MAO in the brain and liver of mice in the groups administered safflower oil were significantly lower (P<0.05) or very significantly lower (P<0.01) than those of the aging model group. However, the activity levels of GSH-Px, total SOD (T-SOD), CuZn-SOD, and Mn-SOD in the brain and liver of the mice were very significantly higher than those of the aging model group. It was supposed that the anti-aging mechanism of Safflower seed oil might be it could inhibit the lipid peroxidation induced by free radicals and reduces lipid peroxide by scavenging free radicals. By improving body's metabolism, it promoted the decomposition and metabolism ofD-galactose, and improved the material energy metabolism, and then regulated the expression of genes related to aging. Meanwhile, the expression of MAO gene was inhibited to reduce MAO content in liver and brain, which resulted in promoting the expression of the genes, including GSH-Px, CuZn-SOD, and Mn-SOD. This could increase the content of GSH-Ps, CuZn-SOD, and Mn-SOD both in liver and brain. We concluded that the safflower seed oil could significantly reduce content of MDA and MAO and increase that of GSH-Ps, CuZn-SOD, and Mn-SOD in liver and brain of aging mice models, performing the obvious anti-aging function.
safflower oil; anti-aging;D-galactose; SOD
湖南省科技计划项目(编号:2016NK2136);长沙市科技计划项目(编号:k150189-21)
韩小苗,女,长沙理工大学在读硕士研究生。
吴苏喜 (1965-),男,长沙理工大学教授,博士。
E-mail:wusuxi@126.com
2016—07—12
10.13652/j.issn.1003-5788.2016.10.030
