加工条件对辣木籽肽抗氧化活性的影响
2016-12-05刘华勇赵强忠马彩霞林恋竹廖超林陈国慧古坚银
刘华勇 赵强忠 马彩霞 林恋竹 廖超林 陈国慧 古坚银
(1. 华南理工大学食品科学与工程学院,广东 广州 510640;2. 浙江大学生物系统工程与食品学院,浙江 杭州 310058;3. 广东华谷辣木生物科技有限公司,广东 广州 510760)
加工条件对辣木籽肽抗氧化活性的影响
刘华勇1赵强忠1马彩霞2林恋竹1廖超林3陈国慧3古坚银3
(1. 华南理工大学食品科学与工程学院,广东 广州 510640;2. 浙江大学生物系统工程与食品学院,浙江 杭州 310058;3. 广东华谷辣木生物科技有限公司,广东 广州 510760)
在水酶法制取辣木籽抗氧化肽的基础上,研究温度、pH、金属离子、糖类对辣木籽肽抗氧化活性的影响。结果表明:115 ℃加热20 min可显著提高辣木籽肽的抗氧化活性;辣木籽肽在酸性环境下抗氧化活性较高;酸性条件下,辣木籽肽加热后,其抗氧化活性提升较大;非热处理条件下,随着金属离子浓度的升高,辣木籽肽的抗氧化活性均有不同程度的提高;热处理条件下,随着Ca2+、Mg2+、Zn2+、K+浓度的升高,辣木籽肽的抗氧化活性变化不大,但略有降低,然而,随着Cu2+浓度的增加,辣木籽肽抗氧化活性显著提高;热处理条件下,加入糖类物质包括:果糖、半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖、低聚半乳糖会大大提高辣木籽糖的抗氧化活性,各种糖对辣木籽肽抗氧化活性提升的高低顺序为:果糖>半乳糖>低聚半乳糖>葡萄糖>乳糖=蔗糖=甘露糖=麦芽糖。该研究对辣木籽肽作为功能性配料用于食品开发具有指导意义。
辣木籽;肽;抗氧化;稳定性
辣木籽含有丰富的油脂、蛋白质及矿物元素,可用于食品、医药、化妆品和润滑剂等方面的产品开发,具有良好的应用前景。其油脂含量为38%,是一种优质油脂来源。辣木籽油不饱和脂肪酸含量丰富,主要为油酸(占70%),油酸含量高的油脂还包括:玉米油、葵瓜籽油、菜籽油等,其中辣木籽油营养丰富,热稳定性高,是理想的健康用油[1-2]。辣木籽蛋白质含量为38%,含有17种氨基酸,Val、Ile、Leu、Phe+Tyr、Lys的含量接近或远远高于FAO/WHO标准模式谱,而Thr,Met+Cys含量稍低于FAO/WHO标准模式谱,营养价值较高[3],是优质蛋白质来源。
肽类物质是众多研究者公认的安全性较高的一类抗氧化剂,具有特定的生物活性,如芝麻活性肽具有降血压、抑菌、抗氧化、溶解血栓及金属螯合作用[4]。然而,在应用、生产和储存过程中,肽类物质存在着因脱酰胺、氧化、水解或环化等作用而引起的降解风险,其相应活性也可能降低或丧失[5]。因此,有必要研究不同加工条件下,辣木籽肽的稳定性。据报道[6-7],肽的抗氧化活性与其氨基酸的组成及排列顺序、疏水性、空间体积大小及酸碱性等有关。辣木籽蛋白含有较丰富的具有供质子或供电子能力的氨基酸,包括:Tyr、Met、Cys;较丰富的疏水性氨基酸包括:Leu、Pro、Phe及Val;以及丰富的酸性氨基酸:Glu[3]。因此,采用酶法可以制备得到具有强抗氧化活性的辣木籽肽。此外,在不同加工环境下(金属离子,pH,高温),多肽结构发生变化,从而影响其抗氧化活性。因此,全面评价辣木籽肽在加工、贮藏过程中的稳定性对其在功能性食品中的应用有着重要参考价值。近年来,找寻提高肽类物质抗氧化活性的方法是生物活性肽领域热门的研究方向之一。美拉德反应是一种在食品加工过程中普遍存在的非酶褐变反应,同时,也是提高多肽抗氧化能力的有效方法之一。
目前,关于辣木蛋白及其水解物生物活性的研究主要集中在动物营养、净水、化妆品方面[8],鲜有关于辣木籽肽抗氧化活性及其稳定性的研究报道。食品加工过程中不可避免会引入糖类物质,通过对比研究辣木籽肽与不同糖类的相互作用及其对辣木籽肽抗氧化活性的影响。辣木籽蛋白质含量高,含有较丰富的供质子或供电子能力的氨基酸、疏水性氨基酸以及酸性氨基酸,但对其高值化加工利用还不够,资源利用率低,因此,本研究在前期水酶法制取辣木籽抗氧化肽的基础上,研究温度、pH、金属离子、糖类对辣木籽肽抗氧化活性稳定性的影响,为辣木籽肽在食品工业生产中开发利用提供理论指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
辣木籽:广东华谷辣木生物科技有限公司;
CuSO4、MgSO4、ZnSO4、KCl:分析纯,富宇化学有限公司;
1,1-diphenyl-2-picrylhydrazyl (DPPH•)、Trolox、果糖、半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖:纯度>98%,美国Sigma公司;
低聚半乳糖:纯度>95%,量子高科(中国)生物有限公司;
Alcalase 2.4L蛋白酶(8万U/mL)、Ns37071蛋白酶(11万U/mL):诺维信公司。
1.1.2 仪器与设备
高速冷冻离心机:ThermoSorvall ST16R型,美国Thermo公司;
恒温振荡器:THZ-82A型,常州澳华仪器有限公司;
高压杀菌锅:DSX-280KD24型,上海申安医疗设备厂;
电热恒温水浴锅:HSG-IIB-6型,上海仪表集团;
定氮仪:KND-2C型,上海纤检仪器有限公司。
1.2 试验方法
1.2.1 辣木籽抗氧化肽的制备 辣木籽脱壳后,经中草药粉碎机粉碎,放入高压灭菌锅中,100 ℃蒸汽处理20 min,冷却后称量,按1∶6的料液质量比加入蒸馏水(扣除蒸汽处理过程中辣木籽粉所吸附的水量),搅匀后,并置于多功能破壁料理机中破壁2 min。取经前处理的辣木籽匀浆物,碱提(pH 8.0、60 ℃碱提1 h)后,冷却至室温,调节pH至7.5,分别加入Alcalase 2.4L蛋白酶、Ns37071蛋白酶(Ns37071占总加酶量比例46%),总加酶量为2.60%,在55 ℃、180 r/min摇床中酶解24 h,95 ℃灭酶30 min,冷却后,10 000×g离心30 min,弃去油层和乳化层,取清液,即为辣木籽抗氧化肽溶液。所得辣木籽肽溶液蛋白浓度为40 mg/mL,总糖含量为200 mg/mL。
1.2.2 加热方式对辣木籽肽抗氧化活性的影响 将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),采用食品工业中常用的3种加热方式(65 ℃加热30 min、95 ℃加热30 min、115 ℃加热20 min)处理辣木籽肽,冷却至室温,测定其DPPH自由基清除能力。
1.2.3 pH对辣木籽肽抗氧化活性的影响
(1) 非热处理条件下pH对辣木籽肽抗氧化活性的影响:将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),调整其pH至酸性范围(食品体系常用pH):3.5,4.0,4.5,5.0,5.5,6.0。静置1 h后,测定其DPPH自由基清除能力。
(2) 热处理条件下pH对辣木籽肽抗氧化活性的影响:将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),调整其pH至酸性范围:3.5,4.0,4.5,5.0,5.5,6.0。静置 1 h 后,采用115 ℃加热20 min的热处理方式处理样品,冷却至室温,测定其DPPH自由基清除能力。
1.2.4 金属离子对辣木籽肽抗氧化活性的影响
(1) 非热处理条件下金属离子对辣木籽肽抗氧化活性的影响:将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),向溶液中加入CuSO4、MgSO4、ZnSO4、CaCl2、KCl,使各金属离子浓度分别达到1,2,3,4 mmol/L,静置1 h后,测定其DPPH自由基清除能力。
(2) 热处理条件下金属离子对辣木籽肽抗氧化活性的影响:将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),向溶液中加入CuSO4、MgSO4、ZnSO4、CaCl2、KCl,使各金属离子浓度分别达到1,2,3,4 mmol/L,静置 1 h 后,采用115 ℃加热20 min的热处理方式处理样品,冷却至室温,测定其DPPH自由基清除能力。
1.2.5 糖类对辣木籽肽抗氧化活性的影响
(1) 非热处理条件下糖类对辣木籽肽抗氧化活性的影响:将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),向溶液中加入果糖、半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖、低聚半乳糖,使各类糖浓度分别达到50 mg/mL,静置 1 h 后,测定其DPPH自由基清除能力。
(2) 热处理条件下糖类对辣木籽肽抗氧化活性的影响:将辣木籽肽溶液蛋白浓度稀释至10 mg/mL(总糖含量为50 mg/mL),向溶液中加入果糖、半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖、低聚半乳糖,使各类糖浓度分别达到50 mg/mL,静置 1 h 后,采用115 ℃加热20 min的热处理方式处理样品,冷却至室温,测定其DPPH自由基清除能力。
1.2.6 测定项目及方法
(1) 蛋白浓度:凯氏定氮法[9]。
(2) 总糖的测定:苯酚—硫酸法[10]。
(3) DPPH自由基清除能力:配制浓度分别为0.00,0.02,0.04,0.06,0.08,0.10 mmol/L的Trolox溶液。配制浓度为0.2 mmol/L的DPPH•无水乙醇溶液,避光保存。将 2 mL Trolox溶液与2 mL DPPH•标准溶液加入到同一试管中,摇匀,室温下暗处静置 30 min,以无水乙醇调零,517 nm处测得吸光值A。将2 mL DPPH•溶液与2 mL无水乙醇混合,517 nm处测得吸亮值AO。DPPH•清除率按式(1)计算:

(1)
式中:
c——DPPH•清除率,%;
A——2 mL Trolox溶液与2 mL DPPH•标准溶液,517 nm处测得吸光值;
Ao——2 mL DPPH•溶液与2 mL无水乙醇混合,517 nm处测得吸光值。
以Trolox浓度为横坐标,DPPH•清除率为纵坐标绘制标准曲线。
通过测定样品的DPPH清除能力来评价其抗氧化能力。将样品稀释4倍,将 2 mL 稀释后的样品与 2 mL DPPH溶液(0.2 mmol/L)加入到同一试管中,摇匀,室温下暗处静置 30 min,以无水乙醇调零,517 nm处测得吸光值A。计算酶解液的DPPH清除率。DPPH值(μmol Trolox/100 g)即:每100 g辣木籽粉经过处理后,与标准品Trolox达到相同DPPH清除能力时,所需Trolox的量。DPPH值越大,样品的抗氧化活性越强。
2 结果与讨论
2.1 加热方式对辣木籽肽抗氧化活性的影响
由图1可知,稀释后的辣木籽肽(10 mg/mL)溶液不经任何处理,其DPPH清除率为27.95 μmol Trolox /100 mL。65 ℃加热30 min、95 ℃加热30 min两种加热方式处理辣木籽肽后,并未显著影响其抗氧化活性。而115 ℃加热20 min后,可显著提高辣木籽肽的抗氧化活性(为原来的3.38倍)。热处理前,稀释后的辣木籽肽溶液中蛋白含量为10 mg/mL(总糖含量为50 mg/mL),自然pH值(6.3),在高温条件下,肽类物质与糖类物质可发生美拉德反应,从而使得热处理后的样品抗氧化活性提高。刘丹[11] 43-44以大豆浓缩蛋白为原料,酶法制备得到抗氧化大豆肽,配制成2 mg/mL的大豆肽溶液,考察其在不同温度(25,40,60,80,100 ℃)下的抗氧化活性变化,发现大豆抗氧化活性肽在 25~60 ℃的范围内具有良好的耐热性,且保持 5 h 后,抗氧化活性保持率依然在 98%左右,而当处理温度升高到 80 ℃时,抗氧化活性的损失比较明显,且处理时间越长,损失越大。由于本试验直接利用辣木籽酶法提取抗氧化肽,未经分离纯化,因此,肽溶液中包含了糖类物质,在高温下可与肽发生美拉德反应,提高其抗氧化活性;而刘丹[11]36利用大豆浓缩蛋白酶法制备抗氧化肽,所制备的大豆肽中糖类物质较少,大豆肽在高温加热的条件下,可能发生降解,降低了其抗氧化活性。因此,抗氧化肽产品并非分离纯化使其越纯越好。蛋白/肽-糖类的相互作用,可提高肽的生物活性。直接用辣木籽本身而非辣木籽蛋白制备抗氧化肽的优势在于:操作简便、成本较低、稳定性好、经济效益更高。
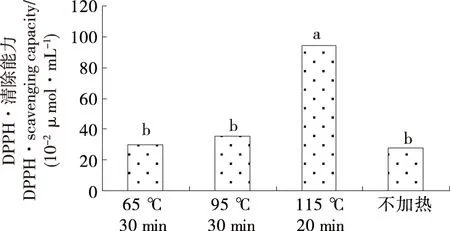
不同字母表示样品间有显著性差异(P<0.05)
2.2 pH对辣木籽肽抗氧化活性的影响
2.2.1 非热处理条件下pH对辣木籽肽抗氧化活性的影响 由图2可知,非热处理条件下,pH在酸性范围时,对辣木籽肽抗氧化活性影响不大。当pH降低至4.0~3.5时,辣木籽肽抗氧化活性有显著性提高,但提升幅度不大。说明辣木籽肽在酸性条件下稳定性更高。而随着pH值的升高,其抗氧化活性略有降低。自然pH条件下(6.3),辣木籽肽抗氧化活性显著低于酸性条件下(4.0~3.5)其抗氧化活性。刘丹[11]43-44研究发现:较低质量分数的柠檬酸会增强大豆肽的羟基自由基清除活性。这与本试验研究结果较相符。
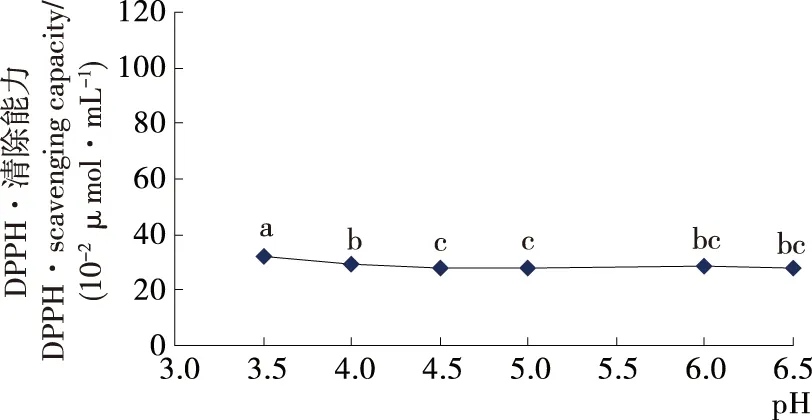
不同字母表示样品间有显著性差异(P<0.05)
Figure 2 Effect of pH on the antioxidant activity of peptides ofMoringaoleiferaseed
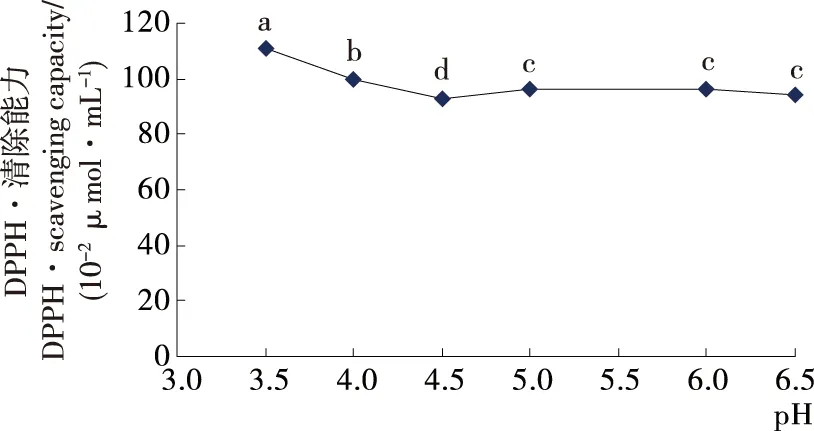
2.2.2 热处理条件下pH对辣木籽肽抗氧化活性的影响 由图3可知,热处理条件下,pH在酸性范围时,辣木籽肽溶液(94.17~111.18 μmol Trolox /100 mL)与非加热条件下的样品(27.95~31.83 μmol Trolox/100 mL)相比,其抗氧化活性显著提升(P<0.05),提升幅度为原样品的3.38~3.98倍。辣木籽肽溶液自然pH条件下(6.3),经115 ℃加热20 min后,其DPPH值为94.17 μmol Trolox/100 mL,远高于相同pH条件下非热处理的辣木籽肽溶液(27.95 μmol Trolox/100mL),但显著低于酸性条件下(4.0~3.5),经115 ℃加热20 min后的辣木籽肽溶液(99.88~111.18 μmol Trolox/100 mL)。李致瑜等[12]研究发现:高温加热会显著降低纯化后的大黄鱼内脏抗氧化肽的抗氧化活性。大黄鱼肽经纯化后,蛋白含量大大提高,推测热处理可破坏肽的结构,从而降低其抗氧化活性。本试验中,辣木籽肽在酸性条件下稳定,且辣木籽肽未经纯化,含有一定量的糖,热处理时,可发生一定程度的美拉德反应,提升其抗氧化活性。pH值越低,加热后,辣木籽肽抗氧化活性提升越大。若将辣木籽肽应用于酸性饮料,经热处理后,能适当提高其抗氧化活性。
2.3 金属离子对辣木籽肽抗氧化活性的影响
2.3.1 非热处理条件下金属离子对辣木籽肽抗氧化活性的影响 由图4可知,非热处理条件下,各金属离子浓度为 0~4 mmol/L的试验范围内,Cu2+会相对提高辣木籽肽抗氧化活性,而Ca2+、Mg2+、Zn2+、K+对肽的抗氧化活性的影响很小。赵谋明等[13]研究发现:Ca2+、Mg2+、Zn2+、K+、Cu2+各金属离子可降低蓝园鲹酶解产物的抗氧化活性,其中Cu2+显著降低其抗氧化活性,而Ca2+、Mg2+、K+对其抗氧化活性的影响较小。金属离子可能与肽形成螯合物,影响其抗氧化活性。不同来源的肽段氨基酸组成不同,高级结构不同,与不同金属离子反应时,螯合程度不同,所形成的螯合物的空间结构不同,结构特点不同,因而对其抗氧化活性的影响不同。
不同字母表示样品间有显著性差异(P<0.05)
Figure 3 Effect of pH and heating treatment on the antioxidant activity of peptides ofMoringaoleiferaseed

图4 非热处理条件下金属离子对辣木籽肽抗氧化活性的影响
Figure 4 Effect of metal ions on the antioxidant activity of peptides ofMoringaoleiferaseed
2.3.2 热处理条件下金属离子对辣木籽肽抗氧化活性的影响 由图5可知,热处理条件下,在各金属离子浓度为 0~4 mmol/L的试验范围内,相比同样经过热处理但不添加金属离子的样品,随着Ca2+、Mg2+、Zn2+、K+浓度的升高,辣木籽肽的抗氧化活性变化不大,但略有降低。加热可能促进辣木籽肽与金属离子的螯合反应,形成部分絮凝产物,一定程度上降低了上清液中肽的含量,因此其抗氧化活性下降。然而,随着Cu2+浓度的增加,辣木籽肽抗氧化活性显著提高(P<0.05)。这可能与辣木籽肽与Cu2+形成的螯合物空间结构与结构特性有关,但需进一步研究,探讨其作用机理。试验结果表明若产品需经过热处理,应适当避免与Ca2+、Mg2+、Zn2+、K+接触。

图5 热处理条件下金属离子对辣木籽肽抗氧化活性的影响Figure 5 Effect of metal ions and heating treatment on the antioxidant activity of peptides of Moringa oleifera seed
2.4 糖类对辣木籽肽抗氧化活性的影响
2.4.1 非热处理条件下糖类对辣木籽肽抗氧化活性的影响 由图6可知,非热处理条件下,加入糖类物质包括:果糖、半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖、低聚半乳糖不会对辣木籽肽的抗氧化活性产生较大影响,添加低聚半乳糖以及麦芽糖可小幅度提高辣木籽肽溶液抗氧化活性。低聚半乳糖以及麦芽糖的添加,可能与辣木籽肽形成复合物,一定程度上改变了辣木籽肽的空间结构,从而影响其抗氧化活性。
2.4.2 热处理条件下糖类对辣木籽肽抗氧化活性的影响
由图7可知,热处理条件下,加入糖类物质包括:果糖、半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖、低聚半乳糖会大大提高辣木籽糖的抗氧化活性,各种糖对辣木籽肽抗氧化活性提升的高低顺序为:果糖>半乳糖>低聚半乳糖>葡萄糖>乳糖=蔗糖=甘露糖=麦芽糖。相比加热时不加糖的样品,添加果糖、半乳糖、低聚半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖可分别使其抗氧化活性提高:2.57,1.57,1.48,1.43,1.19,1.15,1.14,1.13倍。相比不加热无任何添加的样品,添加果糖、半乳糖、低聚半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖后,115 ℃加热20 min,可分别使其抗氧化活性提高:8.70,5.32,4.99,4.82,4.01,3.90,3.84,3.82倍。美拉德反应可以有效提高蛋白肽和氨基酸的抗氧化活性,而且具有天然抗氧化剂的低毒、高效等特点,木糖、葡萄糖、果糖、乳搪和麦芽糖是常常用于提高肽类物质抗氧化活性的糖类[14]45-46。而木糖味焦,美拉德反应后形成的产物味苦,风味较差,因此未纳入本试验的研究内容。

不同字母表示样品间有显著性差异(P<0.05)
Figure 6 Effect of suger on the antioxidant activity of peptides ofMoringaoleiferaseed
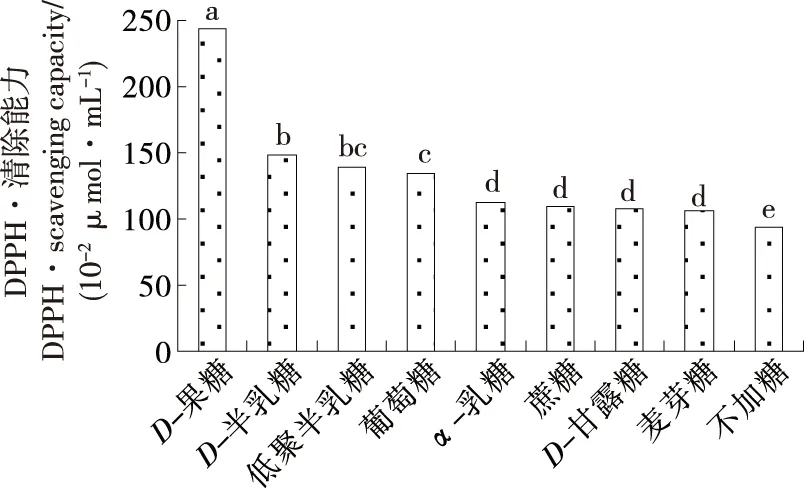
不同字母表示样品间有显著性差异(P<0.05)
Figure 7 Effect of sugars and heating treatment on the antioxidant activity of peptides ofMoringaoleiferaseed
美拉德反应是提高多肽抗氧化能力的方法之一,张强等[15]采用美拉德反应修饰双孢菇多肽,极大地提高了多肽的抗氧化活性。孙常雁[14]56通过美拉德反应修饰乳清蛋白肽,显著提高了其抗氧化活性。
美拉德反应也是一种在食品加工过程中普遍存在的非酶褐变反应,经过热加工和贮藏,辣木籽肽可与糖类发生相互作用,形成具抗氧化活性的美拉德反应产物,提高其抗氧化活性。说明可适当在辣木籽肽中添加果糖、半乳糖、低聚半乳糖、葡萄糖,通过适当热处理,大幅度提升其抗氧化活性。
3 结论
(1) 本研究说明辣木籽肽的抗氧化活性:在115 ℃加热20 min条件下可显著提高;酸性环境下稳定性较高;与金属离子接触时,受Cu2+影响相对显著,而受Ca2+、Mg2+、Zn2+、K+影响不明显。
(2) 热处理条件下,果糖、半乳糖、低聚半乳糖、葡萄糖、乳糖、蔗糖、甘露糖、麦芽糖等糖类物质的加入,辣木籽肽的抗氧化活性提高3.82~8.70倍。证实了美拉德反应同样是提高辣木籽肽抗氧化活性的方法之一。
(3) 对辣木籽肽分离与结构鉴定、构效关系研究以及辣木籽肽在细胞、动物水平上的抗氧化活性等问题尚需进一步研究和探讨。
[1] ABDULKARIM S M, LONG K, LAI O M, et al. Some physico-chemical properties ofMoringaoleifera, seed oil extracted using solvent and aqueous enzymatic methods[J]. Food Chemistry, 2005, 93(2): 253-263.
[2] BHUTADA P R, JADHAV A J, PINJARI D V, et al. Solvent assisted extraction of oil fromMoringaoleifera,Lam. seeds[J]. Industrial Crops & Products, 2016, 82: 74-80.
[3] 樊建麟, 邵金良, 叶艳萍,等. 辣木籽营养成分含量测定[J]. 中国食物与营养, 2016, 22(5): 69-72.
[4] 隋晓, 杜桂彩, 赵爱云, 等. 芝麻活性肽研究进展[J].食品与机械, 2016, 32(2): 193-196.
[5] 于一丁, 于志鹏, 赵文竹, 等. 血管紧张素转化酶抑制肽稳定性研究[J]. 食品工业科技, 2010, 31(1): 412-414.
[7] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D]. 广州: 华南理工大学, 2015: 113-118.
[8] 段琼芬, 陈思多, 马李一, 等. 辣木种子组成及蛋白的开发利用[J]. 安徽农业科学, 2008, 36(32): 14 084-14 086.
[9] 李加兴, 房惠芳, 陈选, 等. 牡丹籽粕蛋白提取工艺优化及其等电点分析[J]. 食品与机械, 2014, 30(3): 147-150.
[10] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999: 68-75.
[11] 刘丹. 大豆抗氧化活性肽的生物制备技术及稳定性研究[D]. 长春: 吉林大学, 2014.
[12] 李致瑜, 张翀, 田玉庭, 等. 大黄鱼内脏抗氧化肽的稳定性研究[J]. 现代食品科技, 2016, 32(1): 151-158.
[13] 赵谋明, 何婷, 赵强忠, 等. 蓝园鲹抗氧化肽抗氧化稳定性研究[J]. 食品科学, 2009, 30(1): 128-130.
[14] 孙常雁. 乳清蛋白肽美拉德反应产物的制备及其抗氧化作用机理研究[D]. 哈尔滨: 东北农业大学, 2014.
[15] 张强, 王松华, 孙玉军, 等. 双孢蘑菇源抗氧化肽的美拉德反应修饰研究[J]. 食品工业科技, 2012, 33(17): 208-211.
Effects of different processing conditions on antioxidant activity ofMoringaoleiferaLam. Peptide
LIUHua-yong1ZHAOQiang-zhong1MACai-xia2LINLian-zhu1LIAOChao-lin3CHENGuo-hui3GUJian-yin3
(1.CollegeofFoodScienceandEngineering,SouthChinaUniversityofTechnology,Guangzhou,Guangdong510640,China; 2.DepartmentofBiosystemEngineeringandFoodScience,ZhejiangUniversity,Hangzhou,Zhejiang310058,China; 3.GuangdongHua-guMoringaBiologicalTechnologyCo,Ltd.,Guangzhou,Guangdong510640,China)
Studied the effect of the antioxidant activity ofmoringaseeds peptide caused by temperature, pH, metal ion, carbohydrate based on producing antioxidant peptides with aqueous enzymatic method. The experiment showed that if themoringaseeds peptide was heated with 115 ℃ for 20 min, its antioxidant activity could be improved obviously. Themoringaseeds peptide’s antioxidant activity was higher in acid environment. Under the acid environment, if themoringaseeds peptide was heated, its antioxidant activity could be improved higher. Under the non- heat treatment, as the rising of the metal ion’s density, the antioxidant activity ofmoringaseeds peptide could be improved with different levels. With heat treatment, as the rising of the Ca2+, Mg2+, Zn2+, K+the antioxidant activity ofmoringaseeds peptide could be lower a little bit. But the antioxidant activity ofmoringaseeds peptide could be improved obviously as the rising of Cu2+density. The antioxidant activity ofmoringaseeds carbohydrate could be improved greatly by adding carbohydrate substances such as fructose, galactose, glucose, lactose, sucrose, mannose, maltose, GOS. The order of the carbohydrate substances that can help to improve the antioxidant activity ofmoringaseeds peptide is fructose>galactose>GOS>glucose>lactose=sucrose=mannose=maltose.The study can take themoringaseeds peptide as functional ingredient in the development of food to give theoretical and method guidance.
MoringaoleiferaLam. seed; peptide; antioxidation; stability
刘华勇,男,华南理工大学在读硕士研究生。
赵强忠(1976-),男,华南理工大学教授,博士。
E-mail: qzzhao@scut.edu.cn
2016—08—31
10.13652/j.issn.1003-5788.2016.10.008
