黄体酮乳膏剂经皮给药在大鼠体内的药动学研究
2016-12-05赵文惠曾诚古丽努尔塔西铁木尔高晓黎
赵文惠,曾诚,古丽努尔·塔西铁木尔,高晓黎
(新疆医科大学,乌鲁木齐830011)
黄体酮乳膏剂经皮给药在大鼠体内的药动学研究
赵文惠,曾诚,古丽努尔·塔西铁木尔,高晓黎
(新疆医科大学,乌鲁木齐830011)
目的 观察黄体酮乳膏剂经皮给药在大鼠体内的药动学参数和生物利用度变化,为其临床应用提供依据。方法 选择健康无卵巢的Wistar大鼠6只,随机分为口服组和经皮组,每组3只。两组均行双周期双交叉试验:分别单次给予黄体酮胶囊(灌胃)、黄体酮乳膏剂(贴覆)各50 mg/kg。口服组用药前,用药后0、5、10、20、30 min及1、2、4、6、8、10、12、24、48、72 h眼眶取血0.4 mL;经皮组用药前,用药后0、0.5、2、4、8、16、24、32、40、48、56、64、72 h眼眶取血0.4 mL。末次取血后停药至少2周,两组交叉给药,同首次给药途径相同时间再次取血。采用ELISA法检测黄体酮血药浓度,DAS药动学软件对数据进行处理,比较两种剂型的药动学参数及生物利用度。结果 经皮组、口服组AUC0~72 h分别为(1 131.43±369.10)、(161.44±94.63) μg/L×h,AUC0~∞分别为(2 364.05±289.25)、(180.90±12.78) μg/L×h,tmax分别为(14.67±3.87)、(1.12±0.31) h,Cmax分别为(49.92±8.41)、(33.56±15.68) μg/L,t1/2ke分别为(63.11±114.81)、(18.71±8.18) h,二者比较P均<0.05。黄体酮乳膏剂的生物利用度是黄体酮胶囊的353.7%。结论 黄体酮乳膏剂经皮给药具有明显的长效、缓释特征,有望成为安全、长效且使用方便的制剂。
黄体酮乳膏剂;药代动学;生物利用度;大鼠
黄体酮是卵巢黄体分泌的天然孕激素,为甾体类激素,水溶性较差,体内吸收差。目前,黄体酮主要剂型有口服制剂和肌肉注射制剂。口服制剂服用后存在首过效应,且半衰期极短,生物利用度较低[1~4];肌肉注射制剂属油溶制剂,注射时刺激性大,注射部位易出现红肿和硬块。为避免黄体酮口服后肝脏的首过效应并减少其胃肠道灭活,本课题组将黄体酮制成经皮吸收的乳膏剂[5~7]。2008年4月~2012年12月,我们观察了黄体酮口服给药和经皮给药在大鼠体内的药动学参数及生物利用度。现报告如下。
1 材料与方法
1.1 材料 健康雌性Wistar大鼠6只,体质量250~320 g,由新疆医科大学实验动物中心提供,动物合格证号:SCXK(新)2003-0001。实验仪器:2-16K台式高速冷冻离心机,德国Sigma公司;model550酶标仪,美国Bio-Rad公司;TGL-16B型高速台式离心机,上海安亭科学仪器厂;AB135-S电子天平、FE20型pH计,梅特勒-托利多国际股份有限公司;DK-S22型电热恒温水浴锅,上海精宏实验设备有限公司;KQ3200超声波清洗器,昆山市超声仪器有限公司。黄体酮对照品,中国药品生物制品鉴定所,批号:100027-201209;甲醇(色谱纯),德国Sigma公司;孕酮ELISA试剂盒,美国ADL公司;黄体酮胶囊,浙江仙琚制药股份有限公司,批号:20141018。黄体酮乳膏,本课题组自制,黄体酮含量为2%。
1.2 动物分组及处理 所有大鼠为避免内源性黄体酮干扰,实验前2周摘除双侧卵巢。随机将大鼠分为口服组、经皮组,每组3只。两组均行双周期双交叉试验。试验前禁食12 h、不禁水,口服组一次性给予黄体酮胶囊50 mg/kg(将1粒黄体酮胶囊内容物溶于辛葵酸甘油酯中,配成5 mg/mL溶液)灌胃;经皮组用剃毛器剃除腹部鼠毛(面积5 cm×4 cm),取黄体酮乳膏5.0 g涂布在称量纸上,贴敷于腹部皮肤(给药量相当于50 mg/kg),用弹性绷带沿大鼠头尾纵向制作紧身衣,用宽胶带在腰部横向固定,保留24 h揭除,用温水擦去残留药物。停药至少2周,两组交叉给药,方法同前。
1.3 黄体酮血药浓度及药动学参数检测 口服组用药前,用药后0、5、10、20、30 min及1、2、4、6、8、10、12、24、48、72 h眼眶取血0.4 mL;经皮组用药前,用药后0、0.5、2、4、8、16、24、32、40、48、56、64、72 h眼眶取血0.4 mL。交叉给药后同首次给药途径相同时间取血。所有血样静置1~2 h,5 000 r/min离心10 min,分离血清,参照文献[8,9]方法检测黄体酮血药浓度,绘制血药浓度-时间曲线,计算药动学参数,包括72 h血药浓度时间曲线下面积(AUC0~72 h)、血药浓度时间曲线下面积(AUC0~∞)、药物浓度达峰时间(Tmax)、药物浓度达峰浓度(Cmax)、半衰期(t1/2ke)及相对生物利用度。相对生物利用度=AUC黄体酮乳膏剂/AUC黄体酮胶囊×100%。
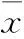
2 结果
2.1 两组黄体酮血药浓度-时间曲线变化 见图1、2。
2.2 两组黄体酮药动学参数比较 两组黄体酮药动学参数见表1。黄体酮乳膏剂的生物利用度为黄体酮胶囊的353.7%。
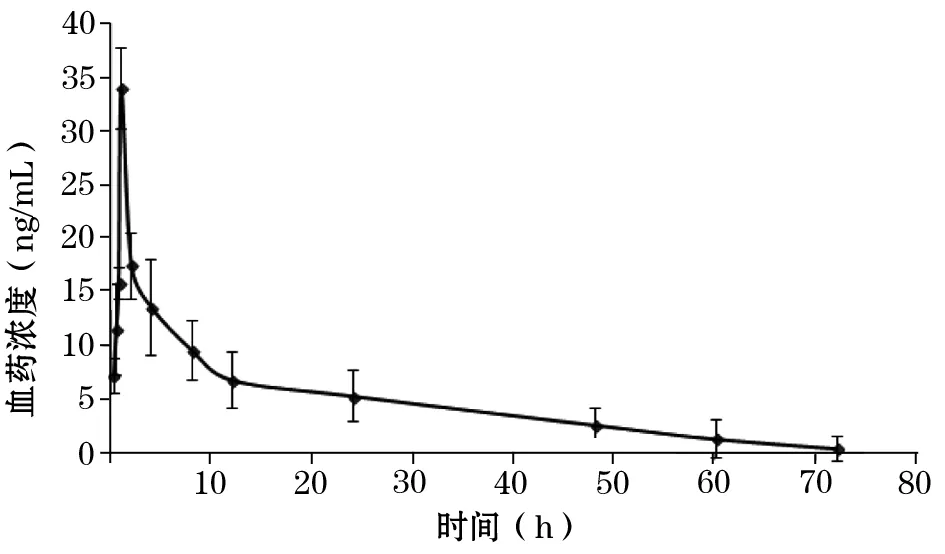
图1 口服组黄体酮血药浓度-时间曲线(n=6)
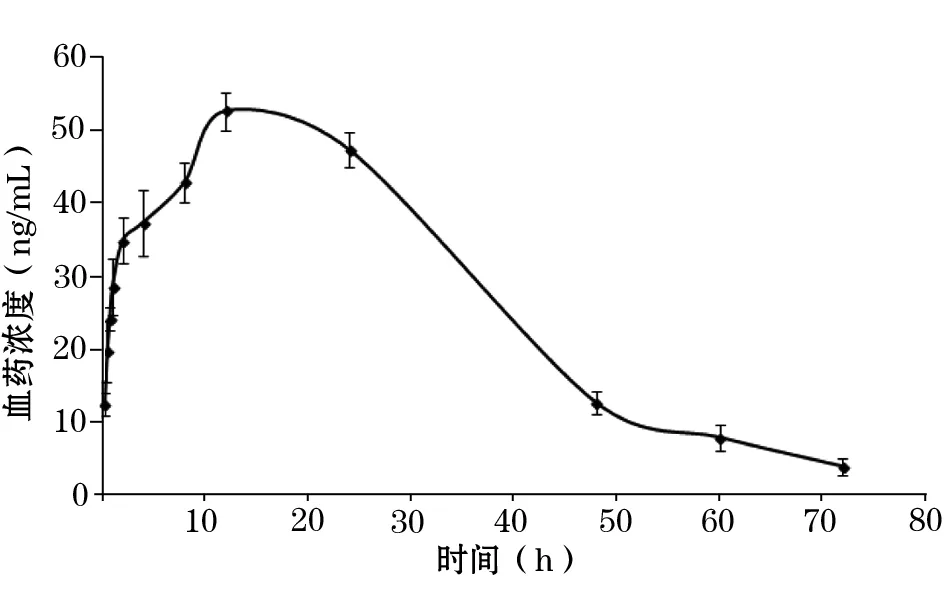
图2 经皮组黄体酮血药浓度-时间曲线(n=6)
表1 两组黄体酮药动学参数比较±s)
注:与口服组比较,*P<0.05。
3 讨论
天然黄体酮溶解度低,体内吸收差,且口服后肝脏对药物的首过效应强,肝脏毒性明显,临床应用效果较差[10,11]。目前已在国内外上市的黄体酮胶丸采用微粉化技术,减小了药物粒径,但其药物生物利用度仍不理想,需口服微粉化黄体酮100~300 mg才能发挥疗效[8]。近年有研究发现,黄体酮可透过人体皮肤到达体内[9,12]。与其他给药途径相比,经皮给药可避免肝脏的首过效应和胃肠道破坏,使某些半衰期较短的药物疗效显著提高,并能在较长时间内维持恒定的释药速率,维持稳定、持久的血药浓度[13,14]。
本课题组前期研制的黄体酮乳膏剂为水包油型乳膏,添加透皮吸收促进剂、增溶剂、抗氧剂等。前期研究证实,该乳膏剂具有对油水亲和力好、皮肤穿透性好、药物释放快、滞留时间长等优点。但未对其药动学参数进行研究。本研究黄体酮血药浓度-时间曲线显示,口服组用药1 h左右达到黄体酮最大血药浓度,随后快速下降;而经皮组用药14.7 h左右达到黄体酮最大血药浓度,并逐渐缓慢下降。证实黄体酮乳膏剂体内滞留时间明显长于黄体酮胶囊,且其最大血药浓度明显高于黄体酮胶囊;药动学参数结果显示,经皮组Tmax和t1/2ke明显长于口服组,说明黄体酮乳膏剂经皮给药可延长药物在体内的滞留时间,延长半衰期,增加药物在体内的血药浓度。本研究还发现,经皮组去除黄体酮乳膏剂24 h内仍可维持一定的血药浓度,说明黄体酮乳膏剂的皮肤储库效应强,药物释放和经皮渗透持久稳定。黄体酮乳膏剂的生物利用度为黄体酮胶囊的353.7%,说明经皮给药可避免肝脏的首过效应,提高药物的生物利用度。
总之,黄体酮乳膏剂经皮给药可避免肝脏的首过效应和胃肠道灭活,具有明显的长效缓释特征,为该新制剂的临床开发奠定了基础。但本研究结果受采血时间、血样分析方法等多种因素的影响,需在今后的研究中加以校正。
[1] 龙腾飞,丁淼,王良岸,等.微粒化黄体酮调控功能失调性子宫出血及闭经患者月经周期的效果[J].广东医学,2014,35(4):588-591.
[2] 姚小东.黄体酮给药系统的研究进展[J].中国计划生育学杂志,2014,22(12):855-858.
[3] Wren BG, Champion SM, Willetts K, et al. Transdermal progesterone and its effects on vasomotor symptoms, blood lipid levels, bone metabolic markers, moods, and quality of life for postmenopausal women[J]. Menopause, 2003,10(1):13-18.
[4] 柯学,王长江,胡一桥.泊洛沙姆18修饰的蜂毒素脂质体在大鼠体内的药动学[J].中国医院药学杂志,2010,30(3):198-201.
[5] 李霞,田海清,巩晓芸,等.GnRHa和rHCG诱导卵泡成熟在加强黄体支持治疗的拮抗剂方案中的疗效对比研究[J].新疆医科大学学报,2014,37(4):392-398.
[6] 赵文惠,高晓黎,陈蓉.2%黄体酮乳膏的皮肤毒性实验研究[J].新疆医科大学学报,2009,32(5):598-600.
[7] Stanczyk FZ. Treatment of postmenopausal women with topical progesterone creams and gels: are they effective[J]. Climacteric, 2014,17(Suppl 2):8-11.
[8] 周虹,秦立强,王燕,等.改良奶牛与传统蒙古黄牛的牛奶中雌激素和孕激素含量的比较[J].中华预防医学杂志,2009,43(6):509-512.
[9] 邓志敏,金黎,陈晶儿,等.消宫瘤颗粒以及其拆方抑制大鼠子宫肌瘤及对雌二醇与孕酮水平的影响[J].时珍国医国药,2007,18(6):1387-1388.
[10] 陈金武,王荣海,戎隆富,等.聚乙醇化重组人生长激素的免疫原性及药动学研究[J].中国药学杂志,2007,42(10):777-780.
[11] 裴泽军,孙欣,王亚平.酶联免疫法测定去氨加压素血药浓度及其药动学[J].中国医院药学杂志,2013,33(18):1503-1505.
[12] Du JY, Sanchez P, Kim L, et al. Percutaneous progesterone delivery via cream or gel application in postmenopausal women: a randomized cross-over study of progesterone levels in serum, whole blood, saliva, and capillary blood[J]. Menopause, 2013,20(11):1169-1175.
[13] 古丽巴哈尔·卡吾力,高晓黎.黄体酮乳膏皮肤安全性及初步药效学研究[J].新疆医科大学学报,2008,31(9):1151-1153.
[14] Peterson CM. Progestogens, progesterone antagonists, progesterone, and androgens: synthesis, classification, and uses[J]. Clin Obstet Gynecol, 1995,38(4):813-820.
乌鲁木齐高新技术产业开发区创新基金(CX10208W);新疆维吾尔自治区高校科研计划科学研究重点项目(20130521170359015)。
高晓黎(E-mail: xli_g@sina.com)
10.3969/j.issn.1002-266X.2016.40.010
R944
A
1002-266X(2016)40-0035-03
2015-06-17)
