IL-33对克罗恩病小鼠肠组织细胞因子及转录因子的影响
2016-12-05孙科明孙华文曾放刘顺杨厚涞吴红学
孙科明,孙华文,曾放,刘顺,杨厚涞,吴红学
(武汉大学人民医院,武汉430060)
·基础研究·
IL-33对克罗恩病小鼠肠组织细胞因子及转录因子的影响
孙科明,孙华文,曾放,刘顺,杨厚涞,吴红学
(武汉大学人民医院,武汉430060)
目的 探讨IL-33对克罗恩病(CD)小鼠肠组织细胞因子(IFN-γ、IL-4、IL-10、TGF-β)及转录因子(T-bet、GATA-3、FOXP3)的影响。方法 选择雌性BALB/c小鼠45只,随机分为对照组、TNBS组、IL-33组,每组15只。TNBS组、IL-33组给予TNBS/50%乙醇混合溶液灌肠建立CD模型,对照组仅予生理盐水灌肠。灌肠后TNBS组腹腔注射PBS,IL-33组腹腔注射重组鼠IL-33(rIL-33),对照组腹腔注射PBS。各组于腹腔注射第5天处死,取肠组织行HE染色,观察肠组织病理变化;采用ELISA法检测肠组织上清液IFN-γ、IL-4、IL-10、TGF-β,Western blotting法检测肠组织T-bet、GATA-3、FOXP3蛋白表达。结果 与对照组比较,TNBS组肠组织炎症明显;肠组织IFN-γ水平升高,IL-4、IL-10、TGF-β水平降低(P均<0.05);T-bet蛋白表达升高,GATA-3、FOXP3蛋白表达降低(P均<0.05)。与TNBS组比较,IL-33组肠组织炎症相对较轻;IFN-γ水平降低,IL-4、IL-10、TGF-β表达升高(P均<0.05),T-bet蛋白表达降低,GATA-3、FOXP3蛋白表达升高(P均<0.05)。结论 IL-33能缓解CD小鼠病情,其机制与抑制Th1细胞分化、诱导Th2和Treg细胞产生有关。
克罗恩病;白细胞介素33;细胞因子;转录因子
克罗恩病(CD)是炎症性肠病(IBD)的一种,其发病机制至今尚不完全清楚,免疫功能紊乱和Th1细胞异常活化可能是导致CD的重要因素[1~3]。Th1细胞主要通过分泌IFN-γ等细胞因子发挥致炎作用,而Th2细胞分泌的IL-4及Treg细胞分泌的IL-10、TGF-β等细胞因子可抑制Th0向Th1细胞分化,起到缓解炎症的作用。IL-33是最新发现的IL-1家族成员,其受体是ST2,二者结合后通过信号转导途径引起机体免疫应答的改变,还可诱导IL-4、IL-10、TGF-β等细胞因子的分泌[4],继而影响Th1、Th2、Treg等细胞,起到免疫调节作用。研究发现,IL-33在不同疾病中发挥的作用不尽相同,如加重哮喘、关节炎等病情[5,6],缓解动脉粥样硬化、肝炎等病情[7,8]。2015年5~10月,我们观察了重组鼠IL-33(rIL-33)对CD小鼠免疫相关细胞因子(IFN-γ、IL-4、IL-10、TGF-β)及转录因子(T-bet、GATA-3、FOXP3)表达的影响。现将结果报告如下。
1 材料与方法
1.1 材料 健康雌性BALB/c小鼠45只,SPF级,6~8周龄,体质量14~20 g,由武汉大学动物实验中心提供,动物许可证号:w20150467。2,4,6-三硝基苯磺酸(TNBS),美国Sigma公司;4%中性甲醛溶液,武汉谷歌生物科技有限公司;TRIzol,美国Invitrogen公司;rIL-33,美国RD公司;IFN-γ、IL-4、IL-10、TGF-β ELISA试剂盒,美国R&D公司;GAPDH抗体,杭州贤至生物科技有限公司;FOXP3、GATA-3抗体,武汉三鹰生物技术有限公司;T-bet抗体,美国Santa公司;HRP标记的羊抗小鼠二抗,武汉博士德生物工程有限公司。
1.2 动物模型制备及处理 所有小鼠适应性饲养7天,随机分为对照组、TNBS组、IL-33组,每组15只。TNBS组、IL-33组参照Kim等[9]的方法建立CD模型[按TNBS水溶液∶50%乙醇(1∶1)混合,取100 μL肛门灌注一次],造模前禁食24 h、不禁水。对照组肛门灌注100 μL生理盐水。液体缓慢灌注完毕,拔出导管,保持小鼠倒立姿势60 s,灌肠后正常饲养。灌肠后对照组腹腔注射PBS 100 μL/次,1次/d;TNBS组腹腔注射PBS 100 μL/次,1次/d;IL-33组腹腔注射含2 μg rIL-33[10]的PBS 100 μL/次,1次/d。各组均连续注射4天。第5天颈椎脱臼法处死,取肛门至回盲部肠管。
1.3 相关指标观察
1.3.1 肠组织病理形态观察 取各组肠组织,4%中性甲醛固定,石蜡包埋,4 μm厚切片。切片经60 ℃烤箱烤片后,二甲苯脱蜡,梯度乙醇脱苯,蒸馏水冲洗;苏木精染色,自来水冲洗;1%盐酸镜检分化,自来水冲洗至切片颜色变蓝;梯度乙醇脱水,0.5%伊红乙醇溶液对比染色,二甲苯透明,中性树脂封片。显微镜下观察各组肠组织病理形态变化。
1.3.2 肠组织上清液IFN-γ、IL-4、IL-10、TGF-β检测 取10 mg肠组织加入1 mL PBS混合液(pH=6.0,内含1 μg抑肽酶、亮肽素、胃蛋白酶抑素A),剪碎匀浆,4 ℃ 12 000 g/min离心20 min,取上清液,保存备检。采用ELISA法检测IFN-γ、IL-4、IL-10、TGF-β。
1.3.3 肠组织T-bet、GATA-3、FOXP3蛋白表达检测 采用Western blotting法。剩余肠组织用RIPA裂解液提取蛋白,测定蛋白的浓度和纯度后,取50 μg总蛋白上样电泳,根据蛋白分子量配置10% PAGE凝胶电泳,直至溴酚蓝前沿跑出胶后停止电泳;转膜(湿转法),取出凝胶根据Marker切取目的条带,用蒸馏水冲洗,剪取与PAGE凝胶相同大小的PVDF膜和滤纸,PVDF膜用甲醇浸泡数秒后和滤纸一同浸泡于电转缓冲液中,按照黑色板→纤维垫→滤纸→凝胶→PVDF膜→滤纸→纤维垫→白色板依次放好,夹紧板后放入转膜仪内,黑色板的一面对黑色负极。转膜条件:200 mA,120 min;封闭:用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h;一抗:用封闭液稀释相应的一抗,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜,抗体T-bet 1∶100稀释、GATA-3 1∶500稀释、FOXP3 1∶1 000稀释;二抗:TBST充分洗涤PVDF膜5~6次,5 min/次,用封闭液稀释HRP标记的羊抗小鼠二抗(1∶50 000稀释),使PVDF膜浸泡于二抗孵育液中,室温摇床孵育2 h;显色曝光:TBST充分洗涤PVDF膜5~6次,5 min/次。每张膜滴加适量的ECL化学发光底物,孵育数分钟,待荧光带明显后,用滤纸吸去多余的化学发光底物,覆上保鲜膜,X光胶片压片后依次放入显影液显影、定影液定影。采用Gel-Pro Analyzer分析处理条带,计算灰度值。
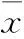
2 结果
2.1 各组肠组织病理改变 对照组肠黏膜完整,腺体排列规则,无炎性细胞浸润;TNBS组肠固有层明显受损,部分区域腺体消失,大量炎细胞浸润;IL-33组肠黏膜相对完整,腺体排列较为有序,少量炎细胞浸润,小面积溃疡。见插页Ⅱ图5。
2.2 各组肠组织上清液IFN-γ、IL-4、IL-10、TGF-β水平比较 见表1。

表1 各组肠组织上清液IFN-γ、IL-4、IL-10、TGF-β水平比较
注:与对照组比较,*P<0.05,**P<0.01;与TNBS组比较,#P<0.05,##P<0.01。
2.3 各组肠组织T-bet、GATA-3、FOXP3蛋白表达比较 见表2。
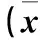
表2 各组肠组织T-bet、GATA-3、Foxp3蛋白相对表达量比较±s)
注:与对照组比较,*P<0.05;与TNBS组比较,#P<0.05。
3 讨论
CD是一种可发生于胃肠道任何部位的慢性、反复发作的非特异性全肠壁炎,至今尚无特异性的治疗手段。目前普遍认为,免疫功能异常是CD发病的主要原因之一,尤其是Th1细胞的过度活化被认为是CD的主要发病机制。
IL-33是IL-1家族中的一种新型细胞因子,其基因定位于人类9号染色体上,编码含270个氨基酸的IL-33前体蛋白,分子质量约30 kDa,主要表达于内皮细胞、成纤维细胞、巨噬细胞、树突状细胞等[11]。IL-33的受体是ST2[12],二者结合后,对免疫系统进行调控,如IL-33可诱导IL-4、IL-10、TGF-β等细胞因子的分泌。有研究发现,IL-33可能是一种共刺激因子,既能促Th1型适应性免疫应答也能促Th2型适应性免疫应答[13]。目前对IL-33在IBD发病过程中的作用研究结论不一。有研究认为,IL-33可能在IBD发病过程中具有双重作用[14,15];也有研究认为,IL-33对IBD患者可能具有保护作用[16]。Seidelin等[17]研究发现,溃疡性结肠炎患者肠黏膜组织IL-33 mRNA水平明显高于正常肠黏膜组织,且其表达与溃疡性结肠炎疾病活动度、活动指数、内镜下评分明显相关。Kobori等[18]研究发现,活动性溃疡性结肠炎患者肠黏膜IL-33 mRNA表达特异性升高,而非活动性溃疡性结肠炎患者和CD患者并未升高。由于该研究对CD患者样本的采集量较少,其结果的可信度不大。Duan等[10]研究发现,IL-33在通过化学方法诱导出的IBD中具有保护作用。以上研究说明,IL-33与IBD的发病有关。
本研究首先建立了小鼠CD模型,然后用rIL-33、PBS进行干预,处死小鼠,取肠组织行HE染色,发现TNBS组肠组织炎症明显,说明CD模型制备成功。而IL-33组肠组织炎症明显较TNBS组轻,说明IL-33能缓解CD的发病进程。本研究还发现,IL-33组肠组织上清液IFN-γ水平较TNBS组明显降低,IL-4、IL-10和TGF-β水平明显高于TNBS组。说明IL-33可抑制Th1分化,促进Th2和Treg的分化。大量研究证实,Th1细胞的特异性转录因子T-bet、Th2细胞的特异性转录因子GATA-3、Treg细胞的特异性转录因子FOXP3对其相应细胞的生长和功能具有重要作用[19~22]。本研究发现,IL-33组T-bet蛋白相对表达量明显低于TNBS组,而GATA-3、FOXP3蛋白相对表达量明显高于TNBS组。进一步证实了上述结论。
综上所述,IL-33能缓解CD小鼠病情,其机制可能与抑制Th1细胞分化、诱导Th2和Treg细胞的产生有关。
[1] Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease[J]. Nat Rev Immunol, 2003,3(7):521-533.
[2] Doganci A, Eigenbrod T, Krug N, et al. The IL-6R alpha chain controls lung CD4+CD25+Treg development and function during allergic airway inflammation in vivo[J]. J Clin Invest, 2005,115(2):313-325.
[3] Warnaar N, Hofker HS, Maathuis MH, et al. Matrix metalloproteinases as profibrotic factors in terminal ileum in Crohn′s disease[J]. Inflamm Bowel Dis, 2006,12(9):863-869.
[4] Schmitz J, Owyang A, Oldham E, et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity, 2005,23(5):479-490.
[5] Hayakawa H, Hayakawa M, Kume A, et al. Soluble ST2 blocks interleukin-33 signaling in allergic airway inflammation[J]. J Biol Chem, 2007,282(36):26369-26380.
[6] Xu D, Jiang HR, Kewin P, et al. IL-33 exacerbates antigen-induced arthritis by activating mast cells[J]. Proc Natl Acad Sci U S A, 2008,105(31):10913-10918.
[7] Miller AM, Xu D, Asquith DL, et al. IL-33 reduces the development of atherosclerosis[J]. J Exp Med, 2008,205(2):339-346.
[8] Volarevic V, Mitrovic M, Milovanovic M, et al. Protective role of IL-33/ST2 axis in Con A-induced hepatitis[J]. J Hepatol, 2012,56(1):26-33.
[9] Kim SH, Bianco NR, Shufesky WJ, et al. Effective treatment of inflammatory disease models with exosomes derived from dendritic cells genetically modified to express IL-4[J]. J Immunol, 2007,179(4):2242-2249.
[10] Duan L, Chen J, Zhang H, et al. Interleukin-33 ameliorates experimental colitis through promoting Th2/Foxp3(+) regulatory T-cell responses in mice[J]. Mol Med, 2012(18):753-761.
[11] Pastorelli L, De Salvo C, Cominelli MA, et al. Novel cytokine signaling pathways in inflammatory bowel disease: insight into the dichotomous functions of IL-33 during chronic intestinal inflammation[J]. Therap Adv Gastroenterol, 2011,4(5):311-323.
[12] Oboki K, Ohno T, Kajiwara N, et al. IL-33 and IL-33 receptors in host defense and diseases[J]. Allergol Int, 2010,59(2):143-160.
[13] Komai-Koma M, Xu D, Li Y, et al. IL-33 is a chemoattractant for human Th2 cells[J]. Eur J Immunol, 2007,37(10):2779-2786.
[14] Sponheim J, Pollheimer J, Olsen T, et al. Inflammatory bowel disease-associated interleukin-33 is preferentially expressed in ulceration-associated myofibroblasts[J]. Am J Pathol, 2010,177(6):2804-2815.
[15] Bamias G, Corridoni D, Pizarro TT, et al. New insights into the dichotomous role of innate cytokines in gut homeostasis and inflammation[J]. Cytokine, 2012,59(3):451-459.
[16] Grob P, Doser K, Falk W, et al. IL-33 attenuates development and perpetuation of chronic intestinal inflammation[J]. Inflamm Bowel Dis, 2012,18(10):1900-1909.
[17] Seidelin JB, Bjerrum JT, Coskun M, et al. IL-33 is upregulated in colonocytes of ulcerative colitis[J]. Immunol Lett, 2010,128(1):80-85.
[18] Kobori A, Yagi Y, Imaeda H, et al. Interleukin-33 expression is specifically enhanced in inflamed mucosa of ulcerative colitis[J]. J Gastroenterol, 2010,45(10):999-1007.
[19] 孙明芳,吴昌平,蒋敬庭.T-bet和Eomes对细胞免疫功能的调控作用[J].现代免疫学,2015,35(3):237-240.
[20] 徐胜.转录因子T-bet在记忆性T细胞分化中的作用[J].中国肿瘤生物治疗杂志,2007,14(7):556.
[21] 徐萌,范恒.干细胞治疗溃疡性结肠炎的研究进展[J].世界华人消化杂志,2015,23(2):214-220.
[22] 曾放,孙华文,刘顺,等.IL-17和Foxp3在小鼠克罗恩病模型中的表达及其意义[J].医学综述,2016,22(9):1751-1753.
国家自然科学基金资助项目(81170368)。
孙华文(E-mail: sunhuawen888@163.com)
10.3969/j.issn.1002-266X.2016.40.008
R574.4
A
1002-266X(2016)40-0029-03
2015-11-10)
