三维适型放疗联合肝动脉栓塞化疗治疗原发性小肝癌的疗效观察
2016-11-28唐涛丁长青孙祖杰张朝
唐涛+丁长青++孙祖杰++张朝


[摘要] 目的 探讨三维适型放疗联合肝动脉栓塞化疗(TACE)治疗原发性小肝癌的效果及预后。 方法 将我院2008年1月~2011年1月经病理证实的49例小肝癌患者随机分为两组,其中介入治疗组24例,仅给予肝动脉栓塞化疗治疗,联合治疗组25例,给予肿瘤部位肝动脉栓塞化疗治疗的同时行三维适型放疗。观察两组近期疗效、远期疗效、甲胎蛋白(AFP)水平及并发症等。 结果 治疗后3个月复查,介入治疗组的完全缓解(CR)率、部分缓解(PR)率、稳定(SD)率、进展(PD)率分别为12.50%、62.50%、16.67%、8.33%,联合治疗组分别为24.00%、64.00%、8.00%、4.00%;介入治疗组3个月、6个月1、2、3、5年生存率分别为100.0%、95.8%、79.2%、66.7%、58.3%、41.7%,联合治疗组分别为100.0%、96.0%、88.0%、79.2%、70.8%、58.3%。两组均未出现严重不良反应,部分患者出现恶心、呕吐等一般不良反应,经对症处理后消失。两组患者治疗半年后复查甲胎蛋白(AFP)水平比较,介入治疗组AFP<200 μg/L、200 μg/L≤AFP≤500 μg/L、AFP>500 μg/L病例分别为3例、12例、9例,联合治疗组AFP<200 μg/L、200 μg/L≤AFP≤500 μg/L、AFP>500 μg/L病例分别为7例、13例、5例,两组在AFP<200 μg/L及AFP>500 μg/L比较,差异具有统计学意义(P<0.05)。介入治疗组中位生存时间36.8个月,联合治疗组中位生存时间47.9个月,差异有统计学意义(P<0.05)。结论 三维适型放疗联合肝动脉栓塞化疗治疗原发性小肝癌具有良好的近期疗效,可有效延长患者的生存期。
[关键词] 原发性小肝癌;三维适型放疗;肝动脉栓塞化疗;随访
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2016)26-0019-05
原发性肝癌在我国是发病率仅次于肺癌的恶性肿瘤[1]。随着社会的发展和生活水平的提高,医疗技术水平和医用设备的进步,社会化体检越来越普及,小肝癌病例的检出率也随之明显增多。小肝癌与早期肝癌概念不完全等同,部分小肝癌早期即可出现微小转移灶及周围血管浸润,且小肝癌的治疗已由传统的单一外科手术切除演变为目前的“手术切除、局部治疗和肝移植相结合,辅以生物、免疫治疗”的多学科综合治疗方案[2,3]。放射治疗是不宜手术原发性肝癌的重要局部治疗手段之一[4]。肝动脉栓塞联合三维放射治疗肝癌可有效地提高患者的生存率,且毒副作用较小,患者易于耐受[5]。本研究对小肝癌采用三维适型放疗(three-dimensional optimal radiotherapy,3DcRT)联合肝动脉栓塞化疗治疗,现报道如下。
1 资料与方法
1.1 一般资料
入组49例均为我院自2008年1月~2011年1月收治的患者,并经彩色多普勒超声、多层螺旋CT增强或MRI检查、肝动脉造影检查、病理学或细胞学证实等,临床诊断为原发性小肝癌,治疗后效果也由影像学检查评价。本组均符合小肝癌的诊断标准[6]:单个癌结节最大直径不超过3 cm或相邻2个癌结节最大直径总和<3 cm。所有患者KPS评分均≥70分。入选患者均有以下1种以上情况:心肺、肝肾功能不全;肿瘤生长部位不佳;患者拒绝外科手术切除治疗。将所有患者随机分为两组,基本临床资料见表1,两组比较无显著性差异(P>0.05)。所有治疗均获得本院医学伦理学委员会许可,并获得患者及其家属的知情同意。
1.2 治疗方法
1.2.1 肝动脉栓塞化疗治疗(TACE) 全部患者给予介入治疗。经股动脉运用seldinger技术进行穿刺并插管,选用碘海醇造影剂,对肝固有动脉实施造影。结合影像明确病灶部位供血动脉位置,使用0.9 mm微导管超选择性进入病灶部位供血动脉。在生理盐水稀释下依次灌注丝裂霉素10 mg、氟脲嘧啶750 mg、顺铂40 mg,经微导管缓慢注入。灌注完毕后造影剂进一步确认,导管开口在肿瘤供血分支动脉,经微导管缓慢地将4~10 mL超液化碘油注入进行栓塞,当血液流动明显减慢时停止推注碘油。每间隔21~28 d行第二、三次介入治疗,治疗前通过CT对患者进行复查,以观察有无活性病灶及碘油沉积情况,化疗及栓塞药物剂量根据复查酌情加减。联合治疗组中21例患者完成肝动脉化疗栓塞治疗,4例完成两次治疗。
1.2.2 三维适形放疗(3DcRT) 联合治疗组25例患者在行肝动脉栓塞化疗的同时给予三维适型放疗。放疗选用瓦里安6MV直线加速器,各靶区的放疗,采用上海拓能(Topslane)公司的维纳斯三维治疗计划系统进行放疗计划设计,给予3~5个共面或非共面射野。定位前30 min嘱患者口服稀释的对比剂250~300 mL,采用真空垫固定体位,用CT模拟机定位进行扫描,扫描层距2~5 mm,范围自膈顶上3~5 cm至右肾下极。在每一层面CT定位图像上,精确勾画肿瘤靶区(gross tumor volume,GTV)轮廓和周围重要器官边界,有2个肿瘤病灶者分别勾画GTV1、GTV2。计划靶区(planing tumor volume,PTV)以GTV外扩0.5~2.0 cm。每个计划靶区平均剂量48~60 Gy,单次剂量2~8 Gy,每次剂量2 Gy的患者1周5次,每次剂量3 Gy及3 Gy以上的隔日一次。计划评估中100%处方剂量包括GTV,95%处方剂量包括90%~100%PTV。单次剂量大小的选择,主要依据患者的年龄、肿瘤大小、肝功能受损程度及一般状况来确定。放射治疗过程中密切观察患者病情变化,定期检查肝功能、彩色多普勒等,积极预防并发症的出现。
1.3 随访
两组病例治疗结束后,每3个月复查上腹部增强CT或MRI及甲胎蛋白(AFP),1年后每6个月复查1次。根据2008年美国肝脏病协会(AASLD)提出的RECIST 修订标准,以“目标病灶动脉期的增强显影的变化情况作为判断肿瘤大小变化的标准”及世界卫生组织(WHO)实体瘤评价标准进行疗效评定[7]:①肿瘤完全消失,并维持4周为完全缓解(complete response,CR);②肿瘤总面积缩小≥50%,并维持4周为部分缓解(partial response,PR);③肿瘤病灶变化介于PR和PD之间为稳定(stable of disease,SD);④肿瘤总面积增加≥25%为进展(progress of disease,PD)。治疗有效率(response rate,RR)以(CR+PR)/总例数×100%计算。12个月后的疗效以局部控制率计算,其中肿瘤消失、缩小、无变化为局部控制率(DCR)=(CR+PR+SD)/总例数×100%,进展或死亡为失控。
1.4 统计学方法
采用SPSS 12.0统计学软件进行统计分析。计量资料以均数±标准差(x±s)表示,组间对比采用t检验;计数资料比较采用χ2检验;绘制Kaplan Meier生存曲线表示生存率,组间对比采用Log-rank检验。P<0.05表示差异有统计学意义。
2 结果
2.1两组患者近期疗效比较
49例患者顺利进行治疗。随访从患者治疗开始,全部病例完成随访,随访率100%,随访时间至2016年6月。介入治疗组治疗后1个月复查,肿瘤缩小者11例,完全坏死液化1例,稳定无明显缩小4例,肿瘤增大或扩散转移8例;联合治疗后1个月复查,肿瘤缩小者15例,完全坏死液化2例,稳定无明显缩小2例,肿瘤增大或扩散转移6例。患者经治疗后3个月复查,局部控制率及近期疗效见表2。
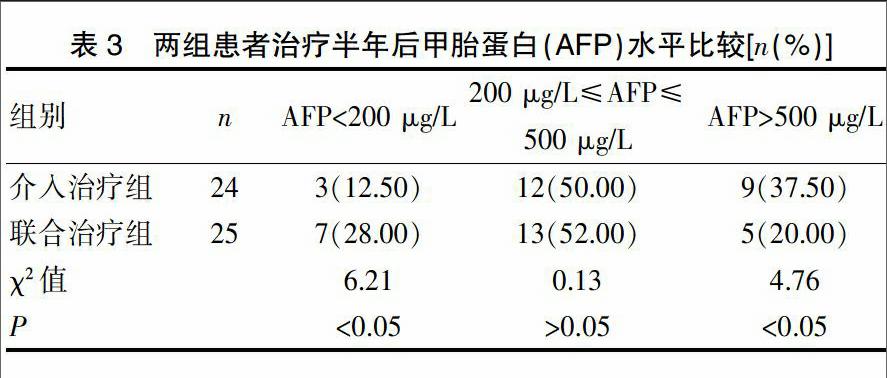
2.2 两组患者治疗半年后甲胎蛋白(AFP)水平比较
两组患者治疗半年后复查甲胎蛋白(AFP)水平,介入治疗组AFP<200 μg/L、200 μg/L≤AFP≤500 μg/L、AFP>500 μg/L病例分别为3例、12例、9例,联合治疗组AFP<200 μg/L、200 μg/L≤AFP≤500 μg/L、AFP>500 μg/L病例分别为7例、13例、5例。见表3。
2.3 两组患者远期疗效比较
生存时间介入治疗组24例患者随访全部完成,联合治疗组25例患者随访1年后仅有1例失访。中位随访时间29.4个月。两组患者第1年3个月复查1次,1年后6个月复查1次。生存率见图1。介入治疗组3个月、6个月、1、2、3、5年生存率分别为100.0%(24/24)、95.8%(23/24)、79.2%(19/24)、66.7%(16/24)、58.3%(14/24)、41.7%(10/24)。联合治疗组3个月、6个月、1、2、3、5年生存率分别为100.0%(25/25)、96.0%(24/25)、88.0%(22/25)、79.2%(19/24)、70.8%(17/24)、58.3%(14/24)。介入治疗组中位生存时间36.8个月,联合治疗组中位生存时47.9个月。
2.4 并发症及不良反应
应用三维适形放疗技术治疗,靶体积较小,患者副反应及并发症少,少数病灶较大患者有纳差、恶心呕吐,经对症处理即可,也有个别患者出现腹泻,合并黄疸者少量病例出现黄疸加重,无需特殊处理。联合治疗组肝动脉化疗栓塞治疗后,部分患者有恶心、呕吐、发热等反应,给予对症处理。12例出现明显的肝区疼痛或疼痛较治疗前加重,为阵发性或持续性的钝痛,可向右肩背部放射。对于不能忍受者给予对症处理。疼痛一般逐渐减轻,在治疗后1~5 d部分或完全缓解。治疗后3 d两组白细胞、红细胞、血小板及淋巴细胞比例均有不同程度的下降。
3 讨论
原发性小肝癌治疗方法很多,如手术切除、肝动脉化疗栓塞(TACE)、经皮穿刺乙醇注射(PEI)、放射治疗(RT)、射频消融(RFA)、高能超声聚焦刀(HIFU)和肝移植等[2]。以往放疗在HCC综合治疗中的作用有限,其原因是在肿瘤靶区未达到根治性治疗剂量时,正常肝脏组织受量已超过耐受量[8]。随着局部精确放疗技术3DcRT的发展,Keane FK等[9]的研究表明应用3DcRT从50 Gy可以提升至70 Gy。放疗已成为肝癌重要治疗手段[10,11]。
本次研究49例患者全部采用三维适型放疗,放疗剂量分别为48~60 Gy不等,根据患者的具体检查情况采用不同分割方法,使GTV的生物学剂量均达到64~72 Gy,足以超过肝脏肿瘤细胞的致死剂量[9]。联合治疗组25例患者在行三维适型放疗的同时给予肝动脉化疗栓塞治疗(TACE),TACE所用药物丝裂霉素、氟脲嘧啶、顺铂对放疗有增敏效果,利用介入化疗靶动脉的选择性和药物作用的首过效应,能以小剂量化疗药物在肿瘤靶器官达到有效浓度。曾昭冲[12]研究表明,肝脏肿瘤动脉灌注时肿瘤局部的药物浓度较静脉给药高3~5倍,其杀灭肿瘤细胞量可增加数倍,两者呈对数关系增加。并且栓塞药物在肿瘤病灶中可以存留较长时间,延长抗肿瘤药物杀灭肿瘤细胞时间,肿瘤供血动脉闭塞能导致肿瘤缺血、缺氧,达到抑制肿瘤生长、促使肿瘤细胞坏死、凋亡的目的[13]。与三维适形放疗起到协同配合的治疗作用研究结果表明,联合治疗组的CR、PR、RR、DCR均高于介入治疗组;联合治疗组的PD率明显低于介入治疗组。联合治疗组有较大获益,近期疗效明显提高。
两组患者治疗半年后复查AFP指标均有降低,联合治疗组比单纯放疗组下降比率更大。联合治疗组1、2、3年生存率为88.0%、79.2%和70.8%,高于介入治疗组的1、2、3年生存率(79.2%、66.7%和58.3%)。联合治疗组中位生存期47.9个月,介入治疗组中位生存期为36.8个月,联合治疗组长于介入治疗组。其结果均有显著性差异,与吴发伟等[14]研究结果一致,提示三维适型放疗联合肝动脉栓塞化疗的疗效优于单纯介入治疗。
近年来,3DcRT正广泛应用于临床,3DcRT治疗肝癌已被多个研究机构证实是安全、有效的治疗方法,为治疗不能手术切除的肝癌提供了新途径[15,16]。放射性肝损伤仍是最应该预防的不良反应。微导管介入治疗具有对患者创伤面小、风险低,短期内患者可以恢复及可对患者多次重复手术的特点,减少或避免了外科手术方式给患者带来的各种不利因素。使用微导管超选择性的插管可以准确、有效地阻断对病灶组织的血液供应,防止损害正常肝脏组织;同时在微导管的引导下,栓塞化疗剂不仅能够进入给病灶组织供血的动脉,还能够通过逆流顺利地进入参与给病灶组织供血的门静脉小分支,从而完整、彻底地阻断对病变组织的血液供应,使病灶组织完全坏死。介入治疗术后部分患者出现胃肠道反应、肝区不适、白细胞减少、发热等症状,给予止吐、止疼、保肝、升白药物治疗后好转。两组患者治疗后复查肝功能指标,无显著差异(P>0.05)。因此,放疗联合介入治疗原发小肝癌是安全可行的[17]。
肝细胞癌治疗后复发与否是影响患者生存的重要因素,因此,定期严密随访监测是早期发现复发和转移的关键所在,AFP检测AFP 阴性肝癌术后复发的敏感度仅有12%,对于转移性肝癌,也不适合作为术后监测的首选方法。超声、CT、MRI等影像学随访能够早期检出AFP阴性肝癌患者术后复发,典型的病变CT、MRI 表现呈动脉期显著强化,门静脉期及延迟期减退[18]。CT较DSA更为简单方便、费用较低,采用合适的窗宽窗位技术能够准确地监测出TACE 治疗后碘油在肿瘤内的分布状况及沉积区域,可通过测量CT值来确定沉积量,CT还可观察瘤体内部分坏死的肿瘤出现缩小情况,增强检查可以观察肿瘤的周围和内部血供情况[19]。MRI对于<2 cm复发肿瘤较CT具有独特优势[18],磁共振表观弥散系数(ADC)能够有效预测患者经TACE治疗后是否早期发生疾病进展,值得应用[20]。
总之,三维适型放疗联合肝动脉栓塞化疗治疗原发小肝癌疗效优于单纯介入治疗,影像学随访有助于疗效评价,值得临床上进一步探讨。
[参考文献]
[1] 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治的专家共识[J]. 肿瘤,2009,29(4):295-304.
[2] 全志伟,王健东. 小肝癌的治疗[J/CD]. 中华肝脏外科手术学电子杂志,2014,3(1):1-4.
[3] 王捷,陈汝福,唐启彬. 原发性肝癌多学科治疗模式[J]. 肝胆外科杂志,2013,23(1):1-11.
[4] Feng M,Ben-josef E. Ratiation therapy for hepatocellular carcinoma[J]. Semin Radiat Oncol,2011,21(4):271-277.
[5] 熊正平,黄芳. 肝动脉栓塞联合三维放射治疗肝癌的疗效评价[J]. 实用肿瘤学杂志,2012,26(3):246-248.
[6] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肿瘤学杂志,2011,16(10):929-946.
[7] Christensen E. Choosing the best endpoint[J]. J Hepatol,2008,49(4):672-673.
[8] 刘成新,巩贯忠,尹勇. 原发性肝癌精确放疗技术的临床应用进展[J]. 中华放射肿瘤学杂志,2014,23(5):440-443.
[9] Keane FK,Wo JY,Zhu AX,et al. Liver-directed radiotherapy for hepatocellular carcinoma[J]. Liver Cancer,2016, 5(3):198-209.
[10] Mede P,Mornex F,Trepo C. Innovative therapy for hepatocellular carcinoma:Three-dimensional high-dose photon radiotherapy[J]. Cancer Lett,2009,286(1):129-133.
[11] Tsai CL,Hsu FM,Cheng JC. How to improve therapeutic ratio in radiotherapy of HCC[J]. Liver Cance,2016,5(3):210-220.
[12] 曾昭冲. 肝癌放疗应采用何种分割剂量?[J]. 中华放射肿瘤学杂志,2006,15(4):347-349.
[13] 冯晓峰,郑永志,周春柳,等. 重组人p53腺病毒注射液在原发性肝癌介入化疗中的应用价值[J]. 世界华人消化杂志,2013,21(15):1437-1441.
[14] 吴发伟,张学成,党亚正,等. 伽玛刀联合肝动脉栓塞化疗治疗原发性肝癌的疗效观察[J]. 现代肿瘤医学,2010,18(1):119-122.
[15] 张玉鹏,李昭宇,赵伟. 影响中晚期原发性肝癌患者的生存因素分析[J]. 宁夏医科大学学报,2013,35(4):402-406.
[16] 梁霞,朱小东,梁世雄,等. 原发性小肝癌三维适形放疗的初步结果[J]. 现代肿瘤医学,2008,16(5):793-794.
[17] Ren ZG,Zhao JD,Gu K,et al. Three-dimensional conformal radiation therapy and intensity-modulated radiation therapy combined with transcatheter arterial che-moembolization for locally advanced hepatocellular carcinoma:An irradiation dose escalation study[J]. Int J Radiat Oncol Biol Phys,2011,79(2):496-502.
[18] 夏水伟,杨宏远,纪建松. 超声、CT和MRI在甲胎蛋白阴性肝癌术后随访中的价值[J]. 中国医学影像学杂志,2015,23(12):943-946.
[19] 祝青,刘书林. CT与DSA 综合影像在原发性肝癌经导管肝动脉化疗栓塞术后随访中的价值[J]. 实用医院临床杂志,2015,12(4):81-83.
[20] 杨欢,袁正,李文涛,等. 磁共振表观弥散系数对肝癌TACE疗效的预测价值[J]. 中国癌症杂志,2016,26(3):257-262.
(收稿日期:2016-07-02)
