果蔬中苯醚甲环唑免疫分析方法的研究
2016-11-21刘冰冯久慧童贝张富源生威张燕陆旸王硕
刘冰,冯久慧,童贝,张富源,生威,张燕,陆旸,王硕
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
果蔬中苯醚甲环唑免疫分析方法的研究
刘冰,冯久慧,童贝,张富源,生威,张燕,陆旸,王硕*
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
针对目前由于三唑类杀菌剂苯醚甲环唑的广泛应用所带来的农药残留问题,建立了苯醚甲环唑的直接酶联免疫检测方法,其灵敏度IC50为(67.96±2.73)μg/L,检测限IC15为(8.86±0.34)μg/L,与11种三唑类杀菌剂的交叉反应率均小于0.01%。苯醚甲环唑在10种果蔬类样品中的平均回收率为89.01%~103.43%,变异系数小于14.33%,检出限为0.443mg/kg。
苯醚甲环唑;抗体;检测;酶联免疫吸附测定法
苯醚甲环唑,又名噁醚唑,商品名为世高、思科,英文名为Difenoconazole,化学名称为顺,反-3-氯-4-[4-甲基-2-(1H-1,2,4-三唑-1-甲基)-1,3-二氧戊烷-2-甲基]苯基-4-氯苯基醚。苯醚甲环唑是一种广谱高效的三唑类内吸性杀菌剂,属于14α-甾醇脱甲基化抑制剂,可以干扰菌丝生长,抑制病原体孢子萌发,最终抑制真菌生长[1]。苯醚甲环唑具有保护和治疗作用,被广泛应用于谷物、油料、水果、蔬菜、花生、甜菜、茶叶、人参等作物以控制病虫害,主要用于防治灰腐病、霜霉病和白粉病,同时还可以抑制草莓和辣椒炭疽病[2]。按照我国农药的毒性分级标准,苯醚甲环唑的毒性经口大于500 mg/kg,属于低毒类农药,对人的每日容许摄入量为0.01 mg/kg体重[3]。但由于是直接喷洒于蔬菜、水果等作物上,使人们易受其危害。许多国家对该农药在食品中的残留限量已经作出了严格的限制,因此对于农产品中苯醚甲环唑残留量的检测日益受到重视。
潘晓威[4]提出利用气相色谱法能够快速检测芒果中苯醚甲环唑的残留量,结果表明:样品经乙腈涡旋提取,通过PSA和无水硫酸镁高速离心净化,气相色谱检测,其添加回收率为79.8%~100.7%,相对标准偏差为0.81%~4.39%,检出限为0.002 5 mg/kg。Sandip H等[5]利用液相色谱-串联质谱法(LC-MS)对秋葵中苯醚甲环唑的残留量进行了检测,回收率为80%~107%,相对标准偏差为4%~17%,检测限为0.005 mg/kg。Ting D等[6]利用苯醚甲环唑作为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,建立了一种固相微萃取-分子印迹方法,用来检测自来水和葡萄汁中的苯醚甲环唑残留。检测结果显示,苯醚甲环唑的回收率为87.6%~95.4%,相对标准偏差小于4.9%,检出限为0.5 μg/L。运用上述常规的仪器分析方法,不仅时间长、费用高,而且操作人员易接触一些有毒的有机溶剂和化学试剂[7]。现今,食品安全检测正朝着快速便捷的方向发展,本研究旨在建立一种简单、快速、灵敏的酶联免疫分析检测方法,这对于日益严重的食品安全问题得到更好更便捷地解决来说意义重大。
1 材料与方法
1.1仪器与试剂
苯醚甲环唑、腈菌唑、三唑醇、戊唑醇、双苯三唑醇、三唑酮、烯唑醇、丙环唑、氟硅唑、粉唑醇、匙孔血蓝蛋白(KLH)、牛血清白蛋白(BSA)、鸡卵白蛋白(OVA)、辣根过氧化氢酶(HRP)、溴代乙酰氯、4-氨基丁酸:均购自美国Sigma公司;氟环唑、戊环唑:购自Dr. Ehrenstorfer Gmbh公司;3,4′-二氯二苯醚:购自北京力徳士化学科技有限公司;其它试剂均为分析纯。包被缓冲液(0.05 mol/L,pH 9.6,碳酸钠-碳酸氢钠缓冲液);磷酸盐缓冲液(0.01 mol/L PBS,pH 7.4);封闭液(0.5%脱脂乳粉/PBS溶液);洗涤液(PBST,pH 7.4);底物液(TMB-过氧化脲溶液);终止液(1.25 mol/L硫酸溶液)。苯醚甲环唑抗体:由食品营养与安全教育部重点实验室制备。
蛋白纯化仪:美国BIO-RAD公司;酶标仪:Thermo公司;冷冻离心机:德国Eppendorf公司;超纯水系统:美国Millipore公司;96孔酶标板:丹麦Nunc公司。
1.2方法
1.2.1直接竞争酶联免疫检测方法的建立
1.2.1.1直接竞争ELISA的检测步骤
抗体以100 μL/well包被于酶标板上,4℃孵育过夜;洗板后以200 μL/well加入封闭液,37℃孵育1 h;洗板后每孔先加入50 μL梯度稀释的苯醚甲环唑标准品溶液,然后加入50 μL酶标抗原稀释液,37℃竞争反应1 h;洗板后以100 μL/well加入底物液,室温显色20 min;以50 μL/well加入终止液;在双波长方式(450 nm~650 nm)下用酶标仪读取OD值。根据OD值按公式(1)计算抑制率:

式中:OD阴性对照为不加标准品的吸光度值;OD阳性对照为加标准品的吸光值;OD空白为不加标准品和抗血清的吸光度值。
绘制标准曲线:X轴为苯醚甲环唑标品浓度的对
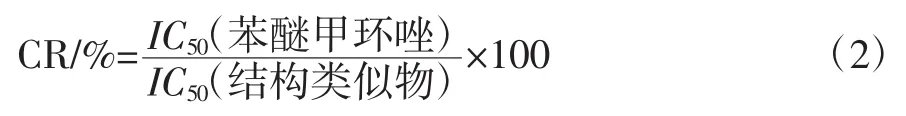
式中:IC50(苯醚甲环唑)为标准曲线上抑制率为50%处对应的苯醚甲环唑浓度;IC50(结构类似物)为标准曲线上抑制率为50%处对应的结构类似物浓度。
1.2.3实际样品检测
1.2.3.1样品预处理
选取青花菜、大白菜、番茄、黄瓜、根芹菜、柑橘、苹果、梨、香蕉、木瓜,共10种果蔬类样品进行研究,所有样品不可洗涤,选取食用部分经充分搅碎后置于4℃备用。试验时,称取5 g样品于50 mL离心管中,加入10 mL正己烷,涡旋震荡5 min,吸取上层清液2 mL,经氮吹浓缩近干,加入1 mL甲醇复溶[8],用0.01 mol/L PBS稀释后用于ELISA检测。
1.2.3.2样品的基质影响及消除
将样品按照1.2.3.1的方法处理后,用PBS分别稀释5、10、50倍,然后分别绘制基质曲线,选取与标准曲线吻合度最高的条件作为最适试验条件。
1.2.3.3加标回收
向选取的果蔬类样品中分别添加3个浓度水平(0.5、2.5、25 mg/kg)的苯醚甲环唑标准品,将加标样品充分混匀,静置一段时间后,按照1.2.3.1的方法处理后,利用直接竞争ELISA法检测,计算苯醚甲环唑的回收率。
1.2.3.4果汁样品检测分析
选取不同品牌的苹果汁和橙汁样品,按照1.2.3.1的方法处理后,进行实际检测分析。数值,Y轴为相应的抑制率,是典型的S型曲线。
1.2.1.2抗体包被量和酶标抗原稀释倍数的优化
试验采用棋盘法对抗体包被量和酶标抗原的稀释倍数进行优化,选取3个抗体包被量(0.05、0.10、0.50 μg/well)和3个酶标抗原稀释倍数(2 000、3 000、4 000),同时进行优化,并绘制抑制率随标品浓度变化的标准曲线,选取ODmax在0.8~1.2之间,IC50值较小的参数为最优条件。
1.2.1.3封闭液的种类及浓度的确定
供选择的封闭液包括:0.5%脱脂乳粉,1.0%脱脂乳粉,0.5%OVA,1.0%OVA,分别用磷酸盐缓冲液配置后,在其他条件不变的情况下进行测定,选取ODmax在0.8~1.2之间,IC50值较小的参数为最优条件。
1.2.2抗体特异性的测定
试验选取腈菌唑、三唑醇、戊唑醇、双苯三唑醇、三唑酮、烯唑醇、氟环唑、戊环唑、氟硅唑、粉唑醇、丙环唑共11种三唑类杀菌剂,按公式(2)分别计算其交叉反应率,以确定苯醚甲环唑抗体的特异性。
2 结果与讨论
2.1直接竞争ELISA检测方法的建立
经优化,抗体以0.50 μg/well包板,酶标抗原稀释3 000倍,封闭液为0.5%脱脂乳粉,苯醚甲环唑标准品从2 000 μg/L开始4倍梯度稀释6个浓度进行测试,绘制抑制率随苯醚甲环唑标准品浓度变化的标准曲线,如图1所示,通过计算得出:灵敏度IC50为(67.96±2.73)μg/L,检测限IC15为(8.86±0.34)μg/L。
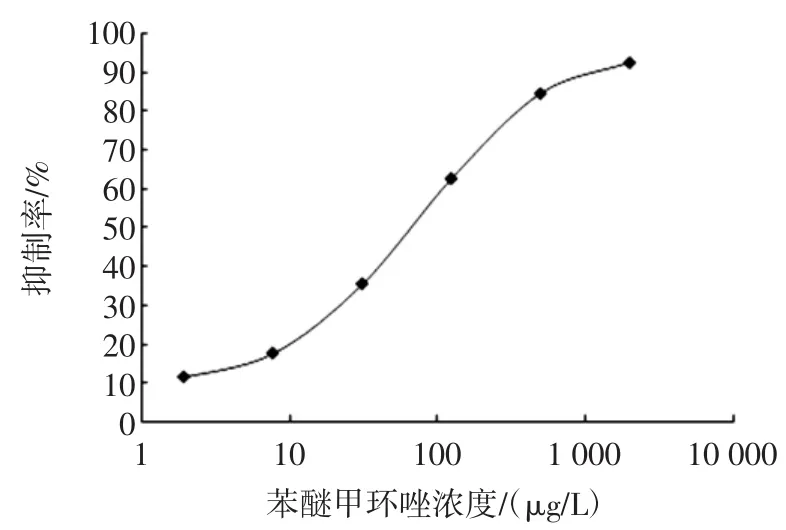
图1 苯醚甲环唑直接竞争ELISA方法的标准曲线Fig.1 Standard curve of difenoconazole by dc-ELISA
2.2抗体特异性的测定
抗体的特异性通常用交叉反应率来表示,交叉反应率是指抗体与结构不同的抗原决定簇发生结合的能力。交叉反应率越小,说明抗体的特异性高,反之,交叉反应率越大,说明抗体具有广谱性,可识别多种同类药物。本试验选取了腈菌唑、三唑醇、戊唑醇、双苯三唑醇、三唑酮、烯唑醇、氟环唑、戊环唑、氟硅唑、粉唑醇、丙环唑,共11种三唑类杀菌剂,与苯醚甲环唑的交叉反应率均小于0.01%,证明该抗体特异性较高,可以对食品中的苯醚甲环唑进行有效检测。
2.3实际样品检测
2.3.1样品的基质影响及消除
样品中的腐殖质、金属离子、有机成分等基质的存在可能会影响检测方法的灵敏度,为了消除基质效应,可以对样品进行适当稀释[9]。在本试验中,以苹果样品为例,将样品按照1.2.3.1的方法处理后,用PBS分别稀释5、10、50倍,然后分别绘制基质曲线,选取与标准曲线吻合度最高的条件作为最适试验条件,试验结果见图2。
当样品提取液用PBS稀释50倍时,最适合进行ELISA的测定。根据样品稀释倍数及直接竞争ELISA方法的检测限,计算得出10种果蔬类样品中苯醚甲环唑的检出限,均为0.443 mg/kg。
2.3.2加标回收
共选择10种果蔬类样品,分别向其中添加3个浓度水平(0.5、2.5、25 mg/kg)的苯醚甲环唑标准品,按照直接竞争ELISA方法进行检测,计算其加标回收率,测定结果如表1、表2所示。
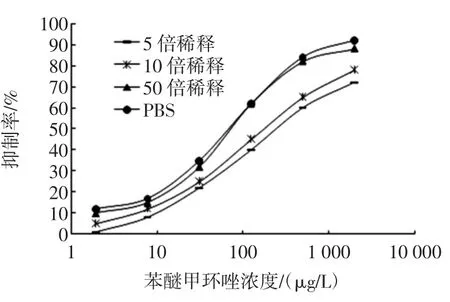
图2 不同稀释倍数提取液的优化结果Fig.2 The optimization of concentrations of extract
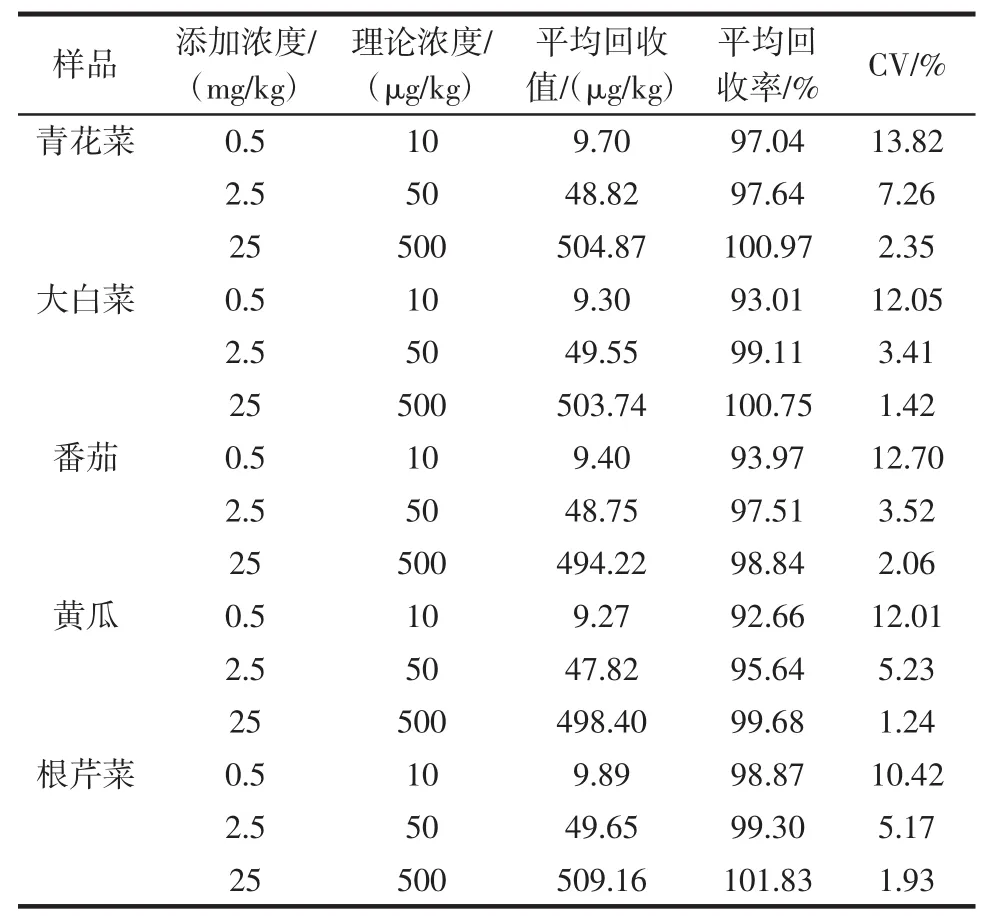
表1 蔬菜样品中苯醚甲环唑的加标回收率(n=3)Table 1 Recoveries studies of difenoconazole in vegetables(n=3)

表2 水果样品中苯醚甲环唑的加标回收率(n=3)Table 2 Recoveries studies of difenoconazole in fruits(n=3)
回收率在89.01%~103.43%之间,变异系数小于14.33%,说明此方法适用于食品样品的检测。
2.3.3果汁样品检测分析
选取不同品牌的苹果汁和橙汁样品进行实际检测分析,利用本研究所建立的dc-ELISA方法进行检测后,试验结果见表3。

表3 实际果汁样品检测及回收率表Table 3 Detection of real samples and their recoveries
由表3可知,6种样品中均无苯醚甲环唑检出(实测浓度低于样品检出限0.443 μg/L)。同时向所有样品中添加2.5 mg/L的苯醚甲环唑标准品计算回收率,样品处理方法同1.2.3.1,回收率为91.04%~113.84%。
3 结论
本研究通过苯醚甲环唑半抗原的设计及合成,人工抗原的制备,多克隆抗体的制备及纯化,最终建立了苯醚甲环唑的直接竞争ELISA检测方法,其灵敏度IC50为(67.96±2.73)μg/L,检测限IC15为(8.86±0.34)μg/L,与11种三唑类杀菌剂的交叉反应率均小于0.01%。选取10种果蔬类样品,经正己烷提取,PBS稀释后,进行加标回收试验,平均回收率为89.01%~103.43%,变异系数小于14.33%,检出限为0.443 mg/kg。本研究所建立的直接竞争ELISA方法,灵敏度和特异性较高,样品处理简单,为农产品中苯醚甲环唑残留的有效监管提供了一种高效的检测工具。
[1]K Wang,J X Wu,H Y Zhang.Dissipation of difenoconazole in rice,paddy soil,and paddy water under field conditions[J].Ecotoxicology and Environmental Safety,2012,86:111-115
[2] Gopinath K,Radhakrishnan N V,Jayaraj J.Effect of propiconazole and difenoconazole on the control of anthracnose of chilli fruits caused by Colletotrichum capsici[J].Crop Protection,2006,25:1024-1031
[3]李海华,廖福广,王鹏,等.杀菌剂苯醚甲环唑的制备[J].北京理工大学学报,2006,26(4):365-368
[4]潘晓威.苯醚甲环唑在采后芒果中残留动态及风险评估[D].海口:海南大学,2014
[5]Sandip H,Dasharath P O,Sagar C U,et al.Residue analysis of fipronil and difenoconazole in okra by liquid chromatography tandem mass spectrometry and their food safety evaluation[J].Food Chemistry,2015,176:145-151
[6]Ting D,Jing C,Min W,et al.An in situ immobilized pipette tip solid phase microextraction method based on molecularly imprinted polymer monolith for the selective determination of difenoconazole in tap water and grape juice[J].Journal of Chromatography B,2014,951:104-109
[7]江小雪,张昭,武霓,等.酶联免疫分析技术在杀菌剂残留检测中的应用[J].浙江农业科学,2009,1(3):562-565
[8]王雯,梁颖,钱建亚.液相色谱-质谱联用检测番茄中苯醚甲环唑残留[J].江苏农业学报,2011,27(3):668-671
[9]Maria-Pilar M,Shirley G,Bruce D.Immunochemical techniques for environmental analysis II,Antibody production and immunoassay development[J].Trends in analytical chemistry,1995,14(8):415-425
Development of An Enzyme-linked Immunosorbent Assay for the Detection of Difenoconazole in Fruits and Vegetables
LIU Bing,FENG Jiu-hui,TONG Bei,ZHANG Fu-yuan,SHENG Wei,ZHANG Yan,LU Yang,WANG Shuo*
(Key Laboratory of Food Nurtrition and Safety Ministry of Education of China,The School of Food Engineering and Biotechnology of Tianjin University of Science and Technology,Tianjin 300457,China)
A direct competitive enzyme-linked immunosorbent assays(dc-ELISA)was developed for detection of difenoconazole.The sensitivity(IC50)and the limit of detection(IC15)were(67.96±2.73)μg/L and(8.86± 0.34)μg/L,respectively.The assay conditions were optimized and the cross-reactivity against other triazole fungicides was low.The recoveries were in range of 89.01%-103.43%and RSD were below 14.33%.The detection limit for the method was 0.443 mg/kg.
difenoconazole;antibody;detection;ELISA
10.3969/j.issn.1005-6521.2016.21.025
国家自然科学基金青年科学基金(31301462)
刘冰(1979—),女(汉),副教授,博士,研究方向:食品安全检测。
王硕(1969—),男,教授,研究方向:食品安全检测。
2015-12-21
