钙库操纵性钙通道在人循环纤维细胞中的表达及功能*
2016-10-26钟金男何光珍高亚东
钟金男, 兰 兰, 何光珍, 黄 革, 杨 炯, 高亚东
(武汉大学中南医院呼吸内科, 湖北 武汉 430071)
·短篇论著·
钙库操纵性钙通道在人循环纤维细胞中的表达及功能*
钟金男,兰兰,何光珍,黄革,杨炯,高亚东△
(武汉大学中南医院呼吸内科, 湖北 武汉 430071)
目的: 研究钙库操纵性钙通道(store-operated calcium channels,SOCC)相关功能蛋白ORAI1-3和STIM1-2在人循环纤维细胞(circulating fibrocytes)中的表达及SOCC对人循环纤维细胞分化的影响。方法: 采集健康人外周静脉血,分离出单个核细胞,体外培养分化为循环纤维细胞。采用RT-PCR和real-time PCR检测循环纤维细胞中ORAI1-3及STIM1-2的mRNA表达情况,并检测SOCC抑制剂对循环纤维细胞分化的影响。结果: Real-time PCR 检测结果显示ORAI1-3和STIM1-2 mRNA在循环纤维细胞中有较高的表达水平,并且SOCC抑制剂 SKF-96365对循环纤维细胞分化具有明显的抑制作用。结论: SOCC表达于循环纤维细胞中,并且影响循环纤维细胞的分化。
循环纤维细胞; 钙库操纵性钙通道; ORAI1-3; STIM1-2
人循环纤维细胞(circulating fibrocytes)是外周循环中的一种骨髓来源的间充质祖细胞[1],由CD14+单核细胞分化而来[2],主要参与组织的修复与纤维化的过程,除此之外,还能作为抗原递呈细胞激活 T 淋巴细胞[3]、促进血管生成[4]和稳定细胞外基质[5]。在健康个体中,它占有核细胞的比例不到1%[6]。近年来,大量研究证实循环纤维细胞是肌成纤维细胞的前体[7],能够迁移并在肺中募集,可能通过促进平滑肌层增厚[8]、促纤维化和/或促进炎症过程[3]、促进新血管生成[4]和重建细胞外基质[5]等途径参与慢性哮喘气道重塑过程。
钙信号是细胞的重要第二信使,参与了细胞的增殖、分化、迁移和细胞因子分泌等多种功能的调控。细胞内钙离子浓度升高主要通过肌浆网(sarcoplasmic reticulum,SR)/内质网(endoplasmic reticulum,ER)等钙库中的内钙释放和胞外钙离子内流两种途径实现[9]。细胞膜上钙库操纵性钙通道(store-operated calcium channel, SOCC)介导的钙库操纵性钙内流(store-operated calcium entry,SOCE)是非兴奋性细胞外钙内流的主要途径[10]。
目前发现ORAI家族蛋白ORAI1-3主要参与SOCC的钙内流孔道的构成,而STIM家族蛋白STIM1-2 主要作为胞内钙库钙离子浓度的“传感器”,在钙离子浓度下降时将这一信号传递到胞膜的 SOCC,促使其开放,介导钙离子内流。本研究应用real-time PCR检测了体外培养的人循环纤维细胞中SOCC相关功能蛋白ORAI1-3和STIM1-2表达情况,并初步探讨SOCC抑制剂对循环纤维细胞分化成熟的影响,为将来深入探讨它们在支气管哮喘病理机制中的功能奠定基础。
材 料 和 方 法
1主要试剂
RPMI-1640 培养基、1 mmol/L HEPES、100×非必须氨基酸、100 mmol/L丙酮酸钠和100× ITS-3均购自Sigma;青霉素(1×107U/L)/链霉素(10 g/L)混合液(100×)和200 mmol/L谷氨酰胺购自HyClone;平底 24孔组织培养板购自BD Biosciences;人CD14+单核细胞负选磁珠购自 Dynal Biotech;TRITC连接的鼠抗人CD45 和 I型胶原(collagenⅠ,ColⅠ)抗体、驴抗兔 IgG H&L(FITC)II 抗及 SKF-96365 购自Abcam;TRIzol、DNA处理酶I 和逆转录酶SSⅢ购自Invitrogen;高保真 Taq酶和 SYBR®Premix Ex TaqTM购自 TaKaRa。所有引物由生工生物工程(上海)股份有限公司根据设计合成。
2主要方法
2.1人循环纤维细胞的分离及培养用肝素抗凝管采集每位健康志愿者(来自武汉大学医学院,均签署书面知情同意书)外周血50 mL, 用pH 7.4 无菌磷酸盐缓冲液(PBS)等体积稀释后, 用等体积的淋巴细胞分离液分离, 2 000 r/min离心 20 min,小心吸取白膜。用至少3倍体积的无菌 PBS 洗涤白膜,1 500 r/min离心15 min,轻轻吸除上清。分离所得的细胞即为外周血单个核细胞(periphral blood mononuclear cells,PBMCs)。加500 μL 隔离缓冲液(0.1% BSA 和2 mmol/L EDTA 的无Ca2+及Mg2+的PBS)轻轻混匀细胞,用Dynabeads®UntouchedTM人单核细胞磁珠负选试剂盒得CD14+单核细胞。用无血清的 RPMI-1640 完全培养基[含10 mmol/L HEPES,2 mmol/L谷氨酰胺,1×105U/L 青霉素,100 mg/L 链霉素, 0.2% BSA,1× ITS-3(5 mg/L胰岛素,5 mg/L转铁蛋白,5 μg/L亚硒酸钠),1 mmol/L 丙酮酸钠,1×非必需氨基酸] 1 mL 重悬细胞,吹打混匀。将所得的细胞按2.5×109/L的密度接种于24 孔培养板内,每孔2 mL,然后将培养板置于含 5% CO2的细胞培养箱内37 ℃培养7d,观察细胞形态变化。
2.2人循环纤维细胞的鉴定(1)形态学鉴定:按上述方法培养7 d后,光镜下观察,呈纺锤状的长梭形贴壁细胞即为循环纤维细胞。(2)免疫组织化学鉴定:将分离的细胞接种于共聚焦培养皿内,置于37 ℃,含 5% CO2的细胞培养箱内培养 7 d,然后选择分化较好的细胞培养皿,弃培养基, PBS 洗涤细胞 3 次,加入TRITC 连接的 CD45 抗体,4 ℃孵育 30 min 后,细胞清洗 3 次。用 250 μL 的固定破膜剂重悬细胞,4 ℃固定破膜 20 min。加入 PBS 溶液 2 mL,轻轻晃动培养皿,洗涤细胞 3 次,用含 2% 牛血清白蛋白的 PBS 室温封闭60 min。加 Col Ⅰ的I抗,4 ℃过夜。再用 2 mL PBS 清洗细胞3 次后,加入 FITC 标记的驴抗兔IgG的II抗,4 ℃暗室孵育,过夜。 2 mL PBS清洗细胞 3 次后,加入 PBS ,荧光显微镜下观察CD45和Col I的表达情况。
2.3RT-PCR及Real-time PCR检测循环纤维细胞中ORAI1-3及STIM1-2的mRNA表达情况将分离得到的CD14+单核细胞按 2.5×108/L 的密度接种到24 孔培养板培养7 d。取样后每管加入1 mL TRIzol进行RNA 抽提,最后每管RNA 晾干后加40 μL灭菌0.1‰ DEPC 处理双蒸水溶解RNA 沉淀。取2 μg 总RNA 至1.5 mL 离心管中进行反转录,所使用DNase I 和逆转录酶SS Ⅲ均来自Invitrogen ,反转录完成后生产的cDNA 产物补双蒸水至50 μL。RT-PCR 检测采用的反应体系为:0.4 μL primer F/R(10 μmol/L),2 μL dNTPs (2.5 mmol/L),2 μL 10倍缓冲液,0.2 μL Ex Taq,2 μL反转录cDNA 产物为模板,最后补灭菌双蒸水至20 μL;反应条件为:为94 °C 5 min;94 °C 15 s,60 °C 30 s,72 °C 30 s,共28循环;72 °C 5 min。反应完成后PCR 产物经0.8% 琼脂糖凝胶电泳检测。Real-time PCR 检测基因表达量采用的反应体系是10 μL SYBR®Premix Ex TaqTM,0.4 μL primer F/R(10 μmol/L),0.4 μL ROX Reference Dye Ⅱ(10 μmol/L),2 μL 反转录cDNA 产物,最后补灭菌双蒸水至20 μL。Real-time PCR 反应程序为:94 °C 10 s;94 °C 5 s,60 °C 38 s,40 循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。RT-PCR 以及real-time PCR 所用引物见表1。
2.4SOCC抑制剂对循环纤维细胞分化的影响将分离得到的 PBMCs 按 2.5×108/L 的密度接种到24孔板内;分组情况如下:分别设置空白对照组和SOCC抑制剂 SKF-96365 干预组:选择 1 μmol/L、3 μmol/L、10 μmol/L、30 μmol/L 和 100 μmol/L 多个浓度梯度;37 ℃培养箱内培养7 d,然后于 10 倍光学显微镜下观察循环纤维细胞分化的情况,随机取5 个视野拍照,并进行细胞计数。
表1RT-PCR 以及real-time PCR所用引物序列
Table 1.The sequences of the primers for RT-PCR and real-time PCR

NamePrimersequence(5'-3')Product(bp)GAPDHF:CATCACCATCTTCCAG-GAGCGA343R:GTCTTCTGGGTGGCAGTGAT-GGhORAI1F:AATCTCAACTCGGTCAAG-GAGTC343R:ACTGTCGGTCAGTCTTATG-GCTAhORAI2F:CGCAGTACCAGTACCCGCG-GCCG327R:AGCCCGTGTGACTC-CCAGGGCCAhORAI3F:GCGAGCAGGCCCCGCTGAAC348R:CTTCAATGTGGGGCAGCAGA-CAChSTIM1F:GTTTGCCTATATCCAGAAC-CGTTA342R:TACCATGAGCTGTGAGAT-TCTAGChSTIM2F:AGATGGTGGAATTGAAG-TAGAGG344R:CTTGAGCTGAAGTTTTT-GTCTGTG
F: forward; R: reverse.
3统计学处理
本实验中所有数据均在Excel中完成分析,数值计量资料均以均数±标准差(mean±SD)表示,两组间差异比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1循环纤维细胞的鉴定
将分离所得 PBMCs 用无血清培养基培养7 d后,光镜下可见部分贴壁细胞分化为长梭形,形态上符合已分化的循环纤维细胞的特征(图1),与文献报道一致[11];免疫组织化学检测细胞分子标记的表达情况,冰丙酮固定细胞并破膜后,用 TRITC 连接的 CD45 抗体和 FITC 连接的 Col I 抗体对细胞进行染色,经生物素亲和素的信号放大作用,荧光显微镜下可同时观察到 TRITC 的红色荧光和 FITC 的绿色荧光,证实梭形细胞能够同时表达CD45和Col I分子(图2)。

Figure 1.Morphological characteristics of human circulating fibrocytes. PBMCs were cultured in serum-free medium for 7 d (×200). Typical fibrocytes were spindle-shaped (black arrow); some round adherent cells with big nucleus were macrophages differentiated from PBMCs (red arrow); small round suspended cells were lymphocytes (blue arrow).
图1循环纤维细胞的形态学特征
2RT-PCR和real-time PCR 检测循环纤维细胞中ORAI1-3和STIM1-2的mRNA表达
RT-PCR 结果显示各基因引物特异性良好,条带特异且PCR 产物大小符合预期,同时也表明了这批引物能够用于real-time PCR 检测,凝胶电泳检测结果见图3。进一步使用这些引物我们在6 个志愿者的人体循环纤维细胞中对ORAI1、 ORAI2、ORAI3、STIM1和STIM2进行了real-time PCR 的检测。结果显示,ORAI1 mRNA的表达量明显高于ORAI2和ORAI3;而STIM1 mRNA的表达量也高于STIM2,表明ORAI1和STIM1是循环纤维细胞SOCC的主要构成和调节分子,见图4。

Figure 2.The molecular markers of human circulating fibrocytes. The results of immunohistochemical detection of the molecular markers expressed in the fibrocytes were shown.
图2循环纤维细胞的分子标记
Figure 3.The mRNA expression of SOCC-related proteins in human circulating fibrocytes detected by RT-PCR.
图3RT-PCR检测循环纤维细胞SOCC相关蛋白的mRNA表达
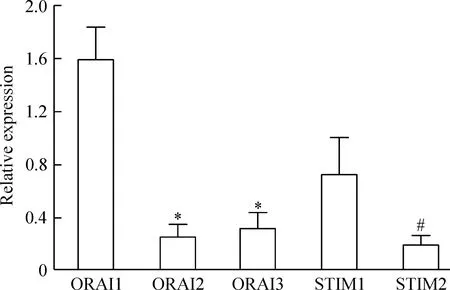
Figure 4.The mRNA expression of ORAI1-3 and STIM1-2 in human circulating fibrocytes detected by real-time PCR.Mean±SEM.n=6.*P<0.05vsORAI1;#P<0.05vsSTIM1.
图4Real-time PCR检测ORAI1-3 和STIM1-2的mRNA 在人循环纤维细胞组织中的表达谱及表达丰度
3SOCC抑制剂SKF-96365对循环纤维细胞分化的影响
SKF-96365 是 SOCC的非特异性抑制剂,研究表明在SKF浓度为10 μmol/L时,基本上对细胞无毒害作用[12]。如图 5 所示,无血清培养基培养的PBMCs在加入较低浓度(1 μmol/L和3 μmol/L)的SKF-96365时,循环纤维细胞的分化过程即受到明显的抑制,且具有很强的浓度依赖性,即浓度越高抑制越明显。当 SKF-96365 的浓度为10 μmol/L 时,能抑制大部分循环纤维细胞的分化。
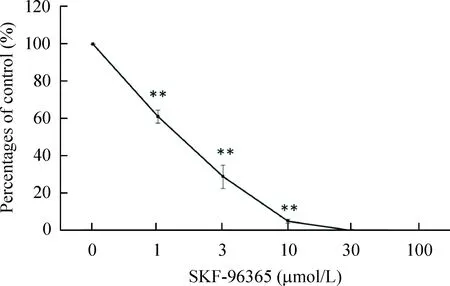
Figure 5.SOCC inhibitor SKF-96365 inhibited the differentiation of human circulating fibrocytes. SKF-96365 at diffe-rent concentrations was added into culured PBMCs. Numbers of cells in 5 randomly selected fields were counted. Mean±SEM.n=3.**P<0.01vs0 μmol/L.
图5SOCC抑制剂 SKF-96365 对循环纤维细胞分化的影响
讨 论
气道重塑是慢性哮喘的重要特征,其病理改变包括气道上皮下纤维化及肌成纤维细胞聚积[13]。许多研究都表明循环纤维细胞是参与哮喘结构和功能损害的重要因素。最早在2003 年Schmidt 等[14]发现在哮喘患者的气道中含有循环纤维细胞(CD45+/CD34+和Col I 为识别标记),而且这些细胞随着患者接触过敏原增多而数量增多。一项独立研究发现严重难治性哮喘患者的支气管活检样本中支气管壁中循环纤维细胞数量较正常组明显升高,而外周血中的循环纤维细胞数量也明显升高[8]。最近一项临床研究也发现哮喘患者外周血中的循环纤维细胞数量与哮喘的严重程度呈正相关,可以作为临床严重哮喘的生物学标志[15]。
SOCC是非兴奋性细胞胞外Ca2+内流的主要通道,参与了基因转录、细胞凋亡、肌肉收缩、炎症和应激等多种生理和病理生理过程。有研究表明ORAI1和STIM1两种蛋白是构成SOCE 通道的重要组成部分。ORAI是近年来发现的一种位于细胞膜上的4次跨膜离子通道蛋白,哺乳动物ORAI家族中有3 个成员:ORAI1、ORAI2和ORAI3,其中ORAI1是最重要的SOCE 的效应蛋白。研究表明ORAI1可以和ORAI2、ORAI3复合体来介导SOCE[16]。STIM家族成员包括STIM1和STIM2 。在哺乳动物研究中发现STIM1是SOCC的重要调节分子,而STIM2主要与维持钙库的稳定有关。STIM1是分子量为77 kD 的跨膜蛋白,主要位于ER 膜上,它具有感受钙池充盈状态并将感受信号通过不同蛋白作用机制传递给ORAI及TRPC通道的双重功能,是共同介导SOCE 的关键分子[17]。我们的 mRNA 表达研究表明,体外培养的循环纤维细胞均表达这些 SOCC相关蛋白,其中以STIM1和ORAI1的表达最为丰富,提示STIM1和ORAI1是循环纤维细胞 SOCC的主要构成分子和调节分子。
单核细胞是循环纤维细胞的前体,SOCC介导的钙离子内流参与单核细胞的激活、增殖、分化及细胞因子的分泌等多种生理过程[18]。我们的既往研究显示,在单核细胞分化而来的巨噬细胞和树突状细胞[12,19],SOCC发挥了重要功能,对树突状细胞的成熟和抗原递呈等功能具有调节作用,并有可能参与哮喘气道炎症过程。循环纤维细胞同样由单核细胞分化而来,因此,理论上SOCC同样会发挥功能调控作用。我们的研究结果证实了SOCC调控循环纤维细胞的分化过程。成纤维细胞和肌成纤维细胞可由循环纤维细胞分化而来,其基因表达和炎症介质释放等多种细胞功能调控与非选择性的 SOCC密切相关[20-21]。因此,循环纤维细胞的分化以及其进一步的分化为成纤维细胞和肌成纤维细胞的过程均受到SOCC的影响,提示SOCC可以作为一个节点分子,调节循环纤维细胞参与的病理生理过程,比如慢性哮喘的气道重塑过程。下一步我们将用体内实验进一步验证SOCC抑制后对循环纤维细胞在慢性哮喘气道重塑中的作用的影响。
本实验结果显示循环纤维细胞表达SOCC相关基因,并且SOCC的活性影响循环纤维细胞的分化,表明SOCC是循环纤维细胞功能的重要调节机制。
[1]Bucala R, Spiegel LA, Chesney J, et al. Circulating fibrocytes define a new leukocyte subpopulation that mediates tissue repair [J]. Mol Med, 1994, 1(1):71-81.
[2]Yang L, Scott PG, Giuffre J, et al. Peripheral blood fibrocytes from burn patients: identification and quantification of fibrocytes in adherent cells cultured from peripheral blood mononuclear cells[J]. Lab Invest, 2002, 82(9):1183-1192.
[3]Chesney J, Bacher M, Bender A, et al. The peripheral blood fibrocyte is a potent antigen-presenting cell capable of priming naive T cellsinsitu[J]. Proc Natl Acad Sci U S A, 1997, 94(12):6307-6312.
[4]Hartlapp I, Abe R, Saeed RW, et al. Fibrocytes induce an angiogenic phenotype in cultured endothelial cells and promote angiogenesisinvivo[J]. FASEB J, 2001, 15(12):2215-2224.
[5]Bianchetti L, Barczyk M, Cardoso J, el al. Extracellular matrix remodelling properties of human fibrocytes[J]. J Cell Mol Med, 2012, 16(3):483-495.
[6]Quan TE, Cowper S, Wu SP, et al. Circulating fibrocytes: collagen-secreting cells of the peripheral blood [J]. Int J Biochem Cell Biol, 2004, 36(4):598-606.
[7]Isgro M, Bianchetti L, Marini MA, el al. The C-C motif chemokine ligands CCL5, CCL11, and CCL24 induce the migration of circulating fibrocytes from patients with severe asthma[J].Mucosal Immunol, 2013, 6(4):718-727.
[8]Lo CY, Michaeloudes C, Bhavsar PK, et al. Increased phenotypic differentiation and reduced corticosteroid sensitivity of fibrocytes in severe asthma[J]. J Allergy Clin Immunol, 2015, 135(5):1186-1195.
[9]Parekh AB, Putney JW. Store-operated calcium channels[J]. Physiol Rev, 2005, 85(2):757-810.
[10]Cheng KT, Ong HL, Liu X, et al. Contribution of TRPC1 and Orai1 to Ca2+entry activated by store depletion[J]. Adv Exp Med Biol, 2011, 704:435-449.
[11]Ekert JE, Murray LA, Das AM, et al. Chemokine (CC motif) ligand 2 mediates direct and indirect fibrotic responses in human and murine cultured fibrocytes[J]. Fibrogenesis Tissue Repair, 2011, 4(1):1-10.
[12]Geng S, Gao Y, Yang J, et al. Potential role of store-operated Ca2+entry in Th2 response induced by histamine in human monocyte-derived dendritic cells[J]. Int Immunopharmacol, 2012, 12(2): 358-367.
[13]Nelson HS, Davies DE, Wicks J, et al. Airway remodeling in asthma: new insights[J]. J Allergy Clin Immunol, 2003, 111(2):215-225.
[14]Schmidt M, Sun G, Stacey MA, et al. Identification of circulating fibrocytes as precursors of bronchial myofibroblasts in asthma[J]. J Immunol, 2003, 171(1): 380-389.
[15]Shipe R, Burdick MD, Strieter BA, et al. Number, activation, and differentiation of circulating fibrocytes correlate with asthma severity[J]. J Allergy Clin Immunol, 2016,137(3):750-757.e3.
[16]Vig M, Peinelt C, Beck A, et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+entry[J]. Science, 2006, 312(5777):1220-1223.
[17]Zhang SL, Yu Y, Roos J, et al. STIM1 is a Ca2+sensor that activates CRAC channels and migrates from the Ca2+store to the plasma membrane[J]. Nature, 2005, 437(7060):902-905.
[18]Aires V, Hichami A, Filomenko R, et al. Docosahexaenoic acid induces increases in [Ca2+]ivia inositol 1, 4, 5-triphosphate production and activates protein kinase Cγ and -δ via phosphatidylserine binding site: implication in apoptosis in U937 cells[J]. Mol Pharmacol, 2007, 72(6):1545-1556.
[19]Gao YD, Hanley PJ, Rinné S, et al. Calcium-activated K+channel (KCa3.1) activity during Ca2+store depletion and store-operated Ca2+entry in human macrophages [J]. Cell Calcium, 2010, 48(1):19-27.
[20]Ikeda K, Nakajima T, Yamamoto Y, et al. Roles of transient receptor potential canonical (TRPC) channels and reverse-mode Na+/Ca2+exchanger on cell proliferation in human cardiac fibroblasts: Effects of transforming growth factor β1[J]. Cell Calcium, 2013, 54(3):213-225.
[21]Kurahara LH, Sumiyoshi M, Aoyagi K, et al. Intestinal myofibroblast TRPC6 channel may contribute to stenotic fibrosis in Crohn′s disease[J]. Inflamm Bowel Dis, 2015, 21(3):496-506.
(责任编辑: 林白霜, 罗森)
Expression and function of store-operated calcium channels in human circulating fibrocytes
ZHONG Jin-nan, LAN Lan, HE Guang-zhen, HUANG Ge, YANG Jiong, GAO Ya-dong
(DepartmentofRespiratoryMedicine,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China.E-mail:gaoyadong@whu.edu.cn)
AIM: To investigate the expression and function of store-operated calcium channels (SOCC) in human circulating fibrocytes.METHODS: Peripheral blood mononuclear cells (PBMCs) were isolated and cultured in serum-free media. After 7 d, the PBMCs differentiated into fibrocytes. RT-PCR and real-time PCR were performed to determine the mRNA expression of ORAI1-3 and STIM1-2 in the fibrocytes. SOCC inhibitor SKF-96365 was used to elucidate the role of SOCC in the differentiation of fibrocytes. RESULTS: The results of real-time PCR showed that the mRNA expression of ORAI1-3 and STIM1-2 was positive in cultured fibrocytes. SKF-96365 (10 μmol/L) significantly inhibited the differentiation of fibrocytes.CONCLUSION: SOCC-related proteins ORAI1-3 and STIM1-2 are abundantly expressed in the fibrocytes, and may play an important role in the differentiation of these cells.
Circulating fibrocytes; Store-operated calcium channels; ORAI1-3; STIM1-2
1000- 4718(2016)04- 0733- 06
2015- 09- 29
2016- 03- 14
国家自然科学基金资助项目(No. 81270069)
Tel: 027-67813277; E-mail: gaoyadong@whu.edu.cn
R587.1
A
10.3969/j.issn.1000- 4718.2016.04.025
杂志网址: http://www.cjpp.net
