ApoCⅢ转基因引起的高血浆甘油三酯对弹力蛋白酶诱导的LDLR-/-小鼠腹主动脉瘤的影响*
2016-10-26鱼毛毛曹旖旎王云霞刘国庆
陈 聪, 鱼毛毛, 曹旖旎, 王云霞, 王 超, 刘国庆, 祁 荣
(北京大学心血管研究所,分子心血管学教育部重点实验室,北京100191)
ApoCⅢ转基因引起的高血浆甘油三酯对弹力蛋白酶诱导的LDLR-/-小鼠腹主动脉瘤的影响*
陈聪,鱼毛毛,曹旖旎,王云霞,王超,刘国庆,祁荣△
(北京大学心血管研究所,分子心血管学教育部重点实验室,北京100191)
目的: 研究载脂蛋白CⅢ(ApoCⅢ)转基因引起的高血浆甘油三酯(TG)对腹主动脉瘤发生发展的影响。方法:以LDLR-/-和ApoCⅢ+LDLR-/-小鼠喂饲高脂饲料,分别造成高胆固醇血症和高胆固醇合并高甘油三酯血症模型;采用弹力蛋白酶法在2种基因型小鼠上诱导建立腹主动脉瘤模型;以动脉瘤发生率、动脉瘤直径、主动脉弹力板降解情况及血管基质金属蛋白酶的表达等为指标,比较LDLR-/-和ApoCⅢ+LDLR-/-小鼠分别在普通饲料和高脂饲料喂饲条件下,腹主动脉瘤的发生和发展情况;采用TNF-α诱导血管平滑肌细胞(VSMC)建立动脉瘤体外微环境模型,研究来自具有正常含量ApoCⅢ 或高含量ApoCⅢ小鼠 的富含甘油三酯的脂蛋白(TRLs)对弹力蛋白表达的影响。结果:高脂饲料加重了LDLR-/-小鼠的腹主动脉瘤程度;高脂饲料喂饲的ApoCⅢ+LDLR-/-小鼠腹主动脉瘤轻于高脂喂饲的LDLR-/-小鼠;在体外,TRLs具有抑制TNF-α诱导的VSMC弹力蛋白酶降解的作用,且来自高含量ApoCⅢ 小鼠的TRLs对弹力蛋白降解的抑制作用更为显著。结论:ApoCⅢ转基因引起的高血浆甘油三酯能减轻弹力蛋白酶诱导的LDLR-/-小鼠的腹主动脉瘤,该作用可能与ApoCⅢ基因及其导致的高血浆甘油三酯有关。
腹主动脉瘤; 载脂蛋白CⅢ; 甘油三酯; 富含甘油三酯的脂蛋白; 血管平滑肌细胞
腹主动脉瘤(abdominalaorticaneurysm,AAA)是一种常见的心血管疾病,并被证明具有一定的遗传可能性[1-3]。人群基因组调查结果显示,低密度脂蛋白受体(low-densitylipoproteinreceptor,LDLR)突变与AAA具有密切关系[1,4]。LDLR缺失导致血液中总胆固醇(totalcholesterol,TC)清除障碍从而引起高胆固醇血症,对AAA具有加重作用[5]。Hobbs等[6]进行临床研究发现低密度脂蛋白胆固醇(low-densitylipoproteincholesterol,LDL-C)可能通过刺激炎症反应导致基质降解,促使AAA的发生和发展。
载脂蛋白CⅢ(apolipoproteinCⅢ,ApoCⅢ)高表达可抑制脂蛋白脂酶的活性及肝脏对富含甘油三酯的脂蛋白(triglyceride-richlipoproteins,TRLs)残体的摄取,导致高甘油三酯(triglyceride,TG)血症[7]。已有的研究表明ApoCⅢ 基因突变可减小心血管疾病的发生风险[8]。但ApoCⅢ和血浆甘油三酯水平与心血管疾病的相互关系还有待进一步深入研究[7]。目前还没有ApoCⅢ基因与AAA相关性方面的研究报道。而血浆甘油三酯水平与AAA的相关性研究尚少,且主要为临床病例分析,其结果也仍存在一定争议。1998年,Watt等[9]通过临床数据分析得出高甘油三酯是动脉瘤破裂的重要危险因素;2007年,也有临床研究显示AAA患者血浆甘油三酯水平升高[10]。而Golledge等[11]2010年的调查研究表明血浆甘油三酯水平与AAA的发生无相关性。因此,研究并明确ApoCⅢ基因及其引起的高甘油三酯血症对AAA发生发展的影响将对明确AAA的发病及临床治疗具有重要意义。
本研究以LDLR缺陷(LDLR-/-)小鼠和ApoCⅢ转基因LDLR敲除(ApoCⅢ+LDLR-/-)小鼠为模型,采用高脂饲料分别诱导2种基因型小鼠的高胆固醇血症和高胆固醇合并高甘油三酯血症;采用弹力蛋白酶法诱导构建小鼠AAA模型,研究比较普通饲料和高脂饲料喂饲下2种基因型小鼠AAA的发病程度,明确ApoCⅢ基因及其导致的高甘油三酯血症与AAA发病的关系。我们选择ApoCⅢ+LDLR-/-双基因型小鼠作为研究对象的原因,一是ApoCⅢ转基因小鼠随着拷贝数的增加,血浆甘油三酯水平有所下降(平均水平约1 000mg/dL左右),而ApoCⅢ+LDLR-/-小鼠的血浆甘油三酯水平在普通饲料下即可达到2 000mg/dL以上,血浆甘油三酯水平更高,更有利于研究ApoCⅢ基因及甘油三酯水平对AAA发病的影响;其二,LDLR-/-背景的加入可以提高小鼠血浆胆固醇水平,可验证高胆固醇对AAA作用的临床研究结果。在体外血管平滑肌细胞(vascularsmoothmusclecells,VSMC)模型上,用TNF-α刺激能够激活VSMC处于炎症活化的状态[12-13],表现在炎症因子IL-6和单核细胞趋化蛋白1(monocytechemoattractantprotein-1,MCP-1)的过度表达,基质金属蛋白酶(matrixmetalloproteinases,MMP)-2和MMP-9的蛋白表达和活性的增加,以及促分裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK)通路蛋白的活化等。本研究用TNF-α刺激VSMC模拟动脉瘤体外微环境,研究来自具有正常含量或高含量ApoCⅢ 小鼠的TRLs对TNF-α诱导的弹力蛋白降解的影响,以期区分并阐明ApoCⅢ基因及高甘油三酯对AAA的作用。
材 料 和 方 法
1动物
健康7~8周龄雄性LDLR-/-和ApoCⅢ+LDLR-/-小鼠,体重20~25g,ApoCⅢ转基因和LDLR-/-小鼠均购自Jackson实验室。 ApoCⅢ转基因和LDLR-/-小鼠杂交、 回交及基因型鉴定,得到双基因修饰动物模型ApoCⅢ+LDLR-/-。小鼠于北京大学医学部SPF级动物房饲养,室温(25±2)℃,湿度55%±3%,明暗周期12h,每日给予洁净饮水。
2主要试剂
TC和TG测定试剂盒购于北京中生北控生物科技公司; 猪胰弹力蛋白酶和水合氯醛购自Sigma;OCT包埋剂购自樱花公司;rabbitanti-elastin单抗购自Abcam;mouseanti-GAPDH多抗以及HRP标记的山羊抗兔、鼠IgG均购自SantaCruz。
3主要方法
3.1小鼠基因性鉴定小鼠出生后第 22 天,断乳并剪取小鼠尾巴,加0.5mL组织裂解液(Tris-HCl,pH7.4;ProteaseK浓度为25g/L)置 55 ℃孵育过夜,常法抽提基因组DNA,参照Jackson实验室提供的鉴定方法,采用PCR技术确定LDLR-/-和ApoCⅢ+LDLR-/-小鼠的基因型。
3.2弹力蛋白酶法制备小鼠AAA模型小鼠腹腔注射0.5%的水合氯醛进行全身麻醉。仰卧固定,下腹部正中切口,逐层切开进入腹腔,钝性分离肾动脉水平以下髂动脉水平以上腹主动脉段约1cm。将浸有1.3U弹力蛋白酶溶液的聚乙烯海绵完全包绕游离的腹主动脉段,浸润40min后,取出海绵,常规手术关闭腹壁切口。对照假手术组小鼠采用生理盐水浸润的聚乙烯海绵完全包绕游离的腹主动脉段,其它操作同手术组。
3.3实验分组及造模将LDLR-/-和ApoCⅢ+LDLR-/-2种基因型的小鼠在实验条件下适应性饲养1周后,测量体重,取血测定血浆TC和TG水平,根据体重、TC和TG水平将每种基因型小鼠平均分为2组,分别设定为普通饲料组和高脂饲料组。高脂饲料为含20%猪油和0.5%胆固醇的饲料。普通饲料和高脂饲料分别喂饲2周后,采用弹力蛋白酶法制备AAA模型。每种饲料下,分别设LDLR-/-小鼠的AAA对照组和模型组,ApoCⅢ+LDLR-/-小鼠的AAA对照组和模型组。造模后,小鼠保持原有的高脂或普通饲料喂饲,2周后取血并处死小鼠取材。
3.4血浆TC和TG的测定各组禁食12h,麻醉后眼眶采血,离心分离血浆,采用酶比色法试剂盒检测小鼠血浆TC和TG,详细操作方法参考说明书。
3.5AAA发病程度的评价取小鼠腹主动脉,以腹主动脉瘤发生率、腹主动脉直径、主动脉切片的醛品红染色病理评分及主动脉切片的MMP-9免疫组化染色等为指标评价腹主动脉瘤的严重程度。
3.6MMP-9的免疫组化染色采用免疫组化法检测血管动脉瘤部位的MMP-9的表达情况。小鼠动脉瘤血管切片采用3%H2O2封闭内源性过氧化酶;10%正常羊血清孵育1h封闭;滴加抗MMP-9的I抗 (1∶100);切片于4 ℃冰箱中过夜;PBS缓冲液震荡清洗3次;滴加辣根过氧化物酶标记的II抗;DAB染色;苏木精复染;常规封片显微镜下观察,棕染的细胞为MMP-9阳性细胞。
3.7体外动脉瘤微环境的建立参考文献报道的方法,建立活化的VSMC用以模拟体外动脉瘤微环境。在培养的原代VSMC(P3~P6)中加入TNF-α100μg/L刺激激活VSMC处于炎症活化状态。
3.8TRLs的提取及孵育细胞(1)取ApoCⅢ+(ApoCⅢ基因过表达)小鼠和甘油磷酸肌醇锚定高密度脂蛋白结合蛋白1 (glycosylphosphatidylinositol-anchoredhigh-densitylipoprotein-bindingprotein1,GPIHBP1) 敲除(GPIHBP1-/-,ApoCⅢ基因表达正常)小鼠的血液,肝素抗凝后分离血浆。(2) 100μL血浆加入超速离心管,上面缓缓加入100μL生理盐水。(3) 在HitachiP42AT转子中超速离心(42 000r/min,10 ℃)3h。(4) 小心吸取上层TRLs用于细胞实验,所有步骤均在无菌操作台中进行,防止细菌污染。 (5) 大鼠VSMC加入50mg/L(以TG含量定量)的TRLs处理48h。
3.9Westernblot检测elastin的表达细胞孵育时间结束后提取总蛋白,BCA试剂盒测定总蛋白质浓度,将各组蛋白质浓度调到同一水平,置于-70 ℃冻存(低温冰箱)。制备10%SDS;聚丙烯酰胺凝胶,样品加热变性后,每孔加蛋白样品20μg电泳,半干式电转移仪转膜到PVDF膜;5%脱脂奶粉室温封闭1h,单克隆I抗elastin(1∶2 000稀释),4 ℃过夜,洗膜,按1∶5 000加入过氧化物酶标记的II抗2h,洗膜后加入增强型化学发光试剂,显色。
4统计学处理
用SPSS16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,采用t检验或单因素方差分析(one-wayANOVA)进行统计学分析,以P<0.05为差异有统计学意义。
结 果
1小鼠基因型鉴定结果
1.1LDLR 基因敲除小鼠PCR扩增出170bp条带为野生型特异性片段,350bp条带为LDLR等位基因特异性片段。 只有170bp条带为野生型小鼠,只有350bp小鼠为纯合子LDLR敲除小鼠,同时具有170bp和350bp条带为杂合子LDLR敲除小鼠,见图1A。本实验选用PCR结果只有350bp条带的小鼠,即纯合子LDLR敲除小鼠进行实验。
1.2ApoCⅢ转基因小鼠PCR扩增出173bp大小的条带为ApoCⅢ特征条带,出现173bp条带表示为ApoCⅢ转基因小鼠,无173bp大小的条带为非转入ApoCⅢ基因小鼠,见图1B。本实验选用PCR结果中有173bp条带小鼠和同时在LDLR基因型鉴定中只有350bp条带的小鼠,即ApoCⅢ+LDLR-/-小鼠进行实验。
2血脂水平
普通饲料喂饲时,2种基因型小鼠的TC和TG水平较喂饲前没有明显的变化。高脂饲料喂饲4周后,LDLR-/-小鼠TC水平增加了2倍(P<0.01),TG水平增加了1倍(P<0.01);ApoCⅢ+LDLR-/-小鼠的TC水平增加了1.36倍(P<0.01),TG水平增加了0.4倍。2种基因型小鼠血脂水平比较,ApoCⅢ+LDLR-/-小鼠的TC水平是LDLR-/-小鼠的2倍(P<0.01),TG水平是其20倍左右(P<0.01),见图2。
3腹主动脉瘤发生率及腹主动脉直径变化
在2种不同饲料喂饲下,2种基因型小鼠的对照组(假手术组)动脉瘤的发生率均为零;模型组的腹主动脉与对照组相比明显扩大。普通饲料喂饲下造模,2种基因型小鼠的动脉瘤发病率均为80%;高脂饲料喂饲下造模,2种基因型小鼠动脉瘤发生率均达100%。LDLR-/-小鼠高脂喂饲后,动脉瘤直径的扩张显著增加(P<0.05);而ApoCⅢ+LDLR-/-小鼠在普通和高脂饲料喂饲下,动脉瘤直径没有明显变化;高脂喂饲的ApoCⅢ+LDLR-/-小鼠的动脉瘤直径比高脂喂饲的LDLR-/-小鼠的动脉瘤直径显著减小(P<0.05),见图3。
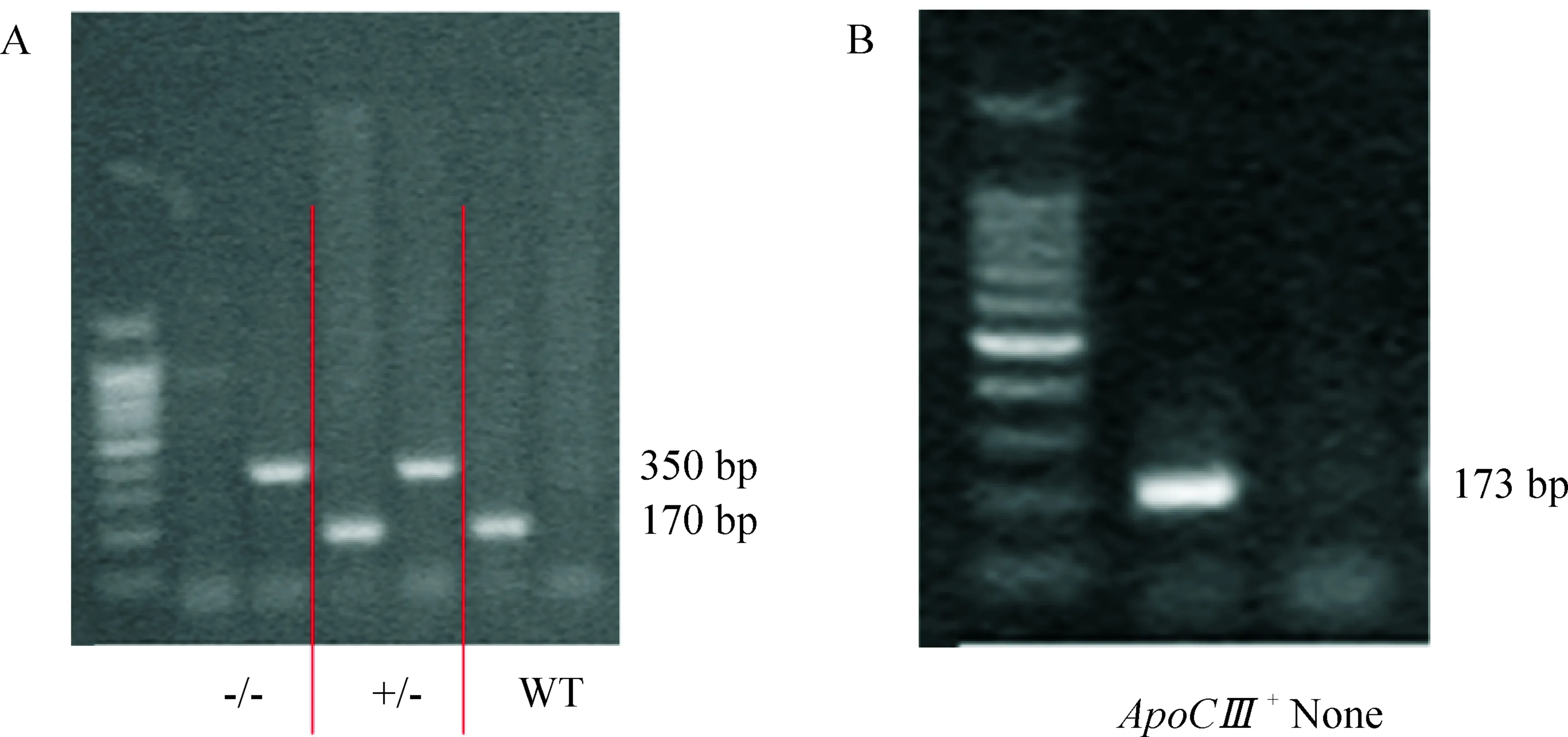
Figure1.MultiplexPCR-basedgenotypingofmice.A: LDLRgenotyping. -/-:homozygous; +/-:heterozygous;WT:wild-type.B: ApoCⅢgenotyping.
图1小鼠基因型鉴定PCR产物琼脂糖凝胶电泳分析
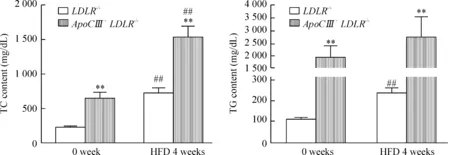
Figure2.PlasmaTCandTGlevelsinLDLR-/-andApoCⅢ+LDLR-/-miceafterhigh-fatdiet(HFD)for4weeks.Mean±SD. n=9~14.**P<0.01 vs LDLR-/-;##P<0.01 vs 0week.
图22种基因型小鼠高脂饮食4周的血脂变化
4醛品红染色病理评分
动脉壁弹力蛋白的醛品红染色结果显示,LDLR-/-和ApoCⅢ+LDLR-/-小鼠的对照组小鼠动脉壁完整,未发生弹力蛋白降解情况;模型组小鼠的动脉壁弹力蛋白发生不同程度的降解。采用ImageJ对染色结果进行半定量分析,结果表明高脂喂饲下,LDLR-/-小鼠血管弹力蛋白的降解程度较普通饲料喂饲时显著增加;ApoCⅢ+LDLR-/-小鼠血管弹力蛋白的降解程度在高脂与普通饲料喂饲下没有显著差异,见图4。
5动脉切片的MMP-9的表达情况
免疫组化染色结果显示,高脂喂饲后,LDLR-/-小鼠动脉瘤血管中MMP-9的表达较普通喂饲的LDLR-/-小鼠的表达水平高,而ApoCⅢ+LDLR-/-小鼠动脉瘤血管中MMP-9的表达水平均比同样喂饲条件下的LDLR-/-小鼠的MMP-9表达低,见图5。
6TRLs对TNF-α诱导的VSMC弹力蛋白表达的影响
采用100μg/LTNF-α刺激48h后,VSMC的弹力蛋白表达明显下降,提示TNF-α诱导VSMC模拟动脉瘤发生微环境的体外细胞模型建立成功。分别加入ApoCⅢ+和GPIHBP1-/-小鼠来源的TRLs(含50mg/LTG)和100μg/LTNF-α共同孵育48h后,VSMC弹力蛋白表达均比单纯TNF-α(未加TRLs)孵育的明显上调,且ApoCⅢ+来源的TRLs(ApoCⅢ高含量) 孵育后,弹力蛋白表达上调显著高于GPIHBP1-/-来源的TRLs(ApoCⅢ正常含量),见图6。
讨 论
从以上结果可知,与普通饲料喂饲相比,高脂饲料喂饲4周后LDLR-/-小鼠血浆总TC水平增加了2倍,TG水平增加了1倍;LDLR-/-小鼠的动脉瘤发生率,动脉瘤直径扩张程度,动脉弹力蛋白的降解程度及动脉瘤血管中MMP-9的表达均显著增加,说明高脂饮食通过增加LDLR-/-小鼠的血脂水平,尤其是增加了血浆TC水平加重了AAA。这一结果验证了前人的研究结果,即高胆固醇与AAA发生风险呈正相关[6]。
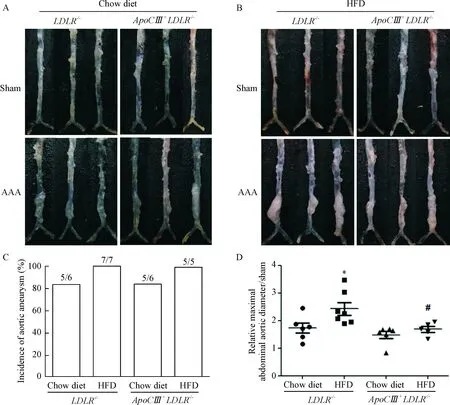
Figure3.AAAmorphologyinthemicefedwithchowdiet(A)andhigh-fatdiet(HFD;B),andincidence(C)andrelativemaximalabdominalaorticdiameter(D)oftheLDLR-/-andApoCⅢ+LDLR-/-mice.Mean±SD. n=5~7.*P<0.05 vs LDLR-/-micefedwithchowdiet;#P<0.05 vs LDLR-/-micefedwithHFD.
图32种基因型小鼠由弹力蛋白酶诱导的动脉瘤形态
高脂饲料喂饲下,ApoCⅢ+LDLR-/-小鼠的动脉瘤直径比LDLR-/-小鼠的显著减小,说明ApoCⅢ转基因对LDLR-/-小鼠的AAA发病程度具有减轻作用。我们知道ApoCⅢ转基因主要是引起TRLs代谢障碍,导致高TG血症。因此,ApoCⅢ转基因引起的高TG水平对AAA的抑制作用值得探讨。已有的研究结果和我们的结果均表明高血浆TC是加重AAA的危险因素,但目前为止高TG血症对AAA的影响仍存在争议且缺乏基础研究的支持。
我们对小鼠的血脂水平进行分析发现,高脂饲料下,ApoCⅢ+LDLR-/-小鼠血浆TC水平是LDLR-/-小鼠的2倍;其血浆TG水平是LDLR-/-的20倍;2种基因型小鼠相比,TG水平的差异远大于TC。因此,我们推测血浆高TG水平是减轻ApoCⅢ+LDLR-/-小鼠AAA的因素之一。
对ApoCⅢ+LDLR-/-小鼠的血脂进行分析发现,高脂喂饲后,ApoCⅢ+LDLR-/-小鼠TC水平比普通饲料喂饲时增加了1.36倍。虽然高胆固醇对AAA具有加重作用,但由于ApoCⅢ+LDLR-/-小鼠即便在普通饲料喂饲下,TG水平已高达2 000mg/dL。因此,在高脂和普通饲料下,ApoCⅢ+LDLR-/-小鼠的动脉瘤直径没有显著差异,进一步说明高TG水平对AAA有抑制作用。
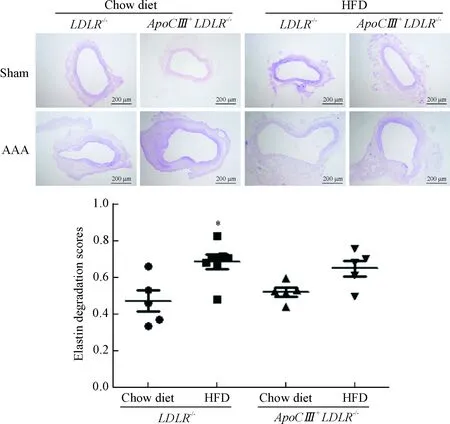
Figure4.Aldehydefuchsinstainingandquantificationoftheelastindegradation.Mean±SD. n=5~7.*P<0.05 vs LDLR-/-micefedwithchowdiet.
图4腹主动脉的醛品红染色及弹力蛋白酶降解分数
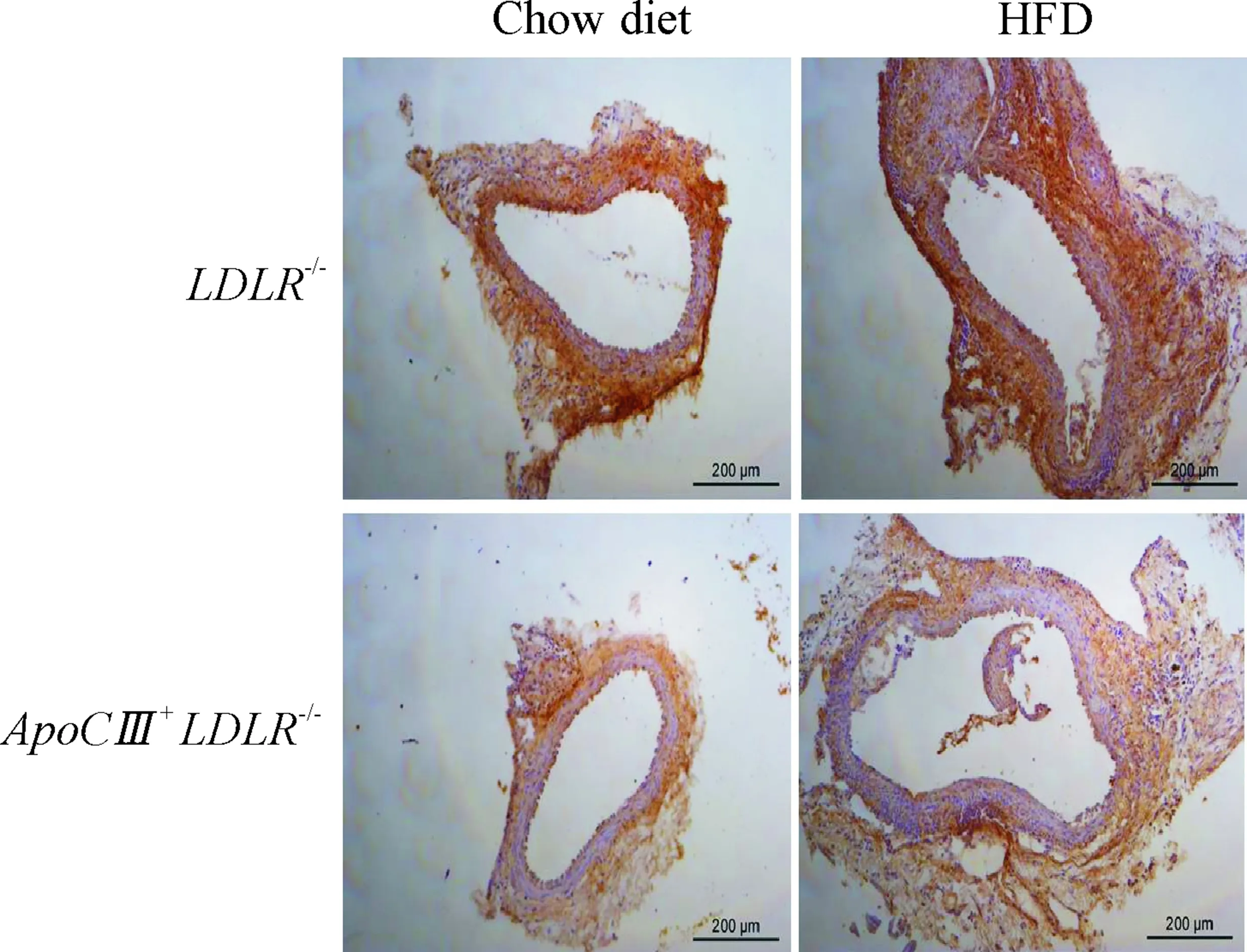
Figure5.MMP-9expressionintheabdominalaortaoftheAAAmice.
图5AAA小鼠腹主动脉瘤部位MMP-9的表达
为进一步探究ApoCⅢ基因本身对AAA的作用,我们在体外分别用具有正常含量和高含量的ApoCⅢ的TRL孵育血管平滑肌细胞,结果表明,TRLs可以显著抑制TNF-α诱导的VSMC弹力蛋白酶表达量的减少,在体外进一步证明高TG对腹主动脉瘤有减轻作用;同时,高含量ApoCⅢ的TRL对弹力蛋白酶的保护作用较正常表达ApoCⅢ基因的TRL更显著,说明在体外,ApoCⅢ本身对AAA具有减轻作用。综上所述, ApoCⅢ基因及其引起的高血浆TG对弹力蛋白酶诱导的LDLR-/-小鼠AAA的发生发展可能均起有抑制作用。虽然此前许多研究表明ApoCⅢ和高血浆甘油三酯是心血管疾病的危险因素,但没有直接证据证明ApoCⅢ和高TG在AAA中的作用。有临床数据研究表明[14],当血浆甘油三酯水平达到足够高时(超过2.3mmol/L)反而可以降低中风的严重程度,这也提示我们高甘油三酯在体内对某些疾病可能发挥保护作用,虽然其机制还未明确。此外,我们虽然在体外证实ApoCⅢ基因本身具有独立于TG之外的减少弹力蛋白酶降解的作用,发挥对AAA的抑制作用,但在体内,我们还不能区分ApoCⅢ基因本身和高血浆TG对AAA的抑制作用。
因此,本实验得出的ApoCⅢ转基因引起的高血浆甘油三酯对LDLR-/-小鼠AAA的减轻作用及其保护弹力蛋白在动脉瘤炎症环境下不被降解的具体机制还有待进一步深入研究。

Figure6.TheeffectsofTRLsontheproteinexpressionofelastinintheVSMCactivatedbyTNF-α.Mean±SD. n=3.*P<0.05 vsblank;#P<0.05,##P<0.01 vsTNF-α;&P<0.05 vsTRLsfromthemicewithhighcontentofApoCⅢ (C3+).
图6TRLs对TNF-α诱导的血管平滑肌细胞弹力蛋白表达的影响
[1]Bown MJ. Genomic insights into abdominal aortic aneurysms[J]. Ann R Collof Surg Engl, 2014, 96(6):405-414.
[2]Kuivaniemi H, Ryer EJ, Elmore JR, et al. Understanding the pathogenesis of abdominal aortic aneurysms[J]. Expert Rev Cardiovasc Ther, 2015, 13(9):975-987.
[3]Bown MJ, Jones GT, Harrison SC, et al. Abdominal aortic aneurysm is associated with a variant in low-density lipoprotein receptor-related protein 1[J]. Am J Hum Ge-net, 2011, 89(5):619-627.
[4]Bradley DT, Hughes AE, Badger SA, et al. A variant in LDLR is associated with abdominal aortic aneurysm[J]. Circ Cardiovasc Genet, 2013, 6(5):498-504.
[5]Prins PA, Hill MF, Airey D, et al. Angiotensin-induced abdominal aortic aneurysms in hypercholesterolemic mice: role of serum cholesterol and temporal effects of exposure[J]. PLoS One, 2014, 9(1):e84517.
[6]Hobbs SD, Claridge MWC, Quick CRG, et al. LDL cholesterol is associated with small abdominal aortic aneurysms[J]. Eur J Vasc Endovasc Surg, 2003, 26(6):618-622.
[7]Wyler von Ballmoos MC, Haring B, Sacks FM. The risk of cardiovascular events with increased apolipoprotein CIII: a systematic review and meta-analysis[J]. J Clin Lipidol, 2015, 9(4):498-510.
[8]Crosby J, Peloso GM, Auer PL, et al. Loss-of-function mutations in APOC3, triglycerides, and coronary disease[J]. N Engl J Med, 2014, 371(1):22-31.
[9]Watt HC, Law MR, Wald NJ, et al. Serum triglyceride: a possible risk factor for ruptured abdominal aortic aneurysm[J]. Int J Epidemiol, 1998, 27(6):949-952.
[10]Rizzo M, Pernice V, Frasheri A, et al. LDL size and subclasses in patients with abdominal aortic aneurysm[J]. Int J Cardiol, 2007, 134(3):406-408.
[11]Golledge J, van Bockxmeer F, Jamrozik K, et al. Association between serum lipoproteins and abdominal aortic aneurysm[J]. Am J Cardiol, 2010, 105(10):1480-1484.
[12]Lee EJ, Kim DI, Kim WJ, et al. Naringin inhibits matrix metalloproteinase-9 expression and AKT phosphorylation in tumor necrosis factor-alpha-induced vascular smooth muscle cells[J]. Mol Nutr Food Res, 2009, 53(12):1582-1591.
[13]Chen YY, Hsu MJ, Hsieh CY, et al. Andrographolide inhibits nuclear factor-κB activation through JNK-Akt-p65 signaling cascade in tumor necrosis factor-alpha-stimulated vascular smooth muscle cells[J]. Sci World J, 2014, 2014:130381.
[14]Dziedzic T, Slowik A, Gryz EA, et al. Lower serum triglyceride level is associated with increased stroke severity[J]. Stroke, 2004, 35(6):e151-e152.
(责任编辑: 陈妙玲, 罗森)
Effects of high plasma triglyceride caused by ApoCⅢ transgene on abdominal aortic aneurysm induced by elastase in LDLR-/-mice
CHEN Cong, YU Mao-mao, CAO Yi-ni, WANG Yun-xia, WANG Chao, LIU Guo-qing, QI Rong
(InstituteofCardiovascularSciences,KeyLaboratoryofMolecularCardiovascularSciences,MinistryofEducation,PekingUniversity,Beijing100191,China.E-mail:Ronaqi@bjmu.edu.cn)
AIM: To investigate the effects of high plasma triglyceride (TG) caused by apolipoprotein C Ⅲ (ApoCⅢ) transgene on the occurrence and development of abdominal aortic aneurysm (AAA). METHODS: The animal models of hypercholesterolemia and hypercholesterolemia combined with hypertriglyceridemia were established by feeding high-fat diet toLDLR-/-andApoCⅢ+LDLR-/-mice, respectively. AAA was induced in these mice by pancreatic elastase. By evaluating the incidence of AAA, relative maximal abdominal aortic diameter, disruption of the elastic lamellar structure and expression of matrix metalloproteinases (MMPs) in the aorta walls of the AAA, the occurrence and development of AAA were compared inLDLR-/-andApoCⅢ+LDLR-/-mice fed with either chow diet or high-fat diet. In addition, aninvitroTNF-α-induced aneurysmal microenvironment model on vascular smooth muscle cells (VSMC) was used to study the impact of triglyceride-rich lipoproteins (TRLs) from mice with normal or high contents ofApoCⅢ on elastin protein expression. RESULTS: Feeding the high-fat diet aggravated the severity of AAA in theLDLR-/-mice.ApoCⅢ+LDLR-/-mice fed with high-fat diet had less severe AAA thanLDLR-/-mice fed with high-fat diet. TRLs inhibited degradation of VSMC elastin protein induced by TNF-α, andinvitroTRLs from the mice with high content ofApoCⅢ, compared to those with normal content ofApoCⅢ, had better inhibitory effect on the degradation of elastin. CONCLUSION: High plasma TG caused byApoCⅢ transgene alleviates AAA of theLDLR-/-mice induced by elastase and high-fat diet. The effect is probably attributed to the hypertriglyceridemia caused byApoCⅢ transgene.
Abdominalaorticaneurysm;ApolipoproteinCⅢ;Triglyceride;Triglyceride-richlipoprotein;Vascularsmoothmusclecells
1000- 4718(2016)04- 0584- 07
2015- 11- 16
2015- 12- 30
国家自然科学基金资助项目(No.81360054)
Tel: 010-82805164; E-mail: ronaqi@bjmu.edu.cn
R543.5; R730.23
A
10.3969/j.issn.1000- 4718.2016.04.002
杂志网址: http://www.cjpp.net
