CCR5在炎症性肠病患者肠黏膜的表达及其与β-arrestin 2表达的关系*
2016-10-26叶小研刘思雪沈溪明黄花荣钟英强
叶小研, 刘思雪, 胡 梅, 沈溪明, 黄花荣, 钟英强△
(中山大学孙逸仙纪念医院 1消化内科, 3病理科, 4儿科,广东 广州510120; 2广东药学院附属第一医院消化内科,广东 广州510080)
CCR5在炎症性肠病患者肠黏膜的表达及其与β-arrestin 2表达的关系*
叶小研1, 2,刘思雪1,胡梅1,沈溪明3,黄花荣4△,钟英强1△
(中山大学孙逸仙纪念医院1消化内科,3病理科,4儿科,广东 广州510120;2广东药学院附属第一医院消化内科,广东 广州510080)
目的: 通过分析CCR5在炎症性肠病(IBD)患者活检肠黏膜的表达及其与β-arrestin 2表达的相关性,探讨CCR5与β-arrestin 2在IBD发病中的作用。方法: IBD活动期组53例、IBD缓解期组26例和正常对照组30例纳入研究,用EnVision二步免疫组化方法检测活检肠黏膜CCR5和β-arrestin 2的表达。结果: IBD活动期组CCR5阳性表达率及免疫组化评分均高于正常对照组和IBD缓解期组(P<0.05),CCR5表达与IBD活动期组的临床严重程度、病变范围及内镜下分级无明显关联性;β-arrestin 2在IBD活动期组的阳性表达率均明显低于IBD缓解期组和正常对照组(P<0.05),并且在IBD活动期β-arrestin 2表达与CCR5表达呈负相关性(P<0.05)。结论: 在IBD活动期组肠黏膜CCR5呈高表达,β-arrestin 2呈明显低表达,CCR5与β-arrestin 2表达呈负相关性。
炎症性肠病; CCR5; β-arrestin 2
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),主要病理生理改变是患者的肠黏膜有各种炎症细胞浸润,这些细胞可表达各种趋化因子受体(chemokine receptors,CR),其与趋化因子、黏附分子相互作用,可诱导白细胞向肠道组织内迁移、聚集、浸润,导致肠黏膜发生炎症性损害。迄今为止已发现至少19种CC趋化因子受体(CC chemokine receptors,CCR),而与IBD相关的主要有10种,其中CCR5是一个关键性的趋化因子受体[1]。研究表明CCR5拮抗剂可以缓解实验性IBD模型的组织病变,减少炎性细胞浸润,继而改善临床症状[2-4],提示CCR5在IBD的发病机制中占有重要作用,并具有作为IBD治疗靶点的可能。
CCR5属于G蛋白偶联受体(G-protein coupled receptors,GPCRs),胞外区N末端与第2胞外环是抗原结合部位,胞内区与G蛋白耦联,参与磷脂依赖性蛋白激酶、JAK-STAT、NF-κB、MAPK等信号传导通路[5-9],C末端含丝氨酸/苏氨酸,可发生磷酸化,与受体脱敏与内化相关。β-抑制蛋白2(β-arrestin 2)为细胞内一种可溶性蛋白质,是GPCRs信号通路的重要负调节因子,可与磷酸化活化的CCR5结合,使下游的G蛋白解偶联,并与网格蛋白包被小体联合作用,介导CCR5的脱敏与内化,参与肠道免疫反应过程。本研究通过分析CCR5在IBD活检肠黏膜的表达及其与β-arrestin 2表达的相关性,了解CCR5与β-arrestin 2在IBD发病中的作用,以探讨IBD的部分调节机制。
材 料 和 方 法
1研究对象
2010年10月~2013年10月(其中CD入选日期为:2012年10月~2013年10月),IBD活动期53例,来自中山大学孙逸仙纪念医院,均符合我国制定的UC或CD诊断标准[10],男25例,女28例,男女比为1∶1.12,年龄为14~74岁。IBD缓解期26例:男12例,女14例,男女比为1∶1.17,年龄为18~65岁。正常对照组:2013年9月至2013年11月,我院行电子结肠镜检查全结肠未发现有肠道病变、无消化道症状、无IBD家族史、无自身免疫性疾病的体检者30例,男14例,女16例,男女比为1∶1.14,年龄为17~62岁。活动期IBD、缓解期IBD和正常对照组3组之间的性别构成和年龄分布无统计学差异。患者均知情同意,并得到中山大学孙逸仙纪念医院伦理委员会的批准。
2主要试剂
兔抗人CCR5多克隆抗体购自Abcam;兔抗人β-arrestin 2单克隆抗体购自CST;二步法抗兔/鼠通用型免疫组化检测试剂盒(含羊抗兔IgG-HRP多聚体和DAB试剂盒)购自上海基因科技有限公司。
3方法
3.1肠镜检查前的准备无渣半流饮食3 d,肠镜检查前1 d晚上,复方聚乙二醇电解质散1包137.15 g溶于2 L水中,1 h内喝完,随后1~2 h饮水500~1 000 mL清洁肠道,术前0.5 h肌注安定注射液10 mg、山莨菪碱注射液10 mg。
3.2活检要求应用电子结肠镜进行全结肠检查,退镜时取活检。IBD活动期患者在炎症最明显处取活检黏膜3~5块,10%甲醛固定;IBD缓解期患者在结肠黏膜好转或恢复正常处取活检黏膜3~5块,10%甲醛固定;正常对照组于乙状结肠处取2块活检组织,10%甲醛固定。所有标本进行石蜡包埋、切片。
3.3EnVision二步法检测CCR5和β-arrestin 2的表达石蜡切片常规脱蜡、水化,抗原热修复。内源性过氧化物酶阻断剂孵育15min,BSA封闭20min,滴加适当比例稀释的 I 抗(CCR5 1∶200,β-arrestin 2 1∶50),4 ℃冰箱过夜,37 ℃复温45 min,滴加羊抗兔IgG-HRP多聚体,室温孵育30 min,DAB显色,苏木精复染10~30 s.中性树胶封片。以PBS代替 I 抗作为阴性对照.以已知阳性切片作为阳性对照。免疫组织化学染色的结果判断:CCR5或β-arrestin 2定位于细胞膜或细胞浆,以细胞膜或细胞浆内出现淡黄色至棕黄色颗粒为阳性染色。免疫组化染色结果判定参照Fromowitz等[11]的方法进行,每张切片随机观察10个高倍镜视野,每个视野计数100个细胞,各视野中阳性细胞数的平均百分数作为该切片的阳性细胞百分比进行计分:染色阳性细胞百分率<5%计为0分,5%~25%计为1分,26%~50%计为2分,51%~75%计为3分,>75%计为4分;染色程度以多数阳性细胞呈现的染色特征为标准计分:细胞未着色为0分,染色呈淡黄色为1分,棕黄色为2分,棕褐色为3分。最后以阳性细胞的百分比和染色强度计分之和所得的总分进行结果判定。0~1分为阴性(-),﹤4分为弱阳性(+),≥4分为强阳性(++)。
3.4分级标准(1)UC内镜下表现的分级标准[12]: 0级:黏膜正常或疤痕化;Ⅰ级:黏膜血管充血、水肿和颗粒状改变,血管网模糊;Ⅱ级:Ⅰ级基础上,黏膜糜烂;Ⅲ级:Ⅱ级基础上,溃疡形成;Ⅳ级:Ⅲ级基础上,黏膜明显增厚、肠腔狭窄;Ⅴ级:发生中重度不典型增生或癌变。(2)CD内镜下表现的分级标准[12]:0级:黏膜正常或疤痕化;Ⅰ级:炎症改变;Ⅱ级:溃疡形成;Ⅲ级:黏膜明显增厚、肠腔炎症性狭窄;Ⅳ级:瘘管形成或疤痕性狭窄;Ⅴ级:发生中重度不典型增生或癌变。(3)UC活动程度分级:入组时,检测血红蛋白(hemoglobin,Hb)、血沉(erythrocyte sedimentation rate,ESR)和血清白蛋白(albumin,Alb),每日记录黏液血便的次数,取3 d的平均数为记分的依据:血便无或轻度者为0分,明显血便者为1分,每天大便次数≤4次者为1分,5~7次者为2分,≥8次者为3分。根据Seo方法计算每个患者的临床活动指数(activity index,AI):AI=60X1+13X2+0.5X3-0.4X4-1.5X5+200,其中X1为血便的程度(X1可取0、1分,具体记分同上),X2为每天大便的次数(X2可取1、2、3分,具体记分同上),X3为ESR,X4为Hb,X5为Alb。临床严重程度采用Seo的AI进行分级:轻度,<150分;中度,150~220分;重度,>220分。(4)CD活动程度分级:CDAI<150分为缓解期,CDAI≥150分为活动期,150~220分为轻度,221~450分为中度,>450分为重度。
4统计学处理
应用SPSS 16.0统计软件,计量资料以均数±标准差(mean±SD)表示,多组间比较采用方差分析或Kruskal-Wallis检验;计数资料以率或构成比表示,组间比较采用2检验;关联性分析采用Pearson相关分析或Spearman等级相关分析,以P<0.05为差异有统计学意义。
结 果
1CCR5在各组肠黏膜的表达
CCR5阳性表达主要位于肠黏膜固有层炎性细胞、固有腺体上皮细胞和血管内皮细胞的胞浆或胞膜。IBD活动期组CCR5阳性率、强阳性率及免疫组化评分均高于正常对照组及缓解组(P<0.05),而缓解期IBD组和正常对照组CCR5阳性表达率和免疫组化评分差异无统计学显著性,见表1。

表1 CCR5在各组肠黏膜的表达
*P<0.05vscontrol.
UC活动期组和CD活动期组肠道组织中CCR5的阳性表达率分别为79.3%和70.8%,强阳性表达率分别为44.8%和25.0%,免疫组化评分分别为2.97±1.78和2.55±1.80,两组间的阳性表达率和强阳性表达率之间的差异存在统计学显著性(P<0.05),而免疫组化评分的差异无统计学显著性,见图1。
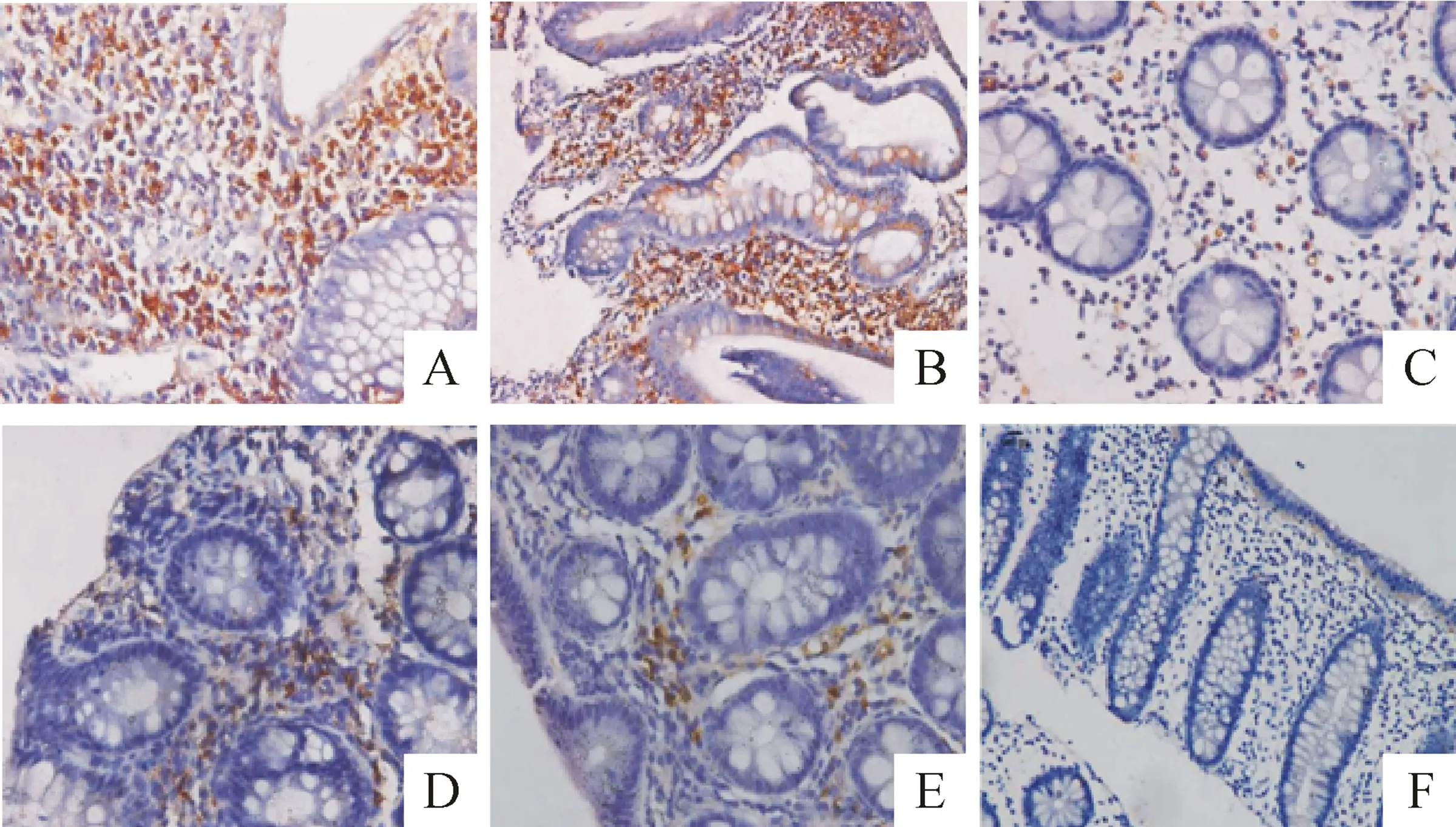
Figure 1.The expression of CCR5 of intestinal mucosa in the groups. A: strongly positive expression of CCR5 in active CD (×400); B: strongly positive expression of CCR5 in active UC (×200); C: weakly positive expression of CCR5 in remissive CD (×400); D: weakly positive expression of CCR5 in remissive UC (×400); E: weakly positive expression of CCR5 in the control (×400); F: negative expression of CCR5 in the control (×200).
图1CCR5在IBD和正常对照组肠黏膜的表达
2CCR5表达与IBD活动期严重程度及内镜下分级的关系
CCR5在IBD临床轻、中、重度的阳性表达率分别为83.3%、93.8%和38.7%,轻、中度IBD的阳性表达率高于重度IBD(P<0.05),但三者免疫组化评分之间的差异无统计学显著性。IBD活动期内镜下分级Ⅱ级、Ⅲ级和Ⅳ级的表达阳性率分别为70.0%、72.7%和81.0%,各级IBD的阳性表达率及免疫组化评分之间差异无统计学显著性。CCR5表达与IBD活动期临床严重程度和内镜下分级无明显相关性,见表2。
3CCR5表达与UC、CD活动期严重程度、病变范围及内镜下分级的关系
UC活动期的病变范围分为直肠、左半结肠和广泛结肠, CD活动期的病变范围分为回肠末段、结肠和回结肠,CCR5表达与活动期UC和CD不同临床严重程度、病变范围及内镜下分级无明显关联性。见表3~4。
4β-arrestin 2在各组活检肠黏膜的表达
β-arrestin 2阳性细胞主要位于肠黏膜固有层和固有腺体上皮层,阳性表达主要位于胞浆或胞膜,在53例活动期IBD患者中,阳性5例,强阳性0例,阴性48例,表达阳性率为9.4%;26例缓解期IBD中,
表2CCR5与IBD活动期严重程度及内镜下分级的关系
Table 2.The correlation of expression of CCR5 with the severity and endoscopic grading of intestinal mucosa in the active IBD
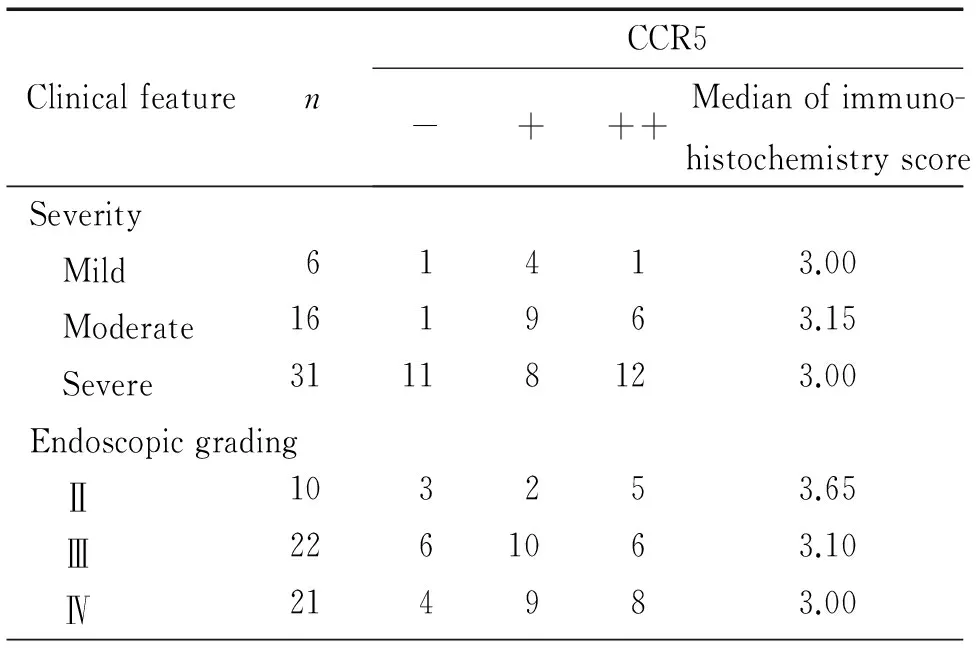
ClinicalfeaturenCCR5-+++Medianofimmuno-histochemistryscoreSeverity Mild61413.00 Moderate161963.15 Severe31118123.00Endoscopicgrading Ⅱ103253.65 Ⅲ2261063.10 Ⅳ214983.00
表3CCR5表达与UC活动期严重程度、病变范围及内镜下分级的关系
Table 3.The correlation of expression of CCR5 with the severity,lesion range and endoscopic grading of intestinal mucosa in active UC
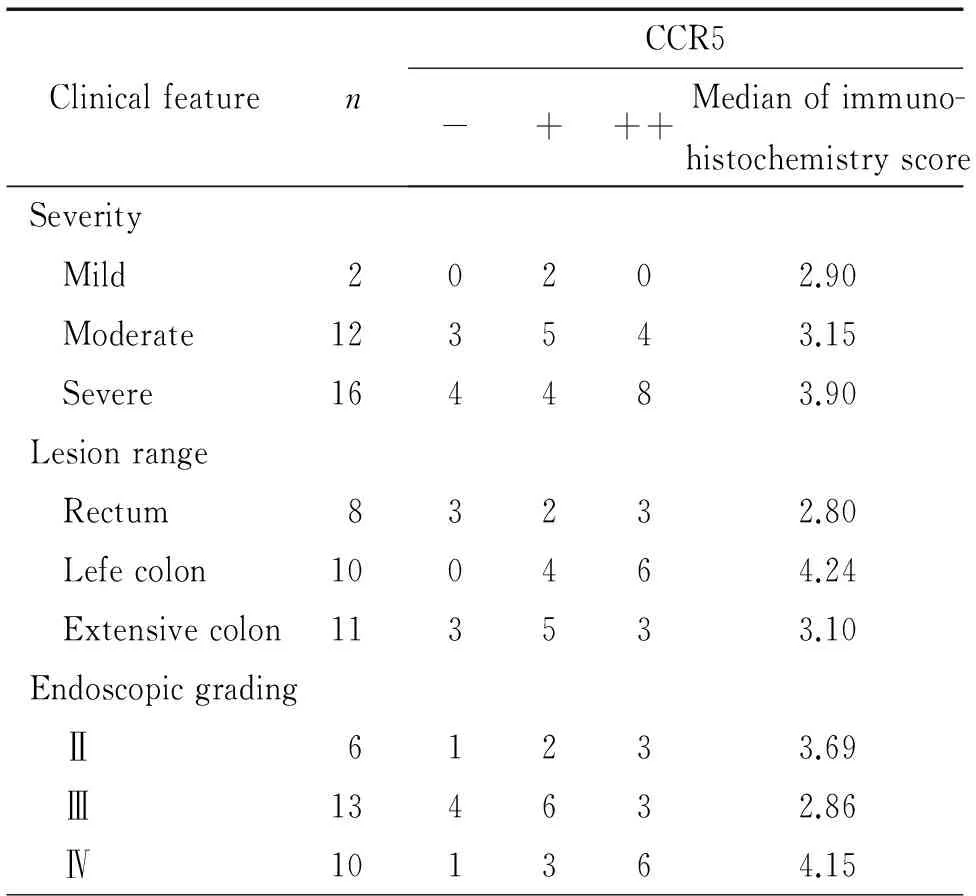
ClinicalfeaturenCCR5-+++Medianofimmuno-histochemistryscoreSeverity Mild20202.90 Moderate123543.15 Severe164483.90Lesionrange Rectum83232.80 Lefecolon100464.24 Extensivecolon113533.10Endoscopicgrading Ⅱ61233.69 Ⅲ134632.86 Ⅳ101364.15
5例阳性,强阳性0例,阴性21例,表达阳性率19.2%;30例正常人中,β-arrestin 2表达阳性12例,强阳性1例,阴性18例,表达阳性率为40.0%。3组阳性率之间的差异存在统计学显著性(P<0.05),见图2、表5。
5β-arrestin 2表达与CCR5表达的关系
β-arrestin 2在IBD活动期阳性表达率均明显低于IBD缓解期和正常对照组,在正常对照组相对呈较高表达,而CCR5在IBD活动期则呈明显的高表达,在IBD缓解期及正常对照组则呈现较低表达,β-arrestin 2与CCR5存在负相关性(P<0.05,r=-0.247),见表6。
表4CCR5表达与CD活动期严重程度、病变范围及内镜下分级的关系
Table 4. The correlation of expression of CCR5 with the severity,lesion range and endoscopic grading of intestinal mucosa in active CD
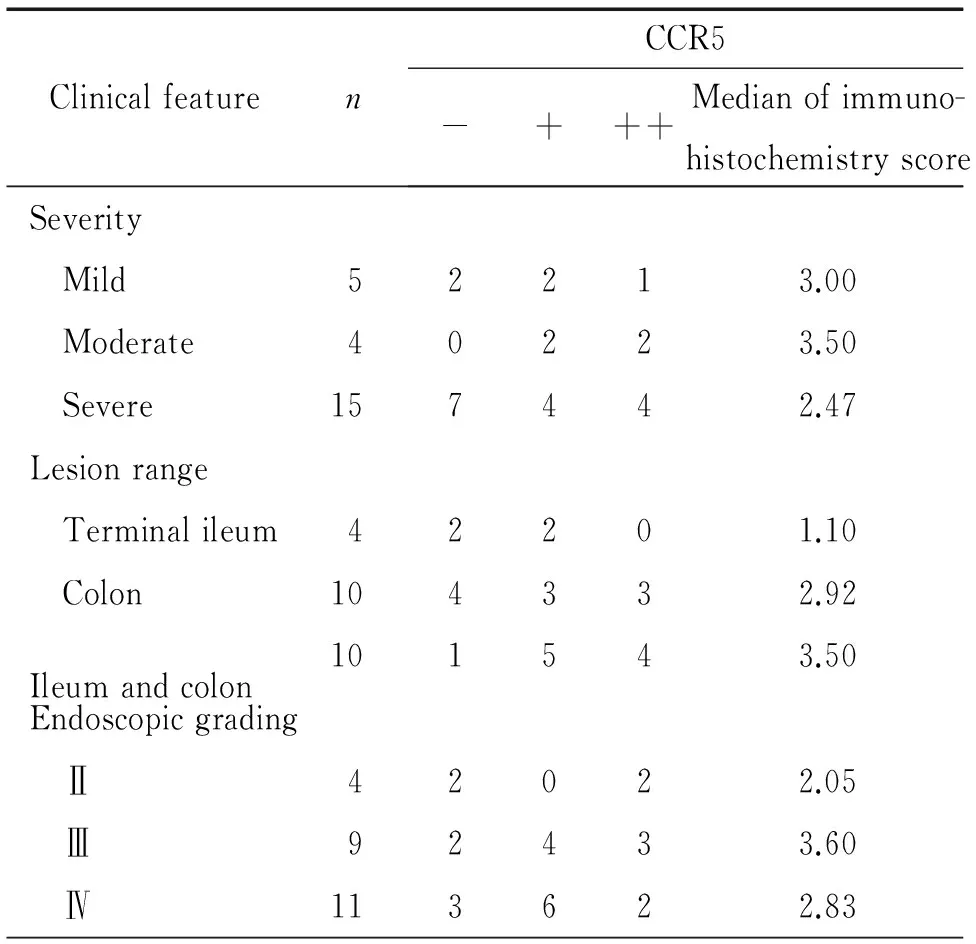
ClinicalfeaturenCCR5-+++Medianofimmuno-histochemistryscoreSeverity Mild52213.00 Moderate40223.50 Severe157442.47Lesionrange Terminalileum42201.10 Colon104332.92 Ileumandcolon101543.50Endoscopicgrading Ⅱ42022.05 Ⅲ92433.60 Ⅳ113622.83
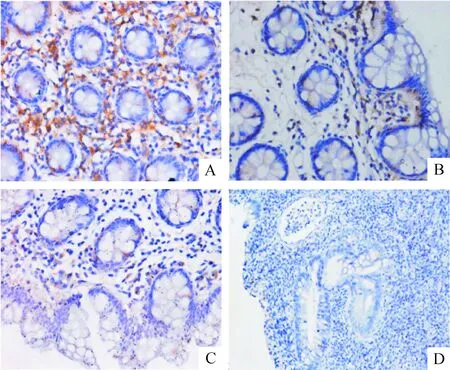
Figure 2.The expression of β-arrestin 2 in the intestinal mucosa in all groups. A: strongly positive expression of β-arrestin 2 in the control (×400); B: weakly positive expression of β-arrestin 2 in the control (×400); C: weakly positive expression of β-arrestin 2 in remissive CD (×400); D: negative expression of β-arrestin 2 in active UC (×200).
图2β-arrestin 2在各组活检肠黏膜的表达
讨 论
目前,IBD的病因与发病机制尚未完全不清楚,Thl/Th2亚群的平衡失调可能是IBD发病的重要免疫机制之一[13-14]。普遍认为主要是Th2型细胞因子

表5 β-arrestin 2在各组活检肠黏膜的表达
*P<0.05vscontrol.
表6β-arrestin 2与CCR5在活动期IBD活检肠黏膜表达的关系
Table 6.The correlation of expression of CCR5 with expression of β-arrestin 2 in intestinal mucosa of the active IBD
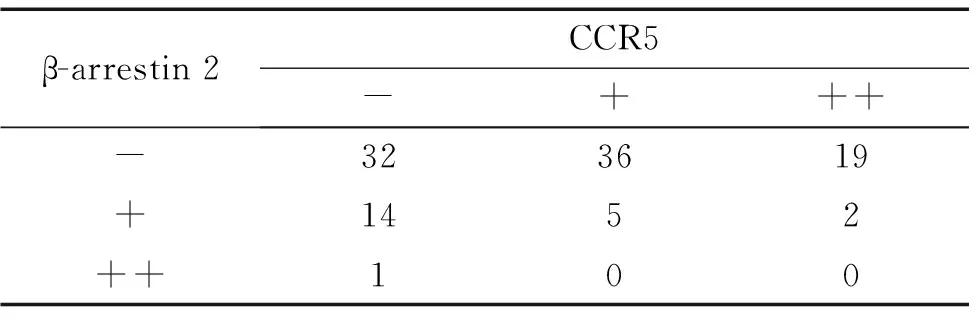
β-arrestin2CCR5-+++-323619+1452++100
参与UC的发病机制,Th2细胞表面表达CCR3、CCR4和CCR8[15];而CD患者主要表现为以Th1细胞为主的免疫应答,Th1细胞表达CCR2和CCR5[16]。Andres等[16]发现葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的CCR5缺失实验性结肠炎小鼠体内IFN-γ表达减少,而IL-4、IL-5和IL-10表达增加,提示CCR5可以促进肠道Th1型免疫反应。Oki等[17]研究发现CCR5特异性表达于Th1细胞表面,CD与UC患者肠黏膜CCR5的表达无明显差异,而CD患者肉芽肿细胞RANTES/CCL5表达阳性,肉芽肿周边CCR5+T细胞明显聚集,提示CCR5可能与非干酪性肉芽肿的形成相关。Ajuebor等[18]在三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)诱导大鼠结肠炎的实验中发现肠黏膜CCR1和CCR5表达明显上调,CCR1/CCR5拮抗剂Met-RANTES能够显著减少肠黏膜单核细胞、肥大细胞和中性粒细胞的浸润,从而减轻肠道损伤。Tokuyama 等[4]用一个非肽类受体拮抗剂TAK-779治疗DSS诱导的实验性结肠炎,检测到结肠黏膜CCR5 mRNA明显下降,单核细胞、巨噬细胞浸润也减少。上述结果均提示CCR5对淋巴细胞、单核细胞、巨噬细胞、肥大细胞和中性粒细胞可能有趋化作用,CCR5可能参与IBD的发病机制。
本研究结果提示CCR5在正常人、缓解期IBD患者的肠黏膜呈一种低表达,但在活动期IBD患者的表达量则明显增加,提示CCR5可能参与IBD的发病与发展过程。CCR5在活动期IBD中的阳性表达率及免疫组化评分均高于缓解期IBD患者,由此推测,CCR5与疾病活动程度相一致,可能是因为药物治疗使炎症细胞浸润减少,从而下调CCR5表达有关。而CCR5表达在轻、中度IBD明显高于重度IBD,可能与重度患者的活检黏膜的炎症细胞破坏较多有关;CCR5在活动期UC的表达明显高于活动期CD,提示在UC黏膜表层的炎症细胞浸润较多,也提示了在本组患者中Th1与Th2细胞均可能参与UC的病理生理过程。
β-arrestin 2是一种介导受体脱敏与内化的胞内蛋白质,在GPCR信号传导通路中起着负调节作用。激活的GPCR与GRK结合发生磷酸化后,β-arrestin 2可与GPCR结合,使GRK解偶联,阻断GPCR与G蛋白的结合,同时β-arrestin 2可聚集磷酸二酯酶从而降解G蛋白信号传导通路中产生的cAMP。另外,GPCR-β-arrestin 2复合物也可与网格蛋白联合作用,使受体内化。通过上述机制,β-arrestin 2介导GPCR的脱敏和内化[19]。CCR5属于GPCR家族,C末端磷酸化后CCR5第二胞内环的DRY模序与β-arrestin 2结合,形成CCR5-β-arrestin 2复合物,复合物与网格蛋白(clathrin)的衔接蛋白2(adapter protein 2,AP-2)结合,使CCR5內吞进入网格蛋白包被小体(clathrin-coated pits),在动力蛋白作用下,网格蛋白包被小体从细胞膜上解离形成囊泡,然后逐步转运至早期内体到晚期内体,最后至溶酶体。CCR5内化后有两种结局:一方面,CCR5脱磷酸化重新循环至细胞膜,穿过晚期内体和高尔基体到达细胞表面;另一方面,CCR5被降解导致受体下调。除了参与GPCR的脱敏与内化作用,β-arrestin 2还可以介导GPCR与激酶介导的信号转导途径,例如GPCR激活的JNK3、ERK和p38信号转导途径[20-22],还可以抑制促炎转录因子NF-κB的活性等。通过调节CCR5的脱敏、内化过程及其信号转导通路,影响免疫细胞的趋化功能和免疫反应。
本研究结果显示β-arrestin 2在活动期IBD呈明显低表达,在缓解期IBD及正常人则表达相对较高,提示β-arrestin 2可能参与IBD患者的肠道免疫反应失调和炎症反应过程。
目前,关于β-arrestin 2内化CCR5的作用位点的研究[23-24]较多,但对内化结果的研究较少。本研究主要着重β-arrestin 2对CCR5内化的结果,对作用机制并未进一步探讨。通过β-arrestin 2与CCR5的关联性分析发现示两者呈负相关性,提示β-arrestin 2作为一个上游调控蛋白,在IBD的发病机制中可能也占有一定的作用。本课题组已应用噬菌体展示肽库技术淘选大鼠CCR5膜外第一、二胞外环特异性结合的活性拮抗肽,并经初步鉴定证明其具有与CCR5结合的能力[25],可为进一步研究β-arrestin 2与CCR5的关联性奠定了基础。
[1]叶小研,钟英强.CCR与炎症性肠病[J].胃肠病学, 2014, 19(1):50-53.
[2]Ajuebor MN, Hogaboam CM, Kunkel SL, et al. The chemokine RANTES is a crucial mediator of the progression from acute to chronic colitis in the rat[J]. J Immunol, 2001, 166 (1):552-558.
[3]Kucuk C, Sozuer E, Gursoy S, et al. Treatment with Met-RANTES decreases bacterial translocation in experimental colitis[J]. Am J Surg, 2006, 191(1): 77-83.
[4]Tokuyama H, Ueha S, Kurachi M, et al. The simultaneous blockade of chemokine receptors CCR2, CCR5 and CXCR3 by a non-peptide chemokine receptor antagonist protects mice from dextran sodium sulfate-mediated colitis[J]. Int Immunol, 2005, 17 (8):1023-1034.
[5]Mellado M, Rodríguez-Frade JM, Vila-Coro AJ, et al.Chemokine receptor homo- or heterodimerization activates distinct signaling pathways[J]. EMBO J, 2001, 20 (10):2497-2507.
[6]Sasaki S, Baba T, Shinagawa K, et al.Crucial involvement of the CCL3-CCR5 axis-mediated fibroblast accumulation in colitis-associated carcinogenesis in mice[J]. Int J Cancer,2014, 135(1):1-10.
[7]Ganju RK, Dutt P, Lijun Wu,et al.β-Chemokine receptor CCR5 signals via the novel tyrosine kinase RAFTK[J].Blood, 1998, 91(3):791-797.
[8]Chuang JY,Yang WH,Chen HT,et al.CCL5/CCR5 axis promotes the motility of human oralcancer cells[J]. J Cell Physiol,2009, 220(2):418-426.
[9]Wong M, Uddin S, Majchrzak B, et al.RANTES activates Jak2 and Jak3 to regulate engagement of multiple signaling pathways in T cells[J].J Biol Chem, 2001, 276(14):11427-11431.
[10]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见[J].中华消化杂志,2012, 32(12):796-813.
[11]Fromowitz FB, Viola MV, Chao S, et al. Ras p21 expression in the progression of breast cancer[J].Hum Pathol, 1987, 18(12):1268-1275.
[12]钟英强, 叶小研. 炎症性肠病的现代内科治疗[J].中华临床医师杂志:电子版,2013,7(16):7354- 7357.
[13]Van Damme N, De Keyser F, Demetter P, et al.The proportion of Th1 cells, which prevail in gut mucosa, is decreased in inflammatory bowel syndrome[J].Clin Exp Immunol, 2001, 125(3):383-390.
[14]Macdonald T, Monteleone G,Pender S.Recent developments in the immunology of inflammatory bowel disease[J].Scand J Immunol, 2000, 51(1):2-9.
[15]Sallusto F, Lanzavecchia A, Mackay CR. Chemokines and chemokine receptors in T-cell priming and Th1/Th2-mediated responses[J]. Immunol Today, 1998, 19 (12): 568-574.
[16]Andres PG, Beck PL, Mizoguchi E, et al. Mice with a selective deletion of the CC chemokine receptors 5 or 2 are protected from dextran sodium sulfate-mediated colitis: lack of CC chemokine receptor 5 expression results in a NK1.1+lymphocyte-associated Th2-type immune response in the intestine[J]. J Immunol, 2000, 164(12):6303-6312.
[17]Oki M, Ohtani H, Kinouchi Y, et al. Accumulation of CCR5+T cells around RANTES+granulomas in Crohn’s disease: a pivotal site of Th1-shifted immune response?[J]. Lab Invest, 2005, 85(1):137-145.
[18]Ajuebor MN, Hogaboam CM, Kunkel SL, et al. The chemokine RANTES is a crucial mediator of the progression from acute to chronic colitis in the rat[J]. J Immunol, 2001,166(1):552-558.
[19]Whalen EJ,Rajagopal S, Robert J, et al. Potential of β-arrestin- and G protein-biased agonists[J].Trends Mol Med, 2011, 17(3):126-139.
[20]DeWire SM, Ahn S, Lefkowitz RJ, et al. Beta-arrestins and cell signaling[J]. Annu Rev Physiol, 2007, 69:483-510.
[21]Brown MD, Sacks DB. Protein scaffolds in MAP kinase signalling[J]. Cell Signal, 2009, 21(4):462- 469.
[22]Kendall RT, Luttrell LM. Diversity in arrestin function[J].Cell Mol Life Sci, 2009, 66 (18):2953-2973.
[23]Hüttenrauch F, Pollok-Kopp B, Oppermann M. G protein-coupled receptor kinases promote-phosphorylation and beta-arrestin-mediated internalization of CCR5 homo- and hetero-oligomers [J]. J Biol Chem,2005, 280(45):37503-37515.
[24]Lagane B, Ballet S, Planchenault T, et al. Mutation of the DRY motif reveals different structural requirements for the CC chemokine receptor 5-mediated signaling and receptor endocytosis[J].Mol Pharmacol, 2005, 167(6):1966-1976.
[25]刘思雪,胡梅,叶小研,等.应用噬菌体展示肽库技术淘选大鼠CCR5膜外第一、二胞外环特异性结合的活性拮抗肽与初步鉴定[J]. 中国病理生理杂志, 2015, 31(7):1225-1230.
(责任编辑: 林白霜, 罗森)
Correlation of CCR5 expression with β-arrestin 2 expression in colonic mucosa of patients with inflammatory bowel disease
YE Xiao-yan1, 2, LIU Si-xue1, HU Mei1, SHEN Xi-ming3, HUANG Hua-rong4, ZHONG Ying-qiang1
(1DepartmentofGastroenterology, 3DepartmentofPathology,4DepartmentofPediatrics,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China;2DepartmentofGastroenterology,TheFirstAffiliatedHospitalofGuangdongPharmaceuticalUniversity,Guangzhou510080,China.E-mail:zhongyingqiang@21cn.com;hhrvivi@21cn.com)
AIM: To analyze the expression of CCR5 and correlation with the expression of β-arrestin 2 in the intestinal mucosa of the patients with inflammatory bowel disease (IBD), so as to study the role of CCR5 and β-arrestin 2 in the pathogenesis of IBD. METHODS: Paraffin sections of the colonic mucosa were prepared from 53 patients with active IBD, 26 patients with remissive IBD and 30 healthy people. Immunohistochemical EnVision two-step method was used to test the expression of CCR5 and β-arrestin 2 in the biopsic intestinal mucosa.RESULTS: The positive rate, strongly positive rate and immunohistochemical score of CCR5 expression in active IBD were significantly higher than those in normal controls or remissive IBD (P<0.05). No correlation of CCR5 expression with clinical severity, lesion distribution, and endoscopic grade in active IBD was observed. The expression of β-arrestin 2 was significantly lower in active IBD than that in the remissive IBD and normal controls, and there was a negative correlation of β-arrestin 2 expression with CCR5 expression (P<0.05). CONCLUSION: The expression of CCR5 is higher, and expression of β-arrestin 2 is lower, and there is a negative correlation of expression of CCR5 with expression of β-arrestin 2 in intestinal mucosa of the active IBD.
Inflammatory bowel disease; CCR5; β-arrestin 2
1000- 4718(2016)04- 0713- 06
2015- 11- 18
2016- 02- 15
国家自然科学基金资助项目(No. 81370499); 广东省自然科学基金资助项目(No. 2014A030313020)
钟英强 Tel: 020-81332598; E-mail: zhongyingqiang@21cn.com; 黄花荣Tel: 020-81332446; E-mail: hhrvivi@21cn.com
R363
A
10.3969/j.issn.1000- 4718.2016.04.022
杂志网址: http://www.cjpp.net
