阿霉素诱导下多发性骨髓瘤细胞中自噬和氧化应激的相互作用*
2016-10-26陈建斌
罗 綦, 陈建斌
(重庆医科大学附属第一医院血液科,重庆 400016)
阿霉素诱导下多发性骨髓瘤细胞中自噬和氧化应激的相互作用*
罗綦,陈建斌△
(重庆医科大学附属第一医院血液科,重庆 400016)
目的: 探讨阿霉素(doxorubicin,DOX)诱导对多发性骨髓瘤细胞系RPMI-8226细胞内自噬和活性氧簇(reactive oxidative species,ROS)生成的影响及其相互作用关系。方法: 不同浓度阿霉素诱导RPMI-8226细胞24 h, 采用Western blot技术检测细胞内beclin 1、LC3等自噬相关蛋白的表达水平。采用DCFH-DA 荧光染色法检测RPMI-8226细胞内ROS的水平,荧光显微镜采集图像。采用氧自由基清除剂N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)及tempol处理RPMI-8226细胞后,通过Western blot技术检测阿霉素诱导下细胞内beclin 1、LC3等蛋白的表达水平。采用自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)处理PRMI-8226细胞后,检测阿霉素诱导下细胞内ROS和凋亡的表达水平。结果: RPMI-8226细胞内beclin 1和LC3Ⅱ/LC3Ⅰ表达水平呈阿霉素剂量依赖性增加,当阿霉素诱导浓度达2 mg/L时,与对照组比较显著增加(P<0.05)。采用2 mg/L阿霉素处理RPMI-8226细胞,通过荧光显微镜观察,ROS水平较对照组明显增加。氧自由基清除剂NAC和tempol处理RPMI-8226细胞后,beclin 1和LC3Ⅱ/Ⅰ的表达水平较阿霉素处理组下降。采用自噬抑制剂3-MA处理细胞后,RPMI-8226细胞内ROS和凋亡的水平较阿霉素处理组及对照组增加。结论: 阿霉素能增加RPMI-8226细胞内自噬和ROS的生成,抑制自噬能增加阿霉素诱导下ROS和凋亡的水平,抑制ROS后能减少阿霉素诱导下多发性骨髓瘤细胞中的自噬。
多发性骨髓瘤; 阿霉素; 自噬; 活性氧簇
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性肿瘤,临床表现为骨痛、贫血、肾功能不全和免疫力低下等[1-3]。近年来,虽新型药物的应用和造血干细胞移植使MM患者生存期较前延长,但联合化疗仍是治疗MM的主要手段[4-5]。阿霉素(doxorubicin,DOX)为蒽环素类抗生素,是目前用于治疗MM联合化疗的常用药物。自噬(autophagy)是一种溶酶体依赖的降解路径。在正常生理状态下,有利于细胞保持自身稳态。在肿瘤形成后,自噬为肿瘤细胞提供更丰富的营养,促进肿瘤生长[6]。3-甲基腺嘌呤(3-methyladenine,3-MA)作为磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂,对自噬能明显起到抑制作用。细胞内的活性氧簇(reactive oxygen species,ROS)作为新陈代谢产物在各类细胞中不断产生和清除,而且在不同的细胞中ROS生成的水平是不相同的,更为重要的是相对于肿瘤细胞,相应的正常细胞中本底的ROS水平更低[7-8]。线粒体在正常氧化呼吸时会产生少量的ROS,但研究显示,中、高度的ROS产生导致ROS胞内蓄积引起氧化应激反应。研究显示ROS产生通过增加线粒体膜通透性直接启动凋亡[9-10]。N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)是一类含巯基的化合物,具有抑制自由基的生成、清除已产生的自由基、调节细胞活性、防止DNA损伤等功能。Tempol是一种超氧化物清除剂,具有神经保护、抗炎症和镇痛效果[11]。本研究显示阿霉素诱导下多发性骨髓瘤细胞自噬相关蛋白表达增加,ROS水平增高。但自噬和ROS在阿霉素诱导的多发性骨髓瘤细胞中的相互作用尚不清楚。本文通过采用自噬抑制剂3-MA和氧自由基清除剂NAC、tempol阐明阿霉素诱导下多发性骨髓瘤细胞中自噬和ROS的相互作用。
材 料 和 方 法
1主要试剂和仪器
RPMI-8226细胞系由上海第二军医大学长征医院血液科侯健教授惠赠。RPMI-1640和胎牛血清(Gibco);二甲基亚砜、阿霉素、3-MA、NAC、tempol、抗β-actin抗体及HRP标记的羊抗兔IgG II抗(Sigma);抗beclin 1抗体和抗LC3抗体(CST)。
2方法
2.1细胞培养RPMI-8226细胞于含10%胎牛血清的RPMI-1640培养基中,在37 ℃ 、5 % CO2及饱和湿度条件下传代培养,每2~3 d换液1次。选取对数生长期细胞进行实验。以未加任何处理的细胞作为正常对照组。
2.2Western blot检测beclin 1和LC3蛋白表达按上述分组处理细胞后,收集各组细胞,PBS清洗细胞2次后,1 000×g离心 3 min,去上清,加入RIPA裂解液,裂解20 min,4 ℃、12 000×g离心20 min,收集上清,BCA法测定蛋白浓度。取50 μg总蛋白经SDS-PAGE分离,将蛋白电转至PVDF膜上。封闭液(5%脱脂牛奶)室温封闭2 h,加入 I 抗(beclin 1 1∶1 000,LC3 1∶1 000,β-actin 1∶5 000),4 ℃ 摇床孵育过夜。次日TBST洗膜3次,室温孵育II抗(1∶5 000) 1 h,ECL化学发光试剂盒(Pierce)显色,曝光,保存图片。
2.3DCFH-DA荧光探针检测细胞内总ROS的变化处理细胞后,加入DCFH-DA荧光染料,37 ℃培养30 min 后,收集细胞,PBS清洗3次,加入新鲜培养基,荧光显微镜下观察并采集图像。
2.4流式细胞术Annexin V/PI双标法检测细胞凋亡细胞处理结束后,PBS 清洗 2 次,将细胞重悬于 300 μL 70%乙醇中,送重庆医科大学生命科学院按Annexin V/PI试剂盒说明检测细胞凋亡。
3统计学处理
所有实验均重复3次,计量资料采用均数±标准差(mean±SD)表示。采用SPSS 16.0统计软件进行分析。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
结 果
1阿霉素处理下 RPMI-8226细胞LC3和Beclin 1的表达水平
与对照组相比,阿霉素处理组中2 mg/L及以上组beclin 1的表达明显增加(P<0.05)。阿霉素处理组LC3Ⅱ/LC3Ⅰ表达水平较对照组表达增加,阿霉素处理浓度达2 mg/L时,差异有统计学显著性(P<0.05),见图1。
2阿霉素处理下RPMI-8226细胞ROS的表达水平
与对照组相比,阿霉素处理组RPMI-8226细胞的ROS生成水平较对照组明显增加,见图2。
3抗氧化剂NAC和tempol处理下beclin 1及LC3的表达
单纯阿霉素(2 mg/L)处理组较对照组beclin 1和LC3 II/I表达水平增加,差异有统计学显著性(P<0.05)。加入抗氧化剂NAC (5 mmol/L)或tempol(2 mmol/L)预处理 RPMI-8226细胞2 h后,beclin 1及LC3 II/I表达较阿霉素组明显降低(P<0.05),见图3。

Figure 1.The protein levels of beclin 1 and LC3 in RPMI-8226 cells after stimulated with doxorubicin (DOX) detected by Western blot. Mean±SD.n=3.*P<0.05vs0 mg/L;#P<0.05vs2 mg/L.
图1阿霉素诱导RPMI-8226细胞后beclin 1和LC3蛋白表达的变化

Figure 2.ROS levels in RPMI-8226 cells after stimulated with doxorubicin (DOX) (DCFH-DA staining,×100). Ctr: control.
图2阿霉素诱导RPMI-8226细胞后ROS生成的变化
43-MA处理下 RPMI-8226细胞ROS生成的变化
阿霉素处理组的ROS生成较对照组明显增加,阿霉素+NAC组的ROS生成较阿霉素处理组明显减少。阿霉素+3-MA(5 mmol/L)处理组的ROS生成与阿霉素处理组比较明显增加,见图4。
53-MA处理下RPMI-8226 细胞凋亡的变化
阿霉素处理组的凋亡水平较对照组明显增加,阿霉素+3-MA(5 mmol/L)处理组的凋亡水平较阿霉素处理组明显增加,差异均有统计学显著性(P<0.05),见图5。
讨 论
研究显示,多发性骨髓瘤是最常见的浆细胞克隆性血液系统肿瘤,在血液系统肿瘤中发病率为10%~15%,近年来发现其发病年龄呈现年轻化趋势[1, 12]。随着经济的发展,现已出现许多治疗多发性骨髓瘤疾病的新药,但在化疗药物联合用药中,阿霉素仍起着非常重要的作用[7]。本实验以阿霉素诱导多发性骨髓瘤RPMI-8226细胞作为体外模型,研究阿霉素诱导下ROS与自噬在RPMI-8226细胞中的相互作用。
细胞受到应激性的死亡威胁时,自噬通过将细胞内受损、变性或衰老的蛋白质以及细胞器运输到溶酶体进行消化降解从而保持细胞的存活,是真核细胞维持稳态、实现更新的一种重要的进化保守机制[6, 13]。研究表明在恶性血液病化疗中,肿瘤细胞激活自噬是肿瘤细胞逃避化疗药物杀伤的可能机制[14, 20-22]。Eretmer 等[23]报道在慢性粒细胞白血病中,可能通过抑制PI3K-AKT-mTORC1通路激活自噬,导致伊马替尼对白血病细胞的杀伤作用减弱。本研究显示阿霉素诱导下RPMI-8226细胞中自噬相关蛋白表达增加,采用3-MA抑制自噬后阿霉素诱导下RPMI-8226细胞凋亡较单用阿霉素增加,说明自噬能减少阿霉素对RPMI-8226细胞的杀伤作用。
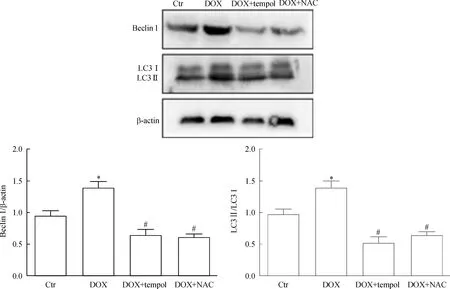
Figure 3.The protein levels of beclin 1 and LC3 after stimulated with doxorubicin (DOX) and pretreated with tempol orN-acetyl-L-cysteine (NAC) determined by Western blot. Ctr: control. Mean±SD.n=3.*P<0.05vsCtr;#P<0.05vsDOX.
图3RPMI-8226在抗氧化剂Tempol及NAC处理下beclin1及LC3的表达
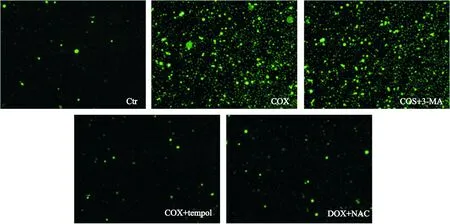
Figure 4.ROS levels in RPMI-8226 cells (DCFH-DA staiing,×100). Ctr: control; DOX: doxorubicin; 3-MA: 3-methyladenine; NAC:N-acetyl-L-cysteine.
图4RPMI-8226细胞ROS的水平
ROS是生物体有氧代谢产生的一类活性含氧化合物的总称,细胞内ROS介导很多细胞生理和病理反应,ROS可作为一种细胞内信号分子参与细胞自噬的激活[24]。近年临床及基础研究都显示高水平的ROS可导致细胞的凋亡[17-20]。在骨髓间充质干细胞中,过氧化氢(H2O2)可使骨髓间充质干细胞凋亡增加[25]。本研究发现阿霉素能诱导多发性骨髓瘤细胞内ROS产生增加。阿霉素可能通过增加多发性骨瘤RPMI-8226细胞内ROS的生成,从而促进RPMI-8226细胞的凋亡。自噬能有效缓解细胞内ROS产生从而发挥其促生存的作用[15-16]。为阐明阿霉素诱导下RPMI-8226细胞内ROS和自噬的相互影响,我们采用NAC及Tempol抑制细胞内ROS,发现阿霉素+NAC组及阿霉素+Tempol组细胞内自噬相关蛋白beclin1和LC3 II/I较阿霉素组表达下降。采用自噬特异性抑制剂3-MA预处理RPMI-8226细胞,阿霉素诱导下RPMI-8226细胞内ROS和凋亡增加。这说明减轻多发性骨髓瘤RPMI-8226细胞内的ROS水平,细胞内自噬水平相应地减少。

Figure 5.The changes of apoptotic rate after blockadge of autophagy. Ctr: control; DOX: doxorubicin; 3-MA: 3-methyladenine. Mean±SD.n=3.*P<0.05vsCtr;#P<0.05vsDOX.
图5抑制自噬后细胞凋亡水平的变化
综上所述,本研究发现阿霉素可同时诱导多发性骨髓瘤细胞中ROS和自噬的发生。抑制阿霉素诱导下多发性骨髓瘤细胞内ROS时,细胞内自噬相关蛋白表达下降。运用自噬抑制剂3-MA处理阿霉素诱导下的多发性骨髓瘤细胞,其ROS的生成增加,同时细胞凋亡增加,说明ROS可诱导细胞内自噬产生,自噬通过降解细胞内ROS减少细胞凋亡。为深入研究阿霉素治疗多发性骨髓瘤的耐药机制提供了新的方向。
[1]Podar K, Tai YT, Hideshima T, et al. Emerging the-rapies for multiple myeloma[J]. Expert Opin Emerg Drugs, 2009, 14(1):99-127.
[2]Podar K, Richardson PG, Hideshima T, et al. The malignant clone and the bone-marrow environment[J]. Best Pract Res Clin Haematol, 2007, 20(4):597-612.
[3]Kristinsson SY, Minter AR, Karde N, et al. Bone diesase in multiple myeloma and precursor disease: novel diagnostic approaches and implications on clinical management[J]. Expert Rev Mol Diagn, 2011, 11(6):593-603.
[4]马军,朱军,石远凯,等. 脂质体阿霉素治疗恶性淋巴瘤及多发性骨髓瘤的中国专家共识[J]. 中国肿瘤临床, 2014, 41(24):1550-1555.
[5]Alexanian R, Haut A, Khan AU, et al. Treatment for multiple myeloma: combination chemotherapy with diffe-rent melphalan dose regimens[J]. JAMA, 1969, 208(9):1680-1685.
[6]Eisenberg-Lerner A, Kimchi A. The paradox of autophagy and its implication in cancer etiology and therapy[J]. Apoptosis, 2009, 14(4):376-391.
[7]Paiva CN, Bozza MT. Are reactive oxygen species always detrimental to pathogens?[J]. Antioxid Redox Signal, 2014, 20(6):1000-1037.
[8]Schieber M, Chandel NS. ROS function in redox signaling and oxidative stress[J]. Curr Biol, 2014, 24(10):R453-R462.
[9]Tian S, Lin J, Zhou J, et al. Beclin 1-independent autophagy induced by a Bcl-XL/BCL-2 targeting compound, Z18[J]. Autophagy, 2010, 6(8):1032-1041.
[10]Klionsky DJ, Cuervo AM, Seglen PO. Methods for monitoring autophagy from yeast to human[J]. Autophagy, 2007, 3(3):181-206.
[11]Wilcox CS. Effects of tempol and redox-cycling nitroxides in models of oxidative stress[J].Pharmacol Ther,2010,126(2):119-145.
[12]Anderson KC, Alsina M, Bensinger W, et al. Multiple myeloma, version 1.2013[J]. J Natl Compr Canc Netw, 2013, 11(1):11-17.
[13]Rabinowitz JD, White E.Autophagy and metabolism[J]. Science, 2010, 330(6009):1344-1348.
[14]Nencioni A, Cea M, Montecucco F, et al. Autophagy in blood cancers:biological role and therapeutic implications[J]. Haematologica, 2013, 98(9):1335-1343.
[15]Kongara S, Karantza V. The interplay between autophagy and ROS in tumorigenesis[J]. Front Oncol, 2012, 2:171.
[16]Zeng R, Chen Y, Zhao S, et al. Autophagy counteracts apoptosis in human multiple myeloma cells exposed to oridoninvitrovia regulating intracellular ROS and SIRT1[J]. Acta Pharmacol Sin, 2012, 33(1):91-100.
[17]Cruz CM, Rinna A, Forman HJ, et al.ATP activates a reactive oxygen species-dependent oxidative stress response and secretion of proinflammatory cytokines in macrophages[J]. J Biol Chem, 2007, 282(5):2871-2879.
[18]Kaminskyy VO, Piskunova T, Zborovskaya IB, et al. Suppression of basal,autophagy reduces lung cancer cell proliferation and :enhances caspase-dependent and independent apoptosis by stimulating ROS formation[J].Autophagy, 2012, 8(7):1032-1044.
[19]Hou J, Cui A, Song P, et al. Reactive oxygen species-mediated activation of the Src-epidermal growth factor receptor-Akt signaling cascade prevents bortezomib induced apoptosis in hepatocellular carcinoma cells[J]. Mol Med Rep, 2015, 11(1):712-718.
[20]Jia L, Dourmashkin RR, Allen PD, et al. Inhibition of autophagy abrogates tumour necrosis factor alpha induced apoptosis in human T lymphoblastic leukaemic cells[J]. Br J Haematol, 1997, 98(3):673-685.
[21]Moore MN. Autophagy as a second level protective process in conferring resistance to environmentally induced oxidative stress[J]. Autophagy, 2008, 4(2):254-256.
[22]Dadakhujaev S, Noh HS, Jung EJ, et al. Autophagy protects the rotenone induced cell death in alpha-synuclein overexpressing SH-SY5Y cells[J]. Neurosci Lett, 2010, 472(1):47-52.
[23]Ertmer A, Huber V, Gilch S, et al. The anticancer drug imatinib induces cellular autophagy[J]. Leukemia,2007, 21(5):936-942.
[24]尤寿江,石际俊,刘春风,等. ROS介导的自噬及其在相关疾病中的作用[J]. 中国病理生理杂志, 2011, 27(1):187-190,195.
[25]刘关羽,何卫阳,苟欣,等. 氧化应激诱导自噬对骨髓间充质干细胞增殖与凋亡的影响[J]. 中国病理生理杂志, 2015, 31(12):2176-2182.
(责任编辑: 卢萍, 罗森)
Crosstalk of autophagy and ROS in multiple myeloma cells stimulated with doxorubicin
LUO Qi, CHEN Jian-bin
(DepartmentofHematology,TheFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China.E-mail:cqchenjianbin2007@126.com.cn)
AIM: To investigate the relationship of autophagy and reactive oxygen species (ROS) in multiple myeloma cell line RPMI-8226 stimulated with doxorubicin. METHODS: The RPMI-8226 cells were stimulated with doxorubicin at different doses, and untreated cells were used as control. The protein expression of beclin 1 and LC3 was detected by Western blot. ROS production was analyzed by DCFH-DA fluorescence staining. After treated with or without 3-methyladenine (3-MA), the ROS production and apoptosis in RPMI-8226 cells were determined by DCFH-DA and flow cytometry, respectively. After treated with or without antioxidants tempol andN-acetyl-L-cysteine (NAC), the expression of beclin 1 and LC3 in RPMI-8226 cells was determined by Western blot. RESULTS: The protein levels of beclin 1 and LC3Ⅱ/LC3Ⅰ were increased in the RPMI-8226 cells stimulated with doxorubicin compared with untreated group. The ROS production was increased in the RPMI-8226 cells stimulated with 2 mg/L doxorubicin compared with untreated group. After treated with 3-MA, the ROS production and apoptosis in the RPMI-8226 cells stimulated with doxorubicin were increased compared with doxorubicin group. After treated with antioxidant NAC or tempol, the expression of beclin 1 and LC3 II/I in the RPMI-8226 cells stimulated with doxorubicin was decreased compared with doxorubicin group.CONCLUSION: The autophagy and ROS levels are increased in RPMI-8226 cells stimulated with doxorubicin. Inhibition of autophagy increases the ROS production and apoptosis of RPMI-8226 cells stimulated with doxorubicin. Inhibition of ROS production reduces doxorubicin-induced autophagy in multiple myeloma cells.
Multiple myeloma; Doxorubicin; Autophagy; Reactive oxygen species
1000- 4718(2016)04- 0665- 06
2015- 11- 20
2016- 03- 17
重庆市卫生计生委医学科研计划项目(No. 2011-1-032)
Tel: 023-89011522; E-mail: cqchenjianbin2007@126.com.cn
R730.23
A
10.3969/j.issn.1000- 4718.2016.04.014
杂志网址: http://www.cjpp.net
