锯叶棕体细胞胚胎发生及植株再生体系的建立
2016-10-21彭欣怡程琴黄秋伟李慧敏王丽萍
彭欣怡 程琴 黄秋伟 李慧敏 王丽萍

摘 要 从锯叶棕成熟种子中成功实现体细胞胚胎发生和植株再生。成熟种子放在MS培养基上培养,加入0.15%活性炭,452 μmol/L 2,4-D和14.7 μmol/L N6-2iP,所有成熟合子胚培养5周后长出体胚簇,12周后,外植体转移到2,4-D浓度减到90.4 μmol/L的MS培养基中进行体胚增殖,之后体胚转移到含有0.9, 9 μmol/L TDZ或没有生长调节剂的基本培养基中转化成小植株。9 μmol/L TDZ对植株再生是无效的,然而,在0.9 μmol/L TDZ中作次培养有12%胚胎能长成完整植株,没有生长调节剂中35%胚胎长出嫩枝,这些嫩枝转移到含有22.2 μmol/L NAA的培养基中全部都会生根。picloram和2,4-D对锯叶棕幼苗愈伤的诱导效果最佳,6-BA次之,对子叶来说,picloram和2,4-D对愈伤的诱导起不到任何作用,而对茎尖的诱导效果最好。
关键词 离体培养 ;锯叶棕 ;体细胞胚胎 ;愈伤诱导
中图分类号 S792.91 文献标识码 A Doi:10.12008/j.issn.1009-2196.2016.07.011
锯叶棕[Serenoa repens(bartram)small],又名锯棕叶或锯棕榈,学名“沙巴棕”,属于棕榈科灌木植物,主要生长在佛罗里达州以及南北美洲的气候炎热地区[1]。锯叶棕是最理想的景观植物,它是一种坚韧,低维护的绿色植物,其生长少受水分胁迫及植物病害和虫害的影响[2]。其成熟的干燥果实可供药用,近年来发现其提取物治疗良性前列腺增生(BPH)和下尿路(LUTS)症状效果显著,现已成为最有效的3种治疗BPH植物药物之一[3-4]。锯叶棕作为草药制剂价值连城,受欢迎程度也正在日益增长。
锯叶棕通过传统种子繁育存在一定的局限性[5],自然萌发需4~6个月,幼苗生长缓慢,一般需要2~6年[6],将种子繁育温度提高到35℃,萌发时间缩短至约1个月[5],然而,很少人清楚锯叶棕在自然条件下的最佳生长和结果条件。
植物组织培养是植物快速繁育的重要技术手段,通过组织培养可以大规模繁育基因优良物种,进行种质资源保护,也可以进行遗传转化实验。国内尚无锯叶棕组织培养的报道。本研究的宗旨是为了发展锯叶棕体外再生的组织培养体系,以期为快速繁育国内优良稀缺植物资源提供参考。
1 材料和方法
1.1 材料
广西亚热带作物研究所与美国加州湾食品科技公司合作引种、试种生长10年的锯叶棕种子[7]。
1.2 方法
1.2.1 外植体准备
将收获放置在阴暗干燥环境下保存1年的种子,剥去果皮和种皮,在超净台上用无菌水洗1遍,再用0.1% 升汞摇晃消毒8 min,去掉消毒液,用无菌水冲洗3遍,每次5 min。将消毒好的种子用枝剪进行横切和纵切,露出种子凝胶状的胚乳和圆锥形的胚。1粒种子1个培养皿。
1.2.2 培养基及培养条件
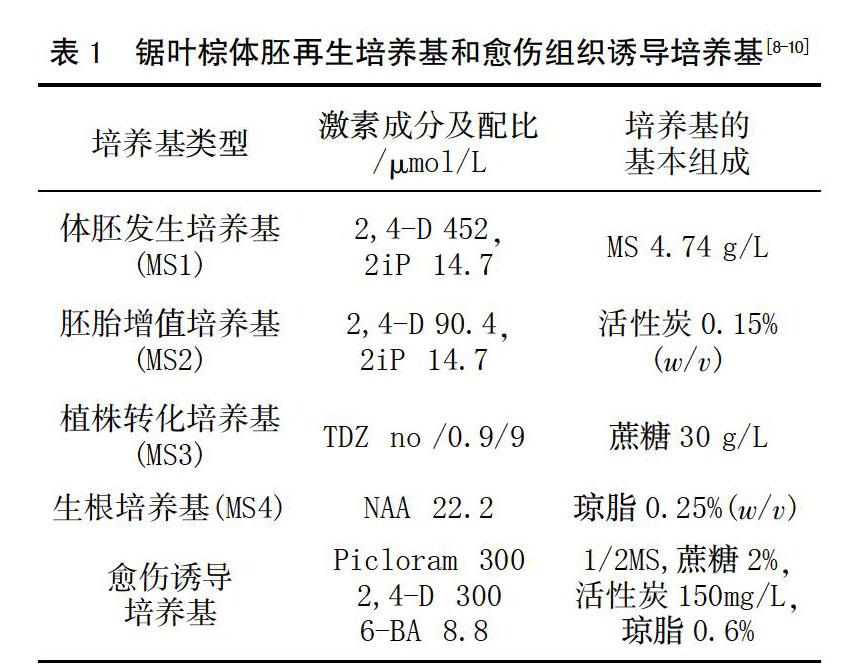
用1.0 mol/L NaOH 将全部培养基pH值调节 为5.8,121℃高压灭菌20 min。根据不同试验在基础培养基中添加不同种类和浓度的激素,26℃黑暗培养。锯叶棕体胚再生培养基和愈伤组织诱导培养基见表1。
1.2.3 愈伤组织的诱导
选取已经萌发成苗的小植株的茎尖、根尖及侧根、子叶等部位以及胚簇进行愈伤组织的诱导,并设置不同激素进行实验,26℃暗培养40 d,观察愈伤组织分化情况,比较愈伤组织诱导的结果,以确定根系外植体的最佳部位。
2 结果与分析
2.1 体细胞胚胎发生与植株再生
机械破损处理能大幅度提高锯叶棕发芽率,发芽率可达到90%,机械破损处理是锯叶棕最有效的促芽方式[11],用枝剪进行横切和纵切,露出种胚以提高种子的萌发率。将处理好的种子每6周转接一次新鲜MS1培养基(图1a)。12周后,外植体转移到2,4-D浓度减到90.4 μmol/L的MS2培养基中增殖,每个原始合子胚增殖为大约200个体细胞胚胎(图1b),在35周内,增殖会继续,但在此培养基上培养不能再维持。
将体细胞胚胎分别转移到TDZ浓度为0,0.9和9 μmol/L 的MS3培养基中进行诱导培养,培养条件为25℃,光照16 h/d(图1c)。每个处理用100个体细胞胚胎实验,在TDZ为0的培养条件下,35%的胚胎长出嫩芽,但不长根;在0.9 μmol/L TDZ的培养中有12%的胚胎产生芽与初级根(图1d),在含有9 μmol/L TDZ培养基中既不出芽也不生根。没有生长调节剂和含有0.9 μmol/L TDZ培養基中诱导得到的小苗转移到含有22.2 μmol/L NAA的MS4培养基中诱导生根,培养8周后,所有的47株外植体都能产生初级根和次生根(图1e)。
2.2 体胚愈伤组织诱导
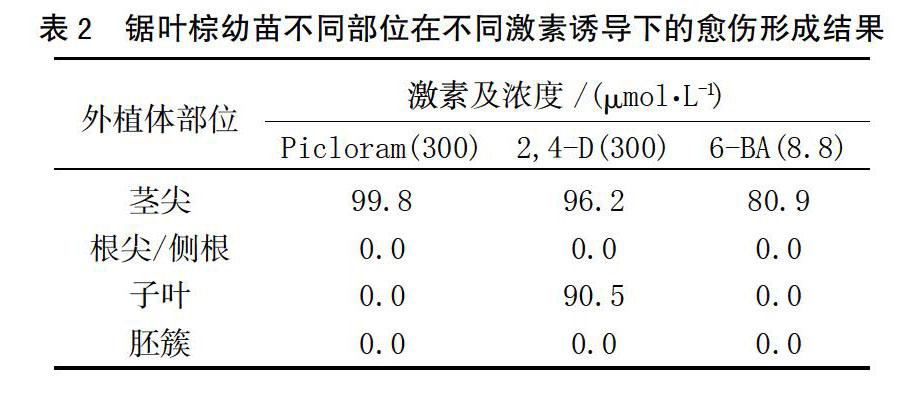
棕榈科植物诱导愈伤难,时间长,但近期报道从油棕未成熟雄性花序成功诱导愈伤,其中加有激素picloram的愈伤诱导率为82%,萘乙酸的诱导率为54%[10]。铁皮石斛已经建立了一个高效愈伤诱导率的体系,将原球茎片段放在1/2 MS培养基上,辅有NAA,6-BA,2,4-D等激素,其中以8.8 μmol/L 6-BA的培养基中愈伤诱导率最高[9]。综合以上信息,采用愈伤诱导培养基对已经萌发成苗的小植株的茎尖、根尖及侧根、子叶等部位以及胚簇进行愈伤组织的诱导,结果显示(表2),子叶和茎尖部位可以形成愈伤,根部和刚萌发出的体胚不能形成愈伤组织。picloram和2,4-D诱导茎尖效果最好,6-BA次之,picloram和2,4-D对子叶愈伤组织诱导无效,结果表明,茎尖是锯叶棕最佳的愈伤诱导材料。
3 讨论
锯叶棕跟其他棕榈一样,是多年生木本单子叶植物,未成熟合子胚是胚胎发生最好的外植体。但本试验利用的是成熟的种子,体胚的形成也只需约1.5月。油棕成熟合子胚添加450 μmol/L picloram和2.5 g/L活性炭的胚性愈伤组织诱导率可以达到97.5%[10]。活性炭由于其能吸附芳香族化合物,因此可以吸附酚类物质,使多酚氧化酶和过氧化物酶失活[12],此特性在棕榈组织培养中降低外植体的褐化、增强再生方面起到非常重要的作用[13]。因此,棕榈组培中加活性炭是常见的方法[14]。不加活性炭的培养基,氧化性太高,所有的合子胚都褐化而不能萌发,一旦加有活性炭,没有氧化和酶类积累,在2周内胚可以膨大到原来体积的4倍。5周后所有的外植体开始长出半透明的胚簇。由于活性炭也可以吸附植物生长调节因子,它也可能对组培产生负面影响。通过放射性示踪剂显示,100 μmol/L 2,4-D在5 d内被0.25%的活性炭吸附掉99.5%[15],然而,本试验使用半固体培养基、减少活性炭浓度和增加2,4-D浓度可以增加2,4-D可利用率。虽然还不清楚在含有0.15%活性炭的半固体培养基中,452 μmol/L 2,4-D可利用的准确百分比,但是这些培养条件大大增加了自由2,4-D的数量,这样就有足够的可利用2,4-D来诱导胚胎发生。
棕榈植物主要用种子进行繁殖,棕榈植物的种子播种后发芽难,发芽时间长,出苗不整齐是其特点,也是生产中的难点[16]。幼苗的愈伤诱导中,茎尖是最好的诱导材料,2,4-D和picloram是最佳的激素诱导剂,但在实验中发现,从1粒种子诱导出的愈伤组织只分化成2~3株小苗,从接种到分化成苗,花时间半年有余,还达不到扩大数量的目的,所花时间、物力和人力也不少,所以在短期内用少量珍稀珍贵的引种品种,进行大量繁殖推广较难,后续工作还需进一步研究。
4 小结
本研究中,锯叶棕不经过愈伤过程直接再生,可以维护外植体来源的完整性,体细胞无性系变异较少,因此,这种再生体系更有利于繁殖棕榈独特基因型和种质资源保护。更多的研究旨在考察不同生长调节剂组合,以及不同基因型的响应,以便建立锯叶棕最优的体外再生系统。
参考文献
[1] 林有润. 观赏棕榈[M]. 哈尔滨:黑龙江科学技术出版社,2003.
[2] Tanner G W, Mullahey J J, Maehr D. Saw-palmetto: an ecologically and economically important native palm[M]. Florida Cooperative Extension Service, IFAS,University of Florida, 1996.
[3] 王 萍,马子龙,刘立云. 锯叶棕的药用价值及市场前景分析[J]. 中国热带农业,2007(3):41-42.
[4] Taofikat B A, Max H P,Barbara W,et al. Serenoa repens (Saw Palmetto)A Systematic Review of Adverse Events[J]. Drug Safety, 2009, 32 (8): 637-647.
[5] Gallo-Meagher M, Green J. Somatic embryogenesis and plant regeneration from immature embryos of saw palmetto, an important landscape and medicinal plant[J]. Plant Cell, Tissue and Organ Culture, 2002, 68: 253-256.
[6] 何洁英. 棕榈科植物种子繁殖及移栽技术初探[J]. 广东园林,1998(1):26-27.
[7] 周全光,黄锦媛,黄丽君. 美国锯叶棕的引进与适应性观测[J]. 广西热带农业,2007(5):21-22.
[8] Dias A C, Guerra M P, Cordoba A S,et al. Somatic embryogenesis and plant regeneration in the tissue culture of Geonoma gamiova(Arecaceae). Acta Hort,1994, 360: 167-171.
[9] Zhao P, Wu F, Feng F S, et al. Protocorm-like body (PLB) formation and plant regeneration from the callus culture of Dendrobium candidum, Wall ex, Lindl[J]. In Vitro Cellular & Developmental Biology-Plant, 2008, 44(3): 178-185.
[10] Talita A B, Zanderluce G L, Jonny E S P. New approaches to improve the efficiency of somatic embryogenesis in oil palm (Elaeis guineensis Jacq.) from mature zygotic embryos.In Vitro Cellular Developmental Biology Plant, 2013, 49: 41-50.
[11] 尚秀華,谢耀坚,张沛健,等. 药用植物锯叶棕种子萌发条件初探[J]. 种子,2014,33:70-73.
[12] Pan M J, van S J. The use of charcoal in in vitro culture-A review[M]. Plant Growth, 1998, 26: 155-163.
[13] Tisserat B. Date palm[M]//Sharp W R, Evans D A, Ammirato P V. Handbook of Plant Cell Culture. New York: Macmillan Publishing Company, 1984(2): 505-545.
[14] Veramendi J, Navarro L. Influence of physical conditions of nutrient medium and sucrose on somatic embryogenesis of date palm. Plant Cell Tiss. Org. Cult, 1996, 45: 159-164.
[15] Ebert A, Taylor F ,Blake J. Changes of 6-benzylaminopurine and 2,4-dichlorophenoxyacetic acid concentrations in plant tissue culture media in the presence of activated charcoal[J]. Plant Cell, Tiss. Org. Cult, 1993, 33: 157-162.
[16] 何洁英. 棕榈植物种子贮藏和繁殖研究[J]. 广东园林,2002(3):37-40.
