谷子类受体蛋白激酶基因SiRLK35的克隆及原核表达
2016-10-14王一帆李臻潘教文王庆国刘炜
王一帆 李臻 潘教文 王庆国 刘炜
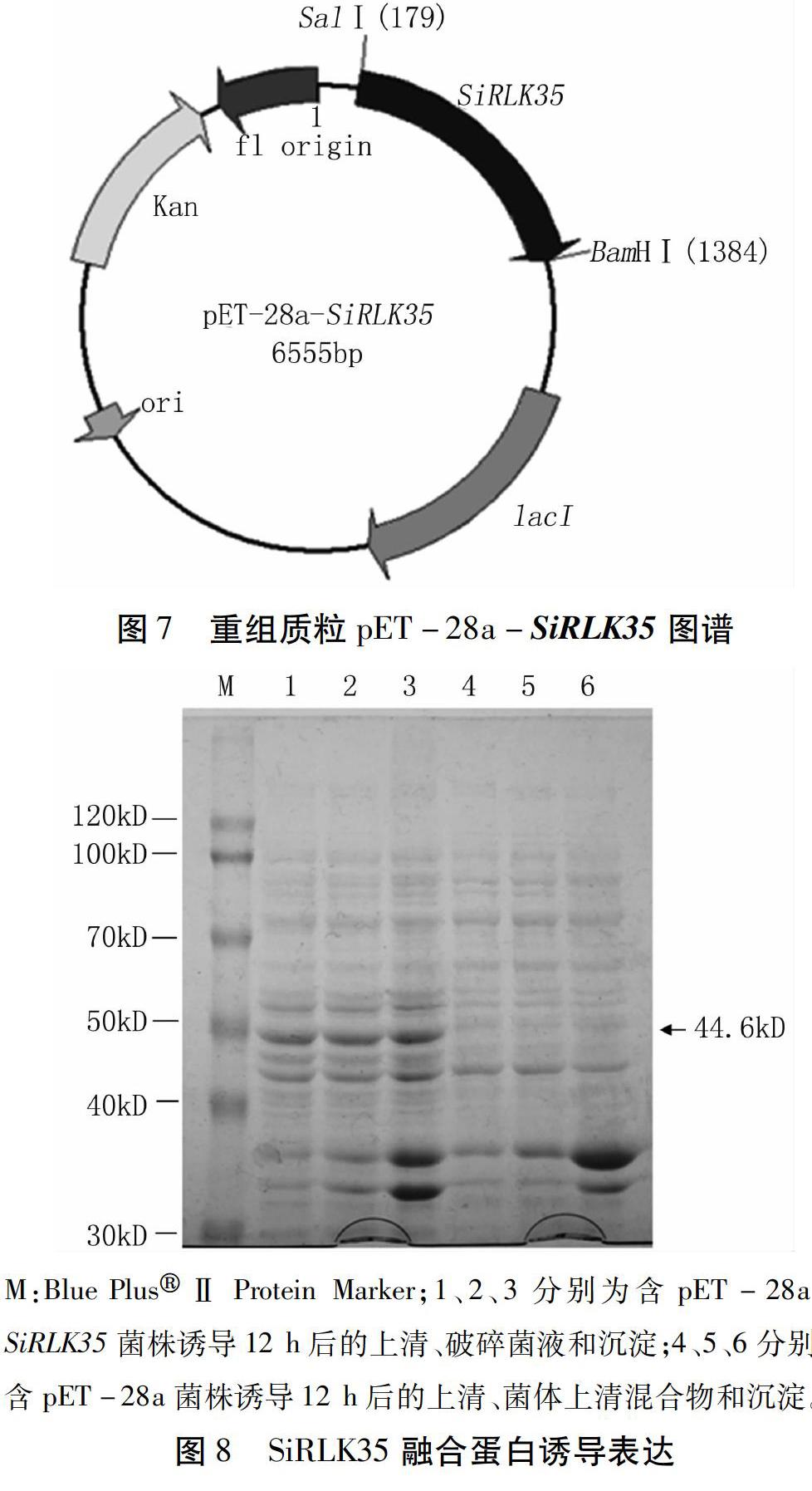

摘要:本研究以“豫谷1号”cDNA为模板,通过PCR技术获得类受体蛋白激酶基因SiRLK35(NCBI登录号:XM_004956247.2 )的全长序列。生物信息学分析显示,该基因编码蛋白由392个氨基酸残基构成,包含一个S_TKc保守结构域以及一个TFS2N结构域,含3个跨膜结构域,N端有信号肽。 SiRLK35基因经BamHⅠ、SalⅠ双酶切后,利用pET-28a构建原核表达载体,转化大肠杆菌菌株BL21(DE3),经0.5 mmol/L IPTG于25℃诱导12 h后,在44.6 kD处得到一明显诱导表达蛋白条带,表达产物与预期相符,证明SiRLK35基因可在大肠杆菌中诱导表达。该结果为进一步研究SiRLK35基因功能奠定基础。
关键词:谷子;类受体蛋白激酶;SiRLK35;原核表达
中图分类号:S515+Q78文献标识号:A文章编号:1001-4942(2016)09-0001-05
Cloning of Receptor-Like Protein Kinase Gene SiRLK35
from Foxtail Millet and Its Prokaryotic Expression
Wang Yifan1, 2,Li Zhen1,Pan Jiaowen1,Wang Qingguo1,Liu Wei1*
(1. Biotechnology Research Center, Shandong Academy of Agricultural Sciences/Shandong Provincial Key Laboratory of
Crop Genetic Improvement, Ecology and Physiology, Jinan 250100, China;
2. College of Life Sciences, Qingdao Agricultural University, Qingdao 266109, China)
AbstractIn this research, the full-length sequence of receptor-like protein kinase gene SiRLK35 (NCBI accession number: XM_004956247.2) was amplified by PCR technique with the cDNA of Yugu 1 as template. Bioinformatics analysis showed that the protein product of SiRLK35 was composed of 392 amino acids. It contained one S_TKc conserved domain, one TFS2N domain, three transmembrane domains and a N terminal signal peptide. The sequence of SiRLK35 was digested with BamHⅠ and SalⅠ, and then the recombined prokaryotic expression vector pET-28a-SiRLK35 was constructed successfully through connecting the fragment with pET-28a. The recombinant was further transformed into E.coli strain BL21 (DE3). Induced with 0.5 mmol/L IPTG, a 44.6 kD fusion protein was obtained, which proved that the SiRLK35 could be induced to express in E.coli. This research layed a good foundation for further study of the function of SiRLK35 gene.
KeywordsFoxtail millet; Receptor-like protein kinase; SiRLK35; Prokaryotic expression
谷子[Setaria italica (L.) Beauv.]又稱为粟,是起源于我国的古老作物,具有抗旱耐贫瘠的特点,是旱作生态农业的重要组成部分。近年来,其营养保健价值、国际竞争力和产量潜力受到研究者的普遍关注[1]。对谷子进行有目的、有针对性的品质、性状研究及抗逆机制的解析是现代谷子基因组学研究发展的重要方向。
前期研究中,通过同位素标记相对与绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术,以自然干旱处理的“豫谷1号”幼苗为材料,筛选到一个响应干旱、蛋白表达量明显下调的类受体蛋白激酶(编号K3ZRC5),对其编码基因序列分析显示,其属于S-类受体蛋白激酶亚家族,命名为SiRLK35,推测其可能参与谷子干旱响应过程,并在谷子抗旱过程中发挥作用。
类受体蛋白激酶(receptor-like protein kinases, RLKs)在植物中广泛存在,数量众多,具有较广泛的生物学功能[2]。动物、植物中的RLKs具有较高的同源性,结构上主要包括胞外受体结构域、跨膜结构域、胞内激酶域三部分[3],作为信号分子受体,它们能够感知胞外信号并将信号传递至胞内。植物RLKs广泛参与植物的生长发育、自交不亲和、生物与非生物胁迫及激素响应等诸多过程[4,5]。
根据胞外氨基端序列的不同,植物RLKs主要分为包含S-类受体蛋白激酶在内的10个亚家族,Walker等[6]在1990年首次从玉米中鉴定到S-类受体蛋白激酶Zmpk1,之后在其它物种中该类RLKs也相继被发现。
本研究拟围绕SiRLK35基因进行较为系统的生物信息学分析,并通过构建原核表达载体pET-28a-SiRLK35,转化大肠杆菌BL21(DE3)感受态细胞,对基因的诱导表达及蛋白产物做进一步研究,为将该基因应用于谷子抗旱研究提供依据。
1材料与方法
1.1材料与试剂
研究所用材料为“豫谷1号”。
TransTaq DNA Polymerase High Fidelity(HiFi)试剂盒、T4 DNA Ligaes试剂盒、2×EasyTaq SuperMix及Trans2K Plus DNA Marker均购于Transgen公司(山东济南雨同生物科技有限公司),PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit试剂盒、pMD18-T Vector试剂盒、pET-28a载体及DL5000 DNA Marker均购于TaKaRa公司,纯质粒小量制备试剂盒购于BioTeke公司(济南承森贸易有限公司),薄型琼脂糖凝胶DNA回收试剂盒购于GENERAY Biotechnology,引物由上海英潍捷基公司合成,其余试剂为进口或国产分析纯。
1.2谷子幼苗RNA的提取及单链cDNA的获得
取培养3周的“豫谷1号”幼苗,按TransZol Plant试剂盒说明书提供的方法提取谷子RNA,并参照PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit试剂盒说明书将所得到谷子RNA反转录成单链cDNA。
1.3SiRLK35基因的克隆
根据SiRLK35基因序列,使用Primer Premier 5设计引物SiRLK35S12:5′-CGGGATCCATGGAAGCCTTCATGGGCATC-3′,SiRLK35A12:5′-CGGTCGACTAAATTTGACTTCATTTCAGCCAGCTG-3′(下划线分别为BamHⅠ、SalⅠ酶切位点),以谷子幼苗cDNA为模板,PCR反应体系为:2×EasyTaq SuperMix 10 μL、引物SiRLK35S12及引物SiRLK35A12各0.5 μL、cDNA 1 μL、ddH2O补齐到20 μL。反应程序设置如下:94℃ 5 min;94℃ 30 s,53℃ 30 s,72℃ 1 min 20 s,35个循环;72℃ 10 min。
1.4SiRLK35基因编码蛋白的生物信息学分析
使用ExPASy (http://www.expasy.org/#)网站预测SiRLK35基因编码蛋白分子量、等电点,使用SMART(http://smart.embl- heidelberg.de/)网站预测SiRLK35蛋白结构域,使用SignalP4.1 (http://www.cbs.dtu.dk/services/SignalP/)网站对其进行信号肽分析,使用TMPred (http://www.ch.embnet.org/software/ TMPRED_form.html)网站分析其跨膜结构域。
1.5SiRLK35原核表达载体的构建
将经PCR扩增得到的SiRLK35基因回收纯化,与pMD18-T载体用T4 DNA连接酶于22℃连接5 min,转化大肠杆菌Trans 5α感受态细胞,均匀涂于100 mg/L Amp抗性LB平板,于37℃倒置过夜培养。对构建的中间表达载体,挑取单克隆经菌落PCR鉴定后,送至山东省农业科学院生物技术研究中心测序室测序。
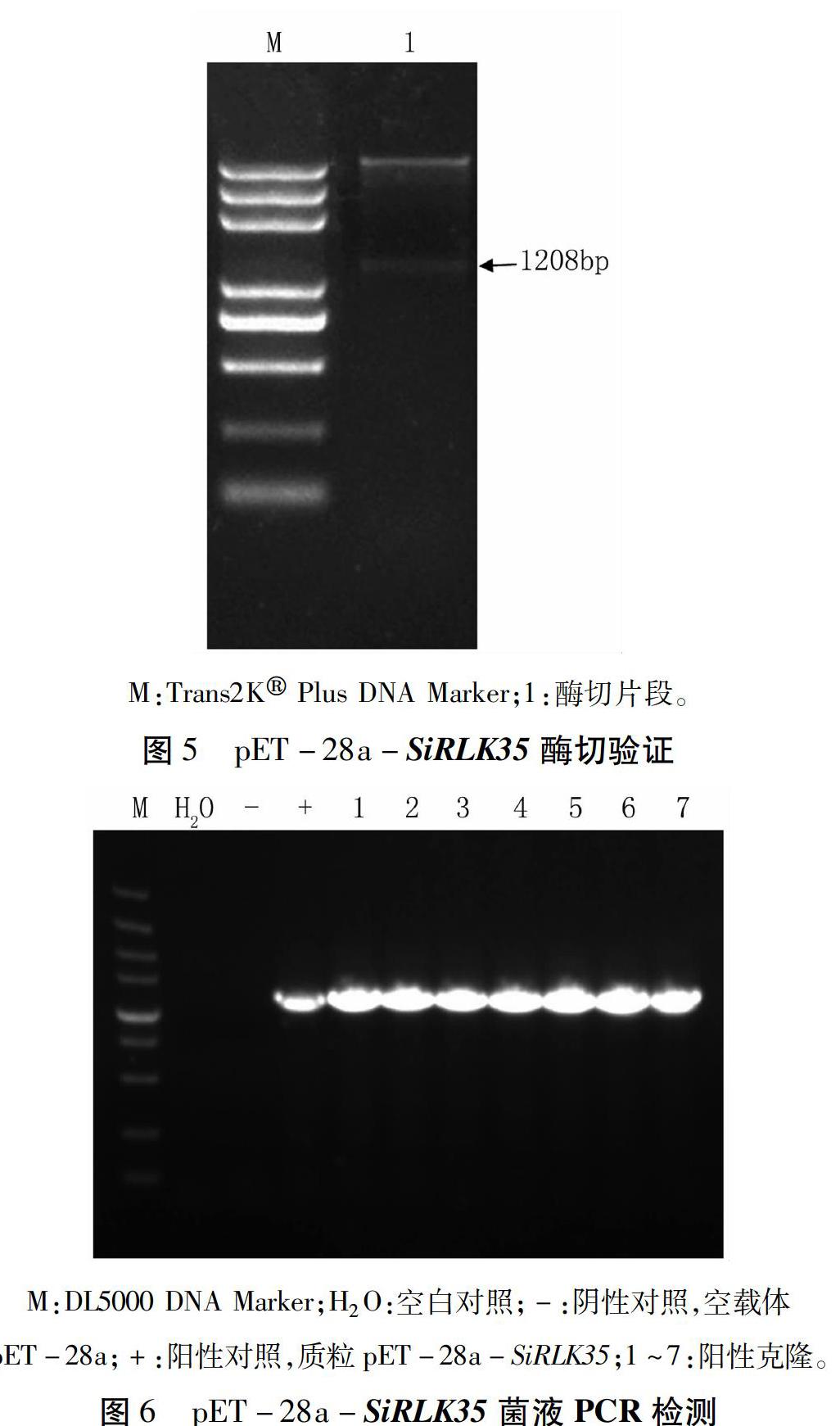
使用BamHⅠ、SalⅠ分别酶切测序正确的pMD18-T-SiRLK35质粒及原核表达载体pET-28a,回收纯化酶切片段,用T4 DNA连接酶22℃连接5 min,转化大肠杆菌Trans 5α感受态细胞,酶切检测。选择鉴定正确的pET-28a-SiRLK35质粒转化大肠杆菌BL21(DE3)感受态细胞,均匀涂于100 mg/L Kan抗性LB平板37℃倒置过夜培养,挑取单克隆经菌落菌液PCR鉴定,获得阳性菌株。
用pET-28a质粒转化大肠杆菌BL21(DE3)感受态细胞,均匀涂于100 mg/L Kan抗性LB平板,于37℃倒置过夜培养,挑取单克隆经菌落PCR鉴定,获得阴性对照。
1.6SiRLK35融合蛋白的诱导表达及SDS-PAGE鉴定
分别将含有重组质粒pET-28a-SiRLK35的BL21(DE3)菌株及阴性对照菌株于37℃振荡培养,菌液按1∶50比例用液体LB培养基稀释,培养至OD600≈0.6,加入IPTG(终浓度为0.5 mmol/L)于25℃、200 r/min诱导12 h。收集菌液经超声波破碎后,5 000 r/min离心10 min,分别取破碎菌液、上清、沉淀进行12%SDS-PAGE电泳,经染色、脱色后观察并拍照。
2结果与分析
2.1SiRLK35基因的克隆
2.2SiRLK35基因编码蛋白的生物信息学分析
通过ExPASy网站预测SiRLK35基因编码蛋白包含392个氨基酸残基,分子量为44.6 kD,等电点为6.88。使用SMART网站分析SiRLK35蛋白结构域,結果显示,在1~200氨基酸之间含有一个S_TKc保守结构域,为Ser/Thr蛋白激酶区,在311~386氨基酸之间有一个TFS2N结构域(图2)。通过SignalP4.1网站对其进行信号肽分析,结果显示,代表C值的线段在第30个氨基酸处分值较高,显示该处为信号肽剪切位点,1~28个氨基酸残基属信号肽,第29和第30个氨基酸残基之间为信号肽裂解点(图3)。使用TMPred网站分析显示SiRLK35蛋白有3个跨膜结构域。
使用BamHⅠ、SalⅠ雙酶切pMD18-T-SiRLK35质粒,回收纯化SiRLK35片段,定向连入原核表达载体pET-28a中,转化大肠杆菌Trans 5α菌株,酶切验证,得到预期大小片段(图5)。转化大肠杆菌BL21(DE3)菌株,进一步进行菌落PCR鉴定,筛选到阳性克隆,获得SiRLK35的原核表达载体pET-28a-SiRLK35 。
M:Trans2K Plus DNA Marker;1:酶切片段。
图5pET-28a-SiRLK35酶切验证
M:DL5000 DNA Marker;H2O:空白对照;-:阴性对照,空载体
pET-28a;+:阳性对照,质粒pET-28a-SiRLK35;1~7:阳性克隆。
图M:Blue Plus Ⅱ Protein Marker;1、2、3分别为含pET-28a-SiRLK35菌株诱导12 h后的上清、破碎菌液和沉淀;4、5、6分别为含pET-28a菌株诱导12 h后的上清、菌体上清混合物和沉淀。
图8SiRLK35融合蛋白诱导表达
3讨论与结论
谷子是起源于我国的传统作物,在我国北方地区种植广泛。谷子根系发达,蒸腾系数低,具有突出的抗旱性能[7]。近期,谷子基因组测序工作的完成为从分子水平揭示谷子抗旱机制奠定了基础[8]。
本课题组通过iTRAQ技术,以干旱处理的“豫谷1号”幼苗为材料,筛选到一个S-类受体蛋白激酶基因,命名为SiRLK35,检索其序列并设计特异性引物,以谷子cDNA为模板,利用PCR技术成功克隆到基因全长。生物信息学分析显示,SiRLK35基因编码蛋白由392个氨基酸残基构成,等电点为6.88;结构分析显示,SiRLK35蛋白包含一个S_TKc保守结构域,为丝氨酸/苏氨酸蛋白激酶区,带有磷酸化位点,是信号级联反应中心[9],此外还含有一个TFS2N结构域;信号肽分析显示,该蛋白N端有信号肽,推测属于分泌型蛋白;跨膜结构域分析显示,该蛋白含3个跨膜结构域,符合类受体蛋白激酶结构特征。
外源基因表达系统在生物学研究中应用普遍,其中大肠杆菌表达系统是蛋白表达技术中发展最早的一项[10]。尽管大肠杆菌表达系统无法进行翻译后加工(肽链折叠、氨基酸的修饰等),表达的蛋白多以无生物活性的包涵体形式存在,但其凭借培养方便、价格低廉、可大规模生产、遗传背景清楚、能够高水平表达外源基因、寄主菌株及载体较多以及安全性好等诸多优点[11],依然是目前应用最普遍、最成熟的外源基因表达系统[12]。pET系统能阻止影响宿主细胞生长速度的毒性基因的克隆且能优化靶蛋白表达,广泛应用于大肠杆菌表达系统[13],BL21(DE3)是pET系统最常用的表达宿主菌。IPTG是在诱导表达系统中最常使用的诱导剂,稳定且不被细菌代谢。大肠杆菌表达系统广泛应用在多个物种的基因外源表达中,杨书玲等[14]克隆了小麦TaPDK基因,通过大肠杆菌实现了表达并将蛋白纯化;宋杨等[15]克隆了短枝型苹果MdRGL基因,并通过pEGX-4T表达载体在大肠杆菌中实现了该基因的表达;赵丽等[16]在大肠杆菌中实现了水稻类受体蛋白激酶OsESG1的原核表达。
本研究利用pET系统构建了SiRLK35基因的原核表达载体pET-28a-SiRLK35,转入大肠杆菌BL21(DE3)感受态细胞,经0.5 mmol/L IPTG于25℃、200 r/min诱导12 h,实现了SiRLK35基因在大肠杆菌中的表达,且诱导表达的蛋白在沉淀中含量较多,推测其主要以包涵体的形式存在,为进一步研究该基因功能以及抗体制备奠定了基础。下一步将在该工作的基础上,拟通过分离、纯化目的蛋白,进而制备蛋白特异性抗体,检测SiRLK35蛋白在植物中的表达情况,为进一步解析SiRLK35基因功能奠定基础。
参考文献:
[1]Lata C, Gupta S, Prasad M. Foxtail millet: a model crop for genetic and genomic studies in bioenergy grasses [J]. Crit. Rev. Biotechnol., 2013, 33 (3): 328-343.
[2]林彦萍,王义,蒋世翠,等.植物类受体蛋白激酶研究进展[J].基因组学与应用生物学,2015,34(2):429-437.
[3]Stone J M, Walker J C.Plant protein kinase families and signal transduction [J]. Plant Physiology, 1995,108: 451-457.
[4]Morris E R, Walker J C. Receptor-like protein kinases: the keys to response [J]. Curr. Opin. Plant Biol., 2003, 6 (4):339-342.
[5]Vaid N, Pandey P K, Tuteja N, et al. Genome-wide analysis of lectin receptor-like kinase family from Arabidopsis and rice [J]. Plant Mol. Biol., 2012,80 (4/5):365-388.
[6]Walker J C, Zhang R. Relationship of a putative receptor protein kinase from maize to the S-locus glycoproteins of Brassica [J].Nature,1990, 345 (6277):743-746.
[7]Zhang G, Liu X, Quan Z, et al. Genome sequence of foxtail millet (Setaria italica) provides insights into grass evolution and biofuel potential [J].Nat. Biotechnol., 2012, 30 (6):549-554.
[8]Bennetzen J L, Schmutz J, Wang H, et al. Reference genome sequence of the model plant Setaria [J]. Nat. Biotechnol., 2012, 30 (6):555-561.
[9]Hunter T. Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling [J]. Cell,1995,80 (2):225-236.
[10]Shamik S S, Frederick R B, Sarah W H, et al. Recombinant protein production in an Eschriechia coli reduced genome strain [J].Metabolic Engineering,2006, 9 (2):133-141.
[11]戴漢川,张晓伟,龙良启,等.一种带增强子的原核高效表达载体的构建及初步应用[J].生物工程学报,2000,16 (5):578-581.
[12]Nuc P, Nuc K. Recombinant protein production in Escherichia coli [J].Postepy Biochem.,2006,52 (4): 448-456.
[13]解庭波.大肠杆菌表达系统的研究进展[J].长江大学学报,2008,5(3):77-82.
[14]杨书玲,张龙雨,张改生,等.小麦TaPDK基因的序列分析、原核表达及纯化[J].核农学报,2013,27(8):13-20.
[15]宋杨,张艳敏,刘美艳,等.短枝型苹果MdRGL基因的克隆及原核表达分析[J].中国农业科学,2012,45(7):1347-1354.
[16]赵丽,张国嘉,郑世刚,等.水稻类受体蛋白激酶OsESG1的原核表达[J].山东农业科学,2015,47(1):1-5.山 东 农 业 科 学2016,48(9):6~9,16Shandong Agricultural Sciences山 东 农 业 科 学第48卷第9期孙亚玲,等:
