新疆芜菁皂苷的体内抗氧化活性研究
2016-09-18杨保求马飞军蒲云峰塔里木大学生命科学学院新疆阿拉尔843300南疆特色农产品深加工兵团重点实验室新疆阿拉尔843300
杨保求,马飞军,蒲云峰,2,*(.塔里木大学生命科学学院,新疆阿拉尔843300;2.南疆特色农产品深加工兵团重点实验室,新疆阿拉尔843300)
新疆芜菁皂苷的体内抗氧化活性研究
杨保求1,2,马飞军1,蒲云峰1,2,*
(1.塔里木大学生命科学学院,新疆阿拉尔843300;2.南疆特色农产品深加工兵团重点实验室,新疆阿拉尔843300)
研究新疆芜菁皂苷对小鼠的体内抗氧化作用,以生理盐水为载体,维生素C为阳性对照,分别采用低、中、高3种剂量芜菁皂苷灌胃饲喂4周后,测定血清、肝脏和肾脏中谷胱甘肽过氧化酶(GSH-Px)和超氧化物歧化酶(SOD)的活力,及丙二醛(MDA)含量。研究结果表明,芜菁皂苷能够显著提高小鼠体内抗氧化酶的活性(P<0.01),降低MDA含量(P<0.01),说明新疆芜菁皂苷具有提高小鼠体内抗氧化能力的作用。
芜菁;皂苷;体内抗氧化
新疆芜菁 [Brassica campestris L.(syn.B.rapa.L.)],俗称恰玛古,大头菜、诸葛菜、蔓菁、圆菜头,是十字花科芸薹属芸薹种的芜菁亚种,主要分布在天山西南、塔里木盆地西北,有较长的栽培历史,是新疆维吾尔族人非常喜食的一种蔬菜[1]。近年来,有学者对新疆芜菁中植物化学成分进行了分析,发现新疆芜菁中除含有维生素、有机酸、蛋白质、矿物质和膳食纤维外[2],还含有多糖[3]、皂苷类[1,4]、酚类、生物碱、黄酮类[5]、硫苷类等成分。此外,也有研究报道新疆芜菁具有抗突变、抗衰老、抗氧化[8]、降血糖[6]、增强耐力[7]、修复辐射损伤等功能。由于新疆芜菁中已知的功能多以芜菁汁或水提液进行研究获得,难以阐释清楚新疆芜菁的功能与其植物化学成分之间的关系。因此,有必要对新疆芜菁中特定化合物的活性进行研究,为开发利用新疆芜菁资源提供科学参考。
皂苷是一类糖苷类次生代谢物,广泛存在于高等植物中[9-10]。皂苷类物质一直以来被认为是许多植物药和民间医药的主要成分,具有许多药学活性,如治疗心绞痛、抗炎、抑菌、杀寄生虫、抗肿瘤、抗病毒、增强免疫、降血糖、抗氧化以及溶血性等[11-16]。目前,已有研究从新疆芜菁中提取到皂苷类物质,并且发现芜菁皂苷具有较好的体外抗氧化能力[4],但是,还鲜见有新疆芜菁皂苷体内抗氧化方面的报道。因此,本文以小白鼠为研究对象,通过皮下注射D-半乳糖,建立亚急性衰老模型[17],考察新疆芜菁皂苷对小鼠体内抗氧化活性的影响,为开发利用新疆芜菁提供科学参考。
1 材料与方法
1.1材料与试剂
新疆芜菁:购于阿克苏农贸市场;甲醇、香草醛、浓硫酸、乙醇、冰乙酸、石油醚(沸程60℃~90℃)、正丁醇、氯化钠、D-半乳糖、维生素C、齐墩果酸标准品等:均为国产分析纯;超氧化物歧化酶(SOD)测试盒、蛋白(TP)定量测试盒、谷胱甘肽过氧化物酶(GSH-PX)测试盒、丙二醛(MDA)测试盒:均购于南京建成生物工程有限公司;普通全价营养颗粒饲料:由新疆维吾尔自治区实验动物中心提供。
1.2试验动物
SPF级昆明种雄性小鼠,6~8周龄,体重18 g~22 g左右,由新疆维吾尔自治区实验动物研究中心提供,生产许可证号SCXK(新)2011.0001。
1.3试验仪器与设备
GZX-9240鼓风干燥烘箱:上海博讯实业有限公司;TGL-16G台式离心机:上海菲恰尔分析仪器有限公司;DZKW-D-2电热恒温水浴锅:北京永光明医疗仪器厂;RE-52旋转蒸发仪:上海亚荣生化仪器厂;冷冻干燥机:上海舜宇恒平科学仪器有限公司;SHZ-D (III)循环水式真空泵:巩义予华仪器有限责任公司;TU-1900紫外可见光分光光度计:北京普析通用仪器有限责任公司。
1.4方法
1.4.1芜菁粗皂苷的提取工艺流程
新鲜芜菁切成1mm~2mm薄片,在70℃的条件下鼓风干燥,然后研磨成粉,过80目筛,冷藏备用;取一定量芜菁粉,置于圆底烧瓶中,按1∶5(g/mL)的比例加入石油醚,浸泡过夜,减压过滤,然后干燥去除残留石油醚,获得脱脂芜菁粉;称取一定量脱脂芜菁粉,按1∶10(g/mL)的比例加入溶剂,浸泡过夜,在温度为55℃、超声功率120 W的条件下,超声25 min,减压过滤,真空浓缩,蒸馏水稀释,然后用等体积水饱和正丁醇萃取2次,将两次萃取液混合并真空浓缩,再冷冻干燥得芜菁皂苷粉,置于-18℃冰箱中,备用。
1.4.2动物分组及饲养
动物饲养室温度(22±2)℃,相对湿度为65%~80%,每天保持12 h光照,12 h黑夜,自由饮食和饮水。在实验环境下适应一周后随机分为6组:空白对照组、模型对照组、阳性对照组、低剂量组、中剂量组和高剂量组,每组10只,雌雄各半。
除空白对照组外,其余每组每天上午灌胃1次,并按照200 mg/kg剂量颈背部皮下注射D-半乳糖;芜菁皂苷低、中、高剂量组分别为37.5、75.0、150.0 mg/kg,阳性对照组为100.0 mg/kg维生素C,模型对照组给予等量生理盐水。连续饲喂4周,每周称量1次动物体重。
1.4.3测试样品处理
试验结束后,禁食12 h,摘眼球取血,3 000 r/min离心5 min,分离血清备用。取血后的小鼠颈椎脱臼处死,取出肝脏和肾脏,用冷的生理盐水洗去血渍,除去结缔组织,滤纸吸干水分,称取组织块0.5 g,置于组织匀浆器中,加入预冷的生理盐水4.5 mL,在冰水浴的条件下,制备成10%的组织匀浆液,3 000 r/min离心15 min,取上清液备用。
1.4.4指标检测
血清、肝脏及肾脏中蛋白含量、超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-PX)活性、丙二醛(MDA)含量,均按试剂盒操作说明测定。
2 结果与分析
2.1芜菁皂苷对小鼠体重的影响
试验过程中,每周称量1次小鼠体重,共计称量5次。将小鼠体重数据进行统计分析,数据用x±s表示,结果见表1。
通过对表1的数据进行方差分析,在试验过程中,各组小鼠生长良好,体重随饲养时间增加而显著增加(P<0.01)。芜菁皂苷低、中、高剂量组和模型对照组、维生素C阳性对照组在同一时间点的体重质量与空白对照组之间并无显著性差异(P>0.05),说明各处理对小鼠生长影响较小或无影响。

表1 芜菁皂苷对小鼠体重的影响Table 1 Effect of SBC on the weight of mice g
2.2芜菁皂苷对小鼠血清、肝脏和肾脏中蛋白含量的影响
取1.4.3的样品,用蛋白(TP)定量测试盒测定蛋白含量,芜菁皂苷对小鼠小鼠血清、肝和肾组织中蛋白含量的结果见表2。

表2 芜菁皂苷对小鼠血清、肝和肾组织中蛋白含量的影响Table 2 Effect of SBC on protein content of serum,liver and kidney
通过对表2的数据进行方差分析,血清、肝脏和肾脏中蛋白含量存在显著差异(P<0.01),这可能是组织部位不同导致的差异。而各处理同一部位的蛋白含量与空白对照比较,却无显著差异(P>0.05),这说明各处理对小鼠血清、肝脏和肾脏中的蛋白含量影响不大或无影响。
2.3芜菁皂苷对小鼠血清、肝脏及肾脏中谷胱甘肽过氧化物酶(GSH-PX)的影响
取1.4.3的样品,用谷胱甘肽过氧化物酶(GSH-PX)测试盒测定蛋白含量,芜菁皂苷对小鼠血清、肝和肾组织中谷胱甘肽过氧化物酶(GSH-PX)活性的结果见表3。
通过对表3的数据进行方差分析,新疆芜菁低剂量组、模型对照组和空白对照组之间无显著差异(P>0.05),但新疆芜菁中、高剂量组和阳性对照组的小鼠体内谷胱甘肽过氧化物酶(GSH-PX)活性显著高于空白对照组(P<0.01),芜菁皂苷中、高剂量组的GSH-PX活性均显著小于阳性对照组(P<0.05),并且新疆芜菁皂苷对谷胱甘肽过氧化物酶(GSH-PX)活性的影响呈正相关。这说明高剂量的芜菁皂苷具有提高小鼠体内谷胱甘肽过氧化物酶(GSH-PX)活性的作用。
2.4芜菁皂苷对小鼠血清、肝脏及肾脏中超氧化物歧化酶(SOD)的影响
取1.4.3的样品,用超氧化物歧化酶(SOD)测试盒测定蛋白含量,芜菁皂苷对小鼠血清、肝和肾组织中超氧化物歧化酶(SOD)活性的结果见表4。
通过对表4的数据进行方差分析,与空白对照组比较,新疆芜菁皂苷低剂量组和模型对照组血清中超氧化物歧化酶 (SOD)活性显著低于空白对照(P<0.01),而肝脏和肾脏中超氧化物歧化酶(SOD)与空白之间无显著差异(P>0.05),而新疆芜菁皂苷中、高剂量组和阳性对照组的超氧化物歧化酶(SOD)活性均显著高于空白对照组(P<0.01),并且新疆芜菁皂苷对超氧化物歧化酶(SOD)活性的影响也呈正相关,芜菁皂苷高剂量组与阳性对照组之间无显著差异(P>0.05),这说明中、高剂量的芜菁皂苷具有提高小鼠体内超氧化物歧化酶(SOD)活性的作用。
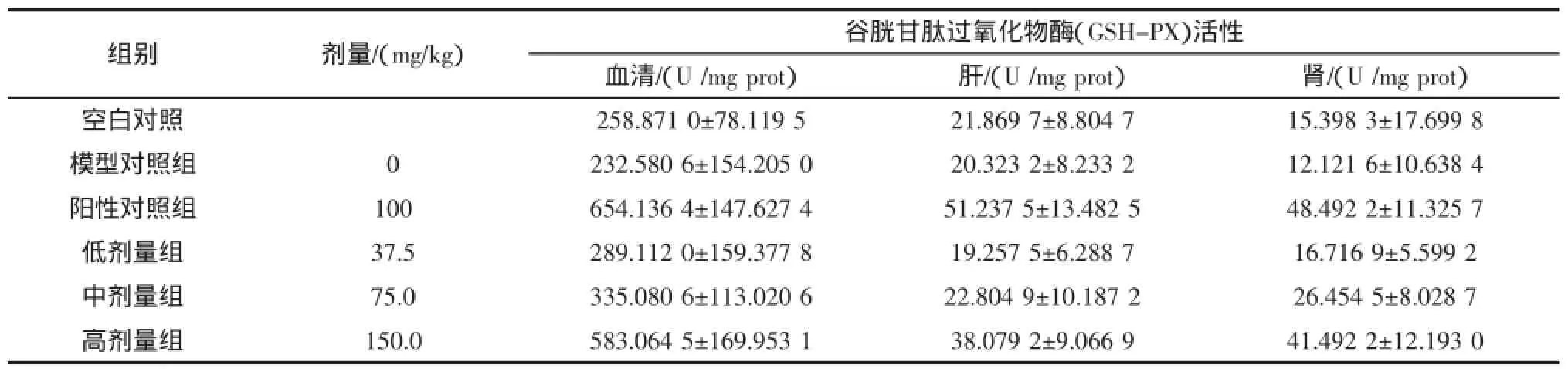
表3 芜菁皂苷对小鼠血清、肝脏和肾脏中谷胱甘肽过氧化物酶(GSH-PX)的影响Table 3 Effect of SBC on GSH-PX activity of serum,liver and kidney

表4 芜菁皂苷对小鼠血清、肝脏和肾脏中超氧化物歧化酶(SOD)的影响Table 4 Effect of SBC on SOD activity of serum,liver and kidney
2.5芜菁皂苷对小鼠血清、肝脏及肾脏中丙二醛(MDA)的影响
取1.4.3的样品,用丙二醛(MDA)测试盒测定蛋白含量,芜菁皂苷对小鼠血清、肝和肾组织中丙二醛(MDA)含量的结果见表5。

表5 芜菁皂苷对小鼠血清、肝和肾组织中丙二醛(MDA)的影响Table 5 Effect of SBC on MDA content of serum,liver and kidney
通过对表5的数据进行方差分析,与空白对照比较,各处理对小鼠血清、肝脏及肾脏中丙二醛(MDA)的影响也存在显著差异(P<0.01)。除模型对照组中丙二醛(MDA)含量显著高于空白对照组外(P<0.01),其余各组的丙二醛(MDA)含量均显著低于空白对照组(P<0.01)。并且新疆芜菁皂苷对丙二醛(MDA)含量的影响呈负相关,高剂量组与阳性对照组之间无显著差异(P>0.05),这说明新疆芜菁皂苷能够显著降低小鼠体内丙二醛(MDA)含量。
3 结论
机体细胞内正常浓度的D-半乳糖可以被代谢,但当D-半乳糖浓度过高时,D-半乳糖会在醛糖还原酶作用下转化成半乳糖醇,由于半乳糖醇不能被进一步代谢而积累在细胞内影响渗透压,引起细胞肿胀代谢紊乱,影响机体内的抗氧化酶活性。因此,在体内抗抗氧化研究中,常常通过皮下注射D-半乳糖来建立衰老动物模型[17]。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)是机体抗氧化系统中重要的酶,其活力高低反映了机体清除自由基能力的强弱,而丙二醛(MDA)是体内多元不饱和脂质氧化的终产物之一,其水平的高低可以反映体内不饱和脂质的过氧化程度,间接地反映机体产生自由基的水平和细胞膜的损伤程度[18]。因此,在体内抗氧化研究中,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)和丙二醛(MDA)常被作为衡量抗氧化能力的指标。
本研究通过连续28 d注射半乳糖溶液和灌胃饲养后,与空白和模型对照组比较,新疆芜菁皂苷中高剂量组小鼠体内的超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-PX)活性均得到显著提高(P<0.01),并且丙二醛(MDA)水平显著降低(P<0.01);新疆芜菁皂苷低剂量组仅能显著降低丙二醛(MDA)水平(P<0.01),而对超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶 (GSH-PX)活性的影响不显著(P>0.05),这说明新疆芜菁皂苷具有提高小鼠体内抗氧化能力的作用。
[1]蒋卉,孟庆艳,蒲云峰.响应面法优化芜菁皂苷提取工艺的研究[J].食品研究与开发,2015,36(12):41-44
[2]马国财,王玉茹,轩正英.新疆芜菁不同品种营养成分分析与比较[J].食品工业科技,2016,36(4):360-364
[3]李雅双,连路宁,刘杰,等.芜菁多糖提取工艺及清除自由基活性的研究[J].食品与发酵工业,2014,40(5):235-240
[4]杨保求,唐琪,蒲云峰.恰玛古皂苷的提取及清除自由基活性的研究[J].中国果菜,2015,35(10):18-21
[5]帕丽达·阿布利孜,海力茜·陶尔大洪,古娜娜·对山别克.正交设计优选维药恰玛古总黄酮的提取工艺[J].光谱实验室,2013,30(2):684-688
[6]姚星辰,陈湘宏,段雅彬,等.芜菁正丁醇提取物对四氧嘧啶型糖尿病小鼠血糖的影响[J].天然产物研究与开发,2015,27(4):706-709
[7]张英,唐伟敏,尼玛,等.西藏芜菁及其加工制品增强人体低氧耐受性的实验研究[J].食品科学,2014,35(3):178-182
[8]Chen Y,Miao Y,Huang L,et al.Antioxidant activities of saponins extracted from Radix Trichosanthis:an in vivo and in vitro evaluation [J].BMC Complement Altern Med,2014,14:86
[9]Sparg S G,Light M E,van Staden J.Biological activities and distribu-tion of plant saponins[J].Journal of Ethnopharmacology,2004,94(2/ 3):219-243
[10]Mroczek A.Phytochemistry and bioactivity of triterpenesaponins from Amaranthaceaefamily[J].Phytochemistry Reviews,2015,14(4):577-605
[11]Zhao D.Challenges associated with elucidating the mechanisms of the hypocholesterolaemic activity of saponins[J].Journal of Functional Foods,2016,23(5):52-65
[12]Reim V,Rohn S.Characterization of saponins in peas(Pisumsativum L.)by HPTLC coupled to mass spectrometry and a hemolysis assay [J].Food Research International,2015,76(10):3-10
[13]Cheok C Y,Salman H A K,Sulaiman R.Extraction and quantification of saponins:A review[J].Food Research International,2014,59(5):16-40
[14]Augustin J M,Kuzina V,Andersen S B,et al.Molecular activities,biosynthesis and evolution of triterpenoidsaponins[J].Phytochemistry,2011,72(6):435-457
[15]Elekofehinti O O.Saponins:Anti-diabetic principles from medicinal plants-A review[J].Pathophysiology,2015,22(2):95-103
[16]郭建军,雷晓,任道远,等.绞股蓝茶总皂苷的纯化及其抗氧化活性研究[J].食品工业科技,2015,35(5):99-102
[17]Song Xu,BaoMingming,Li Diandong,et al.Advanced glycation in D-galactose induced mouse aging model[J].Mechanisms of Ageing and Development,1999,108(3):239-251
[18]高璐,王滢,饶胜其,等.葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J].食品科学,2014,35(23):253-256
In vivo Antioxidant Activity of Saponins Extracted from Brassica Campestris L.
YANG Bao-qiu1,2,MA Fei-jun1,PU Yun-feng1,2,*
(1.College of Life Science,Tarim University,Alar 843300,Xinjiang,China;2.Xinjiang Production& Construction Group Key Laboratory of Agricultural Products Processing in South of Xinjiang,Alar 843300,Xinjiang,China)
This paper studied the in vivo antioxidant activity of saponins extracted from Brassica Campestris L.(SBC).Saline solution was used as carriers,while vitamin C was used as positive control.Mice were fed with SBC at low,medium and high doses,respectively.After feeding for four weeks by the mean of irrigation,the activity of SOD and GSH-Px,and the content of MDA of serum,liver and kidney were determined.The results indicated the SBC could significantly increase the activities of SOD and GSH-Px(P<0.01),and reduce the content of MDA(P<0.01).It suggested that the SBC had the functions of in vivo antioxidation.
Brassica Campestris L.;saponin;in vivo antioxidative activity
2016-05-03
塔里木大学校长基金硕士项目(TDZKSS201311)
杨保求(1979—),男(土家),副教授,硕士,研究方向:食品科学与天然产物。
蒲云峰(1981—),男(汉),副教授,硕士,研究方向:农产品加工与贮藏工程。
