盲肠灌注不同SCFA对驴乳生产性能及乳脂肪酸组成的影响
2016-08-09周小玲王连群陈根元窦全林
周小玲,方 雷,王连群,陈根元,窦全林
(1.塔里木大学动物科学学院,阿拉尔 843300; 2.新疆生产建设兵团塔里木畜牧科技重点实验室,阿拉尔 843300; 3.青海大学农牧学院,西宁 810016)
盲肠灌注不同SCFA对驴乳生产性能及乳脂肪酸组成的影响
周小玲1,2,方雷1,2,王连群1,2,陈根元1,2,窦全林3*
(1.塔里木大学动物科学学院,阿拉尔 843300; 2.新疆生产建设兵团塔里木畜牧科技重点实验室,阿拉尔 843300; 3.青海大学农牧学院,西宁 810016)
摘要:旨在了解驴盲肠发酵产物对乳成分合成的影响。本研究选择4头安装永久盲肠瘘管的泌乳母驴(体重(182±9) kg),在泌乳晚期((155±15) d),经盲肠用连续灌注法,采用4×4拉丁方设计,连续3 h灌注3种不同比例和组合的短链脂肪酸(SCFA):乙丙组(乙酸150 mmol·h-1+丙酸50 mmol·h-1)、乙丁组(乙酸170 mmol·h-1+丁酸30 mmol·h-1)、乙丙丁组(乙酸130 mmol·h-1+丙酸50 mmol·h-1+丁酸20 mmol·h-1),对照组灌注相同体积的缓冲液。结果发现,不同处理组间乳产量无显著差异(P>0.10)。乙丁组乳脂、非脂固形物、乳糖和乳蛋白含量均显著高于乙丙丁组(P<0.10);乙丙和乙丁组中乳蛋白含量显著高于乙丙丁组(P<0.10),其余各指标差异不显著(P>0.10)。乙丙和乙丙丁组的中链脂肪酸比例显著高于对照组(P<0.05),乙丙、乙丁和乙丙丁组长链脂肪酸比例显著低于对照组(P<0.05)。结果显示,经盲肠灌注乙酸和丁酸有助于提高乳成分含量,灌注乙酸和丙酸有利于增加乳脂的中链脂肪酸比例,盲肠SCFA参与并影响驴乳脂合成。
关键词:盲肠;连续灌注法;短链脂肪酸;驴乳;脂肪酸
近年来,许多研究发现驴乳具有抗氧化、抗炎症、调节肠道微生物菌群、脱毒作用和抑制肿瘤细胞增殖等活性[1-3],驴乳受到越来越多研究者和消费者关注,主要消费人群是牛乳过敏的婴儿和免疫机能下降的老人[4]。研究表明驴乳生物活性可能与乳脂有关[5],驴乳脂具有不饱和脂肪酸高和n-3:n-6比率高的特点[6]。现在普遍认为在非反刍动物中,乳脂主要来自于乳腺经由小肠消化吸收入血的饲粮脂肪而合成,其组成由饲粮决定[7-9],但对于具有发达瘤胃的反刍动物来说,乳脂在很大程度是由乙酸从头合成[10],那么对于具有发达后肠发酵的驴来说,后肠相对容积占整个肠道的80%[11],推测发酵产物SCFA对于乳前体物供应有重要作用。
驴盲肠是主要发酵器官,而结肠是主要吸收器官,发酵的代谢产物是以乙酸、丙酸和丁酸为主的短链脂肪酸(Short chain fatty acid,SCFA)[12]。SCFA占宿主能量供应的15%~30%[11],是一个重要的能量来源。G.den Besten等[13]研究表明,盲肠和结肠中的SCFA还广泛参与动物肝组织的脂肪酸合成,主要合成肝棕榈酸和参与硬脂酸的延长反应。J.K.Suagee等[14]报道乙酸参与马的体脂合成,我们先前的研究[15]通过盲肠灌注经标记的乙酸后,证实驴后肠代谢产物乙酸直接参与乳脂合成,然而针对不同SCFA组成和比例驴乳对乳脂的影响,目前尚未有报道。因此本试验通过盲肠灌注不同组成和比例的SCFA,研究其对于驴乳生产性能和乳成分的影响。
1材料与方法
1.1试验动物
选择4只体况良好的健康新疆母驴(年龄5~7岁,体重(182±9) kg,泌乳天数(155±15) d),安装永久性盲肠瘘管。
1.2饲养管理
试验饲粮配制参照马的营养标准(NRC,2007),按精粗比1∶2,将精料和粗料混匀后每日饲喂3次(09:00、14:00、19:00),保证每日剩料量不低于喂量的10%,自由采食。饲粮组成和营养水平见表1。
1.3试验设计与处理
采用4×4拉丁方设计,不同处理组SCFA的组合和比例见表2,设定总SCFA灌注速率为200 mmol·h-1,灌注液中添加缓冲物:NaCl 7 g·L-1、KHCO338 g·L-1、NaH2PO40.6 g·L-1、NaHCO378 g·L-1,并调节pH为7.2,对照组仅灌注等量缓冲液。采用蠕动真空泵(BT300-1F,兰格),连续灌注时间为3 h,总灌注量为450 mL。
早晨09:00饲喂后,10:00开始启动连续灌注,至13:00结束,并按正常时间喂料。每日早晚挤乳2次(10:00、20:00)。测定乳产量,将早晚的乳样混合后取样作为当天样品,连续取乳样3 d。每一期试验期为3 d,间隔期为7 d。
1.4样品采集与分析
饲料样品每期采集1次,混匀后用于测试干物质、粗脂肪、粗蛋白、酸性洗涤纤维、粗灰分、钙和磷含量,测定参照张丽英[16]的方法进行。
收集的乳样一部分置于-4 ℃保存,当天用经校正后的乳成分分析仪(UL80BC,浙大优创)测定乳脂、乳糖、乳蛋白等;一部分样品在-20 ℃冻存,乳脂经提取、皂化和酯化后,采用气相色谱仪(岛津GC2014C,配FID检测器)分析乳脂肪酸,外标法定性和定量。1.4.1脂肪提取量取乳样50 mL,以10 000 r·min-1冷冻离心(-10 ℃)30 min,吸出上层奶油后再次以15 000 r·min-1冷冻(-10 ℃)离心30 min,在冰水中取出上层固化奶油。

表1 饲粮组成及营养水平(干物质基础)
1.预混料组成:维生素A 80 000 IU·kg-1,维生素D340 000 IU·kg-1,维生素E 800 mg·kg-1,维生素K345 mg·kg-1,维生素B120 mg·kg-1,维生素B2150 mg·kg-1,维生素B610 mg·kg-1,维生素B120.5 mg·kg-1,烟酸600 mg·kg-1,泛酸钙350 mg·kg-1,叶酸10 mg·kg-1,生物素40 mg·kg-1,胆碱12 500 mg·kg-1,铁3 000 mg·kg-1,铜500 mg·kg-1,锌3 000 mg·kg-1,锰2 000 mg·kg-1,碘100 mg·kg-1,硒10 mg·kg-1,钴30 mg·kg-1,赖氨酸2%,钙15%,磷8%,氯化钠3%
1.Ingredients of premix:VA 80 000 IU·kg-1,VD340 000 IU·kg-1,VE 800 mg·kg-1,VK345 mg·kg-1,VB120 mg·kg-1,VB2150 mg·kg-1,VB610 mg·kg-1,VB120.5 mg·kg-1,Niacin 600 mg·kg-1,Calcium pantothenate 350 mg·kg-1,Folic acid 10 mg·kg-1,Biotin 40 mg·kg-1,Choline 12 500 mg·kg-1,Fe 3 000 mg·kg-1,Cu 500 mg·kg-1,Zn 3 000 mg·kg-1,Mn 2 000 mg·kg-1,I 100 mg·kg-1,Se 10 mg·kg-1,Co 30 mg·kg-1,Lys 2%,Ca 15%,P 8%,NaCl 3%
1.4.2皂化酯化将0.1 g奶油(精确到0.1 mg)融化后,置于带塞试管中,加入0.5 mol·L-1的氢氧化钠甲醇溶液5 mL,置于(50±2) ℃水浴15 min,加入盐酸-甲醇溶液5 mL,置于80 ℃水浴60 min,冷却至室温,分别加入5 mL蒸馏水和5 mL正己烷,振摇分层后,取上清液1 μL作为试液,供气相色谱仪上机测定。
1.4.3色谱条件色谱柱:CP-sil 88,100 m×0.25 mm×0.2 μm;检测器温度:260 ℃;载气:N2(99.99%);入口压力:200 kPa;色谱柱流量:1.0 mL·min-1;分流比:30∶1;进样口温度:240 ℃;升温程序:70 ℃,4 min~13 ℃/min,175 ℃,27 min~4 ℃/min,220 ℃,40 min,共90.33 min。
1.5数据统计
采用SPSS 19软件对数据进行统计分析,方差分析采用广义线性模型,试验动物、时期和处理组为主效因子,在Alpha=0.05或Alpha=0.10条件下采用Duncan法对处理效应进行多重比较。
2结果
2.1灌注SCFA对驴乳产量和乳成分的影响
在α=0.10水平时,不同处理组间乳产量无显著差异(P>0.10)。乙丁组乳脂、非脂固形物、乳糖和乳蛋白含量均显著高于乙丙丁组(P<0.10);乙丙和乙丁组中乳蛋白含量显著高于乙丙丁组(P<0.10),其余各指标差异不显著(P>0.10)。
2.2灌注SCFA对驴乳脂肪酸的影响
与对照组相比,乙丙组显著地提高乳脂中C8:0、C10:0、C11:0和C12:0比例(P<0.05),显著降低C18:1和C18:2的比例(P<0.05)。乙丁组C11:0比例显著高于对照组(P<0.05),而C18:2比例显著低于对照组(P<0.05)。相比对照组,乙丙丁组显著提高C10:0和C11:0的比例(P<0.05),显著降低C18:1和C18:2的比例(P<0.05)。乙丙组中C10:0和C11:0显著高于乙丁组(P<0.05),而C16:0和C18:1比例显著低于乙丁组(P<0.05)。其余各指标间没有显著差异(P>0.05)。
乙丙和乙丙丁组的中链脂肪酸比例显著高于对照组(P<0.05),乙丙组显著高于乙丁组(P<0.05),其余各组间无显著差异(P>0.05);相应地,乙丙、乙丁和乙丙丁组长链脂肪酸比例显著低于对照组(P<0.05),乙丙组显著低于乙丙丁组(P<0.05),其余各指标间无显著差异(P>0.05)。

表2 不同处理组灌注的SCFA组成和浓度
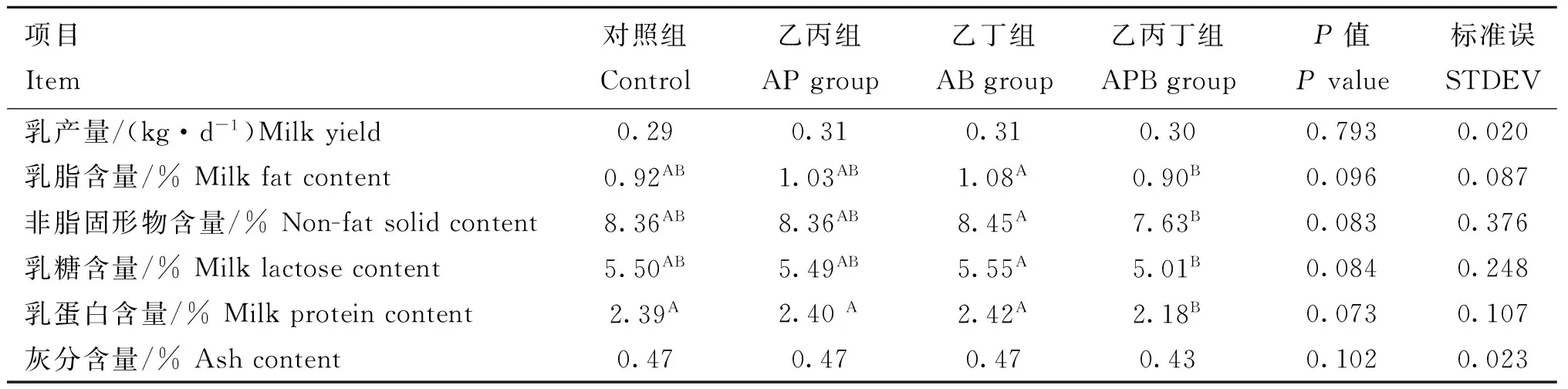
表3 盲肠连续灌注SCFA对驴乳产量和乳成分的影响
同行数据肩标无字母或相同字母表示差异不显著,字母不同表示差异显著。下表同。Alpha=0.10
Values in the same row without letter superscripts or with the same letter superscripts mean no significant difference,while with different letter superscripts mean significant difference.The same as below.Alpha=0.10
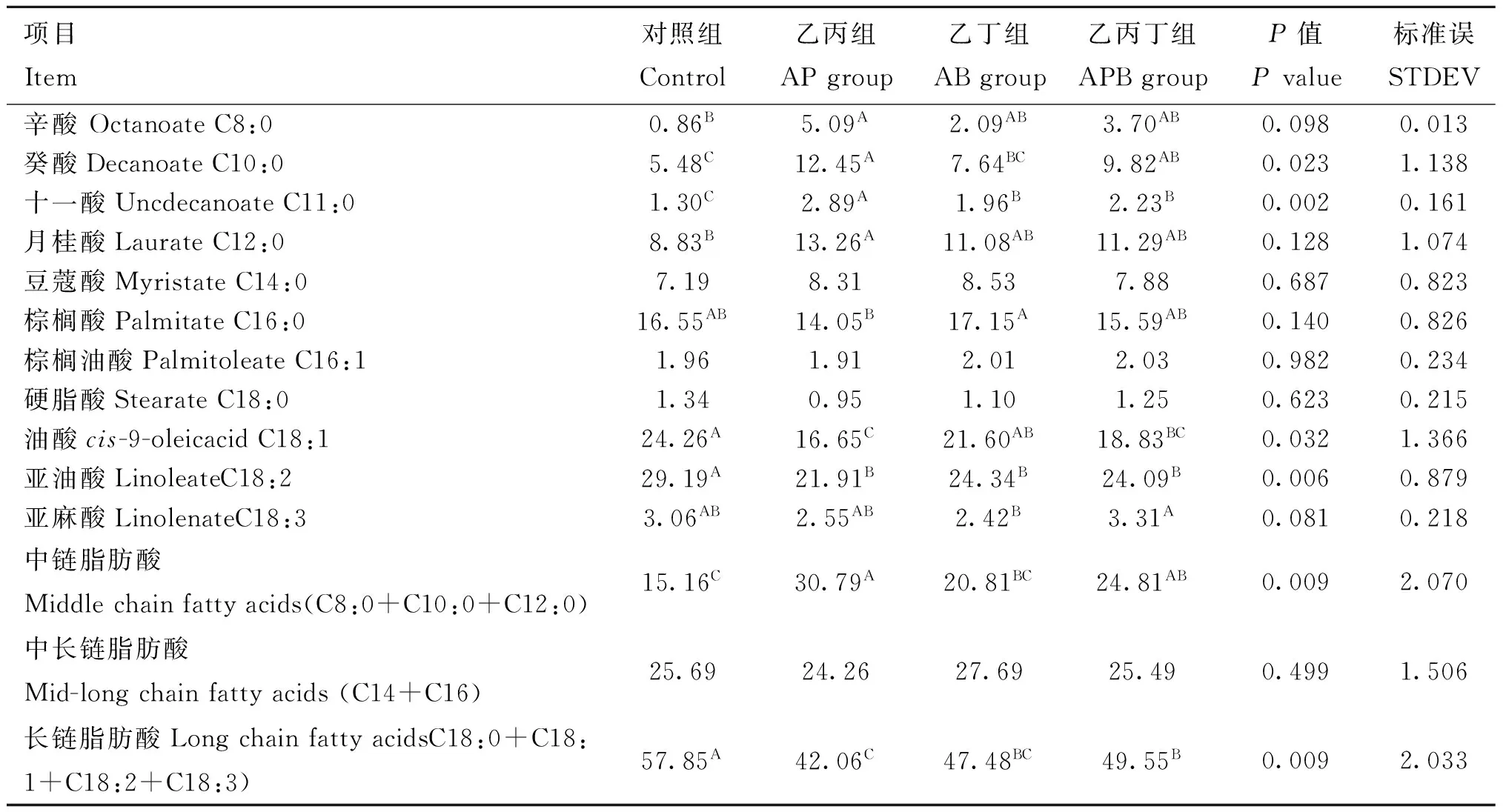
表4 盲肠连续灌注SCFA对驴乳脂肪酸组成的影响
Alpha=0.05
3讨论
迄今为止,关于盲肠SCFA产生速率的报道不多,据M.J.Glinsky等[17]报道,矮马盲肠中SCFA的乙酸产生速率约为3.95~5.78 mmol·min-1,丙酸约为1.03~1.56 mmol·min-1,丁酸约为0.40~0.63 mmol·min-1,依据其下限值和后肠乙、丙和丁酸间组成特点,本研究设计了相应的SCFA组合和灌注量。
后肠中90%的SCFA可被结肠细胞吸收入血[18],吸收后的乙酸大部分被肝、心等内脏器官摄取[19],其中60%被肝摄取,乳腺组织具备自身的脂肪合成系统,主要通过从血液中摄取底物来形成乳成分。泌乳期间血液中SCFA在肝和血液中的分配受饲粮组成、营养水平、体内营养储备等因素所影响,且存在组织间选择性利用[20]。因此血液、乳腺和肝等各部位脂肪酸组成存在差异。目前普遍认为非反刍动物的乳脂由饲粮因素决定[7-9],即主要通过小肠对饲粮脂肪的消化吸收进入血液中而影响乳脂,但笔者前期研究发现驴后肠SCFA也参与乳脂合成[15],同时在目前这一研究中发现不同SCFA比例对乳脂肪酸组成和比例的影响不同。因此前肠和后肠对乳脂合成都有影响,但前肠和后肠对乳脂的相对定量贡献需进一步研究。
由于驴前肠对蛋白质、可溶性碳水化合物的消化速率非常有效,因此不被前肠消化而进入小肠的主要是不可溶性碳水化合物和少量结合蛋白,是一种氮限制性的基质,有助于SCFA形成而非微生物生长[21]。驴后肠SCFA主要以乙酸为主,占65%~70%,丙酸占15%~20%,而丁酸占5%~10%,其余有少量异丁酸、戊酸和异戊酸[12]。G.den Besten等[13]报道,来自于小鼠后肠的SCFA广泛参与肝脂肪和糖代谢,后肠中产生的乙酸会参与肝棕榈酸和胆固醇合成及硬脂酸延长过程,但从本试验的结果来看,除乙丁组棕榈酸比例较乙丙丁组提高外(P<0.05),其余灌注组对棕榈酸和硬脂酸没有影响,而是增加驴乳中中链脂肪酸,与反刍动物中SCFA的作用近似[10,22],这可能表明驴作为单胃性草食动物,与复胃性草食动物在消化代谢方面具有共同点,但具体代谢途径和机制需进一步研究。
在后肠中,乙酸、丙酸和丁酸间可相互转化,尤其是乙酸和丁酸间转化率非常高[13]。乙酸主要用于生糖和生脂[13],丙酸用作生糖底物参与能量代谢[23],丁酸主要作为肠上皮细胞燃料[24]。而乙酸和丁酸都是生脂前体物,这说明了试验中乙丁酸组驴乳脂含量较高的原因。乙酸是进入外周循环血液中的主要SCFA物质,而丙酸和丁酸浓度较低[13]。相比于对照组,乙丙组乳脂中显著地提高从头合成脂肪酸比例,这是因为丙酸本身是一种高效供能物质[23],而乳脂肪酸从头合成是一个耗能过程,推测乙丙组中较高的丙酸比例和浓度有利于提高乳脂中需从头合成的中链脂肪酸比例。乙丁组对乳脂肪酸的影响与对照组差异较小,乙丙丁组对乳脂肪酸的影响介于乙丙和乙丁组之间,可能是由于丁酸代谢中间物β-羟丁酸对于乳腺乳脂肪酸合成具有某种不利作用[25]。综合来看,乙丙组对于乳脂肪酸组成的影响较大,T.M.Wolever等[26]研究发现,由于在结肠中乙酸和丙酸存在互作,丙酸减少了肝中将乙酸用于合成胆固醇的比例,从而加深乙酸对乳脂肪酸组成的影响。
4结论
通过在驴盲肠中灌注不同比例和组成的SCFA,研究发现乙酸和丁酸组合有提高驴乳脂含量的作用,但乙酸和丙酸组合显著提高乳脂肪酸的中链脂肪酸比例。表明盲肠中SCFA对驴乳脂合成具有不可忽视的影响。
参考文献(References):
[1]TRINCHESE G,CAVALIERE G,CANANI R B,et al.Human,donkey and cow milk differently affects energy efficiency and inflammatory state by modulating mitochondria function and gut microbiota[J].JNutrBiochem,2015,26(11):1136-1146.
[2]LIONETTI L,CAVALIERE G,BERGAMO P,et al.Diet supplementation with donkey milk upregulates liver mitochondrial uncoupling,reduces energy efficiency and improves antioxidant and antiinflammatory defences in rats[J].MolNutrFoodRes, 2012,56(10):1596-1600.
[3]MAO Y X,GU J,SUN Y,et al.Anti-proliferative and anti-tumor effect of active components in donkey milk on A549 human lung cells[J].IntDairyJ,2009,19(11):703-708.
[4]AMATI L,MARZULLI G,MARTULLI M,et al.Donkey and goat milk intake and modulation of the human aged immune response[J].CurrPharmDes,2010,16(7):864-869.
[5]MARTEMUCCI G,D’ALESSANDRO A G.Fat content,energy value and fatty acid profile of donkey milk during lactation and implications for human nutrition[J].LipidsHealthDis,2012,11:113.doi:10.1186/1476-511X-11-113.
[6]ZOU X,HUANG J,JIN Q,et al.Lipid composition analysis of milk fats from different mammalian species:potential for use as human milk fat substitutes[J].JAgricFoodChem,2013,61(29):7070-7080.
[7]DOREAU M,BAUCHART D,CHILLIARD Y.Enhancing fatty acid composition of milk and meat through animal feeding[J].AnimProdSci,2010,51(1):19-29.
[8]DUVAUX-PONTER C,TOURNIE M,DETRIMONT L,et al.Effect of a supplement rich in linolenic acid added to the diet of mares on fatty acid composition of mammary secretions and the acquisition of passive immunity in the foal[J].AnimSci,2004,78(3):399-407.
[9]HOFFMAN R M,KRONFELD D S,HERBEIN J H,et al.Dietary carbohydrates and fat influence milk composition and fatty acid profile of mare’s milk[J].JNutr,1998,128(12 Suppl):2708S-2711S.

[11]HINTZ F H,SCHRYVER H F,STEVENS C E.Digestion and absorption in the hindgut of nonruminant herbivores[J].JAnimSci,1978,46(6):1803-1807.
[12]陈根元,周小玲,蒋慧,等.不同年龄驴的后消化道中挥发性脂肪酸含量和组成的分析初探[J].塔里木大学学报,2012,24(4):7-16.
CHEN G Y,ZHOU X L,JIANG H,et al.Primary analysis of the contents and composition of volatile fatty acids in hind gut of different ages of donkeys[J].JournalofTarimUniversity,2012,24(4):7-16.(in Chinese)
[13]DEN BESTEN G,LANGE K,HAVINGA R,et al.Gut-derived short-chain fatty acids are vividly assimilated into host carbohydrates and lipids[J].AmJPhysiolGastrointestLiverPhysiol,2013,305(12):G900-G910.
[14]SUAGEE J K,CORL B A,CRISMAN M V,et al.De novo fatty acid synthesis and NADPH generation in equine adipose and liver tissue[J].CompBiochemPhysiolBBiochemMolBiol,2010,155(3):322-326.
[15]周小玲,陈根元,格明古丽,等.盲肠和静脉灌注(13)C-乙酸对驴乳成分合成的影响[C]//中国畜牧兽医学会马学分会.中国畜牧兽医学会马学分会成立大会.北京:中国畜牧兽医学会马学分会,2014:2.
ZHOU X L,CHEN G Y,GEMINGULI,et al.Effect of cecal and intravenous infusion of 13C-acetate on milk constituent’s synthesis[C]// Horse Association of CAAV.Proceedings of the inaugural meeting of horse association of CAAV.Beijing:Horse Association of CAAV,2014:2.(in Chinese)
[16]张丽英.饲料分析及饲料质量检测技术[M].第3版.北京:中国农业大学出版社,2007:48-80.
ZHANG L Y.Feed Analysis and feed quality testing technology[M].3rd ed.Beijing:China Agricultural University Press,2007:48-80.(in Chinese)
[17]GLINSKY M J,SMITH R M,SPIRES H R,et al.Measurement of volatile fatty acid production rates in the cecum of the pony[J].JAnimSci,1976,42(6):1465-1470.
[18]POUTEAU E,NGUYEN P,BALLVRE O,et al.Production rates and metabolism of short-chain fatty acids in the colon and whole body using stable isotopes[J].ProcNutrSoc,2003,62(1):87-93.
[19]FROST G,SLEETH M L,SAHURI-ARISOYLU M,et al.The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism[J].NatCommun,2014,5:3611.doi:10.1038/ncomms4611.
[20]BICKERTON A S,ROBERTS R,FIELDING B A,et al.Preferential uptake of dietary fatty acids in adipose tissue and muscle in the postprandial period[J].Diabetes,2007,56(1):168-176.
[21]SANTOS A S,RODRIGUES M A,BESSA R J,et al.Understanding the equine cecum-colon ecosystem:current knowledge and future perspectives[J].Animal,2011,5(1):48-56.
[22]程光民,林雪彦,李福昌,等.瘤胃灌注乙丙酸不同摩尔比混合挥发性脂肪酸对奶山羊乳脂合成的影响[J].畜牧兽医学报,2009,40(7):1028-1036.
CHENG G M,LIN X Y,LI F C,et al.The influence of acetate and propionate molar ration in ruminally infused volatile fatty acid mixtures on milk fat synthesis in lactating goats[J].ActaVeterinariaetZootechnicaSinica,2009,40(7):1028-1036.(in Chinese)
[23]FORD E J,SIMMONS H A.Gluconeogenesis from caecal propionate in the horse[J].BrJNutr,1985,53(1):55-60.
[24]WILLIAMS B A,VERSTEGEN M W,TAMMINGA S.Fermentation in the large intestine of single-stomached animals and its relationship to animal health[J].NutrResRev,2001,14(2):207-228.
[25]FORSBERG N E,BALDWIN R L,SMITH N E.Roles of acetate and its interactions with glucose and lactate in cow mammary tissue[J].JDairySci,1984,67(10):2247-2254.
[26]WOLEVER T M,SPADAFORA P,ESHUIS H.Interaction between colonic acetate and propionate in humans[J].AmJClinNutr,1991,53(3):681-687.
(编辑郭云雁)
doi:10.11843/j.issn.0366-6964.2016.07.015
收稿日期:2015-09-21
基金项目:国家自然科学基金项目(31160461)
作者简介:周小玲( 1983-) ,女,四川内江人,副研究员,博士生,主要从事畜产品品质及营养调控研究,E-mail:zxldky@126.com *通信作者:窦全林,副教授,E-mail:452856362@qq.com
中图分类号:S822;S815.4
文献标志码:A
文章编号:0366-6964(2016)07-1422-06
Effects of Cecal Infusion of Different SCFA on Donkey Milk Performance and Milk Fatty Acid Profile
ZHOU Xiao-ling1,2,FANG Lei1,2,WANG Lian-qun1,2,CHEN Gen-yuan1,2,DOU Quan-lin3*
(1.CollegeofAnimalScience,TarimUniversity,Alaer843300,China;2.KeyLaboratoryofTarimAnimalHusbandryScienceandTechnologyofXinjiangProduction&ConstructionGroup,Alaer843300,China;3.AgricultureandAnimalHusbandryCollegeofQinghaiUniversity,Xining810016,China)
Abstract:To investigate the effects of cecal fermentation products on donkey milk synthesis,4 donkeys installed permanently cecal fistula were selected (body weight (182±9) kg) at late lactation stage ((155±15) d).Through continuous infusion method via cecum,using 4×4 Latin square design,3 different proportions and combinations of short chain fatty acids (SCFA) were continuous infused for 3 h:AP group (acetic acid of 150 mmol·h-1+ propionic acid of 50 mmol·h-1),AB group (acetic acid of 170 mmol·h-1+ butyric acid of 30 mmol·h-1),APB group (acetic acid of 130 mmol·h-1+ propionic acid of 50 mmol·h-1+ butyric acid of 20 mmol·h-1),and the control group was perfused equivalent volume of buffer solution,to study the effects of different compositions and proportions of SCFA on donkey milk production and milk fatty acids.The results showed that there was no significant difference (P>0.10) in milk yield among different treatments.Milk fat,non-fat solid,lactose and protein contents were significantly higher in AB group than in APB group (P<0.10);In AP and AB groups,milk protein contents were significantly higher than that in the APB group (P<0.10),the other indices of milk constituents showed no significant difference among different groups (P>0.10).Compared to control group,percent of middle-chain fatty acids in AP and APB groups were significantly increased (P<0.05),while percent of the long-chain fatty acids in AP,AB and APB groups were lower than that in control group(P <0.05).It was concluded that infusion of acetic and butyric acids through cecum helped to improve contents of milk constituents,and infusion of acetic and propionic acids increased percent of middle-chain fatty acids of milk fat,SCFAs from cecum directly affected donkey milk synthesis.
Key words:cecum;continuous infusion method;short-chain fatty acid;donkey milk;fatty acid
