造血干细胞移植后的早期免疫重建
2016-06-25朱明霞万文丽李海申王艳芳克晓燕
朱明霞,万文丽,李海申,王 晶,王艳芳,胡 凯,克晓燕
(北京大学第三医院血液科,北京 100191)
·论著·
造血干细胞移植后的早期免疫重建
朱明霞,万文丽,李海申,王晶,王艳芳,胡凯,克晓燕△
(北京大学第三医院血液科,北京100191)
[摘要]目的:探讨异基因造血干细胞移植(allogenic hematopoietic stem cell transplantation,allo-HSCT)和自体造血干细胞移植(autologous HSCT,auto-HSCT)患者早期免疫重建的异同。方法:收集2011年12月至2014年8月在北京大学第三医院血液科进行HSCT的恶性血液病患者31例,其中15例allo-HSCT,16例auto-HSCT;留取20名健康人外周血标本作为健康对照。采用四色流式细胞术检测两组患者移植后1年内外周血中淋巴细胞亚群的动态变化,并通过检测T细胞受体重排删除环(T cell receptor rearrangement excision circle,TREC)水平判断初始 T细胞功能。结果:移植后12个月内allo-HSCT组和auto-HSCT组患者CD4+T细胞、CD8初始T细胞、效应记忆性T细胞、CD4中枢记忆性T细胞、中期活化性T细胞以及DC重建与健康对照组比较差异有统计学意义(P<0.05),但两组患者间差异无统计学意义(P>0.05),CD8+T细胞和NK细胞迅速恢复正常水平。移植后前3个月内B细胞重建在两组患者间差异无统计学意义(P>0.05),均显著低于健康对照组(P<0.01),但从第6个月起auto-HSCT组显著快于allo-HSCT组患者(P<0.05);移植后第6个月起allo-HSCT组晚期活化性T细胞表达显著高于auto-HSCT组(P<0.05),而auto-HSCT组CD4初始T细胞和CD8中枢记忆性T细胞的表达高于allo-HSCT组(P<0.05)。移植后12个月内allo-HSCT和auto-HSCT组患者外周血CD3+T细胞中TREC水平显著低于年龄相近的健康对照组(P<0.05),allo-HSCT组患者外周血CD3+T细胞中的TREC水平稍高于auto-HSCT组患者,但差异无统计学意义(P>0.05)。结论:allo-HSCT和auto-HSCT患者早期免疫重建的速度和特点很相似,移植患者免疫重建主要不是由异源性移植物所决定,可能与胸腺功能受损后T细胞分化缓慢密切相关。
[关键词]造血干细胞移植;自体移植;异基因移植;淋巴细胞亚群;免疫重建
造血干细胞移植(hematopoieticstemcelltransplantations,HSCT)是治疗恶性血液病有效的手段,虽然存在患者疾病类型、移植前的一般状况以及预处理方案的千差万别,但都会去除或者至少强烈抑制受者造血系统,提供移植物植入的空间而避免出现移植物的排斥。HSCT后免疫功能缺陷是影响临床预后的关键因素,异基因HSCT(allogenicHSCT,allo-HSCT)和自体HSCT(autologousHSCT,auto-HSCT)后都会出现严重的免疫缺陷,很大程度上是由于胸腺功能的降低甚至消失,由于两者在移植物来源、预处理方案以及移植物抗宿主病(graft-versus-hostdisease,GVHD)的预防方案上均不相同,移植后免疫重建理论上也应该存在差异。本研究拟通过观察allo-HSCT和auto-HSCT后患者外周血中淋巴细胞亚群的动态变化,比较两者的免疫重建规律,并通过检测T细胞受体重排删除环(Tcellreceptorrearrangementexcisioncircles,TREC)水平评估初始T细胞功能,从而探讨患者HSCT后促进细胞免疫重建的机制,为加速免疫重建提供新策略。
1资料与方法
1.1研究对象
2011年12月至2014年8月在北京大学第三医院血液科进行HSCT的恶性血液病患者31例,其中15例allo-HSCT,16例auto-HSCT,所有患者均接受粒细胞集落刺激因子(granulocytecolony-stimulatingfactor,G-CSF)动员后的外周造血干细胞,患者主要临床特征见表1。同时留取北京大学第三医院体检中心20名健康人外周血标本作为健康对照(healthycontrols,HC),均获得知情同意。
1.2样本采集
分别无菌抽取移植前和移植后1、3、6、9和12个月各组患者外周静脉血4mL,置于肝素抗凝管中,用于流式细胞术检测。
1.3淋巴细胞亚群检测
采用四色流式细胞术(FACSCalibur流式细胞仪为美国BD公司产品)检测外周血淋巴细胞亚群,所用单克隆抗体和绝对计数TruCount管均为美国BD公司产品。以淋巴细胞绝对数判断患者HSCT后淋巴细胞亚群重建是评估患者总体生存率和无进展生存率的正性独立预后因素[1]。采用以下抗体组合检测淋巴细胞亚群、T细胞亚群以及树突细胞(dendriticcell,DC):(1)T细胞:FITC-CD3/PE-CD8/PerCP-CD45/APC-CD4;(2)B细胞和自然杀伤细胞(naturalkillercell,NK):FITC-CD3/PE-CD16CD56/PerCP-CD45/APC-CD19;(3)活化性T细胞:FITC-CD3/PE-HLA-DR/PerCP-CD45/APC-CD25,以CD3+CD25+为中期活化性T细胞,以CD3+HLA-DR+为晚期活化T细胞;(4)初始T细胞和记忆性T细胞:FITC-CD45RA/PE-CD62L/PerCP-CD3/APC-CD8,以CD45RA+CD62Lhigh为初始T细胞,以CD45RA-CD62Lhigh为中枢记忆性T细胞,以CD45RA+CD62Llow为效应记忆性T细胞;(5)DC细胞:FITC-Lin1/PE-CD123/PerCP-HLA-DR/APC-CD11c,以CD11c+HLA-DR+Lin1-细胞为髓样DC(mDC),以CD123+CD11c-HLA-DR+Lin1-细胞为浆样DC(pDC)。以不同荧光标记的小鼠来源单克隆抗体为同型对照,将CD3+CD4+<400/μL、CD3+CD8+<200/μL、CD19+<100/μL、CD16+CD56+CD3-<100/μL定义为淋巴细胞减少。各取100μL抗凝静脉血放入样品测定管,加入相应荧光标记的单克隆抗体组合,振荡混匀后室温避光孵育20min,溶血、洗涤、上机检测,采用CellQuestPro软件分析数据。
1.4TREC水平检测
采用实时定量PCR检测环形TREC(signal-jointTREC,sjTREC)水平。应用WizardGenomicDNAPurificationKit(Promega公司产品)提取患者及健康对照组外周血单个核细胞(peripheralbloodmononuclearcell,PBMC)基因组DNA,紫外分光光度计检测DNA浓度。目的基因TREC引物及探针核苷酸序列如下:T1下游引物5′-CACATCCCTTTCAACCATGCT-3′;T2上游引物 5′-GCCAGCTGCAGGGTTTAGG-3′;探针T3 5′-6FAM-ACACCTCTGGTTTTTGTAAAGGTGCCCACT-TAMRA,内参基因ALB(albumin)引物和探针核苷酸序列如下:A1上游引物5′-GCTGTCATCTCTTGTGGGCTGT-3′,A2下游引物5′-ACTCATGGGAGCTGCTGGTTC-3′;探针A3 5′-6FAM-CCTGTCATGCCCACACAAATCTCTCC-TAMRA。采用基因合成法构建标准品(引物序列、标准品均由大连宝生物公司合成)。探针法定量PCR试剂盒为大连宝生物公司产品,总反应体积为25μL,在95 ℃预变性10min后,95 ℃ 30s和64 ℃ 1min,共45个循环。反应在ABI7500实时定量PCR仪(美国PE公司产品)中进行,采用ABI7500软件分析数据。根据检测样本中内参基因ALB的实测拷贝数来确定检测样本中所含的细胞数(每个细胞含2个ALB拷贝),计算公式:n=2×105×(TREC均值)/(ALB均值),结果以每105个PBMC中所含的TREC拷贝数表示,并根据CD3+T细胞的阳性率计算每105个CD3+细胞中的TREC含量。
1.5统计学分析
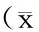
2结果
2.1患者的临床特征
如表1所示,allo-HSCT组受者年龄低于auto-HSCT组患者,差异有统计学意义(P<0.001),两组患者性别差异无统计学意义(P=0.27)。急性白血病和骨髓增生异常综合征患者多进行allo-HSCT,auto-HSCT常见于淋巴瘤和骨髓瘤患者。两组患者均接受经重组人G-CSF动员的外周血造血干细胞移植,其中allo-HSCT组3例患者同时输注1份脐血造血干细胞;allo-HSCT组同胞全相合供者6例,亲缘单倍体供者8例,无关供者1例。allo-HSCT组患者预处理按清髓性和非清髓性两种方案进行,单倍体相合移植采用非体外去除T细胞[加用兔抗人胸腺细胞球蛋白(rabbitanti-humanthymocyteglobulin,ATG)];auto-HSCT组预处理分为全身放射治疗(totalbodyirradiation,TBI)和不含全身放射治疗(no-totalbodyirradiation,NTBI)两种方案,TBI同时联合环磷酰胺、马法兰和依托泊苷,NTBI联合BEAM(BCNU,etoposide,aracytine,melphalan)方案或环磷酰胺、马法兰和依托泊苷方案。
两组患者移植后发生总体感染事件(包括病毒、细菌和真菌感染)差异有统计学意义(多出现于移植后3个月内),allo-HSCT组患者显著高于auto-HSCT组[8/15(allo-HSCT组)vs. 4/16(auto-HSCT组), P=0.04],细菌感染均以肺部感染常见,allo-HSCT组肺部感染发生率显著高于auto-HSCT组[5/15 vs. 2/16,P=0.02];两组均出现2例真菌感染,差异无统计学意义(P=0.99);allo-HSCT组患者发生巨细胞病毒感染常见(10/15),于移植后3个月内出现。移植后2个月内allo-HSCT组大部分患者发生急性GVHD(11/15),1例移植1年后出现慢性GVHD,均用甲泼尼龙治疗。allo-HSCT组2例患者由于GVHD导致多器官功能衰竭死亡,1例重症感染致呼吸衰竭死亡,1例疾病复发死亡;auto-HSCT组1例患者疾病复发死亡,1例死于其他疾病。移植后1年总生存率auto-HSCT组稍高于allo-HSCT组,差异无统计学意义[14/16 vs. 11/15,P=0.56]。
2.2移植后外周血淋巴细胞亚群的重建规律
移植后12个月内CD4+和CD8+T细胞重建在allo-HSCT和auto-HSCT两组间差异无统计学意义(P>0.05),CD4+T细胞绝对数持续减少,均显著低于健康对照组(P<0.01,图1A);CD8+T细胞比CD4+T细胞重建早得多,两组患者移植后3个月时均恢复至正常水平(P>0.05),差异无统计学意义(P>0.05,图1B)。移植后12个月内NK细胞重建在两组患者间差异无统计学意义(P>0.05),也在移植后3个月时恢复正常水平(P>0.05,图1C)。移植后前3个月内B细胞重建在两组患者间差异无统计学意义(P>0.05),均显著低于健康对照组(P<0.01);allo-HSCT组移植后1年内B细胞持续性减低,未恢复至正常水平,而auto-HSCT组于移植后第6个月时B细胞重建恢复,两组间差异有统计学意义(P<0.05,图1D)。
2.3移植后外周血T细胞亚群的重建规律
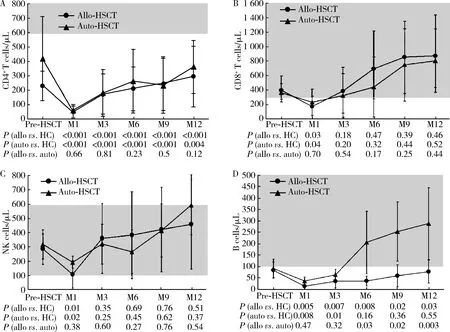
如图2所示,移植后12个月内allo-HSCT和auto-HSCT两组中期活化性T细胞数量显著低于健康对照组(P<0.05,图2A),两组患者晚期活化性T细胞数量显著高于健康对照组(P<0.05,图2B),两组间中期活化性T细胞数量差异无统计学意义(P>0.05),但晚期活化性T细胞数量从移植后第6个月起allo-HSCT组显著高于auto-HSCT组(P<0.05)。移植后12个月内两组患者CD4和CD8初始T细胞数量均显著低于健康对照组(P<0.01,图2C和2F),CD4初始T细胞重建从移植后第6个月起allo-HSCT组低于auto-HSCT组,差异有统计学意义(P<0.05),两组患者CD8初始T细胞重建差异无统计学意义(P>0.05)。移植后12个月内两组患者CD4效应记忆性T细胞数量均显著高于健康对照组(P<0.05,图2D),CD4中枢记忆性T细胞数量均处于正常水平(图2E),而CD8效应记忆性T细胞和中枢记忆性T细胞重建均从移植后第3个月起恢复至正常水平(图2G和2H),两组间除CD8中枢记忆性T细胞数量auto-HSCT组高于allo-HSCT组外(P<0.05),其他记忆性T细胞重建差异无统计学意义(P>0.05)。

表1 31例造血干细胞移植患者临床特征
Allo-HSCT,allogenichematopoieticstemcelltransplantation;auto-HSCT,autologoushematopoieticstemcelltransplantation;PSC,peripheralstemcells;UCB,umbilicalcordblood;TBI,totalbodyirradiation;mBuCy,modifiedbusulfancyclophosphamide;BuFlu,busulfanfludarabine;Ara-c,aracytine;CTX,cyclophosphamide;Flu,fludarabine;ATG,anti-thymocyteglobulin;BEAM,carmustine,etoposide,aracytineandmelphalan;CsA+MMF+MTX,cyclosporineA,mycopenolatemofetil,andmethotrexate;MP,methylprednisolone;aGVHD,graft-versus-hostdisease;CMV,cytomegalovirus.a,studentttest;b,Fisherexacttest.
Pre-HSCT was the point before transplantation. M1, M3, M6, M9 and M12 were from one month to 12 months, post-transplantation. Absolute numbers of T cells, NK cells and B cells of allo- and auto-HSCT patients from one month to 12 months post-transplantation were determined by flow cytometry using TruCount tubes. The 25% and 75% percentiles in heathy control correspond to the lower and to the upper limit of the gray area. The significance of the differences between the two groups of the patients (allo- and auto-HSCT patients) and between each group of patients and heathy controls are detailed in the figure or below the figure, respectively.图1 异基因造血干细胞移植(allo-HSCT )和自体造血干细胞移植(auto-HSCT )后外周血淋巴细胞亚群的重建特点比较Figure 1 Reconstitution of peripheral blood lymphocytes in allo- and auto-HSCT recipients
2.4移植后外周血DC的重建规律
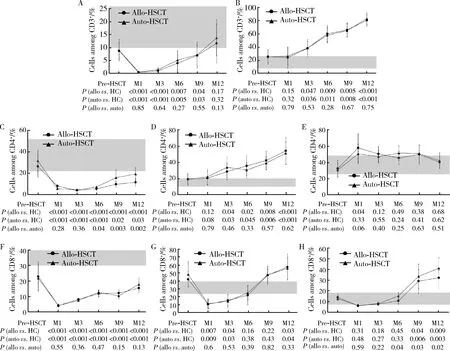
移植后12个月内髓样DC重建在allo-HSCT和auto-HSCT两组间差异无统计学意义(P>0.05),移植后早期显著低于健康对照组(P<0.01),从第3个月时起恢复至正常水平(图3A);移植后浆样DC重建要晚于髓样DC,两组间差异无统计学意义(P>0.05),显著低于健康对照组(P<0.01),直至1年左右逐渐恢复正常(图3B)。
2.5移植后外周血TREC水平的变化
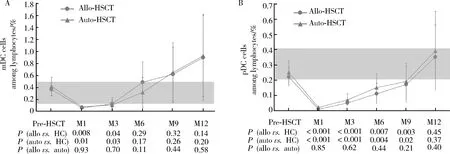
如图4所示,与年龄相近的健康对照相比,allo-HSCT和auto-HSCT组外周血PBMC的TREC水平在移植后各个时间点均显著下降,差异有统计学意义(P<0.001)。两组患者CD3+T细胞的TREC水平均显著低于健康对照组(P<0.01),虽然allo-HSCT组患者外周血CD3+细胞中的TREC水平稍高于auto-HSCT组,但差异无统计学意义(P>0.05)。
3讨论
HSCT后免疫重建严重迟缓,细胞免疫功能持续低下,导致感染和疾病复发,成为HSCT后主要死亡原因,移植后免疫重建已经成为研究热点。HSCT后免疫重建包括固有免疫重建和获得性免疫重建,参与固有免疫重建的NK细胞和DC迅速重建,但以T细胞亚群和功能性B细胞为主的获得性免疫重建是个漫长而分步进行的过程。异基因移植后免疫重建受异源性抗原驱使或细胞因子刺激导致T细胞克隆过度增殖,即使供受者人类白细胞抗原(humanleukocyteantigen,HLA)全相合也会发生GVHD,自体移植后的免疫重建反而完全不受异源性抗原和GVHD所影响。本研究中我们比较allo-HSCT和auto-HSCT后免疫重建的差异,发现两组患者移植后1年内外周血各免疫细胞重建速度和数量非常相似。从临床特征分析,患者年龄和疾病种类是选择移植方式的重要因素,allo-HSCT组患者年龄显著低于auto-HSCT组;预处理化疗中采用的药物有不同程度的毒性,如ATG和氟达拉滨为强效免疫抑制剂,具有较大的毒性,是影响移植后造血重建、免疫重建、感染以及发生GVHD的因素。本研究中allo-HSCT组患者移植后总体感染率高于auto-HSCT组,与预处理和发生GVHD密切相关,但是总体生存率两组间差异并无统计学意义。
A,middle activated T cells; B, late activated T cells; C, CD4 naïve T cells; D, CD4 effector memory T cells; E, CD4 central memory T cells; F, CD8 naïve T cells; G, CD8 effector memory T cells; H, CD8 central memory T cells. Flow cytometry analyses were performed on fresh blood from allo- and auto-HSCT patients from one month to 12 months post-transplantation. Other figure legend and the significance of the gray area as shown in Figure 1.图2 异基因造血干细胞移植(allo-HSCT )和自体造血干细胞移植(auto-HSCT )后外周血T细胞亚群的重建特点比较Figure 2 Reconstitution of peripheral blood T cell subsets after allo- and auto-HSCT
Flow cytometry analyses were performed on fresh blood from allo- and auto-HSCT patients from one month to 12 months post-transplantation.Other figure legend and the significance of the gray area as shown in Figure 1.图3 异基因造血干细胞移植(allo-HSCT )和自体造血干细胞移植(auto-HSCT)后树突细胞(DC)的重建特点比较Figure 3 Reconstitution of peripheral blood dendritic cells after allo- and auto-HSCT
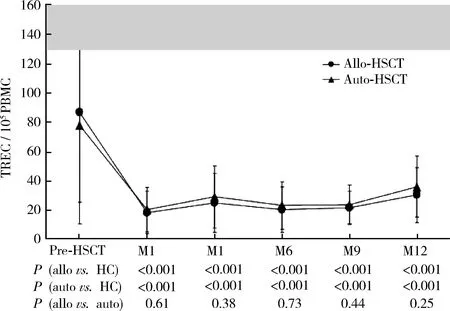
From the average TREC content, as measured per microgram DNA, TREC content per 105 cells was calculated considering that 1 g DNA corresponds to 150 000 cells. The TREC/105cells were corrected by the percentage of CD3+ cells found by flow cytometry yielding the number of TREC/105CD3. The median values are shown as dots (circles or triangles) and the ends of the whiskers correspond to the 25% and 75% percentile values.Other figure legend and the significance of the gray area as shown in Figure 1.图4 异基因造血干细胞移植(allo-HSCT )和自体造血干细胞移植(auto-HSCT )后外周血单个核细胞(PBMC)中T细胞受体重排删除环(TREC)水平的比较Figure 4 Quantification of TRECs from peripheral blood mononuclears after allo- and auto-HSCT
3.1T细胞及T细胞亚群重建
T细胞既是细胞免疫的重要效应细胞,又是体液免疫的调节细胞,移植物中主要的T细胞是记忆性和分化成熟的效应性T细胞,而未分化成熟的T细胞数量相对较少。移植后T细胞免疫重建主要有两条途径:(1)外周途径:移植物中T细胞在外周免疫器官内快速扩增,此种方式不依赖于胸腺功能;(2)胸腺依赖途径:T淋巴祖细胞迁徙至胸腺,在胸腺表皮细胞和DC等作用下,经过阳性和阴性选择,发育为初始T细胞,形成稳定持久的免疫重建。既往研究显示,成人auto-HSCT患者CD4+和CD8+T细胞重建早于allo-HSCT组患者[2],而儿童auto-HSCT患者CD4+T细胞重建要迟于allo-HSCT组[3],这是由于儿童的胸腺输出功能比成人更持久。本研究中CD4+和CD8+T细胞重建在两组间无差异,CD4+T细胞均持续性减少,CD8+T细胞很快恢复重建,与国内众多研究结果相似[4-5]。
HSCT后早期淋巴细胞减少,移植早期T细胞主要来自细胞因子依赖的外周血成熟T细胞体内扩增,这些成熟T细胞主要来自供者外周血干细胞中的T细胞和经过大剂量预处理后患者体内存留的成熟T细胞[6],主要是记忆性T细胞,与初始T细胞相比,其对外来抗原更易产生快速免疫应答。由于大部分allo-HSCT采用含ATG非体外T细胞去除的预处理方案,初始T细胞减少,因而以T细胞为基础的移植物抗白血病(graft-versus-leukemia,GVL)效应下降,GVHD发生率增加。HSCT后CD4+T细胞早期重建与效应记忆性T细胞恢复以及较少初始T细胞的外周稳态扩增有关,本研究中两组患者移植后初始T细胞持续性低下,效应记忆性T细胞表达高于健康对照,故CD4+T细胞重建严重迟缓,可见CD4+T细胞比CD8+T细胞重建更依赖于胸腺的功能。因为T细胞活化水平受感染、GVHD发生和T细胞库外周稳态扩增等因素影响[4],本研究对allo-HSCT和auto-HSCT两组活化T细胞的数量分析后发现,移植后中期活化T细胞重建无差异,移植后第6个月起allo-HSCT组晚期活化T细胞的数量显著高于auto-HSCT组,与文献报道一致[7-8]。
3.2NK、DC及B细胞重建
NK细胞是HSCT后最早恢复的淋巴细胞亚群[9],本研究两组患者移植后3个月时均恢复重建,且两组患者间差异无统计学意义,移植1年后生存率亦未见明显差异。有研究认为HSCT后早期NK细胞重建与疾病无进展生存率相关,HSCT后1个月时NK细胞数较高患者无进展生存率显著高于NK细胞减少患者[10]。与NK细胞不同,DC重建延迟[11],本研究结果显示两组间DC重建差异无统计学意义。既往研究表明pDC与GVHD发生密切相关,移植后浆样DC数目越高GVHD发生率越低[12-13],GVHD可能阻止了pDC的成熟[14]。本研究中allo-HSCT组发生GVHD的患者pDC低于未发生GVHD的患者,但由于病例数太少未做统计学分析。B细胞分化成熟需要CD4+T细胞的辅助,移植后B细胞数量恢复缓慢,其多态性表达与CD4依赖性抗体反应长期不能恢复有关。由于移植后缺乏CD4+T细胞,同时内环境缺陷,即使有供者CD4细胞,成熟B细胞的体细胞突变率也降低,导致B细胞功能下降。本研究中移植后第6个月起auto-HSCT组患者功能性B细胞数量恢复要快于allo-HSCT组患者,而且移植后发生GVHD的患者B细胞重建速度低于未发生GVHD的患者,可能是GVHD及其治疗措施阻碍B细胞重建的结果。
3.3初始T细胞功能
HSCT后T细胞重建主要依赖于供者源T细胞在受者胸腺内发育为初始T细胞,生成具有多样化T细胞受体的T细胞库,形成受者对多种抗原包括肿瘤抗原的免疫应答,所以移植后T细胞重建主要依赖于受者的胸腺功能。胸腺是T细胞发育的场所,T细胞发育时TCRα基因重排过程中删除其间的δ基因而形成一段环状DNA结构,即sjTREC,其含量代表了胸腺内新生的初始T细胞含量,可评价胸腺输出功能,了解机体T细胞增殖潜能[15-16]。TREC水平通常是以每105个外周血PMNC中或者每微升外周血中含量来表示,本研究发现allo-HSCT和auto-HSCT两组患者移植后1个月时外周血CD3+T细胞中的TREC拷贝数均明显下降,3个月时稍有上升,6个月时进一步下降,直至12个月时缓慢上升,提示移植早期胸腺功能尚未恢复,两组患者初始T细胞水平持续低下,移植后早期T细胞主要来自于移植物中成熟的记忆T细胞扩增,患者体内TREC水平持续较低,移植后100d急性GVHD发生率较高以及6个月时出现细菌、病毒和(或)真菌感染明显增加可能与患者胸腺输出功能初始T细胞的功能较差、细胞免疫功能较低有关,与文献报道一致[17]。由于胸腺近期输出功能随着年龄增加而逐渐降低[18],本研究结果发现虽然allo-HSCT组TREC水平高于auto-HSCT组,但无统计学意义,提示两者均存在严重的免疫缺陷。TREC的恢复速度还受GVHD和免疫抑制剂应用等影响,本研究中allo-HSCT组患者发生GVHD的外周血TREC水平低于未发生GVHD患者,但由于病例数太少未做统计学分析,这可能是GVHD损伤胸腺上皮细胞而导致胸腺功能低下,也可能是相关免疫激活使T细胞分化、增殖加速从而稀释TREC的结果,有待进一步积累病例数,结合影响T细胞免疫功能的相关因素分析,获得更可靠的研究结果。
综上所述,本研究中allo-HSCT和auto-HSCT两组患者早期免疫重建特点差异较小,allo-HSCT后免疫重建主要不是由异源性移植物或者是否发生GVHD决定,而可能是成人T细胞库的外周稳态扩增以及胸腺功能受损、免疫重建迟缓导致感染发生的结果,尚有待积累更多的病例数来验证。总之,应该掌握HSCT后免疫重建规律,寻找加速免疫重建的新策略,提前干预治疗,减少感染和疾病复发,从而进一步提高患者的生存率。
参考文献
[1]KimDH,KimJG,SohnSK,etal.Clinicalimpactofearlyabsolutelymphocytecountafterallogeneicstemcelltransplantation[J].BrJHaematol, 2004, 125(2): 217-224.
[2]RobertsMM,ToLB,GillisD,etal.Immunereconstitutionfollowingperipheralbloodstemcelltransplantation,autologousbonemarrowtransplantationandallogeneicbonemarrowtransplantation[J].BoneMarrowTransplant, 1993, 12 (5): 469-475.
[3]KalwakK,GorczynskaE,ToporskiJ,etal.Immunereconstitutionafterhaematopoieticcelltransplantationinchildren:immunophenotypeanalysiswithregardtofactorsaffectingthespeedofrecovery[J].BrJHaematol, 2002, 118 (1): 74-89.
[4]丁丽, 董磊, 郑晓丽, 等. 单倍体相合造血干细胞移植后早期T细胞数量及功能初步分析[J]. 中国实验血液学杂志, 2013, 21(3): 702-706.
[5]赵翔宇,赵晓甦,王亚哲, 等. 异基因造血干细胞移植后T辅助细胞亚群重建研究[J]. 中华血液学杂志, 2013, 34(9): 745-750.
[6]StorekJ,GeddesM,KhanF,etal.Reconstitutionoftheimmunesystemafterhematopoieticstemcelltransplantationinhumans[J].SeminImmunopathol, 2008, 30 (4): 425-437.
[7]NevenB,LeroyS,DecaluweH,etal.Long-termoutcomeafterhematopoieticstemcelltransplantationofasingle-centercohortof90patientswithseverecombinedimmunodeficiency[J].Blood, 2009, 113 (17): 4114-4124.
[8]BenedictePL,AnneH,MichelA,etal.EvolutionofperipheralbloodTlymphocytesubsetsafterallogenicorautologoushematopoieticstemcelltransplantation[J].Immunobiology, 2014, 219(8): 611-618.
[9]SavaniBN,RezvaniK,MielkeS,etal.FactorsassociatedwithearlymolecularremissionafterTcell-depletedallogeneicstemcelltransplantationforchronicmyelogenousleukemia[J].Blood, 2006, 107(4): 1688-1695.
[10]RueffJ,MedingerM,HeimD,etal.Lymphocytesubsetrecoveryandoutcomeafterautologoushematopoieticstemcelltransplantationforplasmacellmyeloma[J].BioBloodMarrowTransplant, 2014, 20(6): 881-903.
[11]LarosaF,MarmierC,RobinetE,etal.PeripheralT-cellexpansionandlowinfectionrateafterreduced-intensityconditioningandallogeneicbloodstemcelltransplantation[J].BloodMarrowTransplant, 2005, 35(9): 859-868.
[12]DuffnerUA,MaedaY,CookeKR,etal.Hostdendriticcellsalonearesufficienttoinitiateacutegraft-versus-hostdisease[J].JImmunol, 2004, 172(12): 7393-7398.
[13]LiH,DemetrisAJ,McNiffJ,etal.Profounddepletionofhostconventionaldendriticcells,plasmacytoiddendriticcells,andBcellsdoesnotpreventgraft-versus-hostdiseaseinduction[J].JImmunol, 2012, 188(8): 3804-3811.
[14]BanovicT,MarkeyKA,KunsRD,etal.Graft-versus-hostdi-seasepreventsthematurationofplasmacytoiddendriticcells[J].JImmunol, 2009, 182(2): 912-920.
[15]YeP,KirschnerDE.ReevaluationofTcellreceptorexcisioncirclesasameasureofhumanrecentthymicemigrants[J].JImmunol, 2002, 168(10): 4968-4979.
[16]RinghofferS,RojewskiM,DohnerH,etal.T-cellreconstitutionafterallogeneicstemcelltransplantation:assessmentbymeasurementofthesjTREC/βTRECratioandthymicnaïveTcells[J].Haematologica, 2013, 98(10): 1600-1608.
[17]DouekDC,VescioRA,BettsMR,etal.Assessmentofthymicoutputinadultsafterhaematopoieticstem-celltransplantationandpredictionofT-cellreconstitution[J].Lancet, 2000, 355(9218): 1875-1881.
[18]MitchellWA,MengI,NicholsonSA,etal.Thymicoutput,ageingandzinc[J].Biogerontology, 2006, 7(5-6): 461-470.
(2014-12-11收稿)
(本文编辑:赵波)
Early immune reconstitution after hematopoietic stem cell transplantation
ZHU Ming-xia, WAN Wen-li, LI Hai-shen, WANG Jing, WANG Yan-fang, HU Kai, KE Xiao-yan△
(DepartmentofHematology,PekingUniversityThirdHospital,Beijing100191,China)
ABSTRACTObjective:To search for differences in early immune reconstitution after allogenic or autologous hematopoietic stem cell transplantation (HSCT). Methods: The peripheral blood (PB) from 31 adult patients undergoing allogenic HSCT (allo-HSCT, 15 patients) or autologous HSCT (auto-HSCT, 16 patients) for the treatment of hematological malignancies and from 20 related healthy controls (HC) from December 2011 to August 2014 was used to analyze the kinetic recovery of lymphocyte subsets by means of flow cytometry during 12 months after HSCT. The T cell receptor rearrangement excision circle (TREC) levels among CD3+ T cells were measured in the patients and HC to evaluate the thymic-dependent T cell reconstitution. Results: The allo- and auto-HSCT recipients did not differ significantly in CD4+ T cells, CD8 naïve T cells, effecter memory T cells (TEM), CD4 central memory T cells (TCM), mid-activated T cells and dendritic cells (DC)during the follow-up (P>0.05). But they both differed significantly from HC (P<0.05). CD8+ T cells and NK cells reconstructed rapidly. There was no significant difference in the numbers of B cells between the allo- and auto-HSCT groups from M1 to M3 (P>0.05). B cells in both the groups were lower than those in HC (P<0.05). The recovery of B cells in auto-HSCT group was faster than in allo-HSCT group at M6 and M12 (P<0.05). The frequencies of CD4 naïve T cells and later activated T cells in allo-HSCT group were significantly higher than in auto-HSCT group at M6 and M12 (P<0.05). The frequencies of CD8 TCM in auto-HSCT group were significantly higher than in allo-HSCT group at M6 and M12 (P<0.05). The TREC levels were significantly lower than in both the groups compared with the age-matched HC during the follow-up (P<0.05). No significant difference was observed between allo-HSCT and auto-HSCT groups (P>0.05). Conclusion: The differences of the nature and the speed of lymphocyte reconstitution observed between the two patents groups were minor. This leads us to conclude that in allografted patients, immune recons-titution and subpopulations of peripheral blood lymphocytes are probably not related to the allogenicity of the graft, but due to the impaired thymus functions and slow differentiation of T lymphocytes in thymus.
KEY WORDSHematopoietic stem cell transplantation;Autologous transplantation; Allogenic transplantation; Lymphocyte subsets; Immune reconstitution
Corresponding author△’s e-mail, xykbysy@163.com
[中图分类号]R392.4
[文献标志码]A
[文章编号]1671-167X(2016)03-0515-08
doi:10.3969/j.issn.1671-167X.2016.03.024
网络出版时间:2016-5-278:25:36网络出版地址:http://www.cnki.net/kcms/detail/11.4691.R.20160527.0825.008.html
