596例HBsAg低值血清样本确诊试验的结果分析*
2016-06-15邓安彦蔡艳娟王东生汪光蓉张国元
邓安彦,蔡艳娟,王东生,王 强,汪光蓉,刘 敏,刘 萍,张国元△
(1.南充市中心医院输血科,四川南充 637000;2.川北医学院附属医院检验科,四川南充 637000;3.博奥赛斯天津生物科技有限公司,天津 300300)
596例HBsAg低值血清样本确诊试验的结果分析*
邓安彦1,蔡艳娟2,王东生2,王强2,汪光蓉2,刘敏1,刘萍3,张国元2△
(1.南充市中心医院输血科,四川南充 637000;2.川北医学院附属医院检验科,四川南充 637000;3.博奥赛斯天津生物科技有限公司,天津 300300)
[摘要]目的通过对HBsAg低值血清样本确诊试验的结果分析,为临床合理评价和解释HBsAg低值结果提供依据。方法对2014年川北医学院附属医院HBsAg阳性结果进行回顾性分析,收集化学发光法(CMIA)检测HBsAg结果为0.05~1.00 IU/mL的低值血清样本596份,采用雅培Architect HBsAg确诊试剂盒对其进行检测。结果HBsAg低值样本占HBsAg阳性样本的12.59%。雅培HBsAg确诊试验的总阳性率为72.15%,其中0.05~0.10、>0.10~0.20、>0.20~1.00 IU/mL的确诊阳性率分别为11.25%、88.35%、100.00%,各水平确诊阳性率比较差异有统计学意义(χ2=410.98,P<0.01)。CLIA方法检测HBsAg血清样本的“可疑区间”为0.08~0.14 IU/mL。在不同年龄阶段的HBsAg阳性样本中,<1岁年龄阶段人群在0.05~0.14 IU/mL的检出率最高,达90.60%(135/149)。结论CLIA方法检测HBsAg时存在一定的假阳性,尤其应注意小于1岁年龄阶段人群的HBsAg的低值结果的评价和解释。
[关键词]化学发光测定法;肝炎表面抗原,乙型;低值;确诊试验
乙型肝炎病毒表面抗原(hepatitis B surface antigen,HBsAg)是用来评价乙型肝炎病毒(HBV)感染与否的非常重要的血清标志物。通过对HBsAg的定量检测,了解HBsAg血清水平的变化情况,可用于评估HBV感染的治疗效果,及时调整用药方案[1-3]。目前,用于HBsAg定量检测的方法主要采用化学发光测定法(CMIA)[4-6],该法具有灵敏度高、精密度好的优点。其中非常具有代表性的检测系统为ABBOTT Architect i2000[7-11]。然而在HBsAg的检测过程中,常会出现一些低值结果,造成实验室工作人员和临床医生在评价和解释结果时出现“有或无”的困惑。为解决上述的困惑,作者对596份HBsAg低值血清样本进行了确诊试验,现将结果报道如下。
1资料与方法
1.1一般资料选择2013年3月至2014年9月川北医学院附属医院门诊和住院人群进行HBsAg检测阳性标本4 734份,其中结果为0.05~1.00 IU/mL的血清样本596份,其中男327份,女269份,平均年龄38岁。
1.2方法
1.2.1仪器与试剂Abbott Architect i2000全自动免疫分析仪及配套的HBsAg试剂盒(Lot:34391LF00,43417LF00)和HBsAg确诊试剂盒(Lot:27427LF00),美国雅培公司生产。
1.2.2检测方法对当天所有HBsAg定量检测结果为0.05~1.00 IU/mL的样本重复检测,当两次检测结果差异小于20%时,计算两次结果的平均值为HBsAg最终定量结果;若两次检测结果差异大于20%时,则再次进行HBsAg检测,HBsAg最终定量结果以最接近的两次结果的平均值为准。同时对当天所有HBsAg最终定量结果为0.05~1.00 IU/mL的血清样本进行HBsAg确诊试验。HBsAg初筛阳性和确诊试验阳性的判断标准严格参照试剂盒说明书:以HBsAg定量检测结果大于或等于0.05 IU/mL判断为HBsAg初筛阳性;HBsAg RLU2>1.00 S/CO,且HBsAg RLU2/HBsAg RLU1>2.00时判断为HBsAg确诊试验阳性。
1.3统计学处理采用SPSS13.0统计软件进行统计学分析,计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1HBsAg低值样本的分布特征HBsAg定量结果为0.05~1.00 IU/mL的血清样本数占HBsAg总阳性数的12.59%(596/4 734)。
2.2HBsAg不同低值水平的确诊阳性率比较运用HBsAg确诊试剂盒检测低值样本的总阳性率为72.15%(430/596),HBsAg 0.05~0.10、>0.10~0.20、>0.20~1.00 IU/mL的确诊阳性率分别为11.25%(18/160)、88.35%(182/206)、100.00%(230/230),3组比较差异有统计学意义(χ2=410.98,P<0.01)。
2.3HBsAg “可疑区间”的建立本试验中,HBsAg “可疑区间”定义为HBsAg定量结果确诊阳性率大于5.00%的下限值与确诊阳性率小于95.00%的上限值的区间。HBsAg的“可疑区间”为0.08~0.14 IU/mL,见表2。

表2 HBsAg不同低值水平的确诊阳性率比较
2.4不同年龄0.05~0.14 IU/mL的检出率和确诊阳性率比较不同年龄阶段人群的HBsAg阳性样本中,以小于1岁年龄阶段人群在0.05~0.14 IU/mL的检出率最高,达90.60%(135/149);确诊阳性率最低,为18.06%(13/72),见图1。
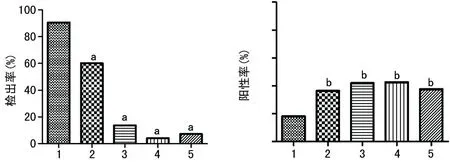
A:检出率;B:确诊阳性率;1:<1岁;2:1~10岁;3:>10~20岁;4:>20~50岁;5:>50岁;a:P<0.01,b:P<0.05,与小于1岁比较。
图1不同年龄0.05~0.14 IU/mL的检出率和确诊阳性率比较
3讨论
HBsAg定量检测由于具有高效的治疗效果预测价值而被广泛关注。目前,应用最为广泛的HBsAg定量检测平台为Abbott Architect检测系统[12-14]。而在临床检测过程中,实验室工作人员在运用该检测系统时经常会遇到一些HBsAg低值结果,针对该类结果的评价和解释方面给临床医生和实验室工作人员带来较大的困扰,尤其在HBsAg单独阳性,而其他乙肝血清学标志物为阴性的情况下。因此,为了能合理评价和解释HBsAg低值结果提供数据支持,作者进行了本次实验。
在本次实验中,按照雅培试剂盒说明书给定的HBsAg阳性判断标准为大于或等于0.05 IU/mL,同时ELISA和CMIA两种方法检测HBsAg结果不一致情况主要集中在0.05~1.00 IU/mL[15],因此本研究设定HBsAg检测结果在0.05~1.00 IU/mL的样本为低值样本。在对该区间的样本进行确认试验后发现,随着HBsAg定量结果的增高,其确诊阳性率也逐渐增高,表明HBsAg真阳性的概率与HBsAg定量结果呈正相关。对HBsAg定量结果进行回顾性分析发现HBsAg低值样本在HBsAg阳性样本中占有相当大的比例,根据在该低值区间不同水平确诊阳性的比例,这可能是由于低水平定量结果造成。同时,本研究为更好地对低值样本的临床意义作出合理的评价和解释,设定了“可疑区间”的概念。在假设检验中,以犯Ⅰ类错误小于5.00%的原则下对“可疑区间”进行定义,即HBsAg定量结果确诊阳性率大于5.00%的下限值与确诊阳性率小于95.00%的上限值之间。经对低值样本不同定量结果的确诊阳性率进行统计,表明采用Abbott Architect检测系统,HBsAg的“可疑区间”设定为0.08~0.14 IU/mL。在该区间内,临床医生或实验室工作人员应告知受检者该检测结果所代表的不确定性,应建议受检者注意随访或直接做HBsAg确诊试验。同时也应注意到,该“可疑区间”是在本实验室的工作条件下通过小样本获得,可能与真实的“可疑区间”有一定出入,不同实验室应根据自身条件进行设定或对该区间进行验证。在对不同年龄阶段人群的HBsAg阳性样本中,0.05~0.14 IU/mL的检出率进行比较,发现以小于1岁年龄阶段人群的检出率最高,怀疑可能有以下两方面的原因:(1)婴幼儿在采血过程中容易溶血,而溶血原因可能造成一定的非特异性的吸附,或本来由于吖啶酯是辣根过氧化物酶的作用底物,溶血释放亚铁血红素,因其具有过氧化物酶样作用,可能引起的非特异性吸附造成发光值本底的增高,引起弱阳性反应;(2)可能由于婴幼儿时期注射乙肝疫苗而造成检测结果的升高。因此,在对该年龄阶段人群HBsAg低值结果进行评价和解释时,应了解受检样本的状态、母亲相应检测结果及其他HBV标志物检测情况作出评估。
参考文献
[1]Martinot-Peignoux M,Asselah T,Marcellin P.HBsAg quantification to optimize treatment monitoring in chronic hepatitis B patients[J].Liver Int,2015,35(Suppl 1):S82-90.
[2]Ruan P,Xu SY,Zhou BP,et al.Hepatitis B surface antigen seroclearance in patients with chronic hepatitis B infection:a clinical study[J].J Int Med Res,2013,41(5):1732-1739.
[3]Demirören K,Kocamaz H,Dogan Y.The importance of the serum quantitative levels of hepatitis B surface antigen and hepatitis B e antigen in children with chronic hepatitis B[J].Turk J Gastroenterol,2015,26(1):36-41.
[4] Chung KH,Kim W,Kim BG,et al.Hepatitis B surface antigen quantification across different phases of chronic hepatitis B virus infection using an immunoradiometric assay[J].Gut Liver,2015,9(5):657-664.
[5] Liao CC,Hsu CW,Gu PW,et al.Comparison of the elecsys HBsAg Ⅱ assay and the architect assay for quantification of hepatitis B surface antigenin chronic hepatitis B patients[J].Biomed J,2015,38(3):250-256.
[6] Weng M,Zeng WZ,Wu XL,et al.Quantification of serum hepatitis B surface antigen in predicting the response of pegylated interferon alfa-2a in HBeAg-positive chronic hepatitis B with prior lamivudine exposure[J].Virol J,2013,10(14):277-279.
[7]Kuo YH,Chang KC,Wang JH,et al.Changing serum levels of quantitative hepatitis B surface antigen and hepatitis B virus DNA in hepatitis B virus surface antigen carriers:a follow-up study of an elderly cohort[J].Kaohsiung J Med Sci,2015,31(2):102-107.
[8]Gupta E,Pandey P,Kumar A,et al.Correlation between two chemiluminescence based assays for quantification of hepatitis B surface antigen in patients with chronic hepatitis B infection[J].Indian J Med Microbiol,2015,33(1):96-100.
[9]Liu WW,Wang AZ,Xie FY,et al.Comparison between Elecsys HBsAg Ⅱ and Architect assays for quantification of serum hepatitis B surface antigen in Chinese patients with chronic hepatitis B[J].Clin Lab,2015,61(1/2):141-147.
[10] Jaroszewicz J,Reiberger T,Meyer-Olson D,et al.Hepatitis B surface antigen concentrations in patients with HIV/HBV co-infection[J].PLoS One,2012,7(8):e43143.
[11] Zeng LY,Lian JS,Chen JY,et al.Hepatitis B surface antigen levels during natural history of chronic hepatitis B:a Chinese perspective study[J].World J Gastroenterol,2014,20(27):9178-9184.
[12]Cheng XD,Song LW,Fang LL,et al.Comparison of three luminescent immunoassays for hepatitis B virus surface antigen quantification during the natural history of chronic hepatitis B virus infection[J].Clin Vaccine Immunol,2014,21(11):1521-1527.
[13] Kim JH,Choi YJ,Moon HW,et al.HBsAg level and clinical course in patients with chronic hepatitis B treated with nucleoside analogue:five years of follow-up data[J].Clin Mol Hepatol,2013,19(4):409-416.
[14] Gheorghita VI,Caruntu FA,Curescu M,et al.Use of quantitative serum HBsAg for optimization of therapy in chronic hepatitis B patients treated with pegylated interferon alfa-2a:a Romanian cohort study[J].J Gastrointestin Liver Dis,2013,22(1):27-32.
[15]邓安彦,蔡艳娟,周守容,等.ELISA 法检测 HBsAg(CMIA)低值血清样本的结果分析[J].现代检验医学杂志,2015,30(2):123-125.
Analysis on confirmatory test results of 596 cases of HBsAg low value serum samples*
DengAnyan1,CaiYanjuan2,WangDongsheng2,WangQiang2,WangGuangrong2,LiuMin1,LiuPing3,ZhangGuoyuan2△
(1.DepartmentofBloodTransfusion,NanchongMunicipalCentralHospital,Nanchong,Sichuan637000,China;2.DepartmentofClinicalLaboratory,AffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong,Sichuan637000,China;3.Bioscience(Tianjin)BiotechnologyCo.,Ltd.,Tianjin300300,China)
[Abstract]ObjectiveTo analyze the confirmatory test results of low HBsAg value serum samples to provide the basis for clinical rational evaluation and explanation of low HBsAg value results.MethodsThe HBsAg positive results in the Affiliated Hospital of North Sichuan Medical College during 2014 were performed the retrospective analysis.596 serum samples with the HBsAg results of 0.05-1.00 IU/mL by the chemiluminiscence immunoassay(CLIA) were collected and then detected by the Abbott Architect HBsAg confirmatory kit.ResultsThe low HBsAg value samples accounted for 12.59% of HBsAg positive samples.The total positive rate of Abbott Architect HBsAg confirmatory test was 72.15%,in which the positive rates of 0.05-0.10 IU/mL,>0.10-0.20 IU/mL and >0.20-1.00 IU/mL were 11.25%,88.35% and 100.00%,respectively,the differences among different levels were statistically significant(χ2=410.98,P<0.01).The suspicious range of HBsAg detected by CLIA was 0.08-0.14 IU/mL.In different ages of the HBsAg positive samples,the detection rate of 0.05-0.14 IU/mL in the <1 year old group was highest and reached 90.60%(135/149).ConclusionCertain false positive exists in CLIA for detecting HBsAg,especially the evaluation and explanation of HBsAg low value results in the age group of <1 year old should be paid attention to.
[Key words]chemiluminescent assay;hepatitis B surface antigens;low value;confirmatory test
doi:·论著·10.3969/j.issn.1671-8348.2016.04.004
*基金项目:国际科技合作专项项目(2015DFA30420)。
作者简介:邓安彦(1972-),副主任技师,大学本科,主要从事临床免疫学检验与研究。△通讯作者,Tel:13508099826;E-mail:13508099826@163.com。
[中图分类号]R446.6
[文献标识码]A
[文章编号]1671-8348(2016)04-0442-03
(收稿日期:2015-07-08修回日期:2015-10-16)
