八肽胆囊收缩素对游离脂肪酸损伤胰岛β细胞氧化应激的影响*
2016-06-14魏立民章冬梅何学峰吕秀芹
魏立民,章冬梅,何学峰,吕秀芹,刘 娜
(河北省人民医院内分泌科,石家庄 050051)
论著·基础研究
八肽胆囊收缩素对游离脂肪酸损伤胰岛β细胞氧化应激的影响*
魏立民,章冬梅,何学峰,吕秀芹,刘娜
(河北省人民医院内分泌科,石家庄 050051)
[摘要]目的观察八肽胆囊收缩素(CCK-8)对游离脂肪酸(FFAs)损伤的小鼠胰岛β细胞(本文为NIT-1细胞株)氧化应激及细胞增殖的影响,探讨CCK-8对胰岛β细胞保护作用的机制。方法将培养良好的NIT-1细胞分为对照组、FFAs组(加入0.25 mmol/L油酸+0.25 mmol/L软脂酸)、CCK-8组(FFAs组基础上同时加入1×10-8mmol/L CCK-8),分别培养48 h 和72 h,观察细胞生长状态,MTT比色法检测细胞增殖能力,流式细胞仪检测细胞凋亡率,检测细胞培养上清液总抗氧化能力(T-AOC),谷胱甘肽还原酶(GSH-Px)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及丙二醛(MDA)活性。结果FFAs组显微镜下可见较多细胞碎片,CCK-8组细胞碎片明显减少;与FFAs组比较,48 h和72 h CCK-8组的光密度(OD)570值显著增高(均P<0.01),与CCK-8处理48 h比较,72 h组OD570值明显增高(P<0.01);与FFAs组比较, CCK-8组细胞上清液CAT、T-AOC、SOD及GSH-Px活性均明显增高,MDA含量降低,差异有统计学意义(P<0.05);72 h CCK-8组较48 h组CAT、SOD活性增加,MDA含量降低。结论CCK-8对FFAs损伤的胰岛β细胞具有一定的抗氧化应激作用,同时CCK-8能够显著刺激NIT-1细胞的增殖。
[关键词]胆囊收缩素;胰岛素分泌细胞;氧化性应激;细胞增殖;脂肪酸类,非酯化
糖尿病是严重影响人类健康的一种内分泌紊乱,其发病率在发展中国家增长迅速,并且在未来的20年仍将持续增加。以往的研究表明,血糖代谢紊乱时通常伴随着活性氧(reactive oxygen species,ROS)产生过量导致的氧化应激,这种应激表现为机体氧化和抗氧化系统间的失衡,在胰岛β细胞功能的衰退中起着重要的作用[1]。因此,通过抗氧化机制保护胰岛β细胞功能也是糖尿病治疗的策略之一。胆囊收缩素(cholecystokinin,CCK)是由小肠黏膜Ⅰ细胞释放的一种肽类激素,8肽胆囊收缩素(CCK-8)为其主要形式。以往的研究表明,CCK具有刺激胰岛素分泌、抑制胰岛β细胞凋亡等作用,具有对损伤后胰岛β细胞的保护作用,但还没有研究表明这种作用是否存在抗氧化应激机制。本研究旨在观察CCK-8对游离脂肪酸(FFAs)损伤的小鼠胰岛β细胞(本文为NIT-1细胞株)氧化应激及细胞增殖能力的影响。
1材料与方法
1.1材料NIT-1细胞为本实验室保存。油酸、软脂酸、CCK-8均购自美国Sigma公司。总抗氧化能力(T-AOC)、谷胱甘肽还原酶(GSH-Px)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及丙二醛(MDA)活性检测试剂盒购自南京建成生物工程公司。其余试剂均为分析纯。
1.2方法
1.2.1NIT-1细胞培养采用含10%胎牛血清的DMEM高糖培养基,将培养至对数生长期的NIT-1细胞用胰酶消化成单细胞悬液,以2×104的密度接种于96孔培养板中,换用含有5%胎牛血清的DMEM高糖培养基,于95%空气、5% CO2、37 ℃、饱和湿度条件下培养。
1.2.2分组将培养至贴壁良好的NIT-1细胞分为对照组、FFAs组(加入0.25 mmol/L油酸+0.25 mmol/L软脂酸)、CCK-8组(FFAs组基础上同时加入1×10-8mmol/L CCK-8)。37 ℃、5% CO2条件下分别培养48 h 和72 h,观察各组细胞生长状态,并留取上清液待测。
1.2.3MTT比色法检测细胞增殖能力处理好的细胞,每孔加5 mmol/L的MTT液20 μL稍摇匀后继续培养4 h,弃培养液,各孔加150 μL 二甲基亚砜,振荡器上振荡10 min,然后置于酶标仪中测570 nm波长的光密度(OD)值,结果以OD值表示。
1.2.4细胞凋亡率的测定消化贴壁细胞,离心、回收细胞,用Hank′s液洗1~2次,将细胞以70%乙醇4 ℃固定12 h以上。再用Hank′s液洗2次后,悬浮于0.5 mL Hank′s液中。加Rnase A(终浓度100 mg/L),37 ℃温育30 min。加入PI(终浓度50 mg/L),4 ℃避光染色45 min后,300目尼龙网过滤。上流式细胞仪分析细胞凋亡率。
1.2.5氧化应激指标的测定T-AOC、GSH-Px、CAT、SOD及MDA活性,均应用上清液标本进行检测,测定方法:T-AOC采用还原法;GSH-Px采用二硫代二硝基苯甲酸法;CAT采用分光光度法;SOD采用WST法;MDA采用硫代巴比妥酸比色法(TBA法)。试剂盒由专人按说明要求进行检测,T-AOC、GSH-Px、CAT、SOD酶活性及MDA测定试剂批内及批间变异系数分别为5.7%和7.0%、3.7%和9.3%、4.1%和7.9%、3.2%和3.7%。

2结果
2.1NIT-1细胞生长状态观察 对照组细胞生长状态良好,FFAs组细胞培养基内浑浊,显微镜下观察可见较多细胞碎片,CCK-8组培养基内细胞碎片明显减少。
2.2CCK-8对NIT-1胰岛β细胞增殖的影响MTT检测结果显示,与FFAs相比,48 h和72 h CCK-8组的OD570值显著增高(均P<0.01);CCK-8组处理48 h与72 h比较,OD570值明显增高(P<0.01)。见表1。
表1CCK-8对胰岛素β细胞增殖的影响
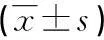

组别48hOD570值72hOD570值对照组0.42±0.050.52±0.06FFAs组0.21±0.030.25±0.04CCK-8组0.33±0.04a0.44±0.06ab
a:P<0.01,与对照组和FFAs组比较;b:P<0.01,与48 h比较。
2.3CCK-8对NIT-1胰岛β细胞凋亡的影响遗传物质DNA变化发现,在正常2倍体 DNA峰前均出现DNA 碎片峰,即凋亡峰。FFAs处理组的细胞凋亡率明显增加(均P<0.01);加入CCK-8的NIT-1细胞凋亡率较FFAs组明显降低 (P<0.01)。见表2。
2.4氧化应激及抗氧化应激指标与FFAs组比较,经CCK-8处理48 h及72 h后细胞上清液CAT、T-AOC、SOD及GSH-Px活性均明显增高,MDA含量降低,差异有统计学意义(P<0.05);72 h CCK-8组较48 h CAT、SOD活性增加,MDA含量明显降低,其余指标变化不明显。见表3。

表2 CCK-8对NLT-1胰岛素β细胞凋亡的影响
a:P<0.01,与对照组比较;b:P<0.01,与FFAs组比较。
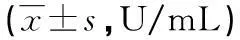
表3 CCK-8对氧化应激指标的影响

续表2 CCK-8对氧化应激指标的影响
aP<0.01,c:P<0.05,与FFAs组比较;b:P<0.01,d:P<0.05,与48 h比较。
3讨论
糖尿病是一种严重的内分泌代谢紊乱性疾病,其特点是慢性高血糖和糖脂代谢、蛋白质代谢异常,糖尿病发病的主要病理生理机制为胰岛素分泌不足和胰岛素抵抗。研究表明,氧化应激是引起2型糖尿病发生、发展的重要因素,而高血糖是产生氧化应激的主要原因[2]。氧化应激会造成机体组织细胞及蛋白和核酸等生物大分子损伤[1,3]。氧化应激的产生可直接损伤β细胞,特别是破坏细胞线粒体结构,促进β细胞凋亡;同时还可通过影响胰岛素信号转导通路间接抑制β细胞功能,如激活核转录因子κB(NF-κB) 信号通路,引起β细胞炎性反应;抑制胰十二指肠同源盒因子1 (PDX-1)的核质易位,抑制线粒体能量代谢,减少胰岛素合成与分泌[4]。SOD为机体主要的自由基清除酶之一,糖代谢异常导致内源性氧自由基清除剂SOD下降,同时SOD合成减少,氧自由基清除不足,反过来又进一步抑制SOD的活性。SOD活性下降引发脂质过氧化物在金属离子存在下催化裂解产生MDA,MDA对细胞有毒性作用,可与蛋白质分子内和分子间交联,诱发细胞凋亡[5]。氧化及抗氧化系统之间的失衡最终会导致胰岛β细胞的损伤及凋亡。此外,β细胞抗氧化防御酶如SOD、CAT等水平较低,对自由基导致的损伤非常敏感也是其容易受损的原因之一。因此,避免胰岛β细胞的氧化应激损伤记忆,增加胰岛素分泌可能是糖尿病治疗中一个重要的方面。FFAs在糖尿病及其并发症的发生、发展过程中起着重要的作用,其可导致糖代谢异常及胰岛素抵抗,FFAs还可以通过炎症、氧化应激等机制导致胰岛β细胞的损伤[6]。
本研究结果显示,CCK-8与胰岛β细胞共同孵育后可显著降低FFAs诱导的氧化应激因子MDA的水平,提高抗氧化应激防御酶SOD、CAT、T-AOC及GSH-Px的水平。本研究也第1次证实CCK-8对游离脂肪酸损伤的胰岛β细胞有一定的抗氧化应激作用。以往有研究报道,给予内毒素休克大鼠模型CCK-8干预,结果发现SOD水平在大鼠血中增加[7];另一项研究表明CCK-8 可呈剂量依赖性抑制过氧亚硝基阴离子诱导的色素上皮细胞的氧化应激,同时也显著减少了色素上皮细胞的凋亡[8]。郝丽娜等[9]应用腹腔注射链尿佐菌素制作大鼠糖尿病模型,并给予CCK-8治疗,结果显示CCK-8可明显减轻晶状体损伤,其机制可能与抑制iNOS基因表达、减少NO生成有关。这些研究均表明CCK-8具有一定的抗氧化作用。
CCK-8是一种典型的脑肠肽,为CCK的主要形式,具备天然 CCK 的全部生物学活性,通过细胞表面CCK受体在中枢、外周神经系统及消化系统发挥着多方面调节作用。有研究表明CCK-8具有刺激胰岛β细胞增殖,抑制胰岛细胞凋亡及增加胰岛素的作用[10-11]。与此结果类似,本研究也提示CCK-8能够刺激胰岛细胞的增殖,同时具有减少由FFAs诱导的细胞凋亡的作用。CCK-8是否通过抗氧化应激途径或其他机制刺激了胰岛细胞的增殖尚无结论。
总之,本研究结果表明,CCK-8对FFAs损伤的胰岛β细胞具有一定的抗氧化应激作用,同时CCK-8能够显著刺激NIT-1细胞的增殖,抑制由FFAs诱导的细胞凋亡的作用,本文结果对胰岛β细胞损伤的保护研究具有一定的帮助。
参考文献
[1]Ahangarpour A,Heidari H,Mard SA,et al.Progesterone and cilostazol protect mice pancreatic islets from oxidative stress induced by Hydrogen peroxide[J].Iran J Pharm Res,2014,13(3):937-944.
[2]Fardoun RZ.The use of vitamin E in type 2 diabetes mellitus[J].Clin Exp Hypertens,2007,29(3):135-148.
[3]Reddy VP,Zhu X,Perry G,et al.Oxidative stress in diabetes and Alzheimer′s disease[J].J Alzheimers Dis,2009,16(4):763-774.
[4]任春久,张瑶,崔为正,等.氧化应激在2型糖尿病发病机制中的作用研究进展[J].生理学报,2013,65(6):664-673.
[5]Stanton RC.Oxidative stress and diabetic kidney disease[J].Curr Diab Rep,2011,11(4):330-336.
[6]Watterson KR,Hudson BD,Ulven T,et al.Treatment of type 2 diabetes by free Fatty Acid receptor agonists[J].Front Endocrinol (Lausanne),2014,5(5):137.
[7]凌亦凌,黄善生,张君岚,等.胆囊收缩素对内毒素性休克大鼠SOD、MDA及吞噬细胞发光的影响[J].中国病理生理杂志,1997,13(5):33-36.
[8]Liu Y,Zhang Y,Gu Z,et al.Cholecystokinin octapeptide antagonizes apoptosis in human retinal pigment epithelial cells[J].Neural Regen Res,2014,9(14):1402-1408.
[9]郝丽娜,王秋红,凌亦凌,等.八肽胆囊收缩素对大鼠糖尿病性白内障的影响[J].基础医学与临床,2005,25(7):648-652.
[10]Gj D.Cholecystokinin[J].Curr Opin Endocrinol Diabetes Obes,2012,19(1):8-12.
[11]魏立民,李海英,朱铁年,等.八肽胆囊收缩素对游离脂肪酸损伤的胰岛β细胞的保护作用[J].中国临床康复,2006,10(8):49-51.
《重庆医学》开通微信公众平台
《重庆医学》已开通微信公众平台(微信号:ChongqingMedicine),《重庆医学》将以微信平台渠道向广大读作者发送终审会动态报道、各期杂志目录、主编推荐文章、学术会议、《重庆医学》最新资讯等消息。欢迎广大读作者免费订阅。读作者可以点击手机微信右上角的“+”,在“添加朋友”中输入微信号“Chongqing Medicine”,或在“添加朋友”中的“查找公众号”一栏输入“重庆医学”,添加关注。
The influence of cholecystokinin-octopeptide on oxidative stess in islet beta cells injured by free fat acids*
WeiLimin,ZhangDongmei,HeXuefeng,LvXiuqin,LiuNa
(DepartmentofEndocrinology,GeneralHospitalofHebeiProvince,Shijiazhuang,Hebei050051,China)
[Abstract]ObjectiveTo observe the effect of cholecystokinin-octopeptide(CCK-8) on oxidative stress and cell proliferation in mice islet β cells (NIT-1 cells) injured by high concentration free fat acids.MethodsIn vitro cultured NIT-1 cells were divided into 3 groups,they were control group,FFAs group (add 0.25 mmol/mL of oleinic acid+0.25 mmol/mL of palmic acid) and CCK-8 group (add FFAs and 1×10-8mmol/L of CCK-8 simultaneously).Cell morphologies were observed;NIT-1 cells proliferations were detected by MTT method,and apoptosis rates were measured by flow cytometry;The levels of T-AOC,GSH-Px,CAT,SOD and MDA in supernatant were also measured.ResultsThere were less cell debris in CCK-8 group than FFAs group(all P<0.01);the OD570value of CCK-8 group was significant higher than FFAs group(P<0.01),and the 72 h CCK-8 group was higher than 48 h CCK-8 group(P<0.01).Compared with FFAs group,the levels of CAT,T-AOC,SOD and GSH-Px in CCK-8 group were increased and the concentration of MDA was decreased obviously(P<0.05),the levels of CAT,SOD in 72 h CCK-8 group were higher than 48 h CCK-8 group,MDA was lower than 48 h CCK-8 group(P<0.05).ConclusionCCK-8 could protect islet β cells injury from FFAs through anti-oxidative stress mechanism and promote NIT-1 cells proliferation.
[Key words]cholecystokinin;insulin-secreting cells;oxidative ctress;cell proliferation;fatty Acids,nonesterified
doi:10.3969/j.issn.1671-8348.2016.01.011
基金项目:河北省科技厅科技支撑计划项目(12276104D-86)。
作者简介:魏立民(1967-),主任医师,博士,主要从事胰岛细胞的损伤与保护研究。
[中图分类号]R589.1
[文献标识码]A
[文章编号]1671-8348(2016)01-0030-03
(收稿日期:2015-06-12修回日期:2015-09-18)
