新孢子虫二温式PCR检测方法的建立及应用
2016-05-10陈千林王振宝宋迎春刘梦丽许正茂巴音查汗
陈千林,王振宝,宋迎春,刘梦丽,许正茂,巴音查汗*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.伊犁出入境检验检疫局综合技术服务中心,新疆伊宁 835000;3.巴音郭楞蒙古自治州动物疾病控制与诊断中心,新疆库尔勒 841000)
新孢子虫二温式PCR检测方法的建立及应用
陈千林1,王振宝2,宋迎春3,刘梦丽1,许正茂1,巴音查汗1*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.伊犁出入境检验检疫局综合技术服务中心,新疆伊宁 835000;3.巴音郭楞蒙古自治州动物疾病控制与诊断中心,新疆库尔勒 841000)
摘要:根据新孢子虫Nc2基因保守区设计特异性引物,应用均匀设计法优化反应中Taq DNA聚合酶、引物浓度和退火温度等,建立新孢子虫二温式PCR检测方法。结果显示,扩增条带与预期目的片段大小(266 bp)相符,未扩增出弓形虫等虫种的阳性DNA片段;扩增片段经克隆、测序发现与引物基因序列的同源性为100%;最低检出量为32.5 fg/μL,是三步法PCR的10(-1)倍,但循环时间缩短了38 min;重复3次对10(-4)、10(-5)、10(-6)和10(-7)稀释的阳性质粒进行二温扩增,10(-7)稀释均未出现扩增条带。同时对156份牛全血DNA进行检测,检出率为10.90%(17/156),与《新孢子虫病检疫技术规范》(SN/T 3499—2013)的检出符合率为83.33%(30/36),二者检测结果差异性不显著(P>0.05)。由此可见,建立的二温式PCR检测方法可用于临床诊断和日常监测新孢子虫,为监控“带虫宿主”提供技术支撑。
关键词:新孢子虫;Nc2基因;二温式PCR
新孢子虫病(Neosporiasis)是由犬新孢子虫(Neosporacaninum)寄生于多种哺乳动物有核细胞内的一种原虫病。该病可导致妊娠母畜发生流产、死胎等,新生仔畜发生运动障碍和神经系统疾病等,牛对该病尤为敏感[1]。犬是新孢子虫的终末宿主兼中间宿主,牛、羊、马、猪等多种家畜均可作为其中间宿主。宿主通过吞食被孢子化卵囊或速殖子污染的水或饲草而发生水平感染;胎儿及仔畜可通过胎盘发生垂直感染[2]。感染后主要寄生于脑、脊髓、神经和内脏等组织中[3]。据报道,该病在牛类动物中的感染率为10%~40%,最高可达82%[4-5];我国新疆、青海、北京、吉林等地也有报道[6-7]。由其导致的繁殖障碍性疾病给畜牧业生产造成了巨大的经济损失。鉴于目前还没有可用于防治新孢子虫病的有效疫苗和特效药物,准确的检测、监控技术是综合防治该病的关键。
与三步法PCR检测相比,二温式PCR将退火、延伸合并成一个温度,在提高退火温度的同时增强了反应的特异性[8]。Nc2基因是新孢子虫重要的表面抗原(SRS2)基因,被认为是诊断犬新孢子虫的特异性基因之一[9]。本试验在Nc2基因保守区设计特异性引物,通过优化各反应条件,建立了一种特异、灵敏、快捷的二温式PCR检测方法。检测结果与《新孢子虫病检疫技术规范》(SN/T 3499—2013)的检出符合率为83.33%(30/36)。本研究建立的二温式PCR检测方法可用于新孢子虫病的临床诊断和流行病学监测。
1材料与方法
1.1材料
1.1.1试验样品血样采集于巴州地区某4县1市的156份牛全血;弓形虫、牛环形泰勒、牛巴贝斯和牛双芽巴贝斯等阳性DNA,由新疆农业大学寄生虫实验室保存。
1.1.2试验试剂DNeasy Blood/Tissue,德国QIAGEN公司产品;Premix ExTaq、DNA Marker DL 2 000、Plasmid Purification Kit等,宝生物工程(大连)有限公司产品;pEASY-Blunt Zero Cloning Kit,北京Trans公司产品;SanPrep柱式DNA胶回收试剂盒,上海生工生物工程技术服务有限公司产品。
1.1.3主要仪器ProFlexTMBase梯度PCR仪,美国Applied Biosystems公司产品;Qsep 100全自动单通道毛细管电泳分析仪,中国台湾Bioptic Inc公司产品;JY 1600C电泳仪,北京君意东方电泳设备有限公司产品;G: BOX EF(MOT)全自动凝胶成像分析仪,英国SYNGENE公司产品。
1.2方法
1.2.1模板DNA制备严格按照QIAGEN DNA提取试剂盒提取血样DNA,并使用NANO DROP 2 000测得DNA含量,置-20 ℃保存待检。
1.2.2引物和PCR扩增运用Primer Premier 5.0和Oligo 6.24软件,根据GenBank中犬新孢子虫Nc2基因序列(登录号:JQ410454.1)保守区设计扩增长度适用于二温式PCR检测的诊断引物Nc2 F和Nc2 R。Nc2 F序列为:5′-CAGGGTAATGCGGATCAGT-3′,Nc2 R序列为:5′ -GCTGGGTAGTGCTCGTC-3′;57℃退火,扩增266 bp序列。《新孢子虫病检疫技术规范》(SN/T 3499—2013)中引物NCF序列为:5′-GGGTGAACCGAGGGAAT-3′,NCR序列为:5′-TCGCCAGTCAACCTACG-3′;58 ℃退火,扩增231 bp序列。委托北京鼎国昌盛生物技术有限责任公司合成。同时用2对引物共同对全血DNA进行扩增,PCR产物经15 g/L琼脂糖凝胶电泳鉴定。
1.2.3阳性DNA克隆、测序回收、纯化阳性产物连入pEASY-Blunt Zero Clong Vector,再转入大肠埃希菌Trans 1-T1感受态细胞中,经Amp+/LB培养基扩大培养后运用Plasmid Purification Kit提取菌体质粒,并对质粒进行PCR鉴定。将鉴定为阳性的重组质粒和克隆菌送至北京鼎国昌盛生物技术有限责任公司测序,对测序结果列进行同源性比对。
1.2.4优化二温法反应体系及循环条件均匀设计法对25 μL反应体系的TaqDNA聚合酶、引物浓度和退火温度等进行优化。TaqDNA聚合酶(5 U/μL)选择0.08 μL~0.16 μL,以0.02 μL为一个梯度;引物(10 pmol/L)选择0.5 μL~1.5 μL,以0.5 μL为一个梯度;退火温度参照引物合成的建议温度,拟设计退火-延伸温度为56℃~72℃,以1℃为一个温度梯度筛选最佳退火温度。
1.2.5特异性试验应用优化的二温反应条件分别扩增新孢子虫、弓形虫、牛环形泰勒虫、牛巴贝斯虫和牛双芽巴贝斯虫阳性DNA,以评价其特异性。
1.2.6灵敏性试验对阳性质粒(浓度为32.5 ng/μL)进行10倍梯度稀释至10-8,并对每个滴度模板进行二温PCR扩增,验证其灵敏性。
1.2.7重复性试验分别对滴度为10-4(3.25 pg/μL)、10-5(325 fg/μL)、10-6(32.5 fg/μL)和10-7(3.25 fg/μL)的稀释质粒重复进行3次二温扩增,以检测其重复性。
1.2.8样品检测应用建立的二温式PCR检测方法和《新孢子虫病检疫技术规范》(SN/T 3499—2013)共同对156份牛全血DNA进行检测,比较2种方法检出符合率,了解当地牛群新孢子虫病流行情况,并运用SPASS软件对两种检测方法进行差异性分析。
2结果
2.1PCR扩增结果
2对引物三步法PCR反应体系为25 μL:10 × PCR buffer(Mg2+plus)2.5 μL,dNTP(2.5 mmol/L)2 μL,上、下游引物(10 pmol/L)各1 μL,TaqDNA聚合酶(5 U/μL)0.1 μL,模板DNA 1 μL。Nc2 F/R循环温度为:94℃预变性5 min;94℃ 30 s,57℃ 30 s,72℃ 30 s,35次循环;72℃ 5 min。SN/T 3499—2013 NC F/R循环温度为:95 ℃预变性5 min;95 ℃ 30 s,58 ℃ 20 s,72 ℃ 30 s,30次循环;72℃ 10 min。取6 μL产物经100 V电泳40 min,分别在266 bp和231 bp处出现扩增条带,均与预期目的片段大小相符(图1)。

M.DNA 标准DL 2 000;1~2.两对引物的阳性检测;3~4.阴性对照
M.DNA Marker DL 2 000;1-2.Positive test of two pairs of primers;3-4.Negative control
图1PCR扩增结果
Fig.1PCR amplification results
2.2PCR产物的克隆、测序结果
阳性质粒经PCR鉴定,获得266 bp的扩增条带,与预期目的条带相符。测序结果与引物所在基因序列(登录号:JQ410454.1)的同源性为100 %(图2)。
2.3二温法反应体系及循环条件的优化结果
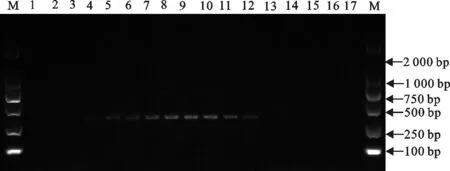
均匀设计法优化的25 μL二温反应体系为:10×PCR buffer(Mg2+plus)2.5 μL,dNTP(2.5 mmol/L)2 μL,上下游引物(10 pmol/L)1.5 μL,TaqDNA聚合酶(5 U/μL)0.16 μL,模板DNA 1 μL。循环条件为:94℃预变性3 min;94℃ 15 s,64℃退火-延伸30 s,30次循环;72℃5 min。总循环时间为43 min,较三步法节约38 min。取4 μL产物电泳发现泳道9扩增条带最亮,因此将64 ℃作为最佳退火-延伸温度(图3)。
2.4特异性试验结果
毛细管电泳仪选择的DNA标准为0~1 000 bp,只有当扩增片段吸收峰高于Lower Marker激光频射(RFU)方可判定为有效扩增,且产物量与RFU值呈正相关。图4中仅出现与目的片段大小相符的单一吸收峰,说明该引物的特异性非常好。同时对新孢子虫、弓形虫、牛环形泰勒虫、牛巴贝斯
虫和牛双芽巴贝斯虫阳性DNA进行二温扩增,仅有新孢子虫阳性DNA出现266 bp的扩增条带,可见二温法的特异性较好(图5)。
2.5灵敏性试验结果
二温法扩增稀释至10-7的阳性质粒时未出现扩增条带,即最低检出量为32.5 fg/μL,有效检出量是三步法的10-1倍,说明其灵敏性较好(图6)。
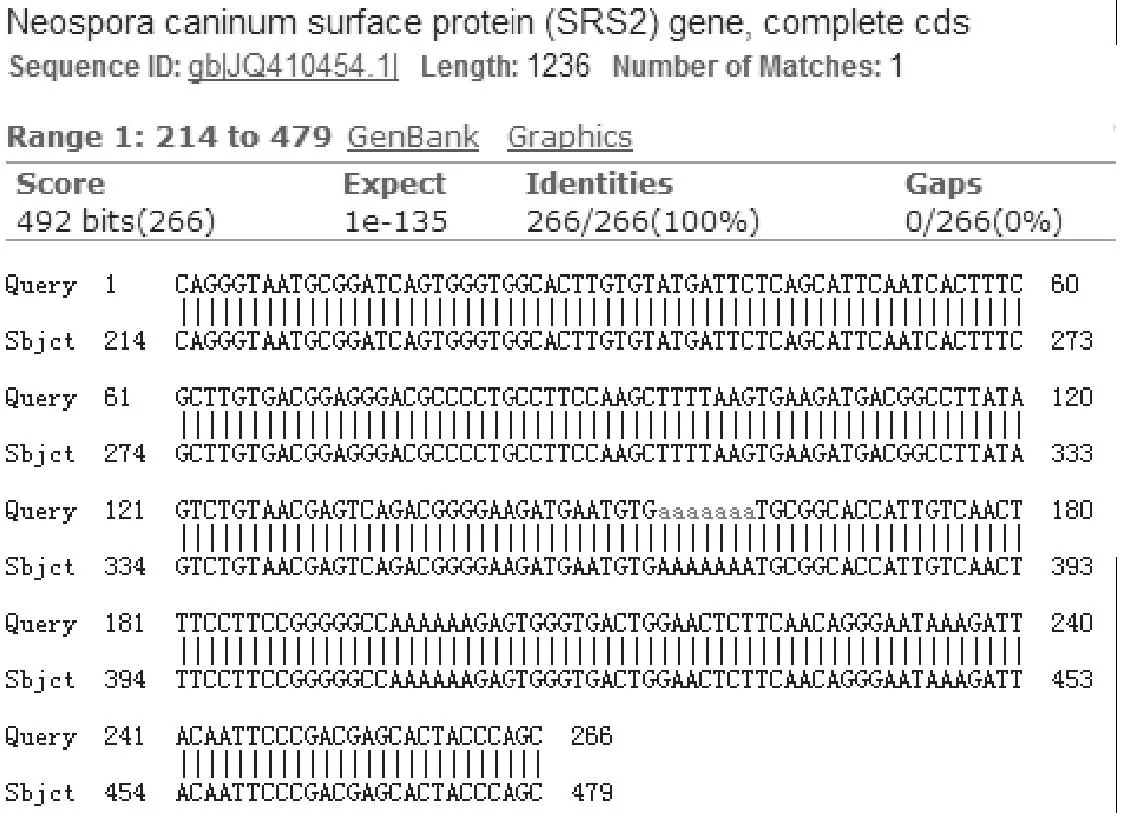
图2 PCR扩增产物序列比对
M.DNA 标准DL 2 000;1~17.退火-延伸温度为56 ℃~72 ℃
M.DNA Marker DL 2 000;1-17.The annealing-extension temperatures were 56 ℃-72 ℃
图3筛选最佳退火-延伸温度
Fig.3Screening optimal annealing-extension temperature

图4 Nc2 F/R 引物二温式PCR产物在266 bp处的特异性条带
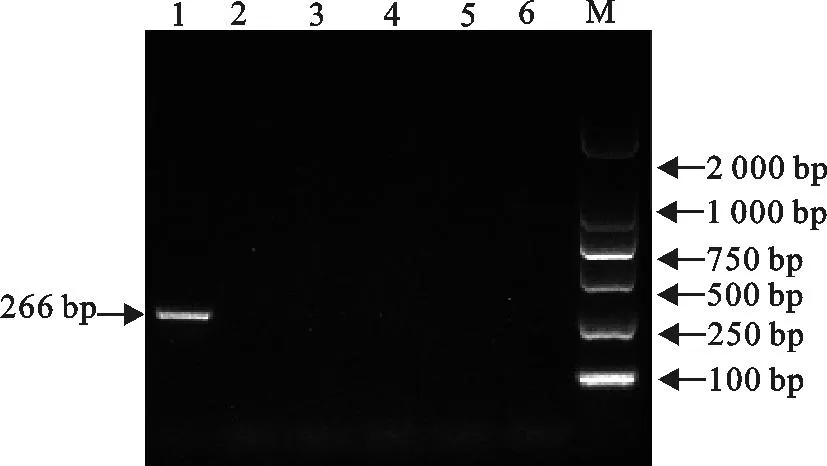
M.DNA 标准DL 2 000;1.新孢子虫阳性;2.弓形虫阳性;3.牛环形泰勒虫阳性;4.牛巴贝斯虫阳性;5.牛双芽巴贝斯虫阳性;6.阴性对照
M.DNA Marker DL 2 000;1.N.caninumpositive;2.T.gondiipositive;3.T.annulatapositive;4.B.bovispositive;5.B.bigeminapositive;6.Negative control
图5特异性试验结果
Fig.5Specificity test results
2.6重复性试验结果
二温式PCR分别重复扩增稀释度为10-4、10-5、10-6、10-7的阳性质粒发现,10-4、10-5和10-6时呈渐暗的扩增条带,10-7无扩增条带,与原结果一致,说明该方法的重复性较好(图7)。
2.7临床检测结果
2对引物共同对巴州部分地区牛全血DNA进行检测,二者同时检出15份阳性样品,检出符合率为83.33%(30/36)(表1)。重复对差异性样品进行扩增,仍未出现共同阳性样品。两检测方法检出结果差异不显著(P>0.05),说明建立的二温式PCR检测方法具有较好的扩增特性。

M.DNA 标准DL 2 000;1~8.三步法检测;9~16.二温法检测;浓度分别为3.25 ng/μL、325 pg/μL、32.5 pg/μL、3.25 pg/μL、325 fg/μL、32.5 fg/μL、3.25 fg/μL、0.325 fg/μL
M.DNA Marker DL 2 000;1-8.The three-step detection;9-16.The two-temperature detection,the concentrations were 3.25 ng/μL,325 pg/μL,32.5 pg/μL,3.25 pg/μL,325 fg/μL,32.5 fg/μL,3.25 fg/μL,0.325 fg/μL,respectively
图6灵敏性试验结果
Fig.6The results of the sensitivity test

M.DNA 标准DL 2 000;1~12.对10-4(3.25 pg/μL)、10-5(325 fg/μL)、10-6(32.5 fg/μL)、10-7(3.25 fg/μL)稀释的3次重复扩增
M.DNA Marker DL 2 000;1-12.The amplification of 10-4(3.25 pg/μL),10-5(325 fg/μL),10-6(32.5 fg/μL),10-7(3.25 fg/μL) with 3 repeats
图7重复性试验结果
Fig.7The results of the repeatability test
3讨论
新孢子虫病作为多种家畜共患的繁殖障碍性寄生虫病,给畜牧生产造成了巨大的损失。目前还没有可用于防治的特效疫苗和有效药物,准确、快速的检测方法结合严格的隔离、淘汰措施对于该病的防控至关重要[10]。三步法PCR中退火温度上升至延伸温度约需4 s,在此程中即可合成长约240 bp~500 bp的片段。因此在扩增100 bp~500 bp的片段序列时可直接省去延伸步骤而直接使用二温式PCR方法,一般将退火-延伸温度较三步法退火温度提高5℃~10℃,以保证反应的特异性[11]。
新孢子虫Nc2和Nc5基因同被认为是诊断犬新孢子虫的特异性基因。《新孢子虫病检疫技术规范》(SN/T 3499—2013)以Nc5基因设计引物,为与之相区别,本试验根据Nc2基因设计引物,成功扩增出266 bp片段,与引物所在基因100%相似。经灵敏性和重复性试验验证,最终建立了新孢子虫病二温式PCR检测方法。该方法最低检出量为32.5 fg/μL,是三步法PCR的10-1倍,但反应时间缩短了38 min。
同时应用不同基因引物进行检测可有效地降低漏检率。应用二温式PCR方法和《新孢子虫病检疫技术规范》(SN/T 3499—2013)共同对156份牛全血DNA进行检测,检出率分别为10.90%(17/156)和12.18%(19/156),检出符合率为83.33%(30/36),与闫双等[12]报道的新疆地区牛新孢子虫阳性率为13.14%(212/1 613)相当,高于史茜等[13]报道的新疆某4个规模化养牛场阳性率为6.49%(10/154),其差异是由于闫双等试验样品和本试验采集样品的范围广,更具地方代表性,史茜等结果更能具体代表当地某牛场的感染率。
由此可见,本研究建立的新孢子虫二温式PCR检测方法特异、灵敏、快捷,可用于新孢子虫病的临床检测和流行病学监控。
参考文献:
[1]Dubey J P,Carpenter J L,Speer C A,et al.Newly recognized falal protozoan disease of dogs[J].J Am Vet Med Assoc,1988,192(9):1269-1285.
[2]Dubey J P.Neosporosis in cattle:biology and economic impact[J].J Am Vet Med Assoc,1999,214(6):1160-1163.
[3]Gondim L F,Mcallister M M,Pitt W C,et al.Coyotes (Canislatrans) are definitive hosts ofNeosporacaninum[J].Int J Parasitol,2004,34(2):159-161.
[4]Jenkins M,Baszler T,Bjorkman C,et al.Diagnosis and seroepidemiology ofNeosporacaninumassociated bovine abortion[J].Int J Parasitol,2002,32(2):631-636.
[5]Gerard C,David K,Todd F,et al.Neosporacaninumserostatus and cling of Holstein cattle[J].Javima,2002,221(9):1165-1168.
[6]刘群,李博,齐长明,等.奶牛新孢子虫病血清学检测初报[J].中国兽医杂志,2003,39(2):8-9.
[7]Chahan B,Gaturaga I,Huang X H,et al.Serodiagnosis ofNeosporacaninuminfection in cattle by enzyme-linked immunosorbent assay with recombinant truncated NcSAG1[J].Vet Parasitol,2003,118:177-185.
[8]王振宝,刘启生,哈森,等.牛环形泰勒虫病二温式PCR诊断方法的建立及初步应用[J].动物医学进展,2012,33(5):59-63.
[9]Nishikawa Y,Tragoolpua K,Makala L,et al.NeosporacaninumNcSRS2 is transmenbrane protein that contains a glycosylphosphatidylinositol anchor insect cells[J].Vet Parasitol,2002,109:191-201.
[10]闫双,陈千林,郭庆勇,等.用重组抗原与商品化试剂盒对比检测牦牛的新孢子虫与弓形虫感染[J].中国动物传染病学报,2013,21(1):71-74.
[11]季新成,王文,牛国辉,等.牛新孢子虫二温式PCR检测方法的建立及应用[J].动物医学进展,2011,32(8):17-20.
[12]闫双,陈亮,巴音查汗.牛新孢子虫病在新疆流行情况调查[J].黑龙江畜牧兽医,2012(10):98-100.
[13]史茜,唐慧芬,牛国辉,等.牛新孢子虫基因芯片检测方法的建立[J].中国预防兽医学报,2014,36(9):715-719.
Establishment and Application of Two-temperature PCR for DetectingNeosporacaninum
CHEN Qian-lin1,WANG Zhen-bao2,SONG Ying-chun3,LIU Meng-li1,XU Zheng-mao1,CHAHAN Ba-yin1
(1.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China;2.SynthesisTechniqueServiceCenterofYiliEntry-ExitInspectionandQuarantineBureau,Yining,Xinjiang,835000,China;3.AnimalDiseaseControlandDiagnosisCenterofBayinguolengMongoliaAutonomousPrefecture,Korla,Xinjiang,841000,China)
Abstract:According to the conserved sequence of Neospora caninum Nc2 gene,the specific primers were designed,the reaction conditions of Taq DNA polymerase,primer concentration and annealing temperature were optimized by using the uniform design method.The results showed that the amplified fragment was same with the expected length(266 bp);It can't amplify the positive DNA fragments of Toxoplasma gondii et.The cloning and sequencing results revealed that the sequence of the amplified fragment had 100% similarity to the target gene,and the minimum detection quantity was 32.5 fg/μL, which is 10(-1) times of three-step PCR method and the circulation time shortens about 38 minutes;There was no amplified band of 10(-7) diluted positive plasmids while 10(-4),10(-5),10(-6) and 10(-7)samples showed positive results after 3 repeats.156 bovine blood samples were detected and the positive rate was 10.90%(17/156) which had 83.33%(30/36) coincidence rate with "Technical specification of Neospora caninums quarantine"(SN/T 3499—2013).This study demonstrated that the two temperature PCR method could be used in clinical diagnosis and daily monitoring of Neospora caninum,and provide the technical support for monitoring reservoir host.
Key words:Neospora caninum;Nc2 gene;two-temperature PCR
文章编号:1007-5038(2016)04-0030-05
中图分类号:S852.723
文献标识码:A
作者简介:陈千林(1991-),男,新疆库尔勒人,硕士研究生,主要从事预防兽医学研究。*通讯作者
基金项目:新疆维吾尔自治区科技成果转化专项项目(201454129);库尔勒市重点科技计划项目(2013051108)
收稿日期:2015-10-07
